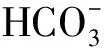構建模型 突破電解質溶液圖像題
景建宏
(福建省福州格致中學 350001)
1 構建模型解答概念相關的圖像題
高中化學部分電解質溶液圖像題給出新概念,要求學生基于對新概念的理解運用所學進行解題.解答該類習題應抱著必勝的信念,尤其應認真讀圖構建對應模型,把握相關物質相關參數變化的因果關系,以迅速找到解題的切入點.
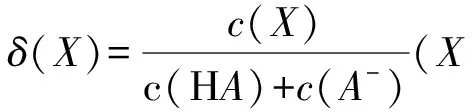
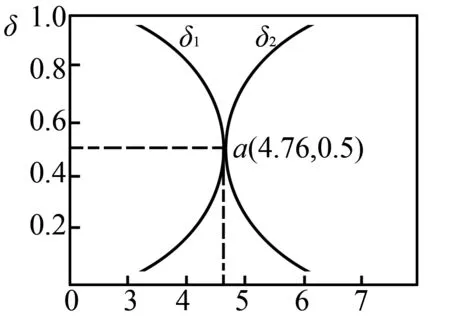
圖1
A.HA對應的曲線為δ2
B.升高溫度,a點向左移動
C.pH為5時,溶液中HA的濃度大于A-的濃度
D.HA的電離常數數量級為10-4

溶液pH增大,HA的電離程度不斷增大,平衡時HA的組成分數不斷減小,而A-的組成分數不斷增大,因此曲線δ2對應A-.由HA的電離吸收熱量,升高溫度,其電離程度增大,平衡時HA的組成分數減小,因此,a點向左移動.由圖可知pH為4.76時HA和A-濃度相等,則pH=5時,HA的濃度小于A-的濃度.a點時δ2為0.5,HA和A-濃度相等,結合pH=4.76,容易計算出HA的電離常數為10-4.76,數量積為10-5.綜上分析只有B項正確.
2 構建模型解答加水稀釋圖像題
加水稀釋是對電解質溶液的常見操作,尤其對于若電解質溶液而言,加水稀釋會引起相關離子濃度發生變化.在解答與之相關的圖像題時應注重把握加水稀釋弱電解質電離變化規律,厘清體積變化與離子數目增大的快慢關系.必要情況下,構建針對性模型,以提高解題正確率.
例2向0.1 mol/L的乙酰水氧酸(用HA表示)不斷加水稀釋.加入水的體積和溶液pH的變化如圖2所示,其中該溫度下HA的Ka=4×10-4,lg2=0.3,則( ).
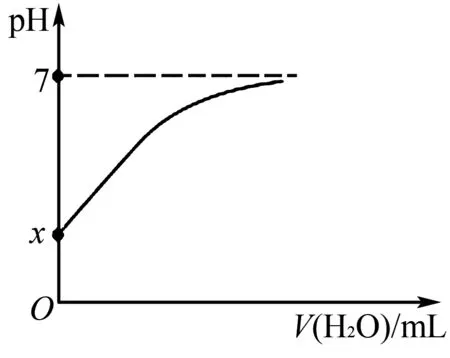
圖2
A.x=1.7
B.稀釋前,HA的電離度為2×10-1.5×100%
C.未加水時溶液中有:c(HA)>c(H+)>c(A-)>c(OH-)
D.加水過程中始終存在c(HA)+c(A-)=0.1mol/L

3 構建模型解答電導率圖像題
電導率這一概念常出現在電解溶液圖像題中,解答該類問題的關鍵在于對電導率這一概念的準確理解,把握影響電導率的因素.其中:離子種類、離子總量、溶液溫度都會給電導率帶來影響.解答與之相關的圖像類問題應注重構建相關模型,更好地掌握溶質的電離以及離子的變化規律.
例3電導率可衡量溶液導電能力的大小.常溫下,分別將相同體積的NaOH、CH3COOH溶液加水稀釋.溶液電導率和加入水的體積變化曲線如圖3所示,則( ).
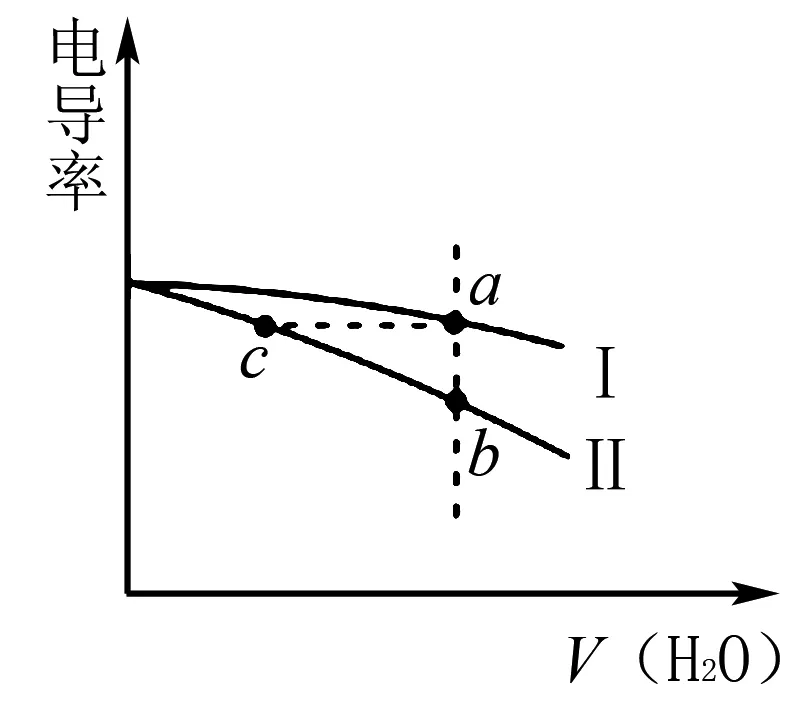
圖3
A.曲線Ⅰ表示NaOH溶液加水稀釋過程
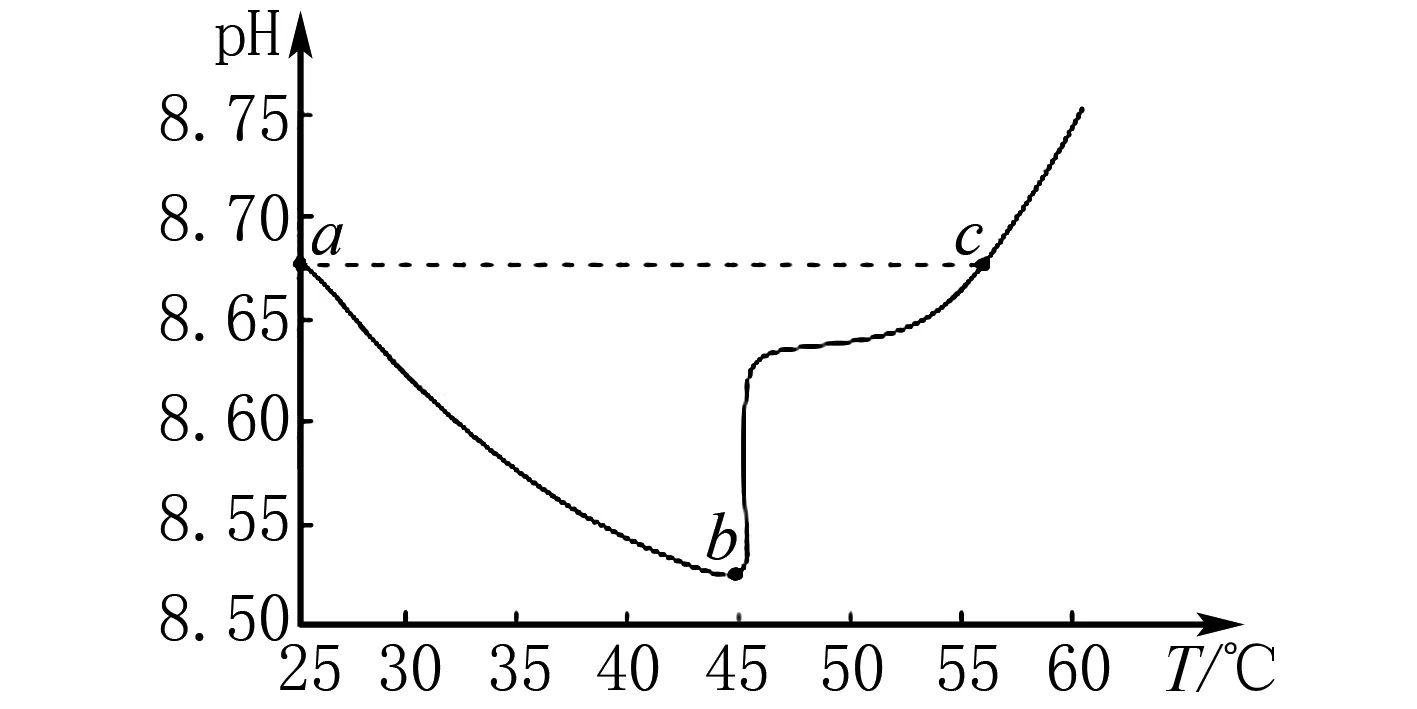
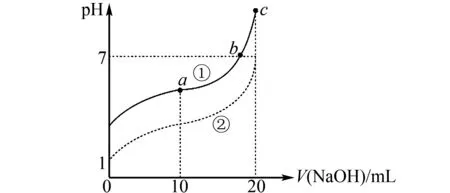
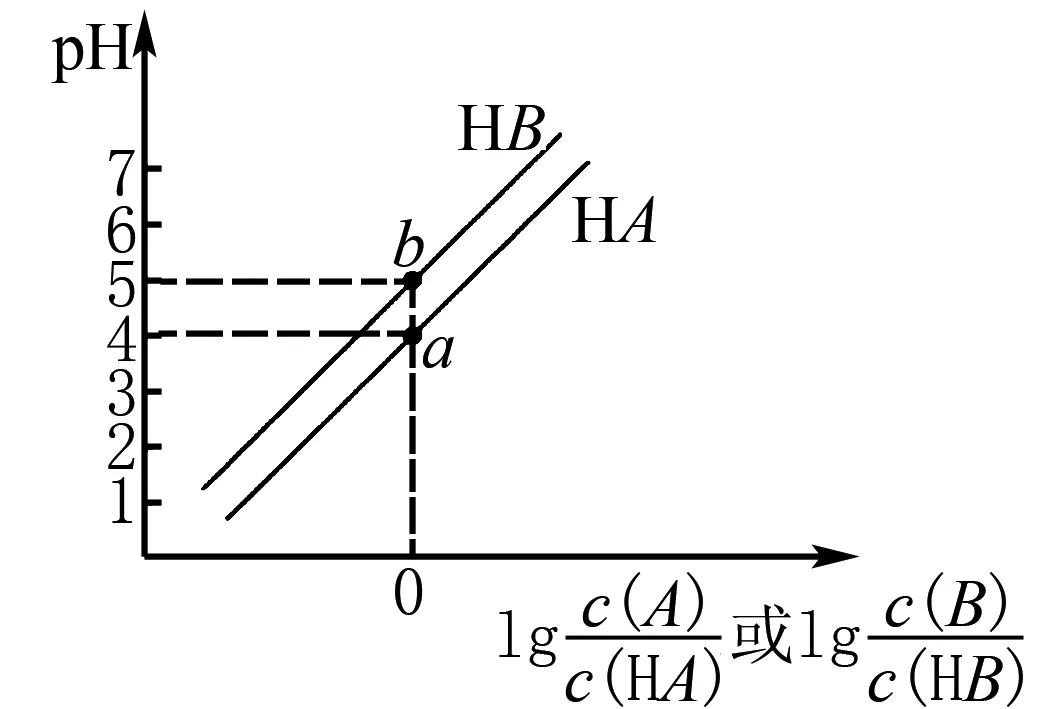
B.溶液pH:c C.溶液中水的電離度:a=c D.a、b兩點溶液混合后的溶液中c(Na+) 該題結合電導率設問,考查強弱電解質在加水稀釋后離子的變化關系.為提高解題效率,可構建如下模型:加水稀釋會促進弱電解質的電離,但是相對于加入水體積的變化,離子的濃度仍是減小的.在比較混合溶液中離子濃度大小時,若溶質之間發生反應,則分析反應后的溶質,并結合物料守恒思想進行分析. 加水稀釋CH3COOH進一步電離,相對來說電導率下降慢,而NaOH溶液的電導率下降快.CH3COOH溶液顯酸性,NaOH溶液顯堿性.而NaOH溶液加水稀釋,溶液中H+濃度增加,pH降低,因此,溶液pH:c>b>a.a、c兩點電導率強度相等,結合水的電離常數易得兩點水的電離程度相等,而加水稀釋水的電離程度增大,水的電離度a=c 酸堿中和滴定是高中化學的重要知識點.滴定過程中如其中一種物質是弱電解質,則需要分析其電離情況.部分習題給出滴定物質以及溶液pH圖像要求學生分析相關問題.解答該類習題為使學生對滴定過程有更為全面地認識,迅速找到解題切入點,應結合圖像構建相關模型. 例4室溫下將0.1mol/L的NaOH溶液逐滴滴入20mL 0.1mol/L的HA溶液中(Ka=1.0×10-5).滴入NaOH溶液的體積和溶液pH的變化如圖4中曲線①所示,則以下說法不正確的是( ). 圖4 A.a點pH>5 B.水的電離程度:c>b>a C.實驗可使用酚酞作指示劑 D.將HA改為20mL 0.1mol/L的鹽酸,則滴定曲線如② 該題屬于酸堿滴定圖像習題,考查學生對滴定過程以及弱酸電離、水解規律地靈活應用.可構建如下模型:弱酸溶液抑制水的電離,因NaOH溶液的滴入其濃度變小,對水的抑制程度變小,直到溶質為NaA,A-發生水解,進而促進水的電離. 根據構建的電離平衡模型以及電離平衡常數的概念,由Ka=1.0×10-5可知A-的水解常數為1×10-9,a點溶液中NaA和HA的濃度相等,其中HA的電離強于A-水解,A-濃度大于HA的濃度,則c(H+)<1×10-5,則對應的pH大于5.HA電離會抑制水的電離,a點至c點時,HA濃度逐漸變小,其中在c點時HA和NaOH剛好全部反應,溶質為NaA,A-水解促進水的電離,因此,水的電離程度c>b>a.滴定終點溶液呈堿性,能夠使用酚酞作指示劑.若將HA改為20mL 0.1mol/L的鹽酸,起初溶液pH變化緩慢,在達到終點才會發生明顯變化,因此,不能使用曲線②表示.綜上分析D項是不正確的. 高中化學電解質溶液圖像類的習題有時會涉及到濃度比值類的問題.解答該類問題需要運用一定的數學知識,構建相關參數與物質濃度之間的關系.同時,運用電解質溶液離子濃度變化規律進行解答. 例5常溫下,向相等pH、體積的HA、HB兩種弱酸溶液中滴加等濃度的NaOH溶液.溶液的pH和粒子濃度比值的關系如圖5所示,則( ). 圖5 A.c(HA)>c(HB) B.水的電離程度:a>b C.將NaOH溶液滴加到HB溶液至pH=7,c(B-)=100c(HB) D.常溫下HB的電離常數為10-4 該題綜合考查數學以及電解溶液離子濃度規律.解答該題可構建以下模型:若離子濃度比值的對數為0,表明兩種離子濃度的大小是相等的.弱酸溶液溶液中OH-是由水電離的.弱堿溶液中溶液中H+是由水電離的. 高中化學有關電解質溶液習題中有時會給出溫度以及pH圖像,要求學習者分析相關問題.解答該類問題應牢固記憶相關概念以及相關參數計算公式.同時,為防止在解題中走彎路,應注重構建對應模型,迅速厘清相關參數之間的關系. 例6實驗中測得升高溫度0.1mol/L的NaHCO3溶液(忽略水的揮發)的pH變化曲線,如圖6所示,下列判斷正確的是( ). A.c(OH-):a B.取a點溶液滴加0.1mol/L CaCl2等體積混合,生成白色沉淀,兩溶液混合時有:c(Ca2+)·c(CO32-) 圖6 該題難度一般,考查學生對Kw影響因素的理解以及有關離子濃度大小關系的比較.解答該題可構建如下模型:Kw僅可溫度有關,溫度越高,Kw越大.比較離子濃度大小關系時應注重運用電荷守恒、物料守恒等.4 構建模型解答滴定圖像題
5 構建模型解答粒子濃度比值類圖像題
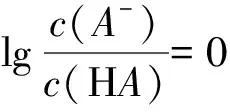
6 構建模型解答溫度與pH圖像題