泰樂菌素純化工藝優化研究
*陳東 張曉強 納奇 鎖嘉偉
(寧夏泰益欣生物科技有限公司 寧夏 750205)
泰樂菌素(Tylosin),亦稱泰農、泰樂霉素,是美國于1959年從弗氏鏈霉菌(Streptomyces fradiae)的培養液中獲得的一種大環內酯類抗生素。泰樂菌素的外觀呈現為一種白色板狀結晶,在水中的溶解性較低,呈現堿性。主要的產品有酒石酸泰樂菌素、磷酸泰樂菌素、鹽酸泰樂菌素、硫酸泰樂菌素及乳酸泰樂菌素,以上鹽在水中的溶解性良好。泰樂菌素水溶液在25℃、pH5.5~7.5時可保存3個月,但是當水溶液中含有鐵離子、銅離子等金屬離子時,會使泰樂菌素水溶液失效。
泰樂菌素是禽畜專用的大環內酯類抗生素,其活性組分主要包括ABCD四種,以A組分為主,在動物體內的活性最強[1]。在2011版英國藥典(獸藥)中,規定泰樂菌素的總組分(A+B+C+D)含量在95%以上,且A組分含量在80%以上[2]。目前,已有報道顯示泰樂菌素對于禽畜類的多種病癥均具有較好的預防和治療效果。與此同時,其作為飼料添加劑已經被國際所認可,且在國內甚至國際市場上的需求量都較大[3]。純度較高的泰樂菌素成品具有廣闊的市場前景,也能帶來較為良好的經濟效益。隨之而來的問題就是,如何獲得純度較高的泰樂菌素,這也成為了目前的研究方向和發展趨勢。
在生物制藥行業中,萃取的方法被廣泛應用,此種方法可以有效去除泰樂菌素中大部分水溶性雜質及無機鹽,將泰樂菌素的有效成分從水相轉移至有機相,除去水溶性雜質,然后通過二級反萃取的方式將泰樂菌素分階段的從有機相轉移至水相,再經過中和精制,得到高純度的泰樂菌素。達到降低雜質含量,提升泰樂菌素純度的目的。

圖1 泰樂菌素結構式
1.實驗儀器及試劑
(1)儀器
實驗中所需數顯式恒溫磁力攪拌水浴鍋由天津華鑫儀器提供;低溫恒溫循環水浴槽由中儀科瑞(鄭州)設備有限公司提供;酸度計由梅特勒-托利多儀器(上海)有限公司提供;高效液相色譜儀由安捷倫科技公司提供;分析天平由上海良平儀器儀表有限公司提供。
(2)試劑
實驗中所需氫氧化鈉、酒石酸、乙酸丁酯全部由天津市承大化學試劑有限公司提供;氫氧化鈣、甲醇、乙腈全部由天津市大茂化學試劑有限公司提供。
2.實驗材料和實驗方法
(1)材料
泰樂菌素濾液來源于寧夏泰益欣生物科技股份有限公司。
(2)方法
①實驗方法
取泰樂菌素濾液以及套用乙酸丁酯,分別設置濾液:乙酸丁酯=1:1.5;1:1;1:0.8;1:0.4四種比例進行混合,置于數顯恒溫水浴鍋內,分別設置30℃、35℃、40℃、45℃、50℃五個萃取溫度。設定萃取時間分別為20min、25min、30min、35min;分別設置萃取次數為一次萃取,兩次萃取,三次萃取;使用濃度為10%~15% NaOH溶液調節pH,最終pH調節到9.0~9.4左右;然后再進行反萃取,最后進行中和精制工藝得到精制液、取樣、待檢。
②檢測方法
用高效液相色譜儀進行含量檢測,檢測方法按照泰樂菌素組分檢驗標準操作規程(USP)進行。
色譜條件:以十八烷基硅烷鍵合硅膠作為填充劑;以200g/L高氯酸鈉溶液-乙腈(60:40)為流動相;檢測波長設定為290nm;色譜柱型號為:4.6mm×25cm,粒徑5um;流速設定為1.0ml/min;柱箱溫度設定為35℃。
流動相具體配制方法為:200g/L高氯酸鈉溶液與乙腈按照體積比為60:40進行配制,混合均勻之后進行過濾,用超聲波清洗器除去流動相中的氣泡,即得。
供試品溶液配制方法為:準確稱取供試品20mg,置100ml容量瓶中,加入乙腈-水(1:1)進行溶解并稀釋,準確定容至刻度線,搖勻,即得。
對照品溶液配制方法為:稱取泰樂菌素對照品(USP)20mg,精密稱定,置100ml容量瓶中,加乙腈-水(1:1)進行溶解并稀釋,準確定容至刻度線,搖勻,即得。
3.結果與分析
(1)濾液與乙酸丁酯的加量對泰樂菌素A組分含量的影響
在萃取這一工序中,萃取劑的用量對萃取的效果會產生極大地作用。萃取劑使用過量可能會加大試劑的浪費,導致生產成本過高;而萃取劑使用量減少會導致萃取不徹底,從而造成泰樂菌素的損失。因此本實驗設置四種投料比例進行驗證,分別為1:0.4,1:0.8;1:1;1:1.5;其余條件固定不變,考察對泰樂菌素A組分含量的影響。具體結果由表1所示。

表1 加量比例對泰樂菌素A組分含量的影響
由表1和圖2可知,隨著投料比例的改變,泰樂菌素A組分含量為一個先增加后降低的改變趨勢,當加量比例設置為1:0.8時,得到的泰樂菌素A組分含量為最高。
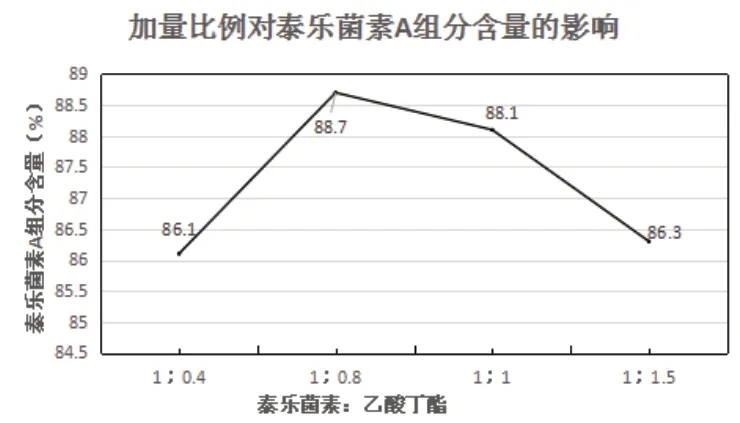
圖2 加量比例對泰樂菌素A組分含量的影響
(2)萃取溫度對泰樂菌素A組分含量的影響
一般來說,隨著溫度的升高,溶質在水相及萃取劑中的溶解度都會有所提高,而且在萃取劑中的溶解度比在溶質中的溶解度大,所以利于萃取的進行。除此之外,溫度升高,溶液的黏度降低,也便于萃取劑與水的分離。但是當溫度過高時,就會導致萃取劑的損失增多。因此設置不同萃取溫度進行驗證,分別為30℃、35℃、40℃、45℃、50℃,保持其余條件不變,考察對泰樂菌素A組分含量的影響。具體結果由表2所示。

表2 萃取溫度對泰樂菌素A組分含量的影響
由表2和圖3可知,隨著萃取溫度的逐漸增加時,泰樂菌素A組分含量變化為先增加后降低,當萃取溫度為45℃時,泰樂菌素A組分的含量達到最佳。此后再升高溫度時泰樂菌素A組分含量開始降低,綜合來看,當萃取溫度為45℃時,泰樂菌素A組分含量最佳。
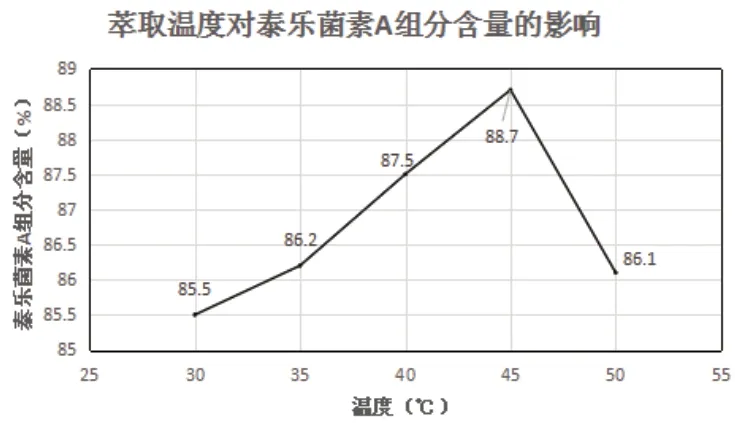
圖3 萃取溫度對泰樂菌素A組分含量的影響
(3)萃取次數對泰樂菌素A組分含量的影響
萃取是提純的手段之一,而萃取次數也至關重要。單次萃取效率遠低于多次萃取,而隨著萃取次數的增加,濾液中泰樂菌素的有效成分會逐漸降低,此時繼續增加萃取次數,泰樂菌素A含量降低,還會造成萃取劑的浪費,導致生產成本增加。因此設置不同萃取次數進行驗證,分別為一次萃取、兩次萃取、三次萃取,保持其余條件不變,考察對泰樂菌素A組分含量的影響。具體結果由表3所示。
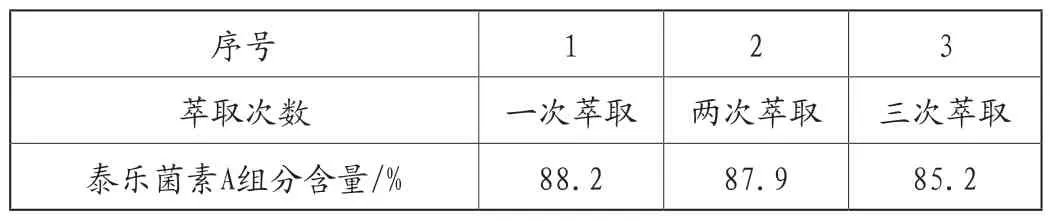
表3 萃取次數對泰樂菌素A組分含量的影響
由表3和圖4可知,當萃取次數的逐漸增加時,泰樂菌素A組分含量逐漸降低,萃取次數越多,泰樂菌素A組分含量越低,但一次萃取顯然無法將絕大多數有效成分萃取出來,綜合生產成本與萃取效率,當萃取次數為兩次時,既能盡可能多的將泰樂菌素A組分萃取完全,又能節約成本,因此確定萃取次數為兩次。
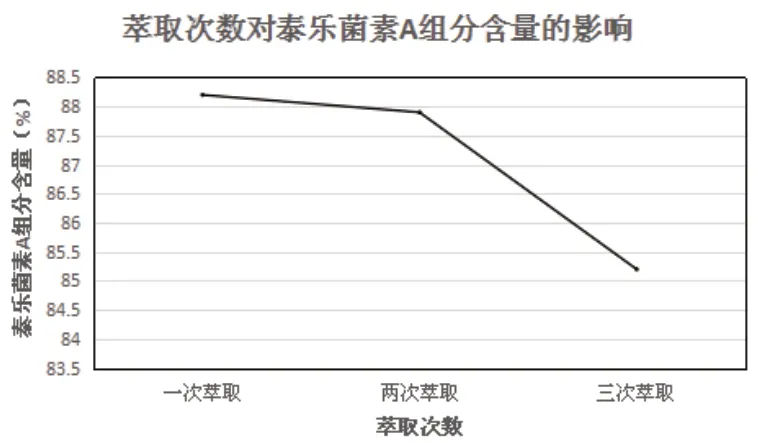
圖4 萃取次數對泰樂菌素A組分含量的影響
(4)萃取時間對泰樂菌素A組分含量的影響
在進行萃取工序時,萃取時間的長短對萃取效率的影響也極為重要。萃取時間過短,會導致泰樂菌素有效成分萃取不完全,從而導致泰樂菌素A組分降低;而當萃取時間過長時,不僅對萃取效率起不到明顯的促進作用,反而會造成預料之外的浪費。因此設置20min、25min、30min、35min、40min等不同萃取時間,保持其它條件不改變,考察對泰樂菌素A組分含量的影響。具體結果由表4所示。
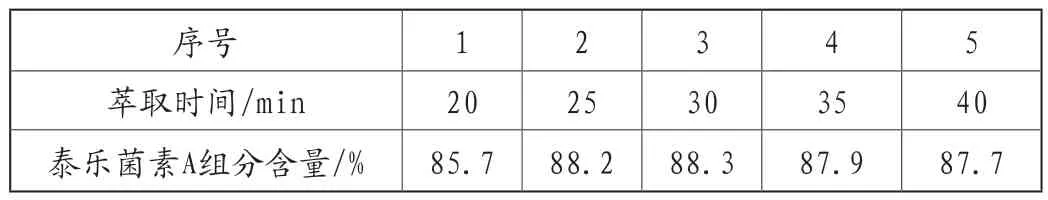
表4 萃取時間對泰樂菌素A組分含量的影響
由表4可知,隨著萃取時間的延長,泰樂菌素A組分含量增加,當萃取時間在25~30min這一范圍內時,泰樂菌素A組分含量基本保持不變且為最佳,而后萃取時間繼續增加,泰樂菌素A組分含量變化不大,綜合生產時間來看,當萃取時間為25~30min時,所得泰樂菌素A組分含量是最高的。
(5)最優條件下的平行實驗
通過單因素試驗,獲得最優參數,組合成為最優的泰樂菌素萃取工藝條件,具體參數如下:泰樂菌素濾液加量:乙酸丁酯加量=1:0.8、萃取溫度為45℃、進行兩次萃取、萃取時間控制為25~30min。以此組合工藝條件進行3組平行實驗驗證此工藝條件的穩定性,結果如表5所示。

表5 平行實驗驗證數據
由表5可知,三組實驗中所得到的泰樂菌素A組分平均含量為89.6%。
4.結論
本研究通過對泰樂菌素濾液與乙酸丁酯投料比例、萃取溫度、萃取次數、萃取時間等工藝參數分別進行單因素實驗,結果表明:當投料比例為1:0.8、萃取溫度為45℃、萃取次數為兩次萃取、萃取時間控制為25~30min時實驗結果最優,并驗證最優參數組合工藝對泰樂菌素的萃取具有顯著的影響,為泰樂菌素的A組分含量的提升提供了有力的支撐,依據此工藝可繼續進行優化實驗。

