鹽脅迫下花生種子萌發期代謝組學分析
徐揚 丁紅 張冠初 郭慶 張智猛 戴良香
(山東省花生研究所,青島 266100)
我國鹽堿地分布廣泛,面積約為3.6×107hm2[1],是重要的現實和潛在的農業資源,但目前保護性開發利用率較低。2021年習近平總書記在黃河三角洲視察工作時做出了“端穩中國糧、鹽堿地大有可為”的重要批示,為開發利用鹽堿地、保障我國糧食安全指明了新方向。花生固氮養地,耐瘠抗旱,并具備較強鹽堿耐受能力,是目前鹽堿地區較適宜種植的經濟和油料作物之一[2-3]。但鹽堿地較高的土壤鹽分會在種子周圍形成高滲透勢、離子(Na+和Cl-)和氧化毒害[4-5],導致花生種子發芽率降低、出苗時間延長、健苗率低、嚴重減產[6-7],成為限制鹽堿地花生生產的瓶頸。因此,如何“促萌發、保全苗、成壯苗”是提高鹽堿地花生產量和擴大種植面積的關鍵,對鹽堿地農業結構優化和花生產業持續發展具有重要現實意義。
種子萌發過程中代謝活動較旺盛[8],吸水膨脹會激活新陳代謝、產生能量、降解高分子內含物并產生營養物質,涉及氨基酸、糖酵解、三羧酸循環和戊糖磷酸等多條代謝途徑[9]。種子萌發的代謝過程對種子發芽及植株形態建成至關重要,已逐漸成為評價種子活力和品質的重要指標[10-11]。目前關于花生種子萌發過程中物質變化的研究主要集中在內源激素等生理生化指標、營養成分變化及基因調控等方面[12-14],對鹽脅迫下花生種子萌發期代謝物動態變化的研究鮮見報道。本研究以生產中廣泛應用且兼具耐鹽能力的花育22 號為試驗材料,利用高效液相色譜串聯質譜技術,監測鹽脅迫下花生種子不同萌發階段相關代謝產物變化,探索花生鹽脅迫應答引發的萌發過程代謝物變化規律,為通過遺傳育種和外源調控促進鹽堿地花生萌發出苗提供重要代謝物資源和理論依據。
1 材料與方法
1.1 材料
供試花生品種為花育22 號,由山東省花生研究所提供。選取當年收獲的籽粒飽滿、均勻一致的種子2 kg 備用。
1.2 方法
1.2.1 種子萌發階段代謝組學樣品的培養與采集 先將備好的花生種子用0.5%次氯酸鈉消毒,無菌水沖洗5、6 次,吸水紙吸干水分后備用。設置2 個NaCl 處理濃度(0 和150 mmol/L),3 個吸水膨脹時間(0 h、6 h 和72 h)。將花生種子(20 粒)置于直徑為120 mm、底部墊有2 層濾紙的培養皿中,每皿中分別加入處理要求的同體積(70 mL)培養液,使種子分別均勻半浸于0 或150 mmol/L 的培養液中,置于28℃暗培養箱中吸脹萌發,每處理6 次重復。分別于培養后0 h、6 h 和72 h 以重復為單位隨機采集各處理皿6 粒種子樣品,置于無菌袋中,于-80℃超低溫冰箱中保存備分析用。不同處理和對照組命名如下:正常條件(0 mmol/L NaCl 即ddH2O,CK)吸水膨脹0 h、6 h 和72 h 各時段的種子樣本分別表示為CK0、CK6 和CK72,150 mmol/L NaCl(S)吸水膨脹0 h、6 h 和72 h 各時段的種子樣本分別表示為S0、S6、S72,每處理6 次重復。其中CK0與S0 皆為吸水膨脹0 h,因處理一致統一為對照(CK)進行代謝組學檢測。經前期研究表明6 h 為花生種子快速吸水膨脹期,72 h 為花生種子胚根伸長期[15-16]。樣品由青島科創質量檢測有限公司同批次檢測完成。
1.2.2 花生發芽率統計 將20 粒/皿花生種子半浸于150 mmol/L NaCl 基質或ddH2O 培養皿(70 mL),均置于28℃暗培養箱中吸脹萌發,每隔2 d 補充NaCl 溶液和ddH2O,6 次生物學重復。自浸種之日起至8 d 每天定時進行種子發芽率調查(胚根突破種皮3 mm 即視為發芽)。發芽率(%)=(發芽種子數/供試花生種子總數)×100%[17]。
1.2.3 代謝組學檢測
1.2.3.1 代謝組學樣品提取 1 000 mg 樣品加入1.3 mL 提取液(甲醇∶水=4∶1;V∶V),低溫下高通量組織破碎儀破碎,低溫渦旋混勻處理30 min。4℃13 000×g離心15 min,取上清后重復上述萃取操作3 次,將上清液在氮氣下混合濃縮。最終,樣品用乙腈∶水=1∶100 μL(V∶V)復溶后用于液相色譜-質譜分析。
1.2.3.2 高效液相色譜串聯質譜(LC-MS/MS)分析 色譜條件:儀器為超高效液相色譜儀(Thermo Vanquish UHPLC,Thermo Fisher Scientific)和Zorbax Eclipse C18色譜柱(1.8 μm×2.1×100 mm,Agilent technologies);柱溫為30℃;流速為0.3 mL/min;流動相組成A(水+0.1%甲酸)和B(純乙腈);進樣量為2 μL,自動進樣器溫度為4℃。質譜條件:儀器為高分辨質譜(Q-Exactive HF,Thermo Fisher Scientific),分別采用電噴霧電離(ESI)正離子和負離子模式進行檢測。離子化模式為加熱電噴霧離子源(heated electron spray ionization,HESI);質譜掃描范圍在100-1 500 m/z,掃描速度為1 000 Da/s。環設定為最大值3;隔離窗口設置為2;動態扣除為10 s;噴霧電壓3.50 kV;毛細管溫度330℃;加熱器溫度325℃。鞘氣、輔助氣體和吹掃氣體分別50.0、12.0 和1.0 arbitrary units。校準溶液用于儀器校準,在全掃描模式(FM)下進行分析。一級MS掃描的分辨率設置為120 000,二級MS/MS 掃描的分辨率為60 000。填充C-Trap 的離子數為1e6,最大注射時間30 ms。標準化碰撞能量(normalized collision energy,NCE)12.5、25 和35 eV;隔離窗口(isolation window,IW)為3;Loop 設置為2。
1.2.3.3 代謝物定性和數據分析 使用Compound Discoverer 3.1 進行保留時間矯正、峰識別、峰提取、峰積分、峰對齊等工作,同時利用Thermo mzCloud 在線數據庫,Thermo mzValut 本地數據庫,ChemSpider 數據庫等進行物質鑒定。數據預處理后,利用Simca-Pv13.0(UmetricsAB,Umea,Sweden)進行偏最小二乘法判別分析(partial least squares discriminant analysis,PLS-DA),利用PLINK軟件進行主成分分析(principal component analysis,PCA),兩者用于研究組間代謝物差異變化情況;利用R 語言軟件包進行PCA 和PLS-DA 的分析繪制[18];采用PLS-DA 模型得到的變量權重值(variable importance in projection,VIP>1),并結合student'st-test(P<0.05)和差異倍數(fold change ≥2 和fold change ≤0.5)相結合的方法篩選差異代謝物[19]。KEGG 是研究生物體內代謝網絡的重要工具,本研究利用超幾何檢驗篩選與比較分析差異代謝物富集的KEGG pathway,獲得差異代謝物參與的重要代謝通路[19]。在美吉I-Sanger 云數據分析平臺上(www.majorbio.com)對所有測序數據進行在線數據分析。運用SPSS 20 軟件,采用Student'st-test 比較各組間的統計學差異。
1.2.4 種子營養成分含量分析 花生種子可溶性蛋白含量測定采用雙縮脲法(Biuret);脂肪含量測定采用索氏抽提法(GB/T5009.6-2016);可溶性糖含量的測定采用蒽酮比色法[20]。
2 結果
2.1 鹽脅迫下花生種子發芽率及種子營養成分含量分析
如圖1-A 顯示,鹽脅迫下花生種子發芽速率較慢,發芽率降低,至培養8 d 其發芽率只有83.5%,顯著低于正常條件(100%)。淀粉、蛋白質和脂肪作為種子中的重要組成部分,其在種子萌發過程中發生劇烈變化,可溶性蛋白質隨種子萌發時間的推進,含量逐漸降低,但到萌發后期即胚根伸長期(72 h)含量增加(圖1-B),而脂肪和可溶性糖含量則隨萌發過程的推進不斷降低,在種子胚根伸長期其含量下降到較低水平(圖1-C,1-D)。鹽脅迫處理下花生種子可溶性蛋白、脂肪和可溶性糖的含量變化趨勢與正常條件相同,但含量均低于對照。鹽脅迫下吸水膨脹期(6 h)和胚根伸長期(72 h)可溶性蛋白含量分別較正常條件降低8.89%和6.25%,可溶性糖含量分別降低15.79%和20.00%(圖1-B,1-D)。綜上結果表明,花生種子萌發需消耗大量蛋白質、糖類和脂肪類物質用于供能,鹽脅迫較正常萌發需消耗更多的能量,可能與脅迫應答有關。
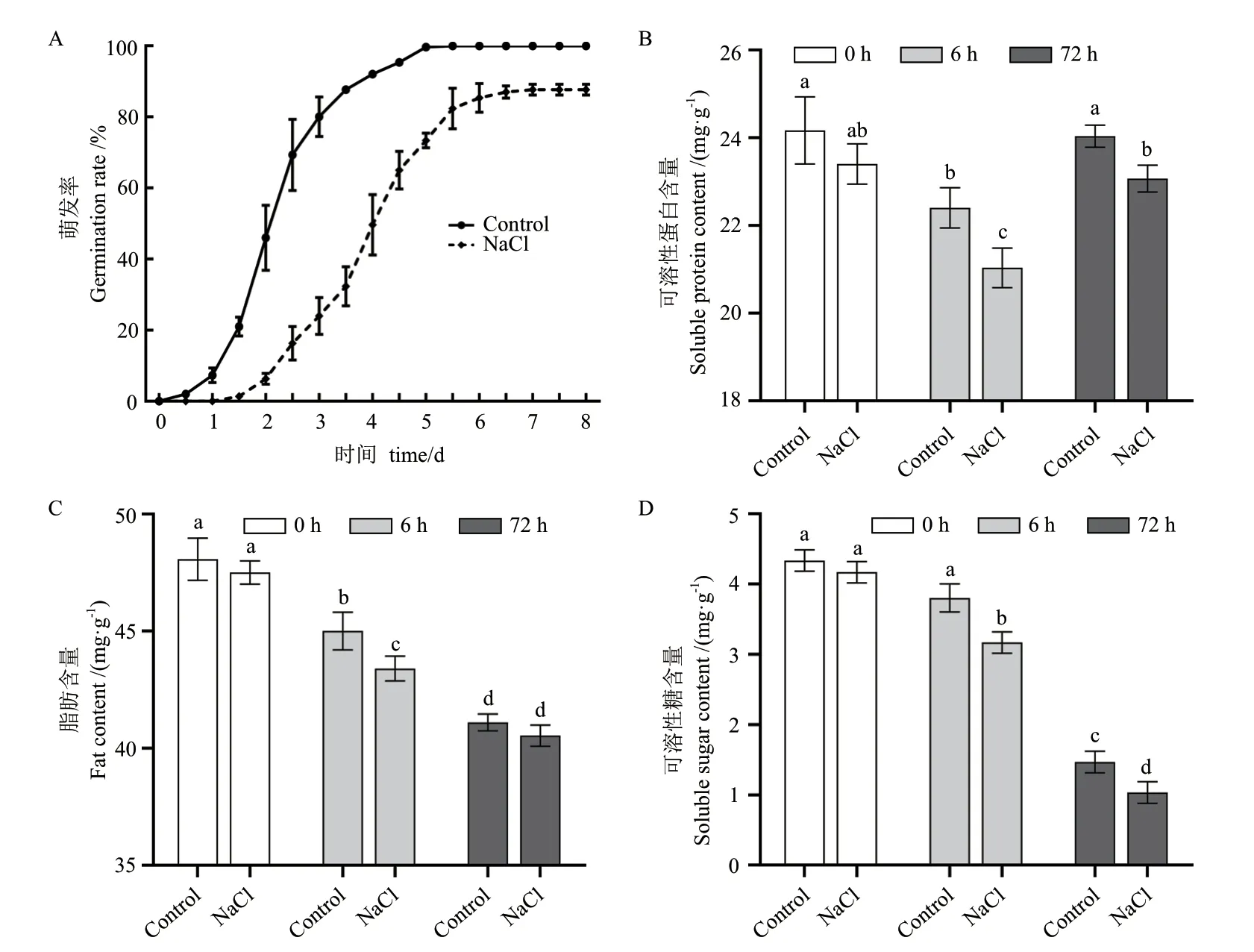
圖1 鹽脅迫和正常條件下花生種子發芽率和種子營養成分含量分析Fig.1 Analysis of peanut seed germination rate and seed nutrient component under salt stress and normal condition
2.2 主成分分析(PCA)和偏最小二乘法判別分析(PLS-DA)
PCA 分析本質上是一種無監督的多元統計分析方法,能從總體上反應各組樣本之間的總體差異和組內樣本之間的變異度大小。對花生種子不同萌發條件、不同萌發時段的代謝物檢測結果進行PCA 分析顯示,正常萌發條件下吸水膨脹6 h(吸水膨脹期,CK6)與對照(吸水膨脹0 h,CK)聚為一類,正常條件下吸水膨脹72 h(胚根伸長期,CK72)與其分離,但仍處于同一象限;而鹽脅迫處理組(S6 與S72)與正常條件各組均存在明顯差異,分布于不同象限,表明鹽脅迫顯著改變萌發期代謝(圖2-A)。PLS-DA 分析可用于評價多變量樣本間差異分析,如圖2-B 所示,CK6 與CK 聚為一類,而CK72 與其分離,表明萌發后期物質能量代謝較前期變化更大。鹽脅迫處理組(S6 與S72)與正常條件各組均存在明顯差異,分布于不同象限,表明鹽脅迫處理較種子萌發本身改變花生種子代謝的效果更顯著,與PCA 結果一致。PCA 和PLS-DA 分析圖上QC 樣本密集分布,說明本次實驗重復性較高(圖2-A,B)。而組內樣本表現更聚集,差異性較小,且樣本全部處于95%置信區間,說明重復間差異小,取樣較合理(圖2-A,B)。PLS-DA 正負離子模式的模型參數分別為R2Y=0.4981,Q2=0.7536(圖2-C)。Q2表示模型的可預測性,Q2大于0.5,表明處理樣本間存在明顯差異(圖2-C)。同時,Q 的回歸線與縱軸的截距在零以下,體現了原模型具有良好的穩定性。PLS-DA 分析表明,該方法能較好的將鹽脅迫和正常萌發下不同萌發階段的花生種子區分開來,不存在過度擬合現象,穩健性良好,結果可用于后續的代謝物差異成分分析。
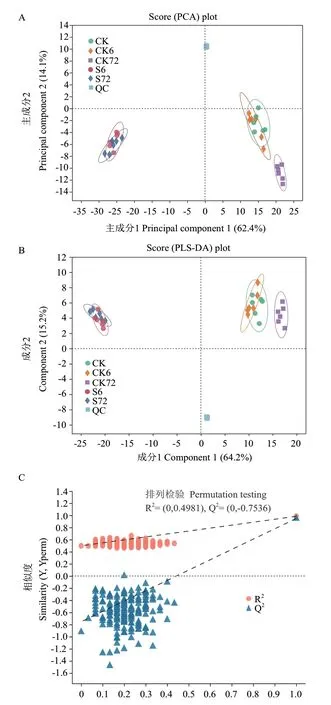
圖2 PCA 和PLS-DA 分析Fig.2 PCA and PLS-DA analysis
2.3 差異代謝物篩選
為進一步分析鹽脅迫對花生種子萌發期代謝物的影響,需要對VIP 值進行計算。結合PLSDA 模型和方差分析(one-way ANOVA)篩選(fold change ≥2 和fold change ≤0.5,同時VIP>1.0 及student'st-test 的P<0.05)差異代謝物,正常萌發不同時段,CK6 與CK 相比,正負離子模式下分別鑒定出差異代謝物5 和6 個,上調表達1 和3 個,下調表達4 和3 個(圖3-A);CK72 與CK 相比,正負離子模式下分別鑒定差異代謝物23 和16 個,上調表達14 和3 個,下調表達9 和13 個(圖3-B);CK72 與CK6 相比,正負離子模式下分別鑒定差異代謝物5 和9 個,上調表達1 和6 個,下調表達4和3 個(圖3-C)。
鹽脅迫與正常條件同時段比較,S6 與CK6 正負離子模式下分別鑒定出差異代謝物69 和56 個,上調表達48 和42 個,下調表達21 和14 個(圖3-D);S72 與CK72 正負離子模式下分別鑒定出差異代謝物69 和67 個,上調表達45 和34 個,下調表達24和33 個(圖3-E)。鹽脅迫不同時段比較分析顯示,S72 與S6 比較正負離子模式下分別鑒定出差異代謝物16 和18 個,上調表達4 和2 個,下調表達12 和16 個(圖3-F)。鹽脅迫與對照比較:S6 與CK 正負離子模式下分別鑒定出差異代謝物65 和45 個,上調表達20 和12,下調表達45 和33(圖3-G);S72與CK 正負離子模式分別鑒定出差異代謝物68 和49個,上調表達25 和22 個,下調表達43 和27 個(圖3-H)。表明花生種子萌發后期(胚根伸長期)較前期(吸水膨脹期)差異代謝物更多,這與隨花生種子萌發期代謝活動趨于旺盛有關。另外,鹽處理顯著改變了花生種子萌發期代謝,差異代謝物數量較正常條件增加。試驗篩選出的差異代謝物為進一步深入分析提供了有效的數據支持。
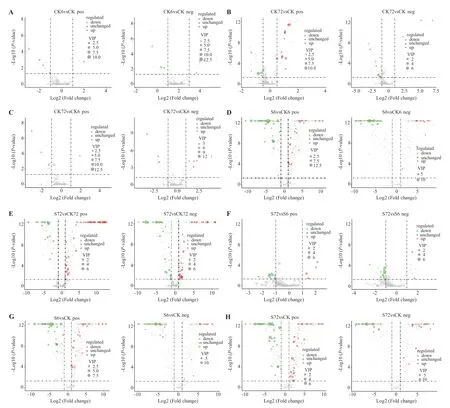
圖3 正負離子模式下不同處理比較差異代謝物火山圖Fig.3 Volcano plot of date in the positive and negative ion modes of differential metabolites under different treatments
2.4 正常條件下花生種子不同萌發時段差異代謝物KEGG pathway分析
將全部差異代謝物提交至KEGG 網站,進行KEGG pathway 分析。結果顯示,CK6vsCK 差異代謝物(皆為目前尚未定義或分類的代謝物)未定位到KEGG pathway,CK72vsCK 差異代謝物共富集到12個KEGG pathway(表1)。其中6 種氨基酸包括左旋絡氨酸(L-Tyrosine)共參與6 個代謝通路,亮氨酸(Leucine)和左旋精氨酸(L-(+)-Arginine)各參與3 個代謝通路;左旋組氨酸(L-Histidine)、左旋甲硫氨酸(L-Methionine)、左旋脯氨酸(L-Methionine)各參與2 個代謝通路。苯乙酰胺(2-Phenylacetamide)和羥基肉桂酸(2-Hydroxycinnamic acid)主要參與苯丙氨酸代謝。正常條件下不同萌發時段差異代謝物比較分析顯示,CK72vsCK6 差異代謝物含量均升高,共富集到10 個KEGG pathway,表明胚根伸長期較吸水膨脹期有更多的代謝物和代謝通路變化(表2)。KEGG pathway 分析顯示各差異代謝物除主要涉及氨基酸合成與代謝相關的信號通路,還涉及乙醛酸和二羧酸代謝、氮代謝以及光合作用(泛醌及其他萜類醌生物合成、卟啉和葉綠素代謝),并且隨種子萌發時間延長,差異代謝物增加,所涉及的代謝通路也更多。

表1 正常條件下花生種子萌發胚根伸長期與對照組(CK72vsCK)差異代謝物富集KEGG pathwayTable 1 Differential metabolites enriched KEGG pathway at radicle extension period compared with CK group(CK72vsCK)in peanut seed germinated under normal condition

表2 正常條件下花生種子萌發胚根伸長期與吸水膨脹期(CK72vsCK6)差異代謝物富集KEGG pathwayTable 2 Differential metabolites enriched KEGG pathway in comparison of radicle extension period with water absorption period(CK72vsCK6)in peanut seed germinated under normal condition
2.5 鹽脅迫下花生種子萌發期差異代謝物KEGG pathway分析
同一萌發時段不同處理下花生種子差異代謝物分析顯示,S6 與CK6 相比,鹽處理后能定位到KEGG pathway 的差異代謝物表達水平均提高,尤其是甜菜堿和脯氨酸兩種滲透保護物。差異代謝物共參與26 個KEGG pathway,主要包括氨基酸合成及代謝、糖代謝、脂質代謝、三羧酸循環(TCA)等代謝過程,還涉及甘油磷脂代謝、谷胱甘肽代謝、芥子油苷生物合成(表3)。S72 與CK72 相比,鹽處理后能定位到KEGG pathway 的差異代謝物除硫胺素含量降低,其他差異代謝物含量均顯著提高,共參與31 個差異代謝物富集KEGG pathway,其中包括與S6vsCK6 相同的26 個通路,并增加了5 個代謝通路,包括3 個氨基酸代謝(半胱氨酸和甲硫氨酸代謝、組氨酸代謝、絡氨酸代謝)、硫胺素代謝和異喹啉生物堿生物合成途徑(表4)。不同萌發時段差異代謝物比較分析顯示,S72 與S6 相比,PC(16:0/0:0)、脫氧腺苷和硫氨酸含量降低,而6 種代謝物包括左旋絡氨酸、甲硫氨酸、左旋組氨酸、羥基肉桂酸、乙酰氨基和苯基酰胺含量均顯著升高,主要涉及多種氨基酸代謝、能量代謝和芥子油苷合成等多條途徑(表5)。鹽脅迫下花生種子胚根伸長期比種子吸水膨脹期有更多的差異代謝物和KEGG pathway 變化,與正常萌發結果一致。另外,鹽脅迫處理比同時段正常萌發KEGG pathway 變化更復雜,除涉及糖代謝(半乳糖代謝,磷酸戊糖途徑)、脂肪代謝(甘油磷脂代謝、檸檬酸循環、乙醛酸和二羧酸代謝等)、氨基酸代謝、光合作用相關途徑外,甘油磷脂代謝、谷胱甘肽代謝和芥子油苷生物合成途徑也發生了變化,這些代謝途徑與脅迫應答密切相關,可能對鹽脅迫下花生種子萌發有利。

表3 花生種子萌發吸水膨脹期鹽脅迫與正常條件(S6vsCK6)對比差異代謝物富集KEGG pathwayTable 3 Differential metabolites enriched KEGG pathway at water absorption period in peanut seed germinated under salt stress and normal condition(S6vsCK6)

表4 花生種子萌發胚根伸長期鹽脅迫與正常條件(S72vsCK72)對比差異代謝物富集KEGG PathwayTable 4 Differential metabolites enriched KEGG pathway at radicle extension period in peanut seed germinated under salt stress and normal condition(S72vsCK72)
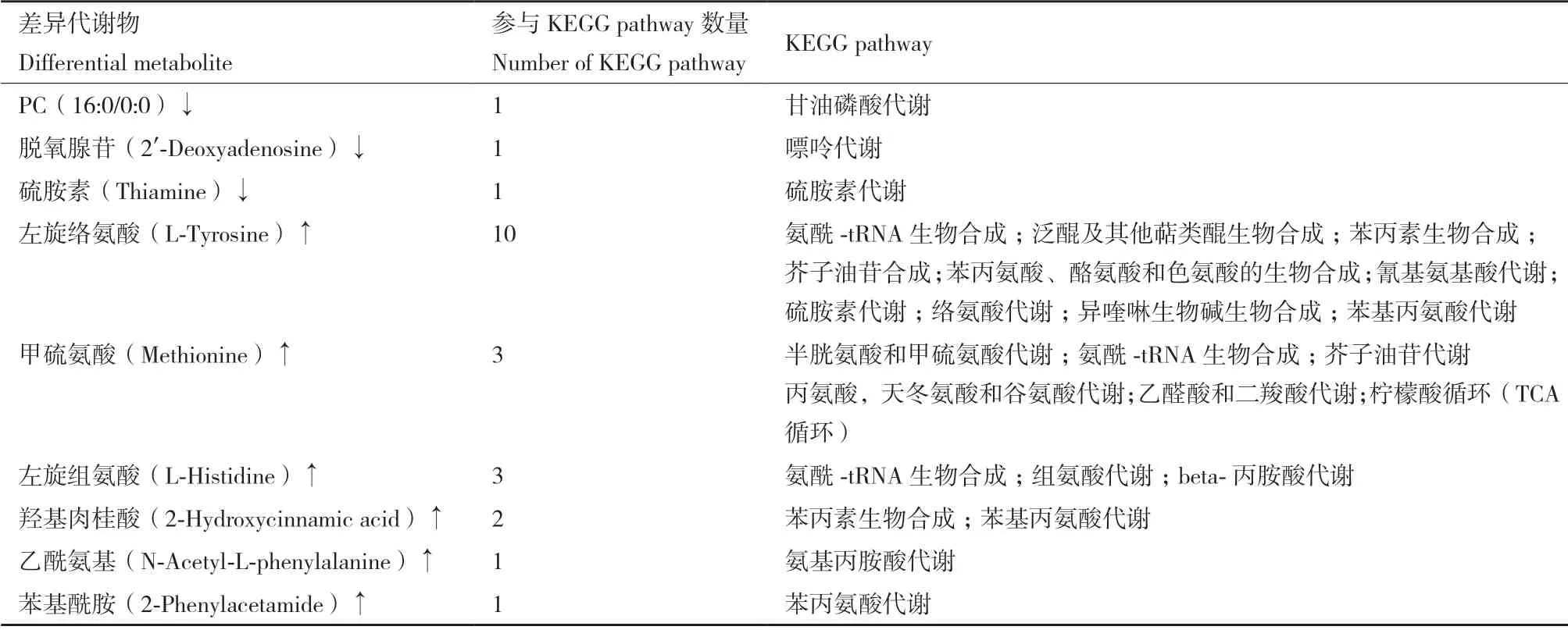
表5 鹽脅迫下花生種子萌發胚根伸長期與吸水膨脹期(S72vsS6)對比差異代謝物富集KEGG pathwayTable 5 Differential metabolites enriched KEGG pathway in comparison of radicle extension period with water absorption period(S72vS6)in peanut seed germinated under salt stress
S6vsCK 比較組差異代謝物及KEGG pathway 與S6vsCK6 組相類似,除亮氨酸和腺苷僅在S6vsCK6組中被檢測到,而槲皮苷和蕓香苷2 種差異代謝物僅在S6vsCK 組中,其主要涉及黃酮和黃酮醇的生物合成及類黃酮生物合成途徑(表6)。而S72vsCK與S72vsCK72 兩組差異代謝物及KEGG pathway 比較顯示,S72vsCK 比較組中未檢測到腺苷,而鑒定到槲皮苷和蕓香苷(表7)。S6 及S72 與CK 比較存在兩個變量,即萌發條件和萌發時間的差異,故與單一變量比較組(S6vsCK6 及S72vsCK6)結果不同,也進一步佐證除鹽脅迫處理外,萌發本身也會改變代謝。

表6 花生種子萌發鹽脅迫吸水膨脹期與對照比較(S6vsCK)差異代謝物富集KEGG pathwayTable 6 Differential metabolites enriched KEGG pathway at water absorption period in peanut seed germinated under salt stress compared with control group(S6vsCK)

表7 花生種子萌發鹽脅迫胚根伸長期與對照比較(S72vsCK)差異代謝物富集KEGG pathwayTable 7 Differential metabolites enriched KEGG pathway at radicle extension period in peanut seed germinated under salt stress compared with control group(S72vsCK)
3 討論
種子萌發是一個復雜變化的過程,起始于吸水膨脹,結束于胚根出芽,是植物生命周期的初始階段,決定了整個生命過程的成敗[21-22]。能量代謝是種子萌發的基礎,可溶性糖參與的糖酵解以及脂肪參與的乙醛酸循環、丙酮酸代謝等代謝途徑是種子萌發的能量來源[11,23]。本研究發現,萌發過程可溶性糖類和脂肪類含量逐漸降低,可能與其不斷分解持續供能有關。蛋白類物質在種子吸水激活后不斷分解為種子的呼吸氧化過程提供碳源及氮源[24],其含量不斷降低,其不斷生產的氨基酸又會繼續組裝成新細胞的蛋白質,故蛋白質含量呈現先降低后升高的變化趨勢,本研究與之前研究結果一致[20]。
差異代謝物鑒定及KEGG pathway 富集檢測顯示,鹽脅迫顯著促進了甘油磷脂代謝、谷胱甘肽代謝、芥子油苷生物合成途徑以及能量代謝等相關通路。甘油磷脂是細胞膜等生物膜的重要組成物質,也是重要的信號分子,在植物生長發育和逆境反應中起重要作用[25-26]。棉花種子可通過提升甘油磷脂代謝水平增強耐鹽性[27];紫花苜蓿通過提高甘油磷脂類物質的含量提高抗旱性[28]。本研究發現甘油磷脂代謝相關的差異代謝物在鹽脅迫處理后均上調表達,猜測鹽脅迫條件下花生種子可通過提升甘油磷脂代謝水平,維護細胞膜的正常功能,促進體內的信號轉導等,增強萌發期耐鹽性。谷胱甘肽是一種重要的抗氧化劑,植物通過形成谷胱甘肽等抗氧化劑抵御逆境脅迫[29]。水稻種子可通過增強谷胱甘肽代謝提高細胞抵御氧化脅迫能力,調控萌發過程[30];冬小麥也能提高谷胱甘肽等代謝增強鎘耐受[31]。本研究中,鹽脅迫處理后提高的谷胱甘肽代謝可能對鹽脅迫下花生種子萌發有一定幫助。芥子油苷是一類有生物學活性的植物次生代謝物,與滲透保護化合物的合成有關,可通過提高耐滲透脅迫能力增強鹽脅迫抗性[32-33]。有研究表明,外源茉莉酸處理能促進鹽芥花青素和芥子油苷的積累,提高植物抗氧化活性[34];外源色氨酸處理可通過調控生長素IAA合成途徑和吲哚族芥子油苷的合成途徑相關基因表達,有效地促進油菜生長調節物質和生物防御物質的累積,提高抗病性[35]。本研究發現芥子油苷生物合成途徑相關差異代謝物在鹽處理后被顯著誘導,可能對鹽脅迫下花生種子萌發有一定促進作用。能量代謝除參與正常生命活動外,在植物響應鹽脅迫過程中也發揮重要作用[36]。本研究發現,鹽脅迫處理后,大量氨基酸代謝,糖代謝和脂肪代謝相關KEGG pathway 的差異代謝物顯著上調,可能與鹽脅迫下花生種子萌發需要更多的能量參與脅迫應答有關。綜上可見,鹽脅迫條件下花生種子萌發期可通過提高甘油磷脂代謝、谷胱甘肽代謝、芥子油苷生物合成和能量代謝等代謝途徑增強花生種子萌發期耐鹽性,適應外界鹽脅迫。
甜菜堿和脯氨酸是植物重要的滲透保護物,可通過提高滲透調節能力增強植物耐鹽性[37-38]。外源甜菜堿可提高苜蓿種子及幼苗的耐鹽能力,促進苜蓿在鹽漬環境下的生長發育[39];甜菜堿浸種能促進鹽脅迫下石榴種子萌發,有效提高幼苗耐鹽性[40]。脯氨酸浸種可提高鹽脅迫下的玉米發芽率,其過氧化物酶和超氧化物歧化酶活性增強[41],還可降低鹽脅迫對油菜種子的抑制,促進其萌發出苗[42]。本研究發現,鹽脅迫處理能顯著提高甜菜堿和脯氨酸的含量,推測這兩種滲透保護物可能對花生種子萌發有利。本研究為遺傳育種和外源調控提供重要代謝物資源,未來可通過外源浸種或遺傳轉化方式,研究諸如甜菜堿和脯氨酸在花生種子萌發期的生物學功能,為促進鹽堿地花生萌發出苗提供可靠途徑。
4 結論
對鹽脅迫下花生種子萌發不同時期代謝組學研究發現,胚根伸長期較吸水膨脹期物質能量代謝更旺盛,甜菜堿和脯氨酸可能是花生種子萌發期適應
鹽脅迫的關鍵調控因子,甘油磷脂代謝、谷胱甘肽代謝以及芥子油苷生物合成等途徑可能是重要的代謝調控通路,可為進一步揭示花生種子萌發期的耐鹽調控機制奠定基礎。

