不同乳酸菌抗氧化作用和膽固醇降解能力的初步研究
徐超,章紹兵,孟珺,王敬麗,朱萌茜
(河南工業大學 糧油食品學院,河南 鄭州,450001)
人體所需能量很大一部分來自于自身的氧化作用,而氧化過程中會產生大量的自由基物質。這些自由基物質會加速人體的衰老并導致一系列的代謝綜合征,例如糖尿病、動脈硬化、心腦血管疾病、神經紊亂疾病等[1],人體本身具有的抗氧化系統并不能完全抵御這些危害,所以尋找安全高效無毒的抗氧化藥物尤為重要。人們在對乳酸菌的研究過程中發現了一些菌株具有較強的綜合抗氧化能力[2],有研究表明乳酸菌在代謝的過程中可以產生一些具有抗氧化性的物質,例如阿魏酸、半胱氨酸、過氧化氫酶等。
高脂血癥是指血漿中的膽固醇或者甘油三酯的水平過高,可直接引起如動脈粥樣硬化、冠心病、胰腺炎等一些嚴重危害人體健康的疾病。根據調查顯示,在近十年間中國成人血脂異常患病率大幅上升[3]。國內外的科學研究均已證實益生菌在緩解高血脂高血糖等方面有顯著的效果,且與傳統藥物治療相比,具有無毒副作用的優點[4]。有研究發現一些嗜酸乳桿菌、鼠李糖乳桿菌、干酪乳桿菌、植物乳桿菌等乳酸菌具有膽固醇降解能力[5]。本文以鼠李糖乳桿菌(LactobacillusrhamnosusGG)為陽性對照,對高加索乳桿菌(LactobacilluskefirBNCC 190565)、嗜酸乳桿菌(LactobacillusacidophilusATCC 4356)、布氏乳桿菌(LactobacillusbuchneriBNCC 187964)購自北京創聯生物技術有限公司;干酪乳桿菌(LactobacilluscaseiCICC 23184)、植物乳桿菌(Lactobacillusplantarumsubsp.plantarumCICC 20279)這5株乳酸菌進行了篩選,初步研究其抗氧化作用和降血脂功能,旨在篩選出1~2株具有良好的抗氧化作用和膽固醇降解功能的乳酸菌。
1 材料與方法
1.1 材料與試劑
L.rhamnosusGG、L.kefirBNCC 190565、L.acidophilusATCC 4356、L.buchneriBNCC 187964購自北京創聯生物技術有限公司;L.caseiCICC 23184、L.plantarumsubsp.plantarumCICC 20279購自中國工業微生物菌種保藏管理中心。
無水乙醇、鄰二氮菲、鐵氰化鉀、三氯乙酸、FeCl3、Na2CO3、六水氯化鐵、濃磷酸、結晶紫,天津市科密歐化學試劑有限公司;胰蛋白酶(生物技術級)、胃蛋白酶(豬源)、對硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside, PNPG)、膽固醇,上海麥克林生化科技有限公司;IV型膠原蛋白、α -葡萄糖苷酶,美國sigma公司;豬膽鹽,上海源葉生物有限公司;牛血清白蛋白,北京索萊寶技術有限公司;甲醇,天津市天力化學試劑有限公司;H2O2,洛陽市化學試劑廠。其余試劑均為分析純。
1.2 儀器與設備
GL-20G高速冷凍離心機,上海安亭科學儀器廠;D3024R臺式高速冷凍型微量離心機,美國SCTLOGEX;SWGCZ-2F 型超凈工作臺,上海篤特科學儀器廠;PHS-3C pH計,上海儀電科學儀器股份有限公司;XMTD-204數顯恒溫振蕩器,江蘇金壇市億通電子有限公司;DPH-360電熱恒溫培養箱、XMTD-7000電熱恒溫水浴鍋,北京市永光明醫療儀器有限公司;BT-1600圖像顆粒分析儀,丹東百特儀器有限公司;MVS-1旋渦混合器,北京金北德工貿有限公司;TV-1901紫外可見分光光度儀,上海精密科學儀器有限公司;立式壓力蒸汽滅菌鍋,上海申安醫療器械廠。
1.3 實驗方法
1.3.1 樣品的制備
1.3.1.1 菌懸液的制備
菌株在MRS液體培養基中連續活化3代,于18 h測定OD600值,并進行活菌計數,確定此時光密度對應的活菌數。將再次活化的菌液調整到相應的光密度,離心(4 000 r/min, 4 ℃, 10 min)得到沉淀。將離心所得沉淀用生理鹽水洗滌2~3次,然后重懸,根據活菌計數的結果把菌懸液統一調整為1.0×109CFU/mL,所得即為所需菌懸液。
1.3.1.2 發酵液的制備
將上述菌懸液按2%的接種量接種到MRS液體培養基中,培養18 h后,離心(4 000 r/min, 4 ℃, 10 min),所得上清液即為所需發酵液。
1.3.2 乳酸菌益生特性的測定
1.3.2.1 產酸
按2%的接種量,將菌懸液接種到MRS培養基中,放在恒溫振蕩器培養,培養條件為:溫度37 ℃、轉速180 r/min。24 h后測定pH值和滴定酸度,滴定酸度測定方法參考GB 5009.239—2016 《食品安全國家標準 食品酸度的測定》。
1.3.2.2 模擬消化道耐受性
(1) 消化液的配制:模擬胃液的配制參考中國藥典,pH值為2.0。模擬腸液的配制在參考藥典的同時加入豬膽鹽(3 g/L),pH值為8.0。使用前均需在37 ℃條件下預熱。
(2) 模擬消化:取1.0 mL菌懸液至9 mL模擬胃液,在溫度為37 ℃,轉速為120 r/min的恒溫振蕩器里模擬消化過程,分別在0、3 h時取樣,進行活菌平板計數,并計算存活率。同樣的方法模擬腸液及膽鹽對乳酸菌的影響[6]。
1.3.2.3 黏附性
設置2個實驗組,以牛血清白蛋白為空白對照,在6孔培養板中分別加入牛血清白蛋白或IV型膠原蛋白,同時每孔放置一片玻片,室溫下包被12 h后棄去蛋白液,用pH值7.2的滅菌PBS清洗5次。分別加入2 mL 108CFU/mL的菌懸液,37 ℃孵育。3 h后將菌懸液棄去,用滅菌PBS洗滌4次。然后用甲醇固定,結晶紫染色,顯微鏡下觀察,隨機選擇10個視野進行計數,10個視野中細菌的平均數作為平均黏附量。每種菌和不同蛋白的組合均設置3個孔位以作重復[7]。
1.3.3 乳酸菌抗氧化能力的測定[8]
1.3.3.1 羥自由基清除能力的測定方法
在試管中加入1 mL鄰二氮菲(2.5 mmol/L)、1 mL無菌PBS(pH 7.2)、1 mL菌懸液或發酵液,再加入1 mL的FeSO4(2.5 mmol/L),充分混勻后加入1 mL的H2O2(20 mmol/L),37 ℃水浴1.5 h后,在536 nm波長處測定吸光度值(OD值),記為A1;將1 mL發酵液或菌懸液稀釋到5 mL,測得吸光度值A2;用生理鹽水代替菌懸液或發酵液,其他操作不變,測得吸光度值A3;用生理鹽水代替菌懸液或發酵液,用蒸餾水代替H2O2,其他操作不變,測得吸光度值A0。羥自由基清除率計算如公式(1)所示:
(1)
1.3.3.2 還原能力測定方法
在2 mL離心管中加入0.5 mL的菌懸液或發酵液、0.5 mL的鐵氰化鉀(1%)、0.5 mL PBS(pH 6.6),充分振蕩混合均勻,在50 ℃水浴20 min后,冰浴急速冷卻,再次加入0.5 mL三氯乙酸(10%),3 000 r/min離心10 min。取其上清液1 mL,加入1 mL FeCl3(0.1%),室溫放置10 min 后,在710 nm波長處測定OD值。用生理鹽水代替樣品作為空白組,用空白組和實驗組OD值的差值來表征還原能力的強弱,計算如公式(2)所示:
還原力=A710(實驗)-A710(空白)
(2)
1.3.3.3 DPPH自由基清除能力測定方法
在2 mL離心管中加入1 mL的菌懸液或者發酵液,然后加入1 mL的DPPH自由基無水乙醇溶液(0.2 mmol/L),使用旋渦混合器混合均勻,在室溫條件下避光反應30 min后離心,離心條件為轉速6 000 r/min、時間10 min。取其上清液在517 nm波長處測定吸光度,測得的吸光度值記為A1;用生理鹽水代替菌懸液或發酵液,其他操作不變,測得的吸光度值記為A2;用生理鹽水代替菌懸液或發酵液,無水乙醇代替DPPH無水乙醇溶液,其他操作不變,測得的吸光度值記為A0。DPPH自由基清除率計算如公式(3)所示:
(3)
1.3.4 乳酸菌降膽固醇能力的測定
1.3.4.1 膽固醇培養基的配制
膽固醇無法直接溶于MRS液體培養基,所以參考郭翔[5]的實驗,將雞蛋黃作為培養基的膽固醇來源。膽固醇培養基:MRS培養基+5%(體積分數)蛋黃液。
1.3.4.2 膽固醇標準曲線的制作
取2.5 g六水氯化鐵溶于87%濃磷酸中,加濃磷酸定容到100 mL,貯存于棕色試劑瓶內,使用時取8 mL該液,加濃硫酸定容至100 mL,所得試劑即為磷鐵硫試劑。準確稱取膽固醇溶解于無水乙醇中,并用無水乙醇定容,使最終質量濃度為2 mg/mL,精確吸取2 mL該液,使用無水乙醇稀釋50倍,可以于冰箱冷藏,使用前放置到室溫。分別取0.0、0.2、0.4、0.6、0.8、1.0 mL膽固醇標準溶液加入試管中,用無水乙醇統一調整到1 mL,然后加入2 mL磷鐵硫試劑搖勻冷卻后,在550 nm波長處測定OD值。
1.3.4.3 膽固醇含量的測定
按2%的接種量在膽固醇培養基中接種乳酸菌,37 ℃、180 r/min的條件下在恒溫振蕩器中培養 24 h,取2 mL的菌液加入離心管中,3 000 r/min離心10 min,取其上清液加入1 mL無水乙醇渦旋振蕩5 min,10 000 r/min離心10 min。再次取400 μL加入到離心管中,加入1.6 mL無水乙醇,振蕩處理5 min, 10 000 r/min離心10 min。取1 mL上清液,加入2 mL磷鐵硫試劑,搖勻冷卻后,在550 nm波長處測定OD值。利用膽固醇標準曲線確定膽固醇含量,并計算降解率[9]。
1.3.5 乳酸菌對α-葡萄糖苷酶抑制能力的測定
參考ZHANG等[10]以及張軍蒙[6]的實驗方法,并略作修改,在試管中加入50 μL菌液、150 μL的PNPG (2.5 mmol/L)、300 μL PBS溶液(0.1 mol/L, pH 6.8),孵育(37 ℃, 10 min),然后加入100 μL α-葡萄糖苷酶(0.2 U/mL)在37 ℃的條件下反應20 min,最后加入2 mL Na2CO3溶液(1 mol/L)終止反應,在405 nm波長處測OD值,測得的OD值記為A1;用PBS代替α-葡萄糖苷酶,其他操作不變,測得的OD值記為A2;用生理鹽水代替菌液,其他操作不變,測得的OD值記為A3;用生理鹽水代替菌液,用PBS代替α-葡萄糖苷酶,其他操作不變,測得的OD值記為A0。α-葡萄糖苷酶抑制率計算如公式(4)所示:
(4)
1.3.6 數據分析
所有數據均由3次或以上平行實驗計算得出平均值,使用SPSS 25和origin 2017進行數據分析處理以及繪圖,使用Duncan法或t檢驗進行顯著性分析,P<0.05時認為具有顯著性差異。
2 結果與分析
2.1 乳酸菌益生特性的比較
2.1.1 不同乳酸菌產酸能力對比
有研究認為乳酸菌在腸道繁殖過程中產生的乳酸、乙酸、丁酸等短鏈脂肪酸可以改變腸道環境,降低腸道的酸度,從而抑制一些致病菌在人體生長,同時還能促進腸道蠕動,加速了病原體的排出。本實驗使用了2種評價方法來評價乳酸菌的產酸能力,一種是測乳酸菌生長24 h前后pH值的變化大小,一種是用NaOH滴定發酵液并換算成乳酸度,用吉爾涅爾度(°T)表示。從圖1-a、圖1-b可看出,2種評價方法得出的結果趨勢相同。6種菌中產酸能力最強的是L.rhamnosusGG、L.caseiCICC 23184和L.plantarumsubsp.plantarumCICC 20279,24 h的ΔpH均在2.0以上,滴定酸度也都在120 °T左右,均顯著高于其他3種菌。王明好[11]對12株乳酸菌的產酸性能測定發現,其中8株菌的ΔpH為2.0~2.5,最高的一株菌ΔpH為2.42。王磊[12]對65株乳酸菌的產酸能力進行測定,發現大多數乳酸菌發酵后的酸度在100 °T左右,僅有2株菌的酸度可達到140 °T以上。綜上所述,L.rhamnosusGG、L.caseiCICC 23184和L.plantarumsubsp.plantarumCICC 20279這3株菌的產酸能力比較優良。
2.1.2 不同乳酸菌模擬消化道耐受性對比
模擬胃液具有胃蛋白酶和低pH,模擬腸液中含有胰蛋白酶和膽鹽,這些均不利于乳酸菌生長。乳酸菌在人體內發揮作用的前提是必須要對人體的胃腸液有一定的耐受性,擁有較高耐受性的菌株才能更好的在人體內存活并發揮出益生作用。由圖2可知,在模擬胃液處理3 h后,存活率最高的為L.buchneriBNCC 187964和L.acidophilusATCC 4356,存活率分別為60.3%和52.5%,其次是L.plantarumsubsp.plantarumCICC 20279,存活率為47.0%,均高于L.rhamnosusGG。張軍蒙[6]測定了18株乳酸菌對胃液的耐受性,結果表明,18株乳酸菌中有11株存活率在20%~45%,只有4株菌的存活率在50%以上;由圖2可知,對腸液和膽鹽具有較高耐受性的菌株是L.acidophilusATCC 4356和L.plantarumsubsp.plantarumCICC 20279,存活率分別為64.5%和48.3%,均高于L.rhamnosusGG。呂嘉櫪等[13]對18株乳酸菌的腸液耐受力進行了測定,結果發現,其中有16株菌的存活率在20% 以上,其中有3株菌的存活率在70% 以上。綜合分析,L.acidophilusATCC 4356和L.plantarumsubsp.plantarumCICC 20279具有良好的消化道耐受性。
2.1.3 不同乳酸菌黏附能力對比
乳酸菌在腸道發揮益生作用前需要在腸道內完成黏附定植,有研究表明[14]細胞外的膠原蛋白參與了細胞黏附。所以本實驗用牛血清白蛋白作為陰性對照,通過比較乳酸菌對IV型膠原蛋白和牛血清白蛋白黏附量的差異來評價菌株的黏附力。由表1可知,除L.kefirBNCC 190565外,其余菌株對2種蛋白的黏附均有顯著性差異,即L.rhamnosusGG、L.buchneriBNCC 187964、L.acidophilusATCC 4356、L.caseiCICC 23184、L.plantarumsubsp.plantarumCICC 20279均對IV型膠原蛋白具有特異性黏附作用。ARGYRI等[15]對13株乳酸菌研究發現,不同菌株的黏附能力差異顯著,植物乳桿菌和鼠李糖乳桿菌具有較強的黏附能力。

圖2 不同菌株在模擬胃液或模擬腸液中處理3 h后的存活率Fig.2 Survival rate of different strains treated in simulated gastric fluid or simulated intestinal fluid for 3 h
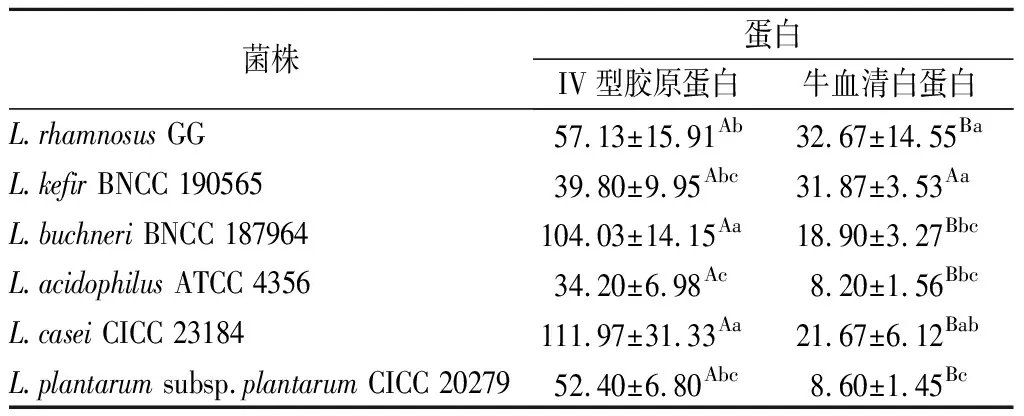
表1 不同菌株對不同蛋白的黏附量Table 1 Adhesion of different strains to different proteins
2.2 乳酸菌抗氧化能力的比較
現存的抗氧化測定方法非常多,但并沒有公認的標準方法,所以在研究物質的抗氧化作用的時候,一般會選取以不同原理為基礎的方法,來共同說明該物質的抗氧化能力。所以綜合考慮,選擇了以下3種方法共同評價乳酸菌的抗氧化能力。
2.2.1 不同乳酸菌菌懸液及發酵液對羥自由基的清除作用
人體中的自由基90%都是氧自由基,羥自由基是一種強烈的氧自由基,這種自由基會導致DNA降解、損傷細胞膜和多糖類物質,由此導致多種人體細胞損傷及脂質過氧化。劉珊春等[16]對18株乳酸菌的羥自由基清除率進行了測定,結果發現清除率最高為34.89%。由圖3可知,幾種菌的菌懸液中,羥自由基清除能力最強的是L.caseiCICC 23184和L.plantarumsubsp.plantarumCICC 20279,L.caseiCICC 23184的羥自由基清除率為40.7%,L.plantarumsubsp.plantarumCICC 20279的羥自由基清除率為38.6%,均高于L.rhamnosusGG;由圖3可知,幾種菌的發酵液中,對羥自由基清除能力最差的是L.buchneriBNCC 187964,清除率為16.7%,其余5種菌發酵液的羥自由基清除率均高于L.buchneriBNCC 187964,且與L.rhamnosusGG無顯著性差異。考慮到乳酸菌產品通常同時包括乳酸菌菌體和分泌物,綜合比較表明,L.acidophilusATCC 4356、L.caseiCICC 23184、L.plantarumsubsp.plantarumCICC 20279均具有較強的羥自由基清除能力。除L.rhamnosusGG外的乳酸菌菌懸液的羥自由基清除率均高于或接近于發酵液,可能是因為這些乳酸菌菌體上清除羥自由基的活性物質含量高于發酵液中的含量。
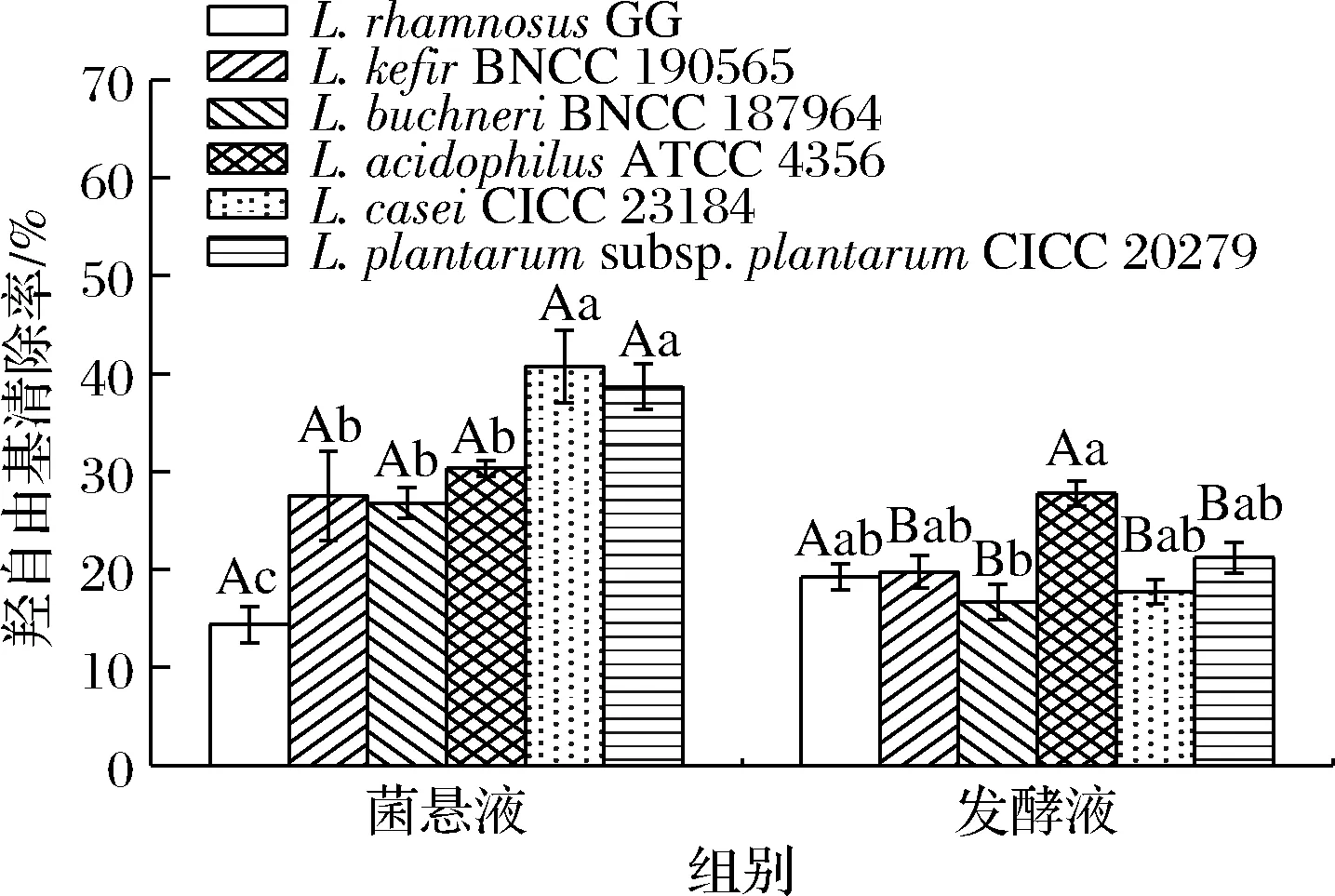
圖3 不同菌株菌懸液和發酵液的羥自由基清除率Fig.3 Hydroxyl radical scavenging rates of bacterial suspensions and fermentation broths of different strains 注:不同大寫字母表示同株菌不同組分有顯著性差異(P<0.05),不同 小寫字母表示不同菌株同種組分具有顯著性差異(P<0.05)(下同)
2.2.2 不同乳酸菌菌懸液及發酵液的還原能力對比
還原能力是指抗氧化劑抵抗氧脅迫和降低螯合亞鐵離子的能力,是體外檢測抗氧化劑抗氧化能力的關鍵指標。由圖4可知,幾種菌的菌懸液中,還原力最強的為L.buchneriBNCC 187964和L.rhamnosusGG;幾種菌的發酵液中,還原力最強的是L.acidophilusATCC 4356,其還原力強于L.rhamnosusGG。綜合比較表明,除L.kefirBNCC 190565外,其余5株菌均表現出較強的還原能力。發酵液還原力顯著高于菌懸液,可能是因為具有還原能力的活性物質主要存在于乳酸菌的發酵產物之中。
2.2.3 不同乳酸菌菌懸液及發酵液對DPPH自由基的清除作用
DPPH是一種人工合成的、穩定的自由基,能與自由基清除劑反應,孤對電子被配對,DPPH自由基變為DPPH-H非自由基形式,溶液從紫色變為黃色,吸光度值也會發生相應的變化。以此為原理進行的抗氧化能力評價的方法具有快速、簡單、靈敏的特點,所以被廣泛應用。由圖5可知,6株菌的菌懸液對DPPH自由基的清除率沒有顯著性差異;從圖5可以看出6株菌的發酵液中,L.plantarumsubsp.plantarumCICC 20279的清除能力顯著高于其他5株菌。對比菌懸液和發酵液的DPPH自由基清除率,發現發酵液的自由基清除能力要遠高于菌懸液。所以推測菌株的抗氧化能力主要靠發酵液中代謝物質來體現。有研究表明,乳酸菌的DPPH自由基清除能力可能和菌體產生的胞外多糖濃度正相關[17]。

圖4 不同菌株菌懸液及發酵液的還原能力Fig.4 The reducing ability of bacterial suspension and fermentation broth of different strains

圖5 不同菌株菌懸液及發酵液的DPPH自由基清除率Fig.5 DPPH radical scavenging rate of bacterial suspension and fermentation broth of different strains
綜合3個指標比較,發現抗氧化能力較強的菌株為L.acidophilusATCC 4356、L.caseiCICC 23184和L.plantarumsubsp.plantarumCICC 20279。DAS等[18]報道了植物乳桿菌和嗜酸乳桿菌具有較高的抗氧化能力,與本文結果相近。
2.3 乳酸菌降膽固醇能力的比較
國外研究者發現,一些飲用乳桿菌發酵乳制品的人群中,其體內的血清膽固醇普遍較低[19]。這一現象引起了學者們的注意,在不斷地研究下,人們發現不同菌類的乳酸菌具有降低膽固醇的效果。本文比較了幾類被證實具有降膽固醇效果的乳酸菌,由圖6可知,6株乳酸菌降解率均在50%以上。TANG等[20]所測的11株菌中膽固醇清除率最高的是一株植物乳桿菌,清除率為47.83%,比較之后可以看出本文所測6株菌均具有優秀的膽固醇降解能力。可能是乳酸菌在生長的過程中,分泌的一些代謝產物,例如胞外多糖或蛋白質,起到了降解膽固醇的作用。王霄鵬等[21]實驗發現乳酸菌發酵液中的多糖、蛋白質等物質對膽固醇均具有一定的降解率。有研究證明,乳酸菌可以通過分泌膽汁鹽水解酶或者吸收、分解膽固醇的方式來降低膽固醇含量[22]。
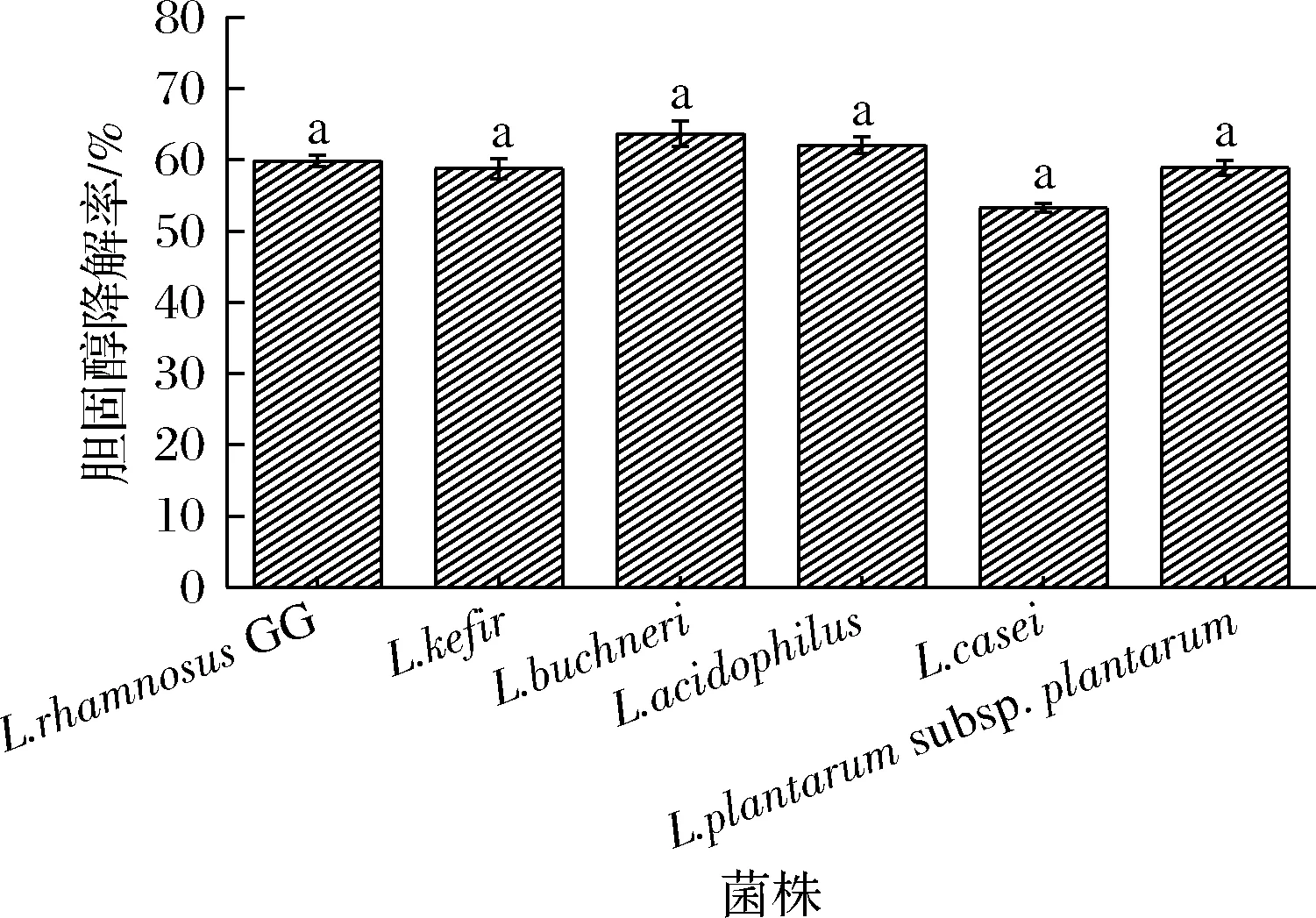
圖6 不同菌株的膽固醇降解率Fig.6 Cholesterol degradation rate of different strains
2.4 乳酸菌對α-葡萄糖苷酶抑制能力的比較
α-葡萄糖苷酶是一種碳水化合物水解酶,催化α-葡萄糖從底物的非還原端釋放。α-葡萄糖苷酶可促進小腸對葡萄糖的吸收,從而提高了血糖和血脂含量水平,所以可以通過抑制α-葡萄糖苷酶來達到降低血糖和血脂的目的[23]。α-葡萄糖苷酶可以降解PNPG產生對硝基苯酚(p-nitrophenol, PNP),所以可以通過測定PNP在405 nm處的吸光度來反映α-葡萄糖苷酶的被抑制程度。由圖7可知,對α-葡萄糖苷酶抑制率最高的是L.buchneriBNCC 187964,抑制率為26.3%,其余5株菌對α-葡萄糖苷酶的抑制率均在10%~20%。WANG等[24]測定了L.rhamnosusGG的α-葡萄糖苷酶抑制率,其抑制率為17.21%,與本文測定的L.rhamnosusGG結果相近。本文所測的其余5株菌的α-葡萄糖苷酶抑制率均與L.rhamnosusGG相近或略高,即均具有較好的α-葡萄糖苷酶抑制效果。
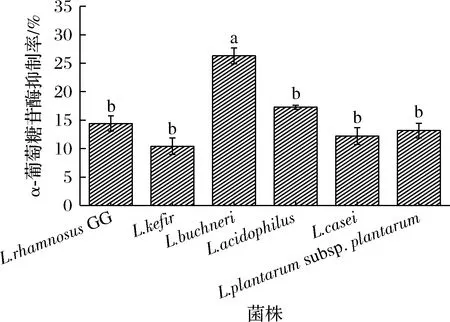
圖7 不同菌株的α-葡萄糖苷酶抑制率Fig.7 α-glucosidase inhibition rate of different strains
3 結論
本文對L.kefirBNCC 190565、L.acidophilusATCC 4356、L.buchneriBNCC 187964、L.caseiCICC 23184、L.plantarumsubsp.plantarumCICC 20279、L.rhamnosusGG這6株乳酸菌進行了益生特性、抗氧化作用、降膽固醇能力、α -葡萄糖苷酶抑制率的測定,旨在篩選出具有較強抗氧化作用、降解膽固醇和降血糖功能的乳酸菌,以期制備出具有更強功能的乳酸菌產品。
對結果分析發現L.acidophilusATCC 4356和L.plantarumsubsp.plantarumCICC 20279具有較強的消化道耐受力,能很好的在人體內生存,且均具有良好的益生活性;抗氧化作用通常需要通過不同的指標來共同評價,考慮到乳酸菌產品通常同時包括乳酸菌菌體和分泌物,所以綜合比較發現抗氧化作用較強的菌株有L.acidophilusATCC 4356、L.plantarumsubsp.plantarumCICC 20279和L.caseiCICC 23184,優于L.rhamnosusGG;6株菌對膽固醇的降解率均在50%以上,表現出很強的膽固醇降解能力;L.buchneriBNCC 187964的α-葡萄糖苷酶抑制率高于L.rhamnosusGG,其余4株菌和L.rhamnosusGG沒有顯著性差異。以L.rhamnosusGG為陽性對照,以抗氧化能力和膽固醇降解率為主要篩選指標,發現L.acidophilusATCC 4356、L.plantarumsubsp.plantarumCICC 20279和L.caseiCICC 23184這3株菌表現良好,但考慮到乳酸菌必須存活下來才能在人體發揮相應的作用,所以排除了腸胃液耐性較差的L.caseiCICC 23184;L.buchneriBNCC 187964具有較強的α-葡萄糖苷酶抑制率,但腸液耐受力較差,同樣被排除;進行一系列的分析比較發現L.acidophilusATCC 4356和L.plantarumsubsp.plantarumCICC 20279不僅有著較好的抗氧化能力和降血脂能力,還有良好的胃腸液存活能力,具有在人體中發揮出相應作用的潛力。

