熱變性程度對谷氨酰胺轉氨酶誘導大豆分離蛋白凝膠性質的影響
趙建生,馬相杰,孟少華,徐姣,李鑫,鄒神中,江玉琴,袁靜瑤,曾茂茂,陳潔
1(河南雙匯投資發展股份有限公司,河南 漯河,462000)2(河南省肉品技術創新中心有限公司,河南 漯河,462000)3(江南大學 食品科學與技術國家重點實驗室,江蘇 無錫,214122)4(江南大學 國家功能食品工程技術研究中心,江蘇 無錫,214122)
大豆分離蛋白(soybean protein isolated,SPI)由于其營養價值高、成本低以及具有眾多優良的功能特性(如起泡性、乳化性、凝膠性等)而被廣泛應用于食品行業中。凝膠性取決于蛋白質的變性、解離和聚集的程度[1-2],是SPI的重要功能特性之一,直接影響大豆制品的外形、口感和質地[3]。目前,誘導SPI凝膠的方法主要有4種,包括熱誘導、酸誘導、鹽誘導或酶誘導[4],其中酶誘導凝膠不會影響食物的營養價值、色澤和質地,是一種作用條件溫和的凝膠手段。谷氨酰胺轉氨酶(glutamine transaminase,TG酶)是在酶誘導凝膠中廣泛使用的一種酶,能夠催化酰基供體進行脫酰胺和酰基轉移,進而形成共價鍵以完成分子交聯[5]。TG酶介導的分子交聯能夠改善蛋白的功能特性,LIU等[6]指出,SPI中幾乎所有的蛋白質組分都能通過TG酶處理而交聯,同時顯著提高蛋白質平均粒徑、乳化性和乳化穩定性、起泡性和泡沫穩定性、持水能力和凝膠質地。YASIR等[7]證實大豆蛋白是TG酶的優良底物,經過TG酶處理后的豆腐更加牢固,硬度顯著增強。
熱變性程度對蛋白質的二硫鍵和疏水相互作用的影響不同,可直接影響大豆蛋白的凝膠特性。RENKEMA等[8]指出,SPI的凝膠形成由熱變性決定,變性蛋白的比例與凝膠的硬度呈正相關。目前,應用較廣的商業SPI,由于受原料或者堿溶酸沉和噴霧干燥等操作的影響,蛋白質結構呈現不同程度的熱聚集,這種聚集體的形成對SPI的功能性質有較大影響[9-10]。然而,關于不同變性程度的SPI對TG酶誘導形成的蛋白凝膠性質的影響報導較少。
因此,本文通過熱處理獲得不同變性程度的SPI,研究不同結構和性質的SPI對TG酶誘導形成的蛋白凝膠性質的影響。同時,探索TG酶在不同SPI濃度、酶濃度、培養溫度條件下的交聯效果,以模擬在實際生產過程中由于不同的加工處理工藝造成的SPI結構和性質差異,以及對最終TG酶誘導的凝膠制品的影響,以利于根據SPI熱聚集體的結構和性質調控大豆蛋白凝膠的性質。
1 材料與方法
1.1 材料
大豆(臺灣292),購于黑龍江慶美種業有限公司;TG酶(酶活力90 U/g),江蘇泰興市東圣生物科技有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS),美國Sigma公司;無水乙醇、考馬斯亮藍、正己烷、鹽酸、氫氧化鈉均為分析純,國藥集團化學試劑有限公司。
1.2 儀器與設備
9FZ-15B粉碎機,臺州余國電器有限公司;DHG-9070恒溫干燥箱,上海一恒科技有限公司;KDN-103F自動凱氏定氮儀,上海纖檢儀器有限公司;DELTA320 pH計,梅特勒-托利多儀器(上海)有限公司;GL-10MD冷凍離心機,湖南湘儀儀器公司;F-2700熒光分光光度計,日本日立公司;S3500激光粒度分析儀,美國Microtrac公司;Mini-PROTEAIN Tetra Cell電泳儀、Gel DocTMEZ imager凝膠成像系統,美國Bio-Rad公司;TA-XT Plus質構儀,英國Stable Micro System公司;ZPH-300顯微鏡,上海宙山精密光學儀器有限公司。
1.3 實驗方法
1.3.1 未熱處理SPI的制備
大豆去皮、粉碎、脫脂,將脫酯豆粉與水以質量比1∶10混合并用2 mol/L的NaOH溶液調節pH至8.0,室溫下攪拌1.5 h。離心(6 500 r/min,25 min,4 ℃)取上清液,采用2 mol/L的鹽酸溶液調節pH至4.5,攪拌1 h后,離心(3 500 r/min,15 min,4 ℃),取沉淀,按照沉淀與水的質量比1∶6復溶并調節pH至7.0,冷凍干燥,得到未熱處理SPI(蛋白得率64.9%,蛋白含量85.5%,水分3.5%,脂肪0.3%,灰分4.6%),將樣品研磨成粉末并真空包裝,置于-80 ℃冰箱存放。
1.3.2 不同熱處理SPI的制備
對未熱處理SPI溶液(蛋白質量分數為6.1%)進行不同程度的熱處理,熱處理溫度分別為65、75、85、95 ℃,熱處理時間為10 min,冷凍干燥,將樣品研磨成粉末并真空包裝,置于-80 ℃冰箱存放。
1.3.3 蛋白凝膠的制備
1.3.3.1 不同熱處理SPI制備的蛋白凝膠
將質量分數12%的不同熱處理SPI充分溶解(溶液pH 6.9),放入4 ℃冰箱冷藏2 h,加入0.90 U/g 的TG酶,中心溫度逐漸升溫至50 ℃,并保溫1 h,75 ℃滅酶15 min,立即冰浴冷卻,冷藏過夜后脫模,備用。
1.3.3.2 不同蛋白濃度下的蛋白凝膠
將SPI按照8%、10%、12%(質量分數)分別進行溶解(溶液pH 6.9),放入4 ℃冰箱冷藏2 h,加入0.90 U/g的TG酶,中心溫度逐漸升溫至50 ℃,并保溫1 h,75 ℃滅酶15 min,立即冰浴冷卻,冷藏過夜后脫模,備用。
1.3.3.3 不同TG酶添加量下的蛋白凝膠
將質量分數12%的SPI充分溶解(溶液pH 6.9),放入4 ℃冰箱冷藏2 h,加入0.45、0.90、1.80 U/g的TG酶,中心溫度升溫至50 ℃,保溫1 h,75 ℃滅酶15 min,立即冰浴冷卻,冷藏過夜后脫模,備用。
1.3.3.4 不同培養條件下的蛋白凝膠
將質量分數12%的SPI充分溶解(溶液pH 6.9),放入4 ℃冰箱冷藏2 h,加入0.90 U/g的TG酶,中心溫度升溫至50 ℃,直接冷藏12 h或保溫1 h,75 ℃滅酶15 min,立即冰浴冷卻,冷藏過夜后脫模,備用。
1.3.4 SDS-PAGE
參考李偉偉[11]實驗方法并稍作改動。濃縮膠丙烯酰胺質量分數為4%,分離膠質量分數為12%,pH 8.0樣品緩沖液含有0.125 mol/L Tris-HCl以及十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、甘油、溴酚藍(質量分數分別為2%、10%、0.05%),其中還原電泳的樣品緩沖液在上述基礎上添加質量分數10%的β-巰基乙醇。稀釋不同結構SPI至質量濃度4 mg/mL,與等體積樣品緩沖液混合,上樣量為15 μL。電泳結束后,用質量分數1%考馬斯亮藍R-250染色30 min,隨后用脫色液脫色至底色褪去,利用凝膠成像系統對膠進行拍照和數據分析。
1.3.5 疏水性的測定
參考郭鳳仙[12]的方法,采用ANS熒光探針法測定。將SPI樣品溶解于0.01 mol/L,pH 7.0磷酸緩沖溶液中,質量濃度范圍為0.2~1.0 mg/mL。取 40 μL 的8.0 mmol/L的ANS溶液與3 mL稀釋后的樣品溶液混合。設定激發波長λex=360 nm(狹縫校正5 nm),發射波長λem=515 nm,用熒光光譜儀測定熒光強度。熒光強度對蛋白質濃度作曲線,斜率即為蛋白質的表面疏水性指數。
1.3.6 溶解度的測定
參考JIANG等[13]測定SPI溶解性的實驗方法并稍作改動,稱取SPI(0.5~2 g)溶解在50 mL磷酸緩沖溶液(pH 7.0)中,磁力攪拌器攪拌1 h,8 000 r/min離心30 min,取上清液,用凱氏定氮法測蛋白質含量。溶解度等于上清液蛋白含量除以總蛋白含量。
1.3.7 粒徑分布的測定
取適量樣品置于激光粒度分析儀內,在濕法模式下測定樣品的粒徑分布曲線。其中顆粒折射率為1.54,分散劑為水,分散劑折射率為1.330。
1.3.8 蛋白凝膠強度的測定
參考王旭峰[4]凝膠強度的測試方法并稍作改動。采用TA-XT Plus質構儀測定制備的蛋白凝膠的硬度。所用探頭為P/0.5,測前速度2 mm/s,測定速度1 mm/s,測后速度5 mm/s,觸發力為5 g,測定距離為凝膠高度的50%。凝膠硬度以測試中所得的最大感應力(g)表示。
1.3.9 蛋白凝膠持水性的測定
將蛋白凝膠樣品在8 000 r/min條件下離心20 min,持水性計算如公式(1)所示:
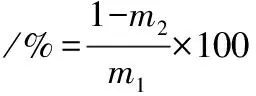
(1)
式中:m1為凝膠樣品中所含水分的總質量,g;m2為離心后凝膠析出水分的質量,g。
1.3.10 蛋白凝膠形態
取樣品切面,將其放在載玻片上用光學顯微鏡放大100倍并拍照。
1.4 數據分析
所有實驗重復3次,采用Origin 2022軟件進行作圖。采用SPSS 19.0分析其顯著性差異以及相關性(P<0.05)。
2 結果與分析
2.1 熱處理溫度對SPI結構和性質的影響
2.1.1 蛋白組成
對不同溫度熱處理的蛋白質進行電泳分析(圖1),得到蛋白質的結構組成。SPI主要由7S蛋白和11S蛋白組成,其中7S是由α′(86 kDa)、α(66 kDa)和β(51 kDa)3個亞基組成,它們通過非共價鍵結合在一起,11S則是由酸性亞基A(34~43 kDa)和堿性亞基B(17~26 kDa)組成,A亞基和B亞基通過二硫鍵形成穩定的AB亞基。在非還原電泳中,與未熱處理相比,65、75 ℃熱處理亞基條帶變化不明顯,隨著加熱強度的增加,條帶頂部的聚集體顏色逐漸加深,即蛋白聚集程度逐漸增強,同時,7S和11S蛋白條帶顏色逐漸減弱,尤其當加熱溫度升至85 ℃后,AB亞基、A亞基和B亞基條帶明顯減少。在還原電泳中,頂端的聚集體數量相比于未加入β-巰基乙醇的樣品顯著減少,并主要轉化為7S組分的α′、α、β亞基和11S組分的A、B亞基,說明引起蛋白分子聚集的作用力主要是二硫鍵[14],高于85 ℃的高溫處理后11S蛋白聚集嚴重,所以聚集體二硫鍵打開后A、B亞基的顏色較深。
總體而言,不同加熱溫度可導致大豆蛋白呈現不同程度的變性現象,SPI的變性伴隨著亞基的變化,其中AB亞基的變化尤為明顯,這與陳力揚等[15]的研究結果一致,具體表現為AB亞基隨著加熱強度的增加逐漸減少直至消失,這種變化的臨界溫度為85 ℃。同時,熱變性大豆蛋白趨向于形成由二硫鍵連接的可溶性聚集體。

1~6分別代表標品、未熱處理、65、75、85、95 ℃的SPI樣品 a-非還原電泳;b-還原電泳圖1 SPI經不同熱處理的SDS-PAGE圖Fig.1 SDS-PAGE patterns of SPI subjected to different heat treatment
2.1.2 表面疏水性和溶解性
對不同熱處理溫度的SPI進行表面疏水性和溶解性分析,結果如圖2所示,隨著熱處理強度的增大,SPI的表面疏水性大幅度提高,尤其當溫度升高至85 ℃時,表面疏水性相比于未熱處理蛋白增加了1.4倍,這是因為隨著熱處理溫度的升高,SPI熱變性加劇,分子鏈展開,暴露了更多的疏水基團,從而引起表面疏水性的增加,該結論與文獻研究結果一致[16-17]。當熱處理溫度進一步提高至95 ℃時,11S徹底變性,表面疏水性與85 ℃熱處理相比差異不大,說明在較高溫度條件下,疏水相互作用可能參與了蛋白分子的重排和聚集[18]。
通過研究不同熱處理溫度下SPI的溶解度發現,隨著溫度的升高可溶性蛋白溶解度呈現總體下降的趨勢,具體而言,65 ℃熱處理的蛋白相比于未熱處理蛋白溶解度無顯著差異(P<0.05),而隨著溫度升高,溶解度顯著降低(P<0.05),尤其對于95 ℃熱處理蛋白而言,溶解度相較于未熱處理蛋白降低了24%。這是因為隨著蛋白的疏水性增強,發生了分子間的聚集行為[19],從而導致其溶解度降低。
2.1.3 粒徑分布
對不同熱處理溫度的SPI進行粒徑分布分析,結果如圖3所示。SPI的熱處理會導致生成不同大小的蛋白聚集體,且隨著熱處理溫度的升高,SPI的粒徑逐漸增大。具體而言,未熱處理以及75 ℃處理的蛋白均存在3個峰,其中未熱處理蛋白分別分布在<0.1、0.7~60、60~110 μm,而75 ℃處理的蛋白的分布峰明顯右移。65、85、95 ℃熱處理蛋白均為單峰,其中65、85 ℃熱處理蛋白粒徑分布峰形寬、矮,且隨著溫度的升高分布峰右移,而當溫度升高至95 ℃時,蛋白出現一個明顯的窄、高峰,且略微向左移動,該結果與王冬梅等[20]的結果一致,陳力揚等[15]也證實了當大豆蛋白的變性程度增大至接近完全變性時,平均粒徑不再增大,反而略微減小。加熱處理破壞蛋白的空間結構,蛋白內部疏水基團暴露,增大了蛋白質分子的疏水相互作用,從而誘導蛋白分子疏水性聚集,粒徑分布向右偏移。當溫度升高至95 ℃時,蛋白分子熱運動過于劇烈,導致大粒徑聚集體熱解聚形成小粒徑蛋白聚集體[19]。

圖2 SPI經不同熱處理的表面疏水性和溶解度Fig.2 The surface hydrophobicity and solubility of SPI subjected to different heat treatment 注:不同小寫字母表示差異顯著(P<0.05)(下同)
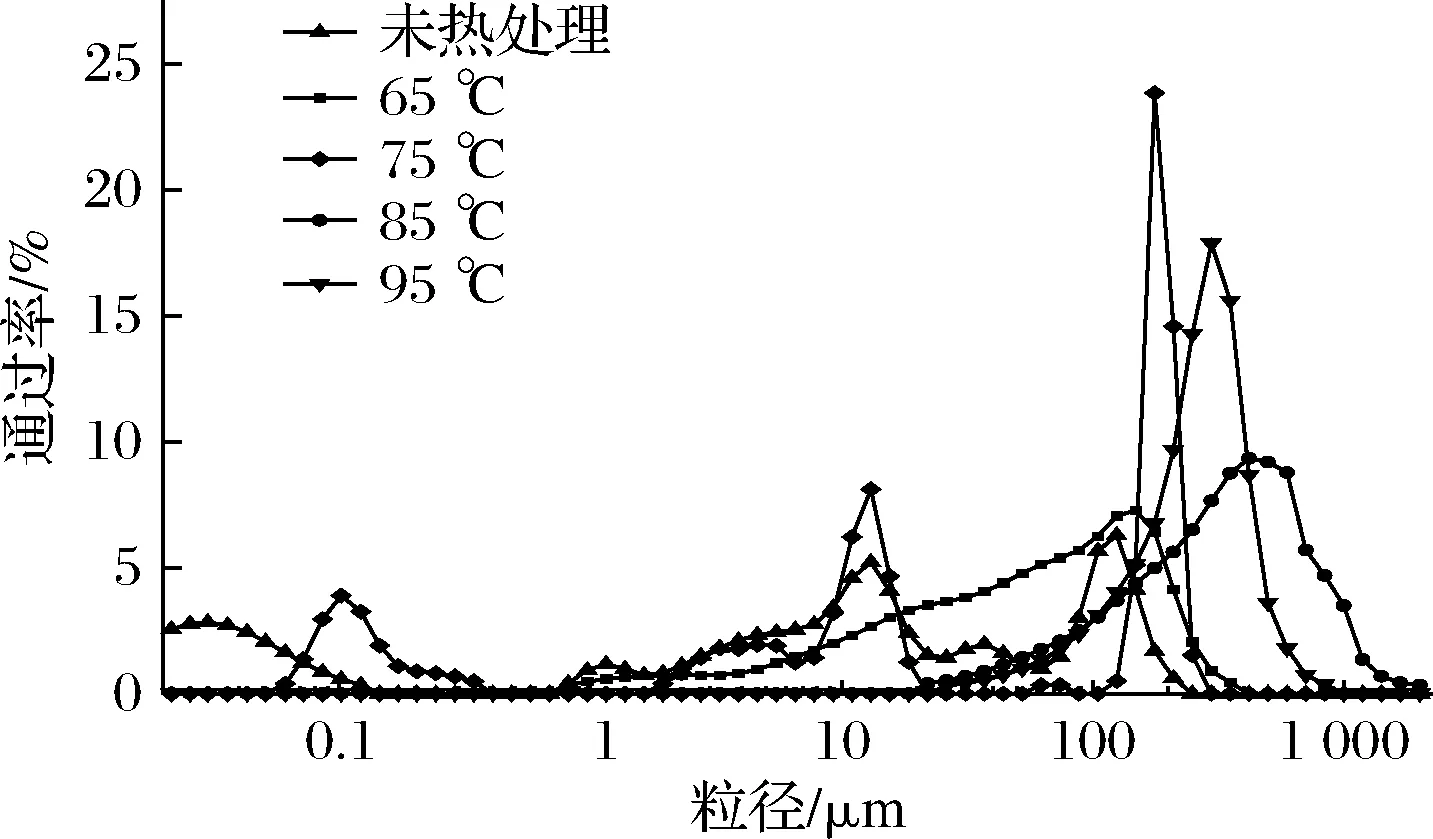
圖3 SPI經不同熱處理的粒徑分布圖Fig.3 Particle size distribution of SPI subjected to different heat treatment
2.2 不同熱處理SPI對其凝膠性質的影響
研究了不同熱處理溫度對TG酶誘導的SPI凝膠的強度(以硬度為表征指標)、持水性以及凝膠形態的影響。由圖4-a可知,65 ℃熱處理蛋白凝膠強度和持水性相比于未熱處理蛋白無顯著差異(P>0.05),而隨著溫度進一步升至75 ℃,凝膠強度顯著增大(P<0.05),這是因為蛋白分子展開,TG酶反應位點增加,有利于凝膠強度和持水性的增強。當升溫至85 ℃時,凝膠強度出現顯著的降低(P<0.05),甚至低于未熱處理蛋白,猜測可能是因為在以TG酶為主導誘導蛋白分子交聯形成凝膠時,隨著溫度的進一步升高,蛋白分子發生疏水性聚集,TG酶反應位點大大減少,從而導致凝膠強度減弱。當溫度升至95 ℃時,凝膠強度又呈現顯著的增強(P<0.05),由2.1中的表面疏水性和粒徑可以推測,高溫導致大豆蛋白分子發生熱解聚,進而進行分子重排和聚集,從而暴露更多的TG酶反應位點,凝膠強度大大增強。由圖4-b和圖4-c可知,隨著熱處理溫度的升高,蛋白凝膠逐漸由略透明轉變成不透明和偏白色狀態,且通過顯微鏡(100倍)看出,蛋白凝膠逐漸由細密無氣孔轉變成氣孔較多較大的狀態。由于95 ℃處理SPI發生的這一有趣現象,后續以其為對象進一步研究蛋白濃度、加酶量和培養溫度對TG酶誘導蛋白凝膠的影響。

a-硬度和持水性;b-宏觀凝膠形態(1~5分別代表未熱處理、 65、75、85、95 ℃熱處理SPI);c-微觀凝膠形態圖4 不同熱處理SPI對其凝膠強度、持水性、宏觀和微觀 凝膠形態的影響Fig.4 Effect of SPI subjected to different heat treatment on the gel strength, water holding capacity, macrograph, and micrograph of SPI gels
2.3 SPI的含量對SPI凝膠性質的影響
圖5為蛋白含量對蛋白凝膠性質的影響,由圖5-a可知,隨著蛋白含量的增加,凝膠強度顯著增大(P<0.05),而持水性基本保持不變,對于凝膠強度而言,當質量分數升高至12%時,凝膠強度是10%的2.9倍。前期預實驗結果表明,蛋白質量分數為6%時形成的凝膠強度很弱,不在所用質構儀的量程范圍內。蛋白凝膠的形成是蛋白-蛋白和蛋白-溶劑的相互作用以及臨近肽鏈之間的吸引力和排斥力平衡的結果[21]。因此,在蛋白質量分數低于6%時,蛋白-溶劑相互作用占主導,體系不易凝結形成凝膠,而隨著蛋白含量的增加,蛋白-蛋白相互作用占主導,凝膠強度隨之增大。由圖5-b和圖5-c亦可知,8%時形成的蛋白凝膠較軟、塌,而隨著含量的增加,凝膠塊較為硬挺,同時形成的氣孔也由少變多。
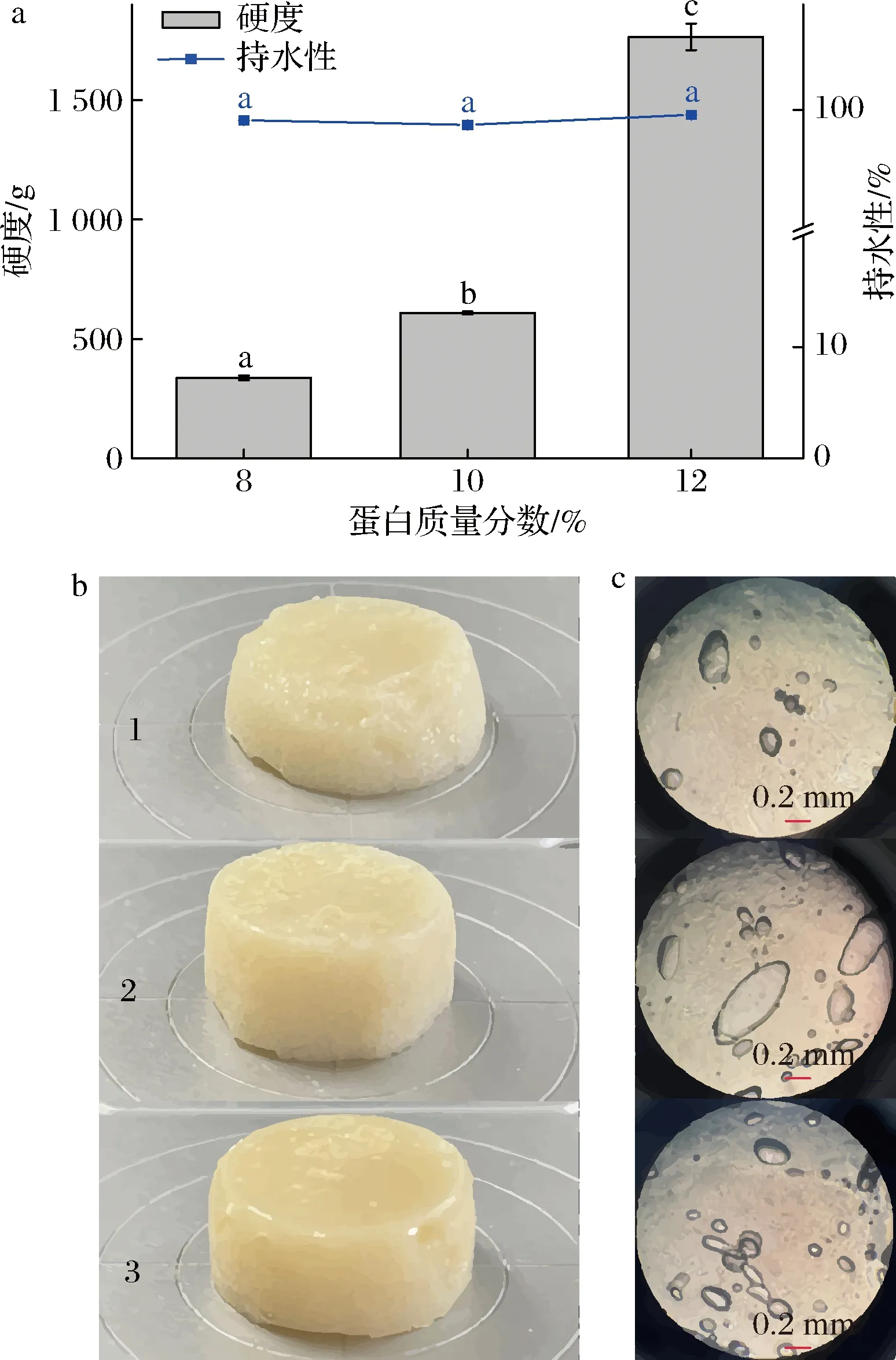
a-硬度和持水性;b-宏觀凝膠形態(1~3分別代表SPI 質量分數8%、10%、12%);c-微觀凝膠形態圖5 SPI含量對蛋白凝膠強度、持水性、宏觀和 微觀凝膠形態的影響Fig.5 Effect of SPI content on the gel strength, water holding capacity, macrograph, and micrograph of SPI gels
2.4 TG酶濃度對SPI凝膠性質的影響
TG酶濃度對大豆蛋白凝膠性質的影響如圖6所示,隨著TG酶濃度的增加(1.80 U/g以內),凝膠強度顯著增大(P<0.05)。已有文獻證實[22],TG酶的酶促反應物ε-(γ-谷氨酸)賴氨酸的含量隨TG酶濃度的升高而升高。TG酶濃度由0.90 U/g增至1.80 U/g時,持水性出現顯著降低(P<0.05),結合圖6-b和圖6-c發現,TG酶濃度的增大無論是宏觀還是微觀層面上均造成了蛋白凝膠氣孔的增多,因而未形成緊密的網絡結構,無法束縛住凝膠體系中的水,從而導致持水性降低。
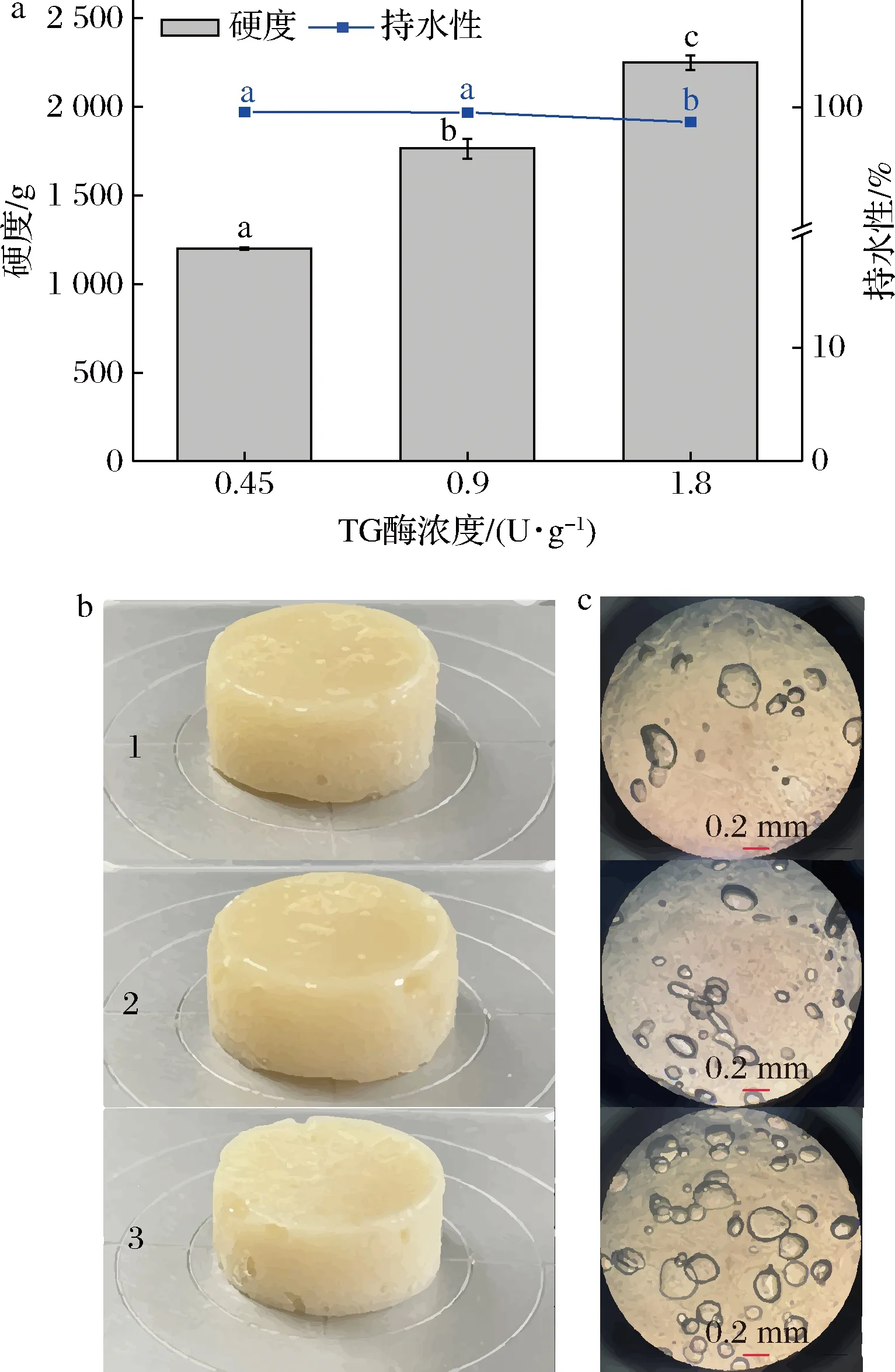
a-硬度和持水性;b-宏觀凝膠形態(1~3分別代表TG酶濃度 0.45、0.90、1.80 U/g);c-微觀凝膠形態圖6 TG酶濃度對SPI凝膠強度、持水性、 宏觀和微觀凝膠形態的影響Fig.6 Effect of TG concentration on the gel strength, water holding capacity, macrograph, and micrograph of SPI gels
2.5 培養溫度對SPI凝膠性質的影響
TG酶的最適培養溫度在50~55 ℃,但是,工業上(如利用TG酶制備千葉豆腐等)常用4 ℃培養過夜。為研究兩種方法對蛋白凝膠性質的影響,選取了加酶后50 ℃水浴培養1 h,75 ℃滅活以及加酶后4 ℃培養過夜,75 ℃滅活兩種處理工藝。由圖7-a可知,50 ℃培養的蛋白凝膠強度顯著高于4 ℃培養樣品(P<0.05),增加約64%。雖然4 ℃培養條件下凝膠強度有一定減弱,但對持水性無影響,同時,由圖7-b和圖7-c可知,4 ℃培養蛋白凝膠較為透明、表面光滑且氣孔較少,這可能是由于低溫條件下蛋白充分溶脹,TG酶可以誘導SPI更好地形成緊密的網絡結構。

a-硬度和持水性;b-宏觀凝膠形態(1、2分別代表培養 溫度50、4 ℃);c-微觀凝膠形態圖7 培養溫度對SPI凝膠強度、持水性、宏觀和微觀凝膠 形態的影響Fig.7 Effect of culture temperature on the gel strength, water holding capacity, macrograph, and micrograph of SPI gels
3 結論
熱處理加劇了SPI亞基的解離與聚集,并導致SPI的表面疏水性增強和溶解性下降,同時粒徑隨溫度的升高而增大,但升至一定程度(95 ℃)粒徑開始減小且分布均勻。熱處理SPI樣品經TG酶誘導形成凝膠后,凝膠強度在85 ℃時最低,而在95 ℃時達到最高,表明大豆蛋白分子經過一定程度的熱處理,分子展開,疏水相互作用增強,逐漸形成聚集體,此過程涉及TG酶反應位點逐漸增多又降低的過程,而在較高溫度下,蛋白分子發生熱解聚,此時TG酶反應位點增多,凝膠強度最大,持水性也隨之增大。對于95 ℃熱處理蛋白的凝膠,隨著蛋白含量的增大,凝膠強度增大,同時氣孔逐漸增多;隨著TG酶添加量的增加,凝膠強度增大,而持水性在TG酶添加量為1.80 U/g時達到最低,同時氣孔多且大;50 ℃培養的蛋白凝膠強度高于4 ℃培養樣品,但凝膠形態不如4 ℃凝膠樣品細膩透明。總之,大豆蛋白一定程度的熱變性(尤其95 ℃熱處理)有利于低溫下(相較于熱致凝膠)經TG酶誘導形成蛋白凝膠,這為工業生產提供了一定的理論依據。

