Connexin43敲降對血紅素誘導的星形膠質細胞凋亡和鐵死亡的影響
陸聰, 桂如林, 呂廣釗, 張志堅, 盧小東, 楊勇
(1. 江蘇大學醫學院,江蘇 鎮江 212013; 2. 廣東省人民醫院神經外科,廣東 廣州 510080)
星形膠質細胞(astrocyte,ASC)是中樞神經系統內數量最多的細胞,為神經元提供營養和機械支持。中樞神經系統在遭受炎癥、腫瘤、損傷等情況下會出現ASC活化,也稱反應性膠質增生[1-4]。ASC之間存在廣泛的縫隙連接,連接蛋白(Connexin,Cx)是形成縫隙連接的分子基礎,約有20種亞型,ASC、神經元和小膠質細胞分別高表達Cx43、Cx36和Cx32[5]。Cx在細胞膜上形成的同源或異源六聚體中空結構稱為連接子,具有半通道功能,介導細胞與細胞外液的物質交換[6-8]。相鄰細胞膜上的連接子對接形成縫隙連接通道,允許分子量在1.5 kDa以下的離子、信號分子和神經遞質等小分子物質在相鄰細胞間傳遞,形成細胞間離子和代謝物偶聯,稱為縫隙連接介導的細胞間通訊(gap junctional intercellular communication,GJIC)[9-10]。此外,Cx43還具有非通道相關的間接調控功能:Cx43羧基端可與β-catenin,c-Src,Cyclin E等調節蛋白以及細胞骨架結合,調控細胞的增殖、遷移、分化和細胞極性[11-13]。
鐵死亡是指一種鐵依賴的程序性細胞死亡。細胞外的無機鐵通常是以無毒的Fe3+的形式與轉鐵蛋白結合,通過細胞膜上的轉鐵蛋白受體轉運進入細胞內。血紅蛋白降解產生的血紅素是一種強烈的活性氧誘導劑,通過細胞膜上的轉運體被轉運至細胞內,釋放出Fe2+參與芬頓循環,產生大量自由基引起細胞鐵死亡[14-15]。
生理狀態下,ASC之間通過Cx43形成廣泛的細胞間縫隙連接,形成的合胞體樣結構對維持中樞神經系統穩態具有重要意義[16-19]。前期研究發現,腦出血后ASC中Cx43表達下調,觸發了Yes相關蛋白(YAP)核轉位,介導了ASC活化過程中的表型轉化[20]。但關于腦出血后ASC中Cx43表達水平對氧化血紅素(hemin)誘導的細胞凋亡和鐵死亡的影響迄今未見報道。
本研究通過敲降ASC中Cx43表達,觀察細胞對hemin損傷作用的反應;通過生信分析,預測Cx43與鐵死亡的相關性及可能涉及的信號通路,并進行驗證,為后續深入的機制研究提供線索。
1 材料與方法
1.1 材料與試劑
SD紅皮鼠購自江蘇大學實驗動物中心,本研究獲得廣東省人民醫院醫學倫理委員會批準(No.GDREC2019173A)。Cx43干擾和對照慢病毒(上海漢恒生物科技公司),具體堿基序列見表1。一步法Tunel細胞凋亡檢測試劑盒和活性氧(ROS)、乳酸脫氫酶(LDH)檢測試劑盒(南通碧云天生物技術公司);丙二醛(MDA)、還原型谷胱甘肽(GSH)測定試劑盒(南京建成生物技術研究所)。小鼠抗α微管蛋白抗體(武漢博士德生物公司),兔抗Cx43、YAP、Bcl-2、Caspase3、c-Caspase3抗體(美國CST公司);兔抗Bax抗體(英國Abcam公司);兔抗谷胱甘肽過氧化物酶4(GPX4)抗體(美國Affinity公司)。RIPA裂解液及HPR標記的羊抗兔二抗(南通碧云天生物技術公司)。
1.2 方法
1.2.1 ASC純化培養 參照文獻[21]的方法提取新生SD大鼠的大腦皮層ASC,取出生1~2 d的SD紅皮鼠,采用5%異氟烷吸入麻醉后斷頭處死,75%乙醇浸泡消毒后取腦,顯微鏡下分離大腦皮層,去除腦膜、血管和海馬。剩余的皮層組織轉入0.25%的胰蛋白酶溶液中,輕輕吹打,37 ℃消化10 min。采用孔徑70 μm細胞濾網過濾組織殘渣,收集濾液,1 000 r/min離心5 min收集細胞沉淀,重懸于10%胎牛血清的高糖DMEM培養液中,接種于多聚賴氨酸包被的培養皿中,置于培養箱內37 ℃、95%濕度和5% CO2條件下培養。當細胞融合時,將培養瓶在37 ℃搖床上以220 r/min振蕩1 h,去除小膠質細胞和少突膠質前體細胞。經免疫熒光染色鑒定,通過此法分離培養的ASC純度超過95%,用于后續實驗。

表1 Cx43干擾和對照慢病毒堿基序列
1.2.2 慢病毒感染及干擾慢病毒篩選 ASC以5×103/孔的密度接種于96孔板中,待細胞貼壁。根據病毒液滴度,分別計算感染復數(multiplicity of infection,MOI)為3,10,60和100時所需的病毒液用量,用完全培養液稀釋,并加入終濃度為5 μg/mL的聚苯乙烯,每孔加入相應MOI值的含慢病毒培養液50 μL,4 h后,每孔再加入50 μL不含病毒液的完全培養液(半體積感染法)。病毒感染24 h后,棄去含有病毒液的培養液,換上新鮮的完全培養液,于37 ℃培養箱繼續培養。感染72 h后,在熒光顯微鏡下觀察綠色熒光細胞百分比,確定各MOI值的感染效率。選擇合適的MOI值用于后續實驗。
將ASC按照5×105/孔的密度接種于6孔板中,按照上述慢病毒感染方法,使用對應的MOI值,進行Cx43-shRNA1,Cx43-shRNA2,Cx43-shRNA3和Cx43NC感染。72 h后收集細胞,提取蛋白用于蛋白質印跡檢測Cx43表達,鑒定各慢病毒的干擾效率,篩選干擾效率最高的慢病毒用于后續實驗。
1.2.3 細胞分組及處理 將ASC按照5×105/孔的密度接種于6孔板中,分為對照組(Control)、溶劑對照組(Vehicle)、hemin組、Cx43NC+hemin組、Cx43KD+hemin組。待細胞貼壁后按照上述慢病毒感染操作進行Cx43-shRNA1和Cx43NC慢病毒感染,48 h后,向各組細胞中加入如下處理因素:對照組為無血清DMEM,溶劑對照組為含有同等稀釋度hemin溶劑的無血清DMEM,hemin組、Cx43NC+hemin組和Cx43KD+hemin組加入終濃度為25 μmol/L hemin的無血清DMEM。對于Verteporfin(Vp,YAP抑制劑)干預實驗分組:Cx43NC+hemin組、Cx43KD+hemin組和Cx43KD+hemin+Vp處理組。Vp的終濃度為5 μmol/L。
1.2.4 ROS,GSH,MDA測定和LDH釋放實驗檢測鐵死亡 上述各組接受處理12 h后的ASC,吸出培養液,加入終濃度為10 μmol/L的DCFH-DA熒光探針,37 ℃孵育20 min后去除DCFH-DA,用無血清細胞培養液洗滌細胞3次,以充分去除未進入細胞內的DCFH-DA。消化收集細胞,采用熒光酶標儀檢測各孔熒光強度。以對照組為參照,計算各組細胞的相對ROS產生量。
收集上述各組接受處理12 h后的ASC,裂解細胞并提取蛋白,采用BCA試劑盒測定蛋白濃度,取細胞裂解蛋白樣品,參照試劑盒說明書進行MDA和GSH檢測,參照標準曲線計算出單位蛋白含量中MDA和GSH的含量,并以對照組為參照,計算各處理組細胞的相對MDA和GSH含量。
收集上述各組接受處理24 h后的ASC,參照LDH檢測試劑盒說明書進行檢測。按照以下公式計算細胞死亡率。細胞死亡率(%)=(處理組樣品光密度-無細胞空白培養液對照組光密度)/(細胞最大酶活性的光密度-無細胞空白培養液對照組光密度)×100。
1.2.5 Tunel染色檢測細胞凋亡 收集上述處理過12 h的細胞,PBS洗滌3次,加入4%多聚甲醛溶液固定1 h。使用一步法Tunel染色試劑盒檢測細胞凋亡,參照試劑盒說明書進行Tunel染色,熒光顯微鏡下觀察并拍照。
1.2.6 蛋白質印跡檢測細胞凋亡和鐵死亡相關蛋白表達 收集上述處理過的細胞,采用RIPA蛋白裂解液提取細胞總蛋白,測定蛋白濃度后,按照每泳道30 μg上樣進行聚丙烯酰胺凝膠電泳、轉膜,依次孵育抗體后加入超敏ECL,在凝膠成像系統中觀察結果并拍照,并用ImageJ進行灰度分析。使用的一抗和二抗稀釋度:α微管蛋白(1 ∶1 000),Cx43(1 ∶1 000),Bax(1 ∶1 000),Bcl2(1 ∶1 000),GPX4(1 ∶1 000),Caspase3(1 ∶1 000),c-Caspase3(1 ∶1 000);HPR標記的羊抗兔二抗(1 ∶5 000)。
1.2.7 免疫熒光染色檢測YAP表達 將ASC以每孔5×104的密度接種于24孔板。按照上述加入處理因素后,將細胞用4%多聚甲醛固定1 h。PBS洗滌3次,室溫下加入0.3% Triton X-100破膜15 min后加入10% BSA溶液封閉1 h。隨后加入兔抗YAP抗體(1 ∶250)并于4 ℃孵育過夜。PBS洗滌后,加入驢抗兔IgG(1 ∶300),室溫孵育1 h。PBS洗滌后,DAPI染色5 min。激光共聚焦顯微鏡下觀察并拍照。
1.2.8 生物信息學分析
1.2.8.1 采用生物信息學對Cx43相關性差異基因進行分析 為了預測Cx43在腦組織中的功能,提取了GTEx數據庫正常腦組織轉錄組數據,根據Cx43表達量對轉錄組表達矩陣進行分組,利用R語言pheatmap包繪制熱圖,當兩組樣本有截然不同的基因表達特征時,利用R語言limma包進行差異基因分析,Log2(差異倍數)的絕對值大于均值+2倍標準差且標準化P值小于0.05被認為是顯著差異基因,基于此得出Cx43相關性差異基因以及其在不同分組中表達差異倍數,用R語言ggplot()函數繪制火山圖。
1.2.8.2 采用生物信息學對Cx43相關性差異基因集富集分析 利用上述方法得到的差異表達基因及其表達變化倍數,使用R語言GSEABase包中的GSEA()函數,選擇“h.all.v7.2.symbols.gmt”作為注釋基因集、設定置換次數為1 000次進行基因集富集分析。結果中NES絕對值>1、NomP<0.05且FDRP<0.25被認為差異有統計學意義。最后選擇顯著富集到的GO基因集,包括Hippo通路基因集,鐵離子通道結合基因集,脂質過氧化基因集,缺氧應激基因集等,利用GSEAplot()函數繪制富集圖。
1.2.8.3 采用生物信息學構建轉錄調控網絡并分析轉錄因子 轉錄調控網絡(transcriptional regulatory network,TRN)由轉錄因子與其靶基因組成,轉錄因子識別特定DNA序列并在基因組層面上調控基因表達。基于此,提取GTEx數據庫中1 141個正常腦組織轉錄組數據,通過sample()函數隨機抽取100個轉錄組矩陣,將其作為標準矩陣,使用R語言RTN包tni.constructor()算法構建轉錄增強相關結構域(transcriptional enhanced associate domain,TEAD)轉錄因子家族的轉錄調控網絡;然后利用Cx43表達量作為分組條件對這1 141個正常腦組織轉錄組表達數據進行分組,使用上述步驟構建好的轉錄調控網絡,利用tni2tna.preprocess()進行轉錄因子調控網絡富集分析,并利用tna.plot.gsea2()函數繪制富集圖。
1.3 統計學分析

2 結果
2.1 ASC中Cx43敲降效果的驗證
Cx43NC和Cx43-shRNA1慢病毒MOI=60時感染效率最高,Cx43-shRNA2和Cx43-shRNA3慢病毒MOI=100時感染效率最高。蛋白質印跡檢測不同慢病毒感染后ASC中Cx43表達水平,結果顯示Cx43-shRNA1的敲降效率最佳(P<0.01)。見圖1。因此選擇Cx43NC(MOI=60)和Cx43-shRNA1(MOI=60)慢病毒進行后續實驗。
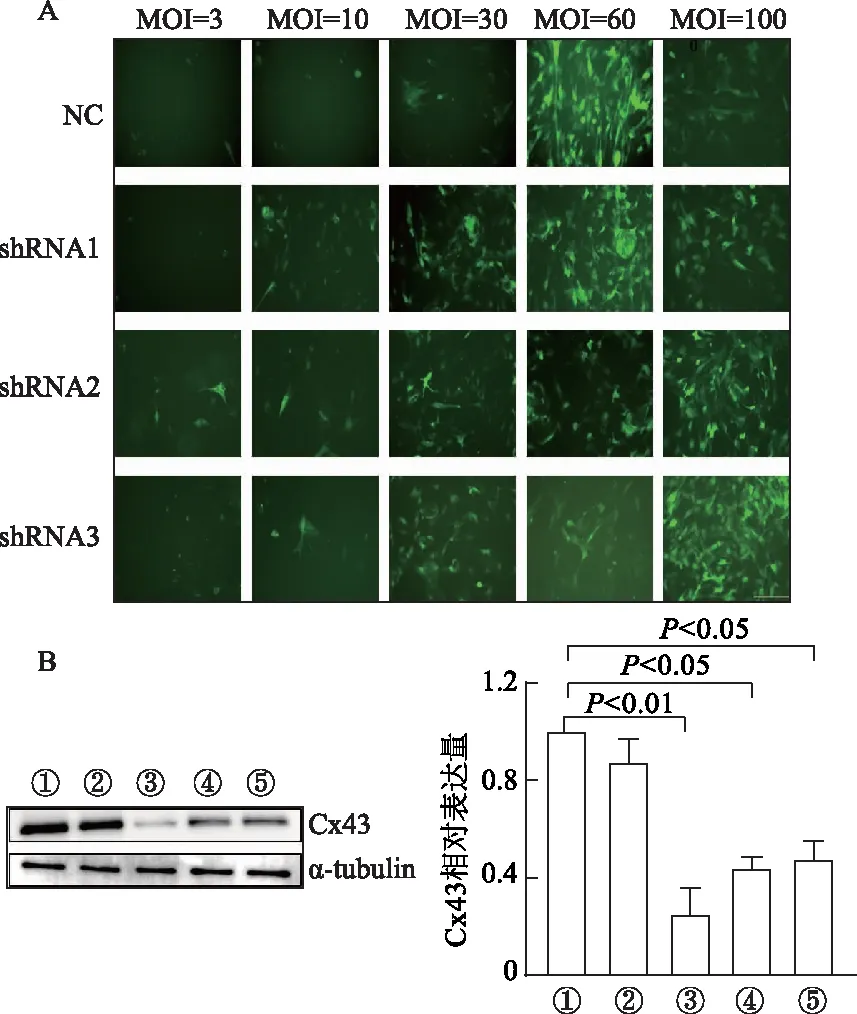
A:不同MOI下病毒感染效率(標尺為100 μm);B:不同干擾慢病毒的敲降效率驗證。①: Control; ②: NC; ③: shRNA1; ④: shRNA2; ⑤: shRNA3
2.2 敲降ASC中Cx43表達后,hemin誘導的細胞凋亡減少,鐵死亡增加
與對照組相比,hemin處理ASC引起細胞凋亡和鐵死亡比例顯著增加(P<0.01),細胞凋亡相關指標Bax/Bcl-2和c-Caspase3/Caspase3顯著升高(P<0.01),鐵死亡負相關指標GPX4和GSH含量顯著降低(P<0.01);與hemin處理組和Cx43NC+hemin組相比,Cx43KD+hemin組凋亡細胞比例顯著降低(P<0.05),細胞凋亡相關指標Bax/Bcl-2,c-Caspase3/Caspase3和鐵死亡負相關指標GPX4和GSH表達量顯著降低(P<0.01和P<0.05),鐵死亡正相關指標ROS和MDA的產生顯著增加(P<0.05),細胞鐵死亡比例顯著升高(P<0.05)。見圖2。說明敲降ASC中Cx43表達后,細胞對hemin誘導的凋亡具有抵抗作用,而對鐵死亡更敏感。
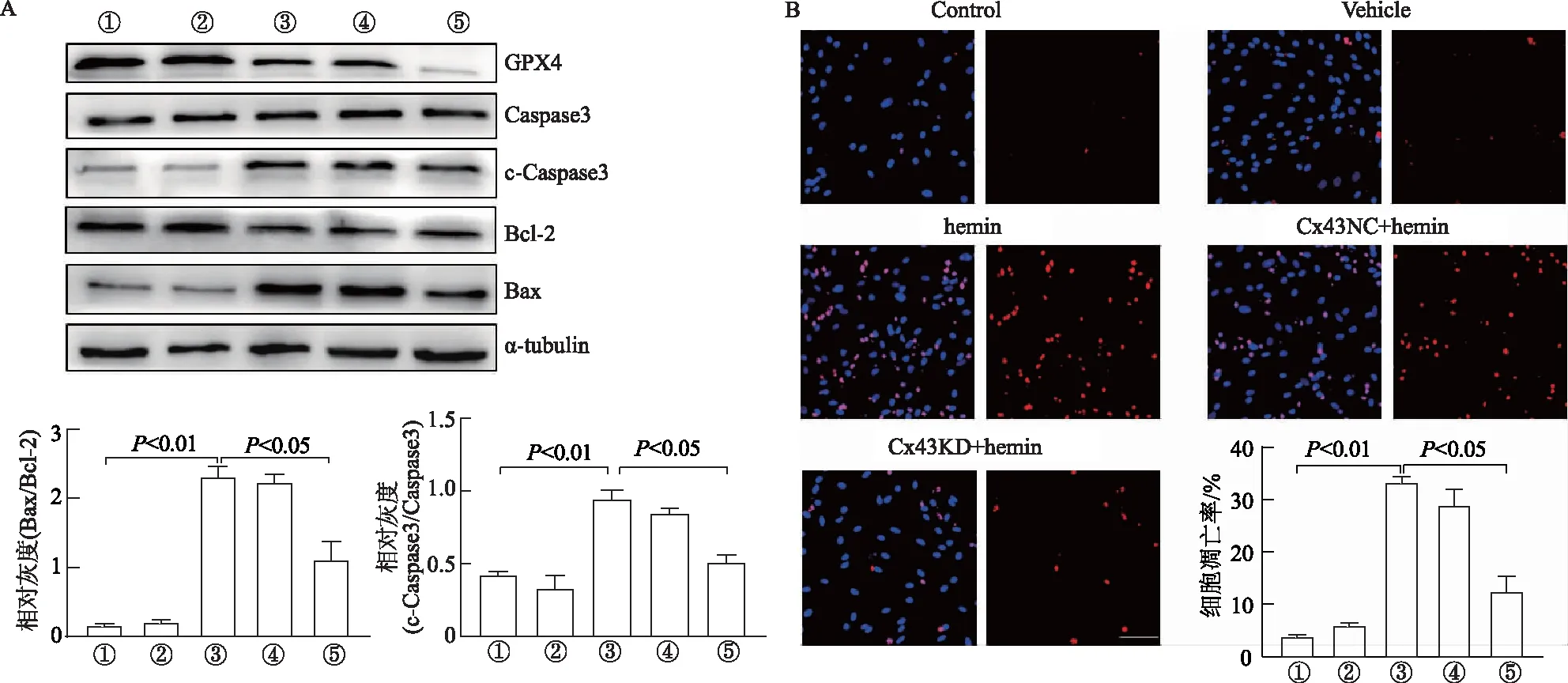

A: 蛋白印跡檢測細胞凋亡和鐵死亡相關蛋白表達及灰度分析; B: Tunel染色結果及凋亡細胞百分比(標尺為100 μm); C: LDH釋放實驗測得細胞鐵死亡率及鐵死亡相關指標檢測結果。①: Control; ②: Vehicle; ③: hemin; ④: Cx43NC+hemin; ⑤: Cx43KD+hemin
2.3 生信分析提示Cx43通過TEAD3調控鐵死亡
熱圖所示GTEx正常人腦組織轉錄組數據庫中,Cx43高/低表達的樣本擁有截然不同的基因特征(圖3A),因此,利用此分組信息進行差異基因表達分析,發現有677個基因表達上調,872個基因表達下調(圖3B);利用差異表達基因的倍數變化信息,并使用基因注釋基因集對其進行基因集富集分析(圖3C),得出Cx43與Hippo信號通路、鐵離子結合基因集、脂質過氧化通路、缺氧應激等通路顯著相關,提示Cx43可能參與調控脂質代謝以及鐵死亡。進一步利用R語言RTN包進行轉錄因子調控網絡分析(圖3D、3E),得出TEAD轉錄因子家族中TEAD3富集結果具有統計學意義,提示TEAD3可能參與調控Cx43相關性下游信號轉導通路。
2.4 ASC中Cx43敲降引起YAP核轉位
對照組中YAP基本均表達于胞質內,hemin處理組少部分細胞出現YAP核轉位,在Cx43KD組中可見大量的細胞存在YAP核轉位現象(圖4中白色箭頭)。提示敲降ASC中Cx43會抑制Hippo信號通路,觸發YAP核轉位。
2.5 Verteporfin處理逆轉Cx43敲降引起的細胞凋亡抵抗和鐵死亡增敏
與Cx43KD+hemin處理組相比,Cx43KD+hemin+Vp處理組細胞凋亡率增高而細胞鐵死亡率降低(圖5),提示Cx43敲降對細胞凋亡和鐵死亡的影響被部分逆轉。
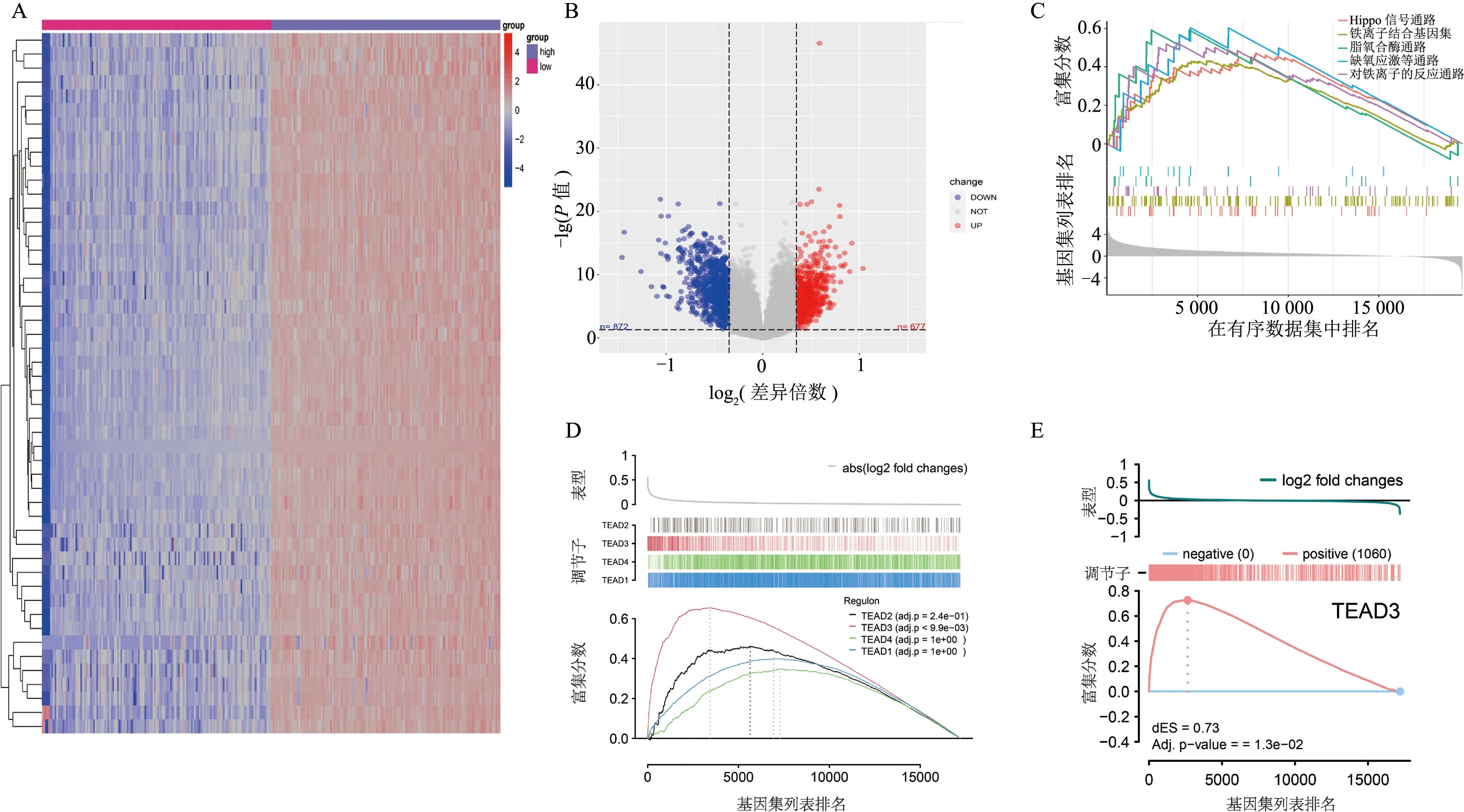
A: GTEx正常人腦組織轉錄組數據庫中Cx43表達熱圖; B: Cx43高/低表達組差異基因表達分析火山圖; C: 基因集富集分析; D~E: 轉錄因子調控網絡分析
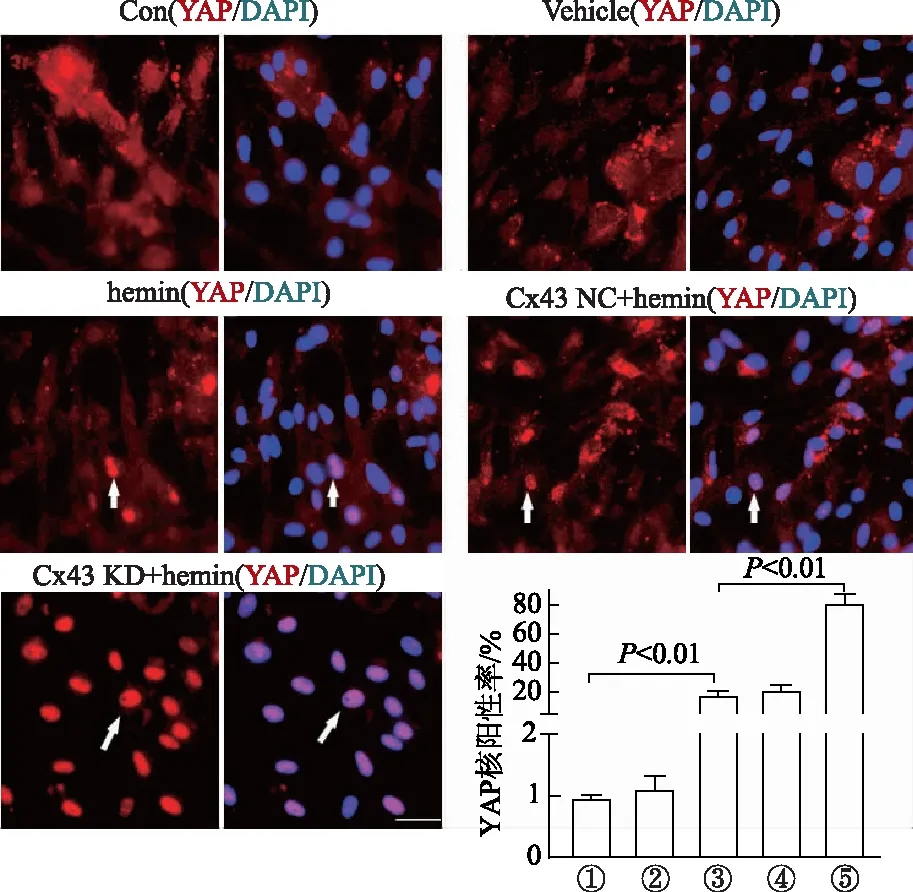
①: Control; ②: Vehicle; ③: hemin; ④: Cx43NC+hemin; ⑤: Cx43KD+hemin。標尺為75 μm
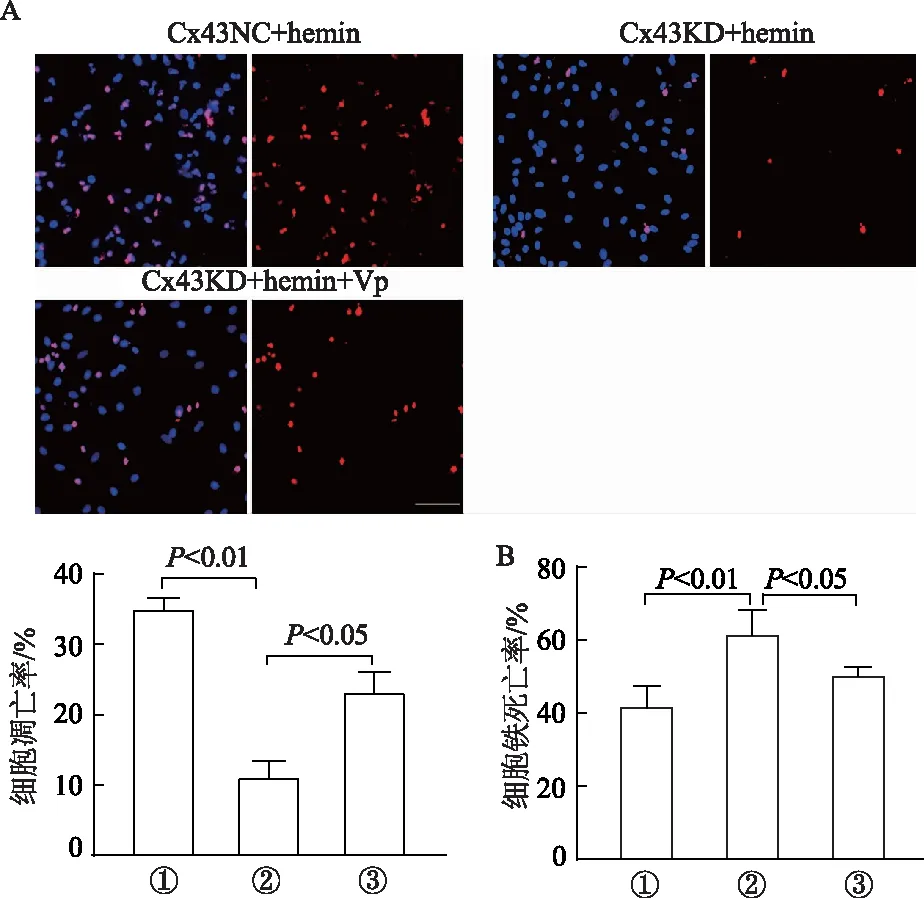
A: Tunel染色結果及凋亡細胞百分比; B: LDH釋放實驗測得細胞鐵死亡率。①: Cx43NC+hemin; ②: Cx43KD+hemin; ③: Cx43KD+hemin+Vp
3 討論
ASC是中樞神經系統內最重要且數量最龐大的支持細胞。ASC之間通過Cx43介導的細胞間縫隙連接形成離子和代謝物偶聯,對于維持組織細胞穩態具有重要作用[16-19]。研究表明,ASC在遭受創傷、炎癥、腫瘤等情況下發生活化,伴隨著Cx43表達水平及其通道功能改變。
前期研究發現,Cx43介導的通道功能對于細胞凋亡和鐵死亡具有重要影響:腦出血背景下Cx43 GJIC功能下降,Cx43半通道出現異常開放。維持Cx43 GJIC功能有助于緩解細胞外微環境中Fe2+負荷,并通過健康細胞向受損細胞輸送GSH以及代謝底物等幫助受損細胞免于鐵死亡及凋亡。ASC在遭受hemin引起的氧化應激損傷后,半通道異常開放會導致細胞膜通透性增加,細胞內的ATP外溢以及細胞外Ca2+內流,激活一系列炎癥反應并引起細胞凋亡,阻斷半通道有助于保護細胞免于凋亡(數據未在本文中顯示)。
由于Cx43具有GJIC和半通道功能以及非通道相關的基因表達調控等多種功能,Cx43 GJIC和半通道在腦出血后繼發損傷中具有截然不同的作用,為了探討Cx43的基因表達調控功能在腦出血后繼發性損傷中的作用及機制,本研究采用干擾慢病毒敲降ASC中Cx43表達,從而觀察ASC對hemin誘導的凋亡和鐵死亡的反應。結果顯示敲減ASC中Cx43表達后,細胞對hemin誘導的細胞凋亡抵抗能力增強,而鐵死亡敏感性增高。然而,Yu等[22]在順鉑誘導的急性腎損傷模型中發現,敲降Cx43表達可以抑制腎小管上皮細胞凋亡和鐵死亡,但具體機制不明。這與本研究關于敲降Cx43對細胞鐵死亡的影響存在分歧,可能是由于所研究的組織細胞類型以及Cx43基礎表達水平差異有關。
為了研究Cx43與鐵死亡的相關性及Cx43調控鐵死亡的分子機制,本研究進行了GSEA分析,結果顯示Cx43與鐵代謝、脂氧合酶以及Hippo信號通路密切相關,并且極有可能通過Hippo通路中的TEAD3調控細胞鐵死亡。Hippo通路是感知細胞外基質硬度和介導細胞接觸抑制的重要信號通路,參與調控組織器官發育。YAP是Hippo通路的關鍵效應分子,Hippo通路的失活使原本被磷酸化而錨定于胞質中的YAP得以釋放從而進入細胞核,與核內的TEAD結合形成轉錄復合體,調控間充質表型轉化、細胞增殖及抗凋亡相關基因的表達[23]。本研究通過YAP免疫熒光染色對生信分析結果進行驗證,結果發現敲降ASC中Cx43表達后出現YAP核轉位,且采用YAP抑制劑可以逆轉Cx43敲降對細胞凋亡和鐵死亡的影響。證實了Cx43可以通過Hippo通路調控細胞凋亡和鐵死亡。
在本課題組前期研究中發現,Cx43與YAP存在共定位,Cx43敲降可以觸發YAP核轉位,與TEAD結合啟動ASC間充質表型轉化[20]。本研究利用Tunel染色發現敲降Cx43表達的ASC表現出對hemin誘導的細胞凋亡的抵抗效應。然而通過檢測細胞壞死及GPX4含量發現,敲降Cx43的表達增加了ASC對hemin誘導的鐵死亡的敏感性。在腫瘤領域,大量研究表明間充質表型轉化的腫瘤細胞增殖、遷移及抗凋亡能力增強。但最新研究表明,間充質表型的腫瘤細胞反而對鐵死亡的耐受性降低,可能與Hippo通路調控NADH氧化酶NOX以及脂氧合酶LOX表達促進細胞膜脂質過氧化損傷有關[15,24-26]。本研究發現敲降ASC中Cx43表達后細胞對hemin誘導的鐵死亡敏感性增加。基于前期Cx43敲降觸發了YAP核轉位的研究發現,結合本研究中的生信分析,提示Cx43敲降極有可能通過抑制Hippo通路,促進YAP核轉位,與TEAD3結合形成轉錄復合體,調控細胞表型轉化、抗凋亡和調控LOX、NOX等促鐵死亡基因的表達而實現。本研究為后續進一步探討Cx43調控細胞凋亡和鐵死亡的機制提供了重要線索。

