超聲輔助酶解促進草魚鱗膠原肽水解進程的內在機制解析
熊 喆,趙 鈺,秦子波,王希搏,榮建華,熊善柏,,胡 楊,
超聲輔助酶解促進草魚鱗膠原肽水解進程的內在機制解析
熊 喆1,2,趙 鈺1,2,秦子波1,2,王希搏3,榮建華1,2,熊善柏1,2,3,胡 楊1,2,3※
(1. 華中農業大學食品科學技術學院,武漢 430070;2. 國家大宗淡水魚加工技術研發分中心,武漢 430070;3.湖北省生物活性肽工程研究中心,荊州 434000)
為探究超聲輔助酶解促進草魚鱗膠原肽水解進程的內在原因,分別研究了超聲對底物蛋白(草魚鱗)的分子結構、表面疏水性、粒徑等理化特性和蛋白酶酶解能力的影響機制,在此基礎上,對超聲酶解進程進行了動力學擬合,從酶解動力學角度進一步評估了促進草魚鱗膠原肽水解進程的“超聲-酶”耦合效應。結果表明,適當的超聲強度(300 W、20 min)可以使底物蛋白的結構展開,此時其表面疏水性最大、粒徑最小,使之更適合后續酶解,但當超聲功率大于300 W時,底物蛋白會重新聚集,其中的部分疏水基團被掩埋,不利于酶解的進行。同時,當超聲功率為300 W、時間為20 min時,單酶酶解組和分步酶解組的酶解能力從2.35×105、3.41×105U/g分別提高至3.44×105、3.86×105U/g,且表現出顯著性差異(<0.05)。通過動力學模型對超聲輔助單酶酶解(2=0.988 8)和分步酶解進程(2=0.960 7)進行了動力學擬合,依據建立的反應動力學方程,證實了超聲輔助分步酶解進程更快,研究結果為超聲輔助酶解工藝制備膠原肽提供了一定理論基礎。
超聲;酶;單酶酶解;分步酶解;酶解進程;動力學擬合
0 引 言
膠原肽是一種介于氨基酸和蛋白質之間的物質,是膠原變性后降解得到的產物[1]。膠原肽具有抗氧化、抗衰老、降血壓、降血糖等多種生理活性功能,在醫藥、食品、化妝品領域有著廣闊的應用前景[2]。目前,膠原肽的制備方法主要分為化學法水解、亞臨界法水解以及酶解法3種方式,在提取膠原肽的過程中,化學法水解在制備過程中會產生大量中性鹽且易腐蝕設備;亞臨界法水解能耗較高且設備較為復雜,酶解法因其反應條件溫和、水解程度相對較高和對環境污染小等優點,被廣泛應用于生產實踐[3-6]。然而傳統酶解法加酶量大且酶解效率較低,因此研究如何進一步提高酶解效率有著十分重要的意義。
在實際提取過程中,不同提取方法之間互相結合可以得到更好的提取效果,因此,為了進一步提高膠原肽的提取效率,改善產品品質,國內外許多學者采用了將物理化學加工手段和酶解相結合的加工方式,其中超聲輔助酶解法就是一種行之有效的催化方法和技術手段。超聲輔助提取的主要原理是利用超聲的空化效應、熱效應和機械作用改變或者破壞大分子的結構,從而提高提取效率[7-9]。超聲輔助酶解分為超聲作用于原料改性、超聲作用于酶改性和超聲作用于酶解過程三種作用模式[10-12]。當前的研究多局限于超聲對底物蛋白的預處理過程,而采用超聲作用于酶解過程模式的研究未見深入報道[13-14]。
在本研究室前期采用超聲輔助酶解方式制備草魚鱗膠原肽時發現,不同超聲條件協同單酶/分步酶解方式能顯著提升草魚鱗膠原肽的水解進程,但其內在作用機制尚不明確[15]。基于此,本研究擬分別從超聲對底物蛋白結構和對蛋白酶酶解能力的影響兩個層面探索超聲影響酶解進程的內在原因,并對酶解過程中水解度-時間進行動力學擬合,探究超聲對酶解進程的影響規律,以期為基于超聲輔助酶解制備膠原肽的工藝優選提供理論基礎。
1 材料與方法
1.1 原料與試劑
草魚鱗片購于華中農業大學菜市場,魚質量和身長分別為(3 500±500) g,(600±30) cm;堿性蛋白酶(200 U/mg)、風味酶(20 U/mg)均為生物試劑,購于上海源葉生物科技有限公司;乙酸、8-苯胺基-1-萘磺酸鈉、甲醛、氫氧化鈉、酚酞、三氯乙酸、福林酚、碳酸鈉、鹽酸、磷酸氫二鈉、磷酸二氫鈉、酪蛋白、酪氨酸均為分析純,購于國藥化學試劑有限公司。
1.2 主要儀器設備
攪拌式超濾杯,美國密理博公司;FD-2A型真空冷凍干燥器,北京博醫康實驗儀器有限公司;HH-2數顯恒溫水浴鍋,常州澳華儀器有限公司;J-1500圓二色譜儀,日本佳司科公司;Nicolet470傅里葉變換紅外光譜,美國尼高力公司;紫外分光光度計,日本島津公司;J-26XP高速冷凍離心機,美國貝克曼庫爾特公司;F-4600型熒光光譜儀,日本日立公司;馬爾文Nano ZS90 納米粒度電位儀,英國馬爾文帕納科公司。
1.3 試驗方法
1.3.1 不同超聲條件處理的草魚鱗制備
超聲輔助酶解法制備草魚鱗膠原肽的工藝流程如圖 1所示。
1)草魚鱗預處理:參照吳瀟揚等[16]的方法采用0.1 mol/L氫氧化鈉溶液和0.5 mol/L鹽酸溶液對100 g草魚鱗進行脫鈣處理,然后用0.5mol/L碳酸氫鈉溶液進行脫脂處理。酶解前將魚鱗在85 ℃的熱水中浸泡1.5 h,并用料理機攪碎[17]。
2)準確稱取一定質量預處理過的草魚鱗,加入蒸餾水調節底物濃度,在不同超聲條件下處理一定時間后,取出凍干,凍干樣備用。
以實驗室前期趙鈺等[15]優選出的超聲輔助單酶酶解/分步酶解的較佳工藝條件為基礎,考察超聲對魚鱗樣品、酶和酶解進程的影響。超聲輔助單酶酶解的試驗條件為:堿性蛋白酶用量為420 U/g,酶解溫度為60 ℃,初始 pH值為8.0~8.5,酶解時間為4 h,在酶解過程中分別施加20 min不同功率(0~600 W)的超聲。超聲輔助分步酶解的試驗條件為:第一步酶解的堿性蛋白酶用量為420 U/g,酶解溫度為60 ℃,初始 pH值為8.0~8.5,酶解時間為3 h;第二步酶解的風味酶用量為420 U/g,酶解溫度為60 ℃,酶解時間為2 h,在酶解過程中施加300 W、20 min的超聲,不同處理方式的超聲時間分布如表1所示。
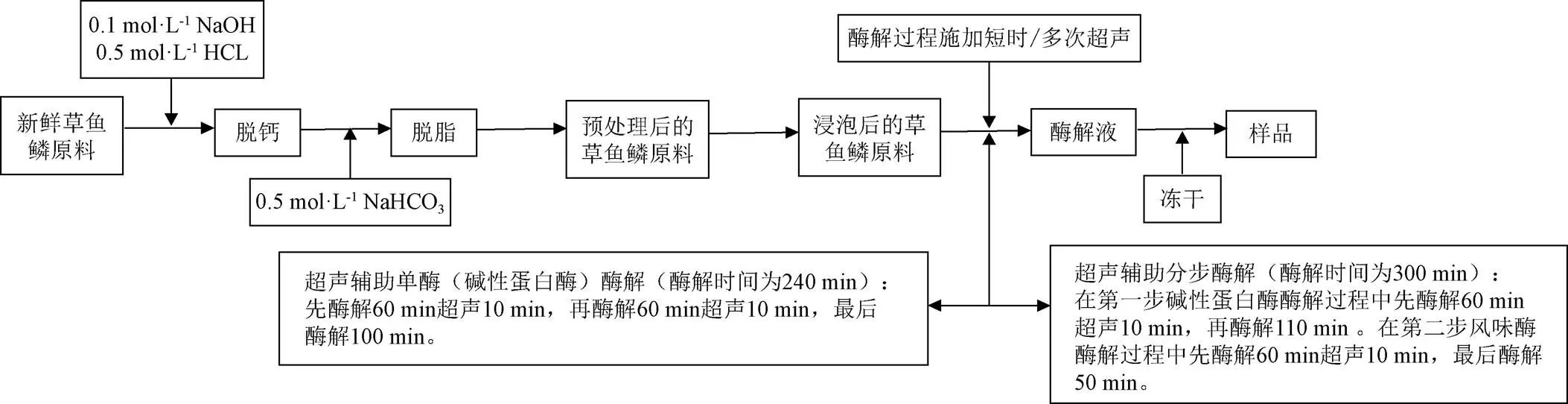
圖1 超聲輔助酶解法制備草魚鱗膠原肽的工藝流程
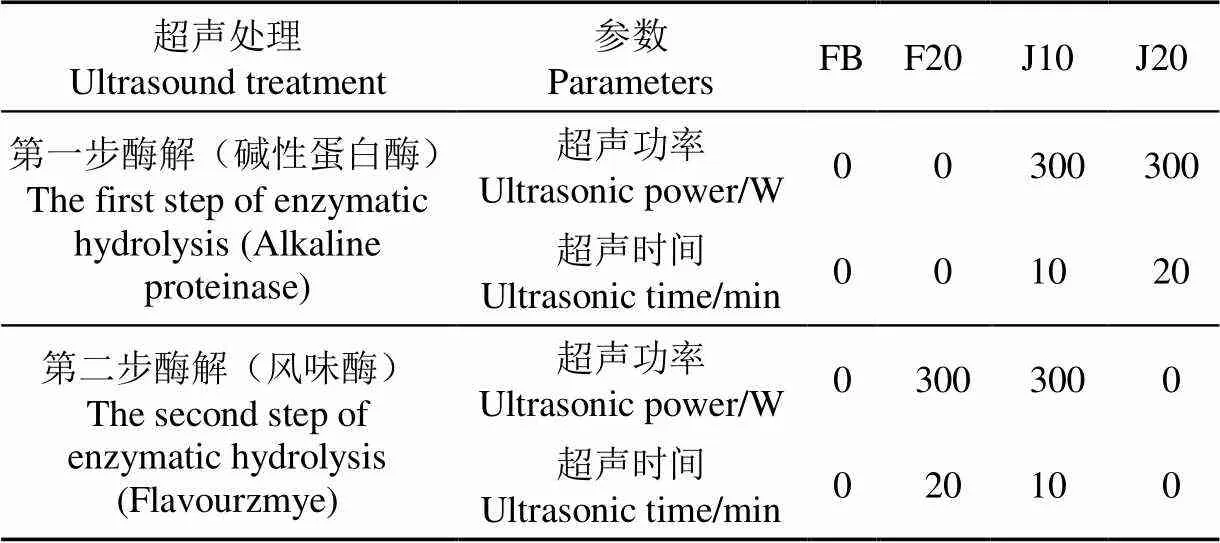
表1 超聲輔助分步酶解制備膠原肽的處理條件
注:FB:傳統分步酶解;F20:第二步酶解過程中施加300 W、20 min超聲;J10:兩步酶解過程各施加300 W、10 min超聲;J20:第一步酶解過程施加300 W、20 min超聲。下同。
Note: FB: Traditional process of stepwise enzymatic hydrolysis; F20: A total of 300 W, 20 min of ultrasound treatment was applied during the second step of enzymatic hydrolysis; J10: The 300 W, 10 min of ultrasound treatment was applied during the first and second step enzymatic hydrolysis respectively; J20: A total of 300 W, 20 min of ultrasound treatment was applied during the first step of enzymatic hydrolysis. The same below.
1.3.2 底物蛋白結構表征及粒徑、表面疏水性分析
1)紅外光譜掃描:底物蛋白紅外光譜分析參考Liu等[18]的方法進行。
2)紫外光譜掃描:將凍干樣品用0.1 mol/L乙酸配制成1 mg/mL溶液,于190~600 nm范圍內進行紫外全波長掃描。
3)內源熒光光譜掃描:將凍干后的樣品溶解在0.1 mol/L的乙酸溶液中配制成0.5 mg/mL的溶液,進行熒光光譜掃描。掃描條件:激發波長280 nm,發射波長300~500 nm,狹縫寬度2.5 nm。
4)底物蛋白圓二色性及二級結構的測定:參照Song等[19]的方法并略作修改:將樣品用0.1 mol/L乙酸溶液溶解,配制成0.5 mg/mL溶液,在190~250 nm波段內進行圓二色譜掃描,掃描速率為50 nm/min,響應時間為1 s,利用楊氏方程計算二級結構百分比。
5)底物蛋白粒徑的測定:將凍干樣品用0.1 mol/L乙酸溶液配制成0.1 mg/mL的樣液,使用馬爾文Nano ZS90納米粒度電位儀分析測定樣品的粒徑分布,測定溫度為25 ℃。
6)底物蛋白表面疏水性的測定:樣品表面疏水性的測定參考楊恒等[20]的方法并略作修改:稱取0.1 g凍干的蛋白樣品,用0.1 mol/L的乙酸溶液配制成蛋白濃度為1 mg/mL的溶液,隨后離心取上清液,用福林酚法測定其蛋白濃度,并將其稀釋。取1.0 mL蛋白溶液與5 mL 8.0 mmol/L的8-苯胺-1-萘磺酸鈉(8-Anilino-1- naphthalenesulfonic Acid,ANS)磷酸鹽緩沖液(0.01 mol/L,pH值為7)混勻,避光反應2 min測定其相對熒光強度。激發波長為371 nm,發射波長為466 nm,掃描速率為240 nm/min,狹縫寬度為10 nm,以蛋白質質量濃度對熒光強度作圖并進行線性擬合,直線斜率為表面疏水性指數。
1.3.3 蛋白酶酶解能力的測定
參照國標GB/T23527—2009測定超聲輔助單酶酶解組和超聲輔助分步酶解組的酶解能力[21]。
1.3.4 酶中間體的驗證
熒光相圖法參考黃珊芬[22]的方法稍作修改:將酶解后的蛋白酶溶液進行熒光光譜測定,掃描條件:激發波長280 nm,狹縫寬度10 nm,掃描范圍300~400 nm,掃描速度1 200 nm/min。讀取熒光發射光譜320 nm和365 nm的熒光強度320和365,然后以320為橫坐標,365為縱坐標,進行線性擬合。
1.3.5 酶解過程動力學方程的擬合
1)酶解過程中酶解液水解度的測定
采用甲醛滴定法[23]測定酶解液中的氨基態氮含量和原料中的總氮含量。按下式計算水解度:

2)動力學方程的擬合
參考余筱潔等[24]的方法,水解度和水解時間的關系方程為:
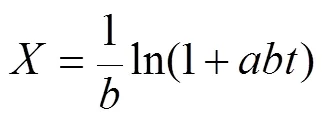
式中為水解度,%;為水解時間,min;為初始水解速率,g/(mL·min);為水解速率,g/(mL·min)。
1.4 數據處理
用SPSS軟件進行數據處理和顯著性分析,顯著性分析取95%置信度(<0.05),數據結果均表示為:平均值±標準差(`SD);使用Origin 2017軟件作圖。
2 結果與分析
2.1 超聲對底物蛋白理化特性的影響
2.1.1 超聲對底物蛋白傅里葉變換紅外光譜的影響
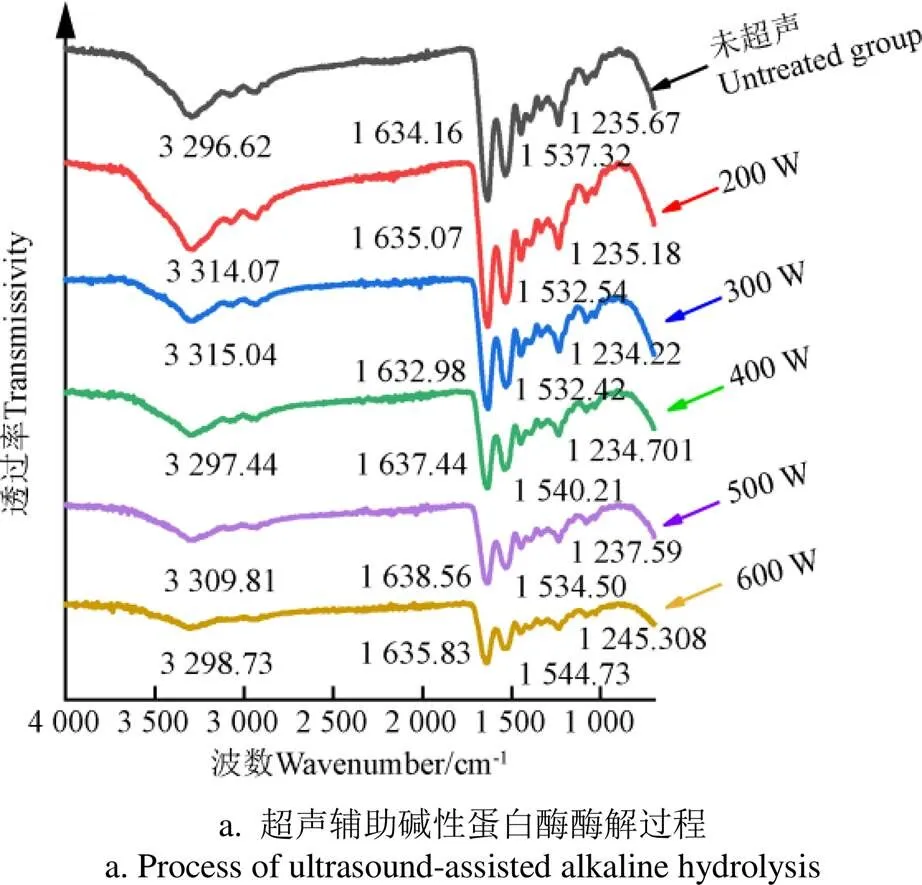
從本實驗室前期[15]優選出的超聲輔助單酶酶解/分步酶解的較佳工藝條件可知,超聲輔助單酶酶解的較佳工藝為在堿性蛋白酶酶解過程中施加300 W、20 min的超聲;超聲輔助分步酶解的較佳工藝條件為在堿性蛋白酶酶解過程中施加300 W、10 min的超聲,然后在風味酶酶解過程中施加300 W、10 min的超聲。以不同超聲條件處理的草魚鱗底物蛋白為對象考察了超聲對底物蛋白的傅里葉變換紅外光譜的影響,如圖2所示。從圖譜中可以看出,超聲主要影響酰胺A帶(N-H鍵的伸縮振動)的出峰位置[16]。對于超聲輔助單酶酶解過程,不同超聲功率對底物蛋白的影響主要體現在酰胺A帶出峰位置的偏移會隨著超聲功率的增加先藍移后紅移,底物蛋白的酰胺A帶從3 296.62 cm-1(未超聲組)藍移至3 315.04 cm-1(300 W超聲組)而后又紅移至3 298.73 cm-1(600 W超聲組)。對于超聲輔助分步酶解的過程,不同超聲條件對底物蛋白的影響主要體現在相較于未超聲組,超聲組酰胺A帶發生了藍移,且J10組(分別在兩步酶解的過程中施加300 W、10 min超聲)藍移的程度最大,從未超聲組的3256.70 cm-1藍移至3 281.78 cm-1。從圖2可以看出,超聲主要影響酰胺A帶的出峰位置,隨著超聲功率的增加其出峰位置先藍移后紅移,即低功率超聲(小于300 W)可以破壞氫鍵的形成,使底物蛋白結構更加松散,而進一步提高超聲功率(大于300 W)底物蛋白之間又會相互作用重新形成聚集體。
2.1.2 超聲對底物蛋白紫外光譜的影響
超聲對底物蛋白紫外光譜的影響如圖3所示,超聲輔助堿性蛋白酶酶解組的紫外吸收峰的吸光值呈現先上升后下降的變化趨勢(圖3a),在低功率超聲(小于300 W)的條件下,空化作用可以使埋藏在底物蛋白內部的疏水基團(例如酰胺基、酯基、烴基)暴露出來,這些疏水基團可能來源于明膠中的疏水性氨基酸側鏈,例如丙氨酸、纈氨酸、亮氨酸、甲硫氨酸等[25],但當超聲功率過大時(大于300 W),這些已暴露的疏水基團之間會發生相互作用形成聚集體,使疏水氨基酸側鏈被掩埋。此外,超聲輔助分步酶解組的紫外吸收峰的吸光值均高于未超聲組(圖3b),即適當強度的超聲(300 W、20 min)可以使底物蛋白的結構更為舒展,使之更利于酶解反應的進行。
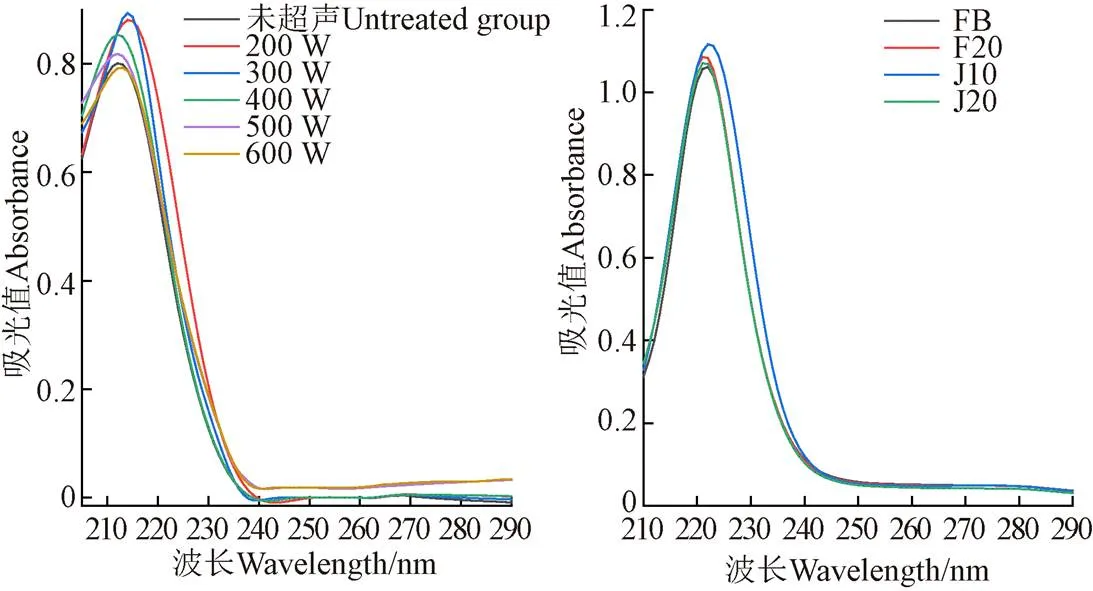
a. 超聲輔助堿性蛋白酶酶解過程a. Process of ultrasound-assisted alkaline proteinase hydrolysisb. 超聲輔助分步酶解過程b. Process of ultrasound-assisted stepwise enzymatic hydrolysis
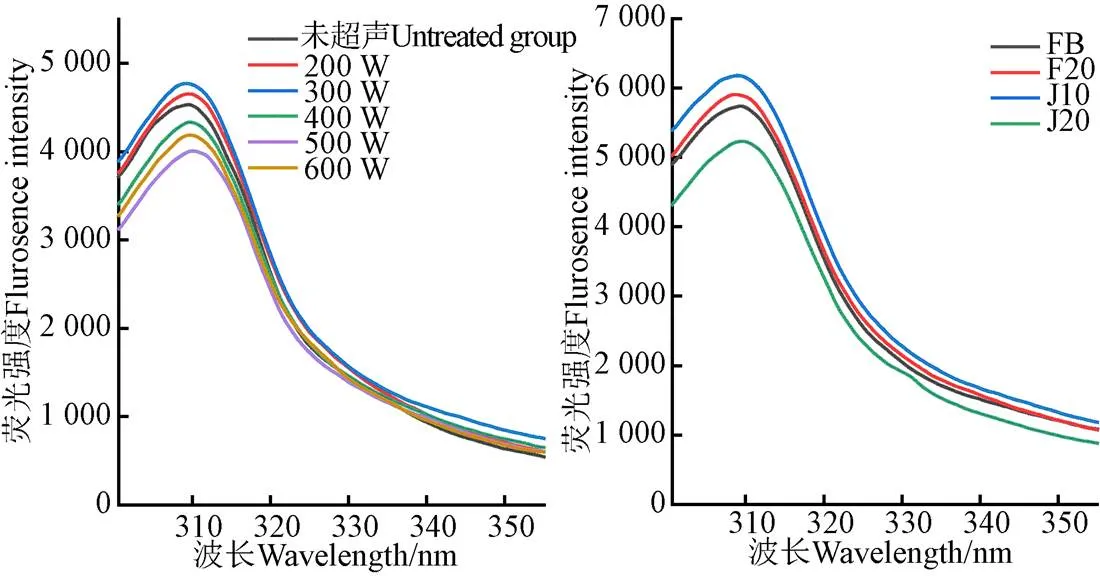
2.1.3 超聲對底物蛋白內源熒光光譜的影響
通過蛋白質內源熒光光譜的測定可反映蛋白質空間構象的變化以及蛋白質之間的相互作用[26]。膠原中不含色氨酸,只含苯丙氨酸和酪氨酸,故熒光光譜主要表現為酪氨酸的特征,其最大發射波長在303 nm處附近[27]。從圖4中可以看出超聲輔助堿性蛋白酶/分步酶解組無論超聲與否,其最大發射波長均在309 nm附近的熒光強度發生了變化,超聲輔助堿性蛋白酶組的內源熒光特征峰的熒光強度隨著超聲條件的變化先上升后下降,當超聲功率為300 W時,熒光峰的熒光強度達到最大值。對于超聲輔助分步酶解組,當超聲方式為J10時(在兩步酶解過程中各施加300 W、10 min超聲)內源熒光特征峰的熒光強度最大。熒光強度的大小與蛋白質的疏水性氨基酸和疏水基團有關,超聲后底物蛋白熒光強度的增強可能是因為在超聲的作用下更多的酪氨酸暴露所致,當超聲功率過大時(大于300 W),已經展開的底物蛋白分子又會重新聚集,酪氨酸被掩埋,故內源熒光強度會降低。同時從圖4中可以看出超聲輔助分步酶解組的熒光強度總體而言要大于超聲輔助堿性蛋白酶酶解組,這可能是在分步酶解時,超聲分布于酶解的各個不同階段,經過熱水浸提之后底物蛋白已有部分展開,此時再施加超聲,可能更有利于底物蛋白結構的進一步展開。
2.1.4 超聲對底物蛋白圓二色譜的影響
190~250 nm的遠紫外區圓二吸收可以反映出蛋白質的主鏈結構,220 nm處正吸收峰和197 nm處負吸收峰是膠原的特征吸收峰[28]。超聲對底物蛋白圓二色譜的影響如圖5a和圖5b所示,所有的超聲輔助堿性蛋白酶/分步酶解組均在198 nm左右出現了一個負吸收峰,且不存在正吸收峰,這說明此時超聲以及熱水的作用已將膠原的三股螺旋結構破壞。對于超聲輔助堿性蛋白酶酶解組,隨著超聲功率的增加,198 nm處的吸收峰的強度呈現先增強后減弱的趨勢,但與未超聲組相比,超聲組的吸收峰強度均大于未超聲組。對于超聲輔助分步酶解組,與未超聲組相比,超聲組的吸收峰強度均大于未超聲組,當超聲時間分布方式為J10時(在兩步酶解的過程中各施加300 W、10 min超聲),198 nm處的吸收峰最大。從圖5中的變化規律可以看出,當施加小于300 W的超聲時可以破壞底物蛋白分子間作用力,破壞其結構,使之更利于酶解,當超聲功率大于300 W時,超聲組的負吸收峰強度略高于未超聲組,但是低于超聲功率為300 W的處理組,這可能是因為在超聲的作用下疏水基團暴露過多,這些疏水基團之間會發生相互作用形成聚集體,不利于酶解的進行[29]。
a. 超聲輔助堿性蛋白酶酶解過程a. Process of ultrasound-assisted alkaline proteinase hydrolysisb. 超聲輔助分步酶解過程b. Process of ultrasound-assisted stepwise enzymatic hydrolysis
氫鍵是維持二級結構的主要作用力,一般來說,-螺旋主要通過羰基氧(-CO)和亞氨基(NH-)之間的分子內氫鍵得到,而-折疊是通過多肽鏈之間的鏈間氫鍵穩定,-轉角是由弱氫鍵結構產生,無規卷曲是由未折疊構象引起,與蛋白質的柔韌性有關[30]。超聲對底物蛋白二級結構比例的影響如圖5c和圖5d所示,對于超聲輔助堿性蛋白酶酶解組(圖5c),經過300 W的超聲處理后,-折疊含量達到最小值為35.6%,同時-轉角和無規卷曲的含量達到最大值,分別為15.1%和49.3%,通常,-折疊占比越小,-轉角和無規卷曲占比越大表明維持底物蛋白分子結構的氫鍵作用越弱,在超聲功率為300 W時,底物蛋白分子中的氫鍵被破壞,蛋白結構逐漸舒展,有利于酶解的進行。同理,在超聲輔助分步酶解組中(圖 5d),-折疊的含量在J10組時達到最小值為37.7%,而-轉角和無規卷曲的含量在J10組時達到最大值,分別為14.6%和47.7%,這表明J10組的超聲時間分布方式可以使底物蛋白結構最大程度被破壞,更有利于酶解的進行。這種二級結構比例的變化表明適度的超聲可以破壞部分氫鍵結構使底物蛋白結構在超聲波的作用下展開,更利于酶解;而在較強的超聲作用下,疏水基誘導的聚集減小了相鄰蛋白質之間的距離,從而增加了強氫鍵結構的數量和強度,不利于底物蛋白的酶解[29]。
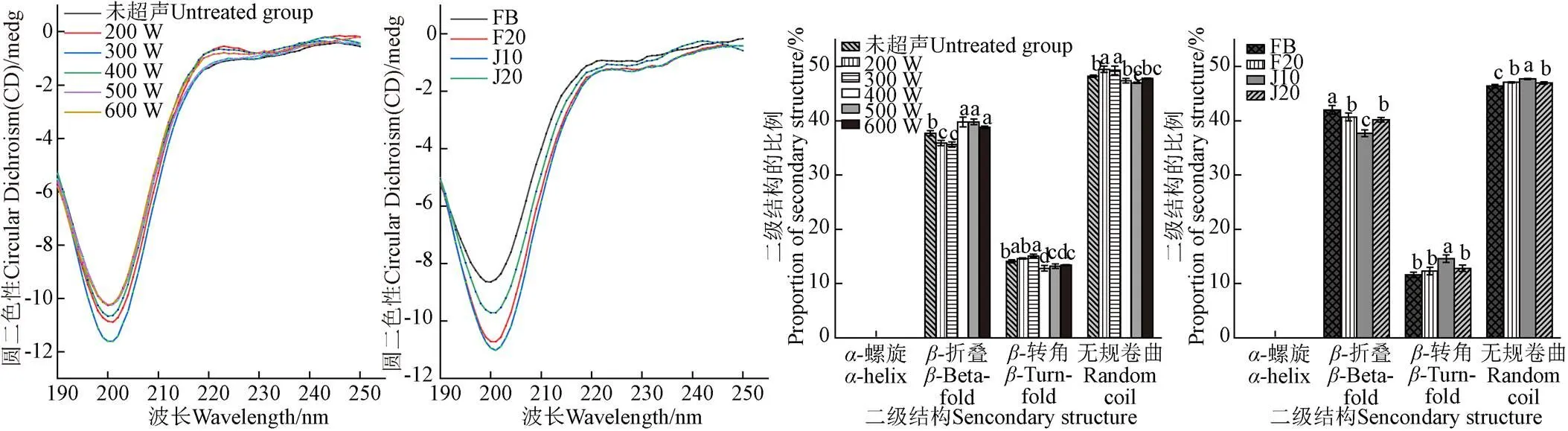

a. 超聲輔助堿性蛋白酶酶解過程底物蛋白的圓二色性a. Circular dichroism of substrate protein during ultrasound-assisted alkaline proteinase hydrolysis b. 超聲輔助分步酶解過程底物蛋白的圓二色性 b. Circular dichroism of substrate protein ultrasound-assisted stepwise enzymatic hydrolysis c. 超聲輔助堿性蛋白酶酶解過程底物蛋白的二級結構占比c. Secondary structure ratio of substrate protein ultrasound-assisted alkaline proteinase hydrolysis d. 超聲輔助分步酶解過程底物蛋白的二級結構占比d. Secondary structure ratio of substrate protein ultrasound-assisted stepwise enzymatic hydrolysis
注:不同字母表示同一指標中不同處理之間的顯著差異(<0.05)。
Note: Different letters indicate significant differences between different treatments in the same indicator (< 0.05).
圖5 超聲對底物蛋白圓二色譜和二級結構比例的影響
Fig.5 Effects of ultrasound on the circular dichroism spectrum and the secondary structure ratio of substrate protein
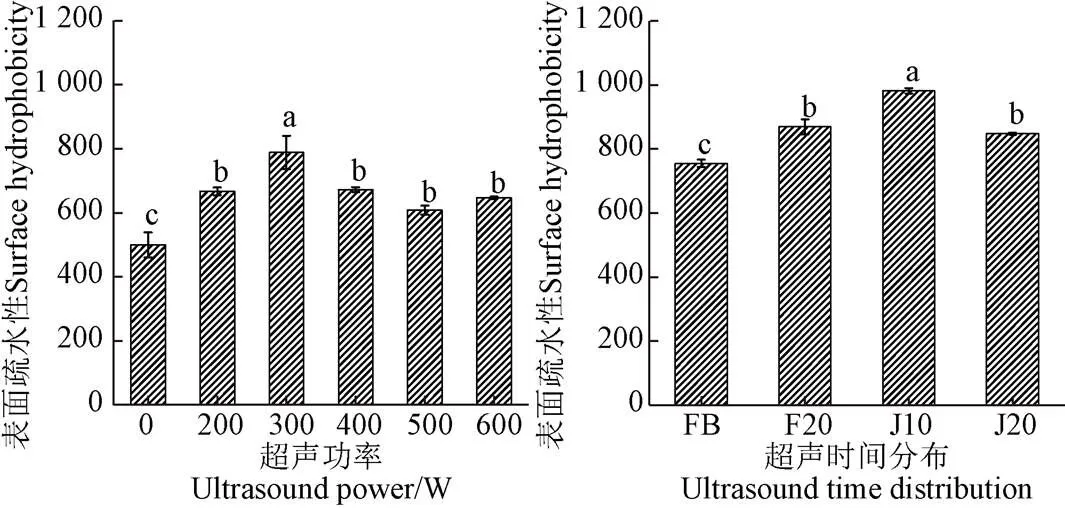
2.1.5 超聲對底物蛋白表面疏水性的影響
蛋白質的疏水性可反映蛋白質三級結構的變化,ANS熒光探針法可有效評價蛋白質表面疏水性[31]。由圖 6可知對于超聲輔助堿性蛋白酶酶解組的表面疏水性,隨著超聲功率增加,呈現先上升后下降的趨勢,當超聲功率為300 W時,達到最大值788.76;對于超聲輔助分步酶解組的表面疏水性,可以看出超聲后底物蛋白的表面疏水性均高于未超聲組,當超聲方式為J10時(分別在兩步酶解過程中施加300 W、10 min超聲),其表面疏水性達到最大值981.46。蛋白質的表面疏水性與蛋白質的結構息息相關,當蛋白質結構松散時,內部的疏水基團外翻,肽鏈表面的非極性氨基酸增加,表面疏水性就會隨之上升,故適當的超聲功率(300 W、20 min)可以使蛋白質的結構更加松散,內部疏水基團外翻。當超聲功率過大時(大于300 W),蛋白質又會聚集形成較大的聚集體,使已展開的結構重新聚集,暴露的疏水基團被重新掩埋[32]。同時從圖中可以看出超聲輔助分步酶解組的表面疏水性總體而言要大于超聲輔助堿性蛋白酶酶解組,這可能是超聲輔助分步酶解時,超聲分布于酶解的各個不同階段,經過熱水浸提之后蛋白質分子已有部分展開,此時再施加超聲,可能更有利于蛋白質分子結構的進一步展開。
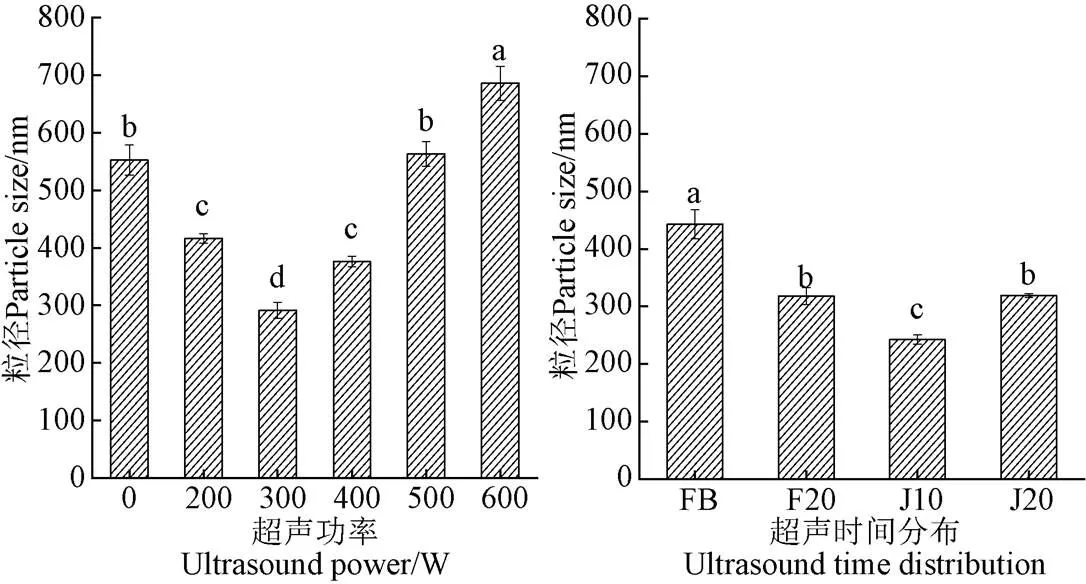
2.1.6 超聲對底物蛋白粒徑的影響
蛋白質的粒徑也是影響蛋白質功能特性和蛋白質構象變化的主要因素[33]。不同的超聲條件對底物蛋白納米粒徑影響如圖7所示。超聲條件不同,底物蛋白粒徑的大小存在差異。對于超聲輔助堿性蛋白酶酶解組,隨著超聲功率的變化,粒徑先減小后增大,當超聲功率為300 W時,粒徑達到最小值291.47 nm;對于超聲輔助分步酶解組,超聲組的粒徑均小于未超聲組,當超聲方式為J10時(在兩步酶解過程中各施加300 W、10 min超聲),底物蛋白粒徑達到最小值為242.47 nm,即經過適當的超聲處理后(300 W、20 min),底物蛋白的粒徑會變小,有利于酶的進一步作用。粒徑的降低可能與蛋白質分子間的相互作用力(氫鍵、疏水相互作用和靜電相互作用)被超聲所產生的微射流以及剪切力所破壞有關[29],超聲功率過大時(大于300 W),底物蛋白又會進一步聚集,粒徑上升。Hao等[34]在研究超聲時間對大豆分離蛋白粒徑的影響時,也得到類似結論,即蛋白質粒徑的增加可能是高功率的超聲導致蛋白質重新形成聚集體所致。

a. 超聲輔助堿性蛋白酶酶解過程a. Process of ultrasound-assisted alkaline proteinase hydrolysisb. 超聲輔助分步酶解過程b. Process of ultrasound-assisted stepwise enzymatic hydrolysis
注:不同小寫字母表示組內存在顯著性差異(<0.05),下同。
Note: Different lowercase letters represent significance differences within the groups (< 0.05), the same below.
圖6 超聲對底物蛋白的表面疏水性的影響
Fig.6 Effects of ultrasound on the surface hydrophobicity of substrate protein
a. 超聲輔助堿性蛋白酶酶解過程a. Process of ultrasound-assisted alkaline proteinase hydrolysisb. 超聲輔助分步酶解過程b. Process of ultrasound-assisted stepwise enzymatic hydrolysis
2.2 超聲對蛋白酶酶解能力的影響
一般認為超聲的機械能和空化作用使酶分子的物理結構發生改變是超聲影響酶解能力的主要原因[35]。不同的超聲條件對蛋白酶酶解能力的影響如圖8a和8b所示,隨著超聲功率的增加,超聲輔助堿性蛋白酶酶解組的酶解能力呈現先上升后下降的變化趨勢,從2.35×105U/g(未超聲組)提高至3.44×105U/g(300 W),且差異顯著(<0.05)。在不同功率誘導酶變性過程中,低強度的超聲(小于300 W)改變酶分子的結構形成中間體,進而表現出較高的酶解能力[36],而高強度的超聲(大于300 W)破壞酶的空間結構,使酶分子三級結構中的各種次級鍵斷裂,進而降低其酶解能力[12]。因此,當超聲功率為300 W時,酶解能力最大(3.44×105U/g),顯著高于其他組別(<0.05)。在超聲輔助分步酶解組中,蛋白酶的酶解能力從3.41×105U/g(傳統分步酶解組)提高至3.86×105U/g(J10組別:在兩步酶解過程各中施加300 W、10 min超聲),在J10組達到最高的酶活,顯著高于其他組別(<0.05)。這是由于超聲處理可以改變酶分子結構,使酶表現出更高的酶解能力,即適當的超聲條件(300 W、20 min)可以提高酶解能力,而當超聲強度過大時(大于300 W),酶解能力則又會降低。此外,超聲輔助分步酶解組的酶解能力整體而言高于超聲輔助堿性蛋白酶酶解組,這是因為在兩種酶的作用下,酶解能力會進一步提高。
由圖8c可知,經過不同超聲功率誘導的堿性蛋白酶去折疊的熒光相圖由3條直線組成,交點出現在3和4附近,表明在超聲功率為300 W和400 W時出現了穩定的折疊中間體(中間體1和中間體2)。結合圖 8c,可以明顯觀察到,中間體1和2所對應的酶活性較其他幾組高,分別為3.44×105和3.29×105U/g,這表明在超聲過程中堿性蛋白酶出現了穩定的中間體。由此可見,超聲對于反應體系而言,既可以改變底物蛋白的結構,又可以改變酶分子的結構。而且適度超聲處理可以有效地展開底物蛋白使之更易于被酶進攻,同時又可以一定程度通過改變酶分子的中間構象使之催化活性提升。
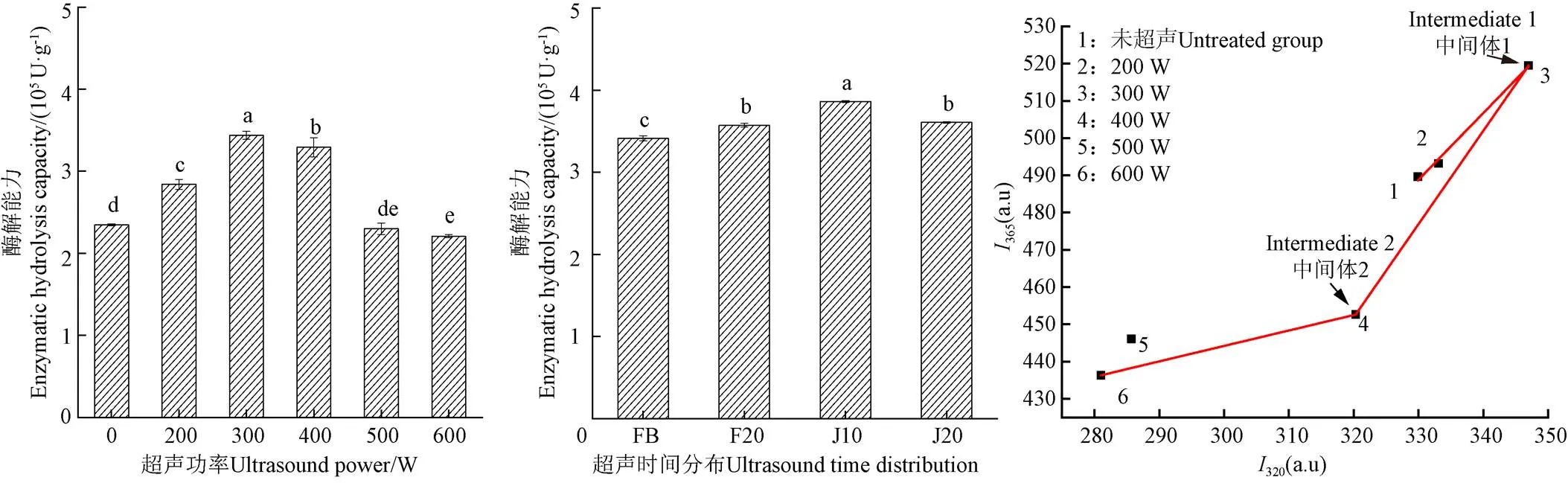

a. 超聲輔助堿性蛋白酶酶解過程a. Process of ultrasound-assisted alkaline proteinase hydrolysisb. 超聲輔助分步酶解過程 b. Process of ultrasound-assisted stepwise enzymatic hydrolysisc. 不同超聲功率輔助堿性蛋白酶的去折疊熒光相圖c. Unfolded fluorescence phase diagram of alkaline proteinase assisted with different ultrasonic powers
注:365:熒光發射光譜365 nm的熒光強度;320:熒光發射光譜320 nm的熒光強度。
Note:365: Fluorescence emission spectrum 365 nm fluorescence intensity;320: Fluorescence emission spectrum 320 nm fluorescence intensity.
圖8 超聲對蛋白酶酶解能力的影響
Fig.8 Effects of ultrasound on the enzymatic hydrolysis capacity of protease
2.3 超聲輔助酶解進程的動力學分析
2.3.1 不同超聲處理對酶解進程的影響
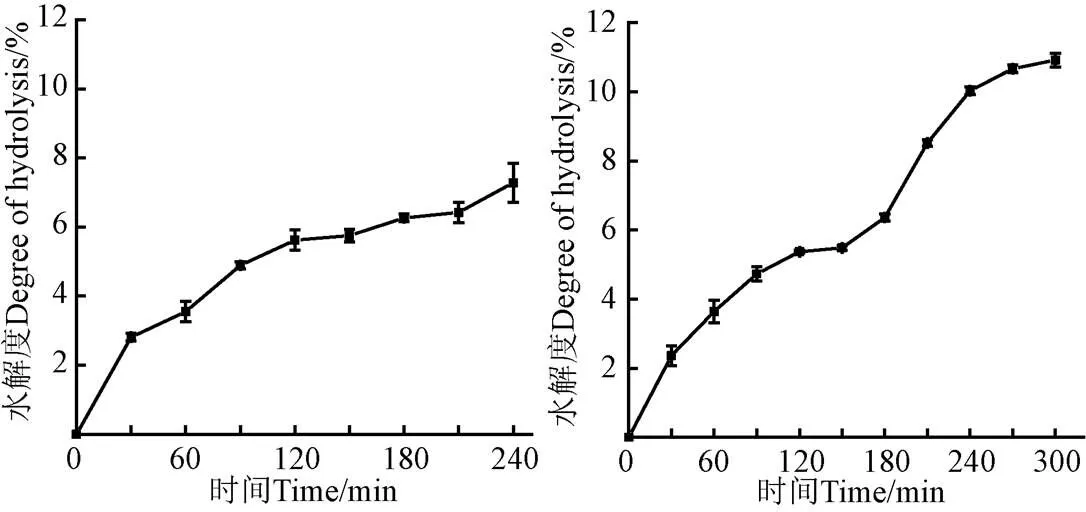
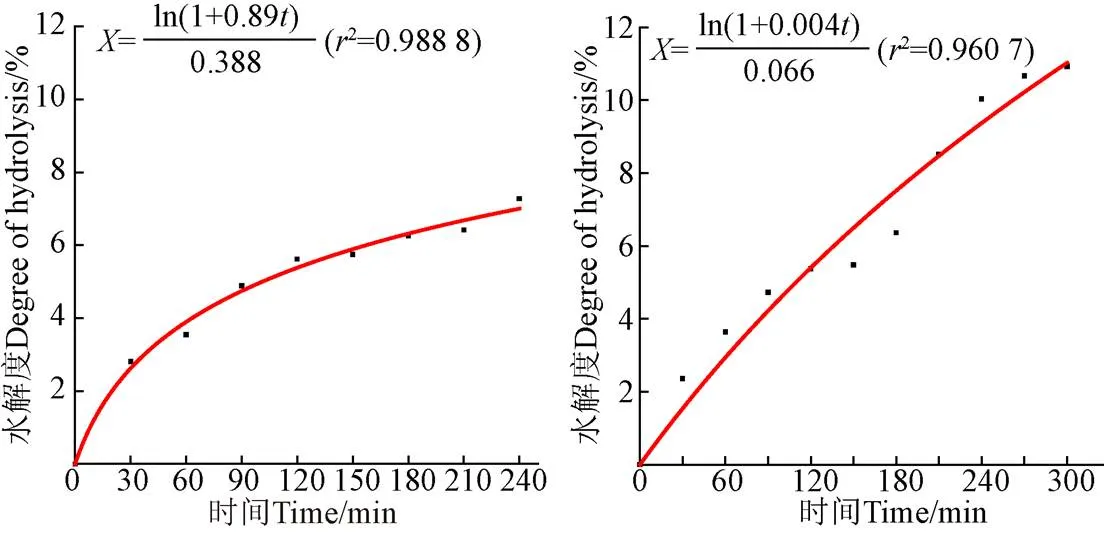
基于超聲對底物蛋白理化特性和蛋白酶酶解能力的影響的分析結果,從堿性蛋白酶酶解組中優選出300 W、20 min的超聲處理,在分步酶解組中優選出J10組(分別在兩步酶解過程中施加300 W、10 min超聲)的超聲處理,探索超聲輔助酶解過程中不同超聲處理后的水解度隨時間的變化規律,如圖9所示。可以看出對于超聲輔助堿性蛋白酶酶解過程(300 W、20 min),隨著水解時間的變化,水解度的變化速率會逐漸趨于平緩,在酶解的240 min過程中,水解度的變化速率發生了兩次陡增,分別在0~30 min和60~90 min這兩個時間段。對于超聲輔助分步酶解(J10組別:在兩步酶解過程中各施加300 W、10 min超聲),隨著水解時間的變化,水解度的變化速率也逐漸趨于平緩,與超聲輔助單酶酶解的過程相似,在分步酶解的過程中,水解度的變化速率也發生了兩次陡增,分別在0~30 min和180~210 min。無論是超聲輔助堿性蛋白酶酶解還是超聲輔助分步酶解,水解度的陡增均發生在施加超聲的時段。
2.3.2 超聲輔助酶解進程的動力學擬合
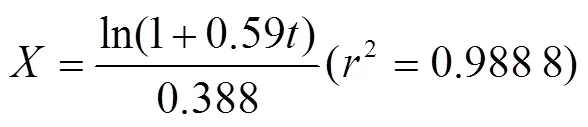
a. 施加300 W、20 min的超聲輔助堿性蛋白酶酶解過程a. Process of ultrasound-assisted alkaline proteinase hydrolysis with 300 W、20 minb. 兩步酶解過程中各施加300 W、10 min超聲b. Ultrasound of two steps of enzymatic hydrolysis each with 300 W and 10 min
a. 施加300 W、20 min的超聲輔助堿性蛋白酶酶解過程a. Process of ultrasound-assisted alkaline proteinase hydrolysis with 300 W、20 minb. 兩步酶解過程中各施加300 W、10 min超聲b. Ultrasound of two steps of enzymatic hydrolysis each with 300 W and 10 min
3 結 論
1)本研究分別考察了超聲對底物蛋白結構、酶和酶解過程的影響,初步探究了超聲加快酶解進程的內在原因。從傅里葉變換紅外光譜、圓二色譜、紫外光譜、內源熒光光譜、表面疏水性、粒徑均可以看出,適當強度的超聲可破壞底物蛋白結構,更利于酶解進行。當超聲強度過大時,游離的蛋白質顆粒可能會重新聚集形成較大的聚集體,不利于酶解進行。
2)超聲可以通過影響蛋白酶的酶解能力進而影響酶解進程。在適當超聲強度下(300 W、20 min)超聲輔助堿性蛋白酶酶解組最大酶解能力可達3.44×105U/g,超聲輔助分步酶解組最大酶解能力可達3.86×105U/g,均顯著高于未超聲組(<0.05),即適當的超聲強度可以提高蛋白酶酶解能力進而加快酶解進程。在超聲輔助酶解過程中,隨著酶解時間的變化,水解度的變化速率會趨于平緩,且水解度的陡增一般發生在施加超聲時段。對超聲輔助酶解過程進行動力學擬合(r>0.95),通過建立的動力學方程發現超聲輔助分步酶解的反應進程更快。
[1] Zhu S C, Yuan Q J, Yang M T, et al. A quantitative comparable study on multi-hierarchy conformation of acid and pepsin-solubilized collagens from the skin of grass carp ()[J]. Materials Science & Engineering C-Materials for Biological Applications, 2019, 96:446-457.
[2] 劉海英. 膠原肽及其產業發展[J]. 食品工業科技,2016,37(12):391-394, 399.
Liu Haiying. Collagen peptide and its industrial development[J]. Science and Technology of Food Industry, 2016, 37(12): 391-394, 399. (in Chinese with English abstract)
[3] 張崟,郭思亞,熊偉,等. 膠原蛋白酶解制備肽工藝研究進展[J]. 中國調味品,2018,43(2):89-95.
Zhang Yin, Guo Siya, Xiong Wei, et al. Protease hydrolysis of collagen peptide technology research progress[J]. China Condiment, 2018, 43(2): 89-95. (in Chinese with English abstract)
[4] Vandeponseele A, Draye M, Piot C, et al. Subcritical water and supercritical carbon dioxide: Efficient and selective eco-compatible solvents for coffee and coffee by-products valorization[J]. Green Chemistry, 2020, 22(24): 8544-8571.
[5] Johnson Esua O, Sun D W, Cheng J H, et al. Functional and bioactive properties of Larimichthys polyactis protein hydrolysates as influenced by plasma functionalized water-ultrasound hybrid treatments and enzyme types[J]. Ultrasonics Sonochemistry, 2022, 86: 106023.
[6] Powell T, Bowra S, Cooper H J. Subcritical water hydrolysis of peptides: Amino acid side-chain modifications[J]. Journal of the American Society for Mass Spectrometry, 2017, 28(9): 1775-1786.
[7] Ren X F, Ma H L, Ma S Y, et al. Effects of sweeping frequency ultrasound treatment on enzymatic preparations of ACE-inhibitory peptides from zein[J]. European Food Research and Technology, 2014, 238(3): 435-442.
[8] Akharume F U, Aluko R E, Adedeji A A. Modification of plant proteins for improved functionality: A review[J]. Compr Rev Food Sci Food Saf, 2021, 20(1): 198-224.
[9] Khan A, Beg M R, Waghmare P. Intensification of biokinetics of enzymes using ultrasound-assisted methods: A critical review[J]. Biophysical Reviews, 2021, 13(3): 417-423.
[10] 賈俊強,馬海樂,曲文娟,等. 超聲預處理大米蛋白制備抗氧化肽[J]. 農業工程學報,2008, 24(8):288-293.
Jia Junqiang, Ma Haile, Qu Wenjuan, et al. Ultrasonic pretreatment for preparation of antioxidant peptides from rice protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2008, 24(8): 288-293. (in Chinese with English abstract)
[11] 黎英,陳雪梅,嚴月萍,等. 超聲波輔助酶法提取紅腰豆多糖工藝優化[J]. 農業工程學報,2015, 31(15):293-301.
Li Ying, Chen Xuemei, Yan Yueping, et al. Optimal extraction technology of polysaccharides from red kindey bean using ultrasonic assistant with enzyme[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(15): 293-301. (in Chinese with English abstract)
[12] 李素云. 超聲和超聲協同堿預處理對大米蛋白酶解效果影響及過程模擬研究[D]. 鎮江:江蘇大學,2017.
Li Suyun. Ultrasound and Ultrasound Synergy Alkali Pretreatment Process of Proteolytic Digestion Effects on Rice and Simulation Study[D]. Zhenjiang: Jiangsu University, 2017. (in Chinese with English abstract)
[13] Hildebrand G, Poojary M M, O'donnell C, et al. Ultrasound-assisted processing offor enhanced protein extraction[J]. Journal of Applied Phycology, 2020, 32(3): 1709-1718.
[14] Yang X, Wang L L, Zhang F Y, et al. Effects of multi-mode S-type ultrasound pretreatment on the preparation of ACE inhibitory peptide from rice protein[J]. Food Chemistry, 2020, 331: 127216.
[15] 趙鈺,余小月,熊喆,等. 超聲輔助酶解制備草魚鱗膠原肽及其理化特性評價[J/OL]. 現代食品科技,2022. [2022-07-26] https: //doi. org/10. 13982/j. mfst. 1673-9078. 2022. 9. 1227
Zhao Yu, Yu Xiaoyue, Xion Zhe, et al. Ultrasonic assisted enzymatic hydrolysis of grass fish collagen peptide and its physical and chemical properties evaluation[J/OL]. Modern Food Science and Technology, 2022. [2022-07-26] https: //doi. org/10. 13982/j. mfst. 1673-9078. 2022. 9. 1227 (in Chinese with English abstract)
[16] 吳瀟揚,熊善柏,尤娟,等. 采用“梯度升溫法”提取魚鱗明膠及其理化特性的研究[J]. 現代食品科技,2019,35(2):118-125.
Wu Xiaoyang, Xiong Shanbai, You Juan, et al. The gradient heating method was used to extract fish scale gelatin and its physicochemical properties[J]. Modern Food Science and Technology, 2019, 35(2): 118-125. (in Chinese with English abstract)
[17] 胡楊,楊莉莉,熊善柏,等. 不同預處理方法對酶法制備的草魚鱗膠原蛋白肽特性的影響[J]. 華中農業大學學報,2016,35(5):105-111.
Hu Yang, Yang Lili, Xiong Shanbai, et al. Effects of different pretreatment methods on the properties of collagen peptides from grass carp scales prepared by enzymatic method[J]. Journal of Huazhong Agricultural University, 2016, 35(5): 105-111. (in Chinese with English abstract)
[18] Liu L L, Hao W M, Dai X N, et al. Enzymolysis kinetics and structural-functional properties of high-intensity ultrasound-assisted alkali pretreatment ovalbumin[J]. International Journal of Food Properties, 2020, 23(1): 80-94.
[19] Song X, Li Z X, Li Y Y, et al. Typical structure, biocompatibility, and cell proliferation bioactivity of collagen from Tilapia and Pacific cod[J]. Colloids and Surfaces B-Biointerfaces, 2022, 210: 1-11.
[20] 楊恒,時海波,鄒燁,等. 超聲波輔助酸提雞肺膠原蛋白的持油性和乳化性[J]. 江蘇農業學報,2019,35(4):940-947.
Yang, Heng, Shi Haibo, Zou Ye, et al. Auxiliary acid with ultrasonic chicken oil and emulsification of lung collagen[J]. Jiangsu Journal of Agricultural Sciences, 2019, 35(4): 940-947. (in Chinese with English abstract)
[21] 張晶雪,李永其,張蔚等,蛋白酶制劑:GB/T23527-2009[S]. 中國輕工業聯合會,2009.
[22] 黃珊芬. 基于過渡態理論的超聲誘導蛋白酶特性及結構變化研究[D]. 鎮江:江蘇大學,2017.
Huang Shanfen. Study on the Changes of Protease Characteristics and Structure Induced by Ultrasound Based on Transition State Theory[D]. Zhenjiang: Jiangsu University, 2017. (in Chinese with English abstract)
[23] Leni G, Soetemans L, Caligiani A, et al. Degree of hydrolysis affects the techno-functional properties of lesser mealworm protein hydrolysates[J]. Foods, 2020, 9(4): 381.
[24] 余筱潔,張有做,周存山,等. 酶法水解紫菜蛋白動力學研究[J]. 中國食品學報,2011,11(3):62-7.
Yu Xiaojie, Zhang Youzuo, Zhou Cunshan, et al. Enzymatic hydrolysis of seaweed protein dynamics research[J]. Journal of Chinese Institute of Food Science and Technology, 2011, 11(3): 62-67. (in Chinese with English abstract)
[25] Tanbir A, Amin I, Aqlima Ahman S, et al. Recent advances on the role of process variables affecting gelatin yield and characteristics with special reference to enzymatic extraction: a review[J]. Food Hydrocolloids, 2017, 63: 85-96.
[26] 王喜波,崔強,張安琪,等. 超聲處理改善不同比例大豆-乳清混合蛋白理化性質[J]. 農業工程學報,2018,34(22):299-305.
Wang Xibo, Cui Qiang, Zhang Anqi, et al. Ultrasonic treatment improving physical and chemical properties of soybean-whey mixed protein in different proportions[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(22): 299-305. (in Chinese with English abstract)
[27] 秦倩倩. 超聲波預處理對草魚皮膠原蛋白特性和酶解產物活性的影響[D]. 鎮江:江蘇科技大學,2019.
Qin Qianqian. Ultrasonic pretreatment of grass carp protein features and enzymatic hydrolysis product references on active influence[D]. Zhenjiang: Jiangsu University of Science and Technology, 2019. (in Chinese with English abstract)
[28] Drzewiecki K E, Grisham D R, Parmar A S, et al. Circular dichroism spectroscopy of collagen fibrillogenesis: A new use for an old technique[J]. Biophysical Journal, 2016, 111(11): 2377-2386.
[29] 王洋. 超聲預處理酶解制備高生物利用度玉米蛋白及其過程近紅外光譜原位實時監測[D]. 鎮江:江蘇大學,2020.
Wang Yang. Ultrasonic Pretreatment of Enzymatic Hydrolysis of Corn Protein and Its High Bioavailability Process Near Infrared Spectrum Real-time Monitoring in Situ[D]. Zhenjiang: Jiangsu University, 2020. (in Chinese with English abstract)
[30] Li C, Arakwa T. Feasibility of circular dichroism to study protein structure at extreme concentrations[J]. International Journal of Biological Macromolecules, 2019, 132: 1290-1295.
[31] Gu X, Campbell L J, Euston S R. Influence of sugars on the characteristics of glucono-delta-lactone-induced soy protein isolate gels[J]. Food Hydrocolloids, 2009, 23(2): 314-326.
[32] 黃丹丹,馬良,韓霜,等. 超聲預處理影響金槍魚皮膠原酶解工藝及機理初探[J]. 食品與發酵工業,2017,43(4):141-146.
Huang Dandan, Ma Liang, Han Shuang. Ultrasonic pretreatment effects tuna references on digestion process and mechanism of a preliminary study[J]. Food and Fermentation Industries, 2017, 43(4): 141-146. (in Chinese with English abstract)
[33] Li H J, Hu Y F, Zhao X H, et al. Effects of different ultrasound powers on the structure and stability of protein from sea cucumber gonad[J]. Lwt-Food Science and Technology, 2021, 137: 11043.
[34] Hao H, Cheung I W Y, Pan S Y, et al. Effect of high intensity ultrasound on physicochemical and functional properties of aggregated soybean beta-conglycinin and glycinin[J]. Food Hydrocolloids, 2015, 45: 102-110.
[35] Shen X, Fang T Q, Gao F, et al. Effects of ultrasound treatment on physicochemical and emulsifying properties of whey proteins pre- and post-thermal aggregation[J]. Food Hydrocolloids, 2017, 63: 668-676.
[36] Ma H L, Huang L R, Jia J Q, et al. Effect of energy-gathered ultrasound on Alcalase[J]. Ultrasonics Sonochemistry, 2011, 18(1): 419-424.
Analysis of the internal mechanism for ultrasound-assisted enzymatic hydrolysis for promoting the hydrolysis of grass carp scale collagen peptide
Xiong Zhe1,2, Zhao Yu1,2, Qin Zibo1,2, Wang Xibo3, Rong Jianhua1,2, Xiong Shanbai1,2,3, Hu Yang1,2,3※
(1.,,,430070,; 2.-,, 430070,; 3.,,434000,)
In order to explore the internal mechanism of the hydrolysis process of collagen peptide derived from grass carp scale (), the effects of ultrasound treatment on the structure of substrate protein (grass carp scale) and the hydrolysis ability of protease were studied by Fourier transform infrared spectra, ultraviolet spectra, circular dichroism spectra, surface hydrophobicity, endogenous fluorescence spectra, particle size and enzyme activity. On this basis, the kinetics of ultrasound-assisted enzymatic hydrolysis was fitted. First of all, Fourier Transform Infrared Spectroscopy (FT-IR), Ultraviolet Spectroscopy (UV-vis), Circular Dichroism (CD), Surface Hydrophobicity (S0-ANS), endogenous fluorescence spectroscopy and particle size were all employed to investigate the effects of ultrasound on the structure of substrate protein (grass carp scale). The FT-IR results indicated that the absorption peak of the substrate protein in amide A band showed a trend of first blue-shift and then red-shift with the increase of ultrasound intensity. In the meanwhile, the intensity of negative absorption of the substrate protein at 198 nm in CD spectrum, the fluorescence intensity of the endogenous fluorescence peaks in endogenous fluorescence spectroscopy and absorbance values of absorption peaks in UV-vis were all showed a first increased and then decreased tendency with the increasing of ultrasound intensity. Moreover, with the increasing of ultrasound intensity, the surface hydrophobicity of the substrate protein was increased firstly and then decreased, and the particle size was reduced firstly and then increased. All of these results indicated that the appropriate ultrasound power (300 W, 20 min) led to the expansion of substrate protein, which made it more suitable for the subsequently enzymatic hydrolysis. However, when the ultrasound power was greater than 300 W, the substrate protein would be re-aggregated so that some of the hydrophobic groups were buried, which was not conducive to the enzymatic hydrolysis. At the same time, with the increasing of ultrasound intensity, enzymatic hydrolysis capacity of protease in single-enzyme hydrolysis group was increased firstly and then decreased. When the ultrasound treatment was conducted in 300 W for 20 min, the enzymatic hydrolysis capacity of alkaline protease was increased from 2.35×105to 3.44×105U/g. Furthermore, when the ultrasound treatment of 300 W and 10 min was applied in each step of the step-by-step enzymatic hydrolysis group, the enzymatic hydrolysis capacity was increased from 3.41×105to 3.86×105U/g. Finally, the kinetics of the ultrasound-assisted enzymatic hydrolysis process were fitted by the kinetic model, and the reaction kinetic equation was established, which further demonstrated that the ultrasound-assisted step-by-step enzymatic hydrolysis process was faster than single-enzyme hydrolysis. In summary, ultrasound treatment could speed up the enzymatic hydrolysis process by destroying the structure of the substrate protein and enhancing the enzymatic hydrolysis ability of protease, thereby improving the enzymatic hydrolysis efficiency.
ultrasound; enzymes; single enzyme hydrolysis; stepwise hydrolysis; hydrolysis process; kinetic fitting
10.11975/j.issn.1002-6819.2022.16.034
TS254.9
A
1002-6819(2022)-16-0313-09
熊喆,趙鈺,秦子波,等. 超聲輔助酶解促進草魚鱗膠原肽水解進程的內在機制解析[J]. 農業工程學報,2022,38(16):313-321.doi:10.11975/j.issn.1002-6819.2022.16.034 http://www.tcsae.org
Xiong Zhe, Zhao Yu, Qin Zibo, et al. Analysis of the internal mechanism for ultrasound-assisted enzymatic hydrolysis for promoting the hydrolysis of grass carp scale collagen peptide[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(16): 313-321. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.16.034 http://www.tcsae.org
2022-05-23
2022-07-13
湖北省自然科學基金項目:基于分子組裝行為解析“明膠-TGase”相互作用及其對消化吸收特性的影響機制(ZRMS2022000745);中央高校基本科研業務費專項基金資助(2662018JC019);國家大宗淡水魚產業技術體系項目(CARS-45-28)
熊喆,研究方向為水產品加工及副產物綜合利用,生物活性肽的開發及應用。Email:2282121369@qq.com
胡楊,博士,副教授,博士生導師,研究方向為水產品加工及副產物綜合利用。Email:huyang@mail.hzau.edu.cn

