CircCDC14A沉默保護星形膠質細胞免受OGD/R誘導的損傷作用機制分析
孫顯峰, 羅 勇, 陳呂安
缺血性腦卒中是一種腦部血液循環障礙疾病,是由于各種原因引起的腦組織缺氧及缺血,導致相應的組織產生壞死或軟化[1]。缺血性腦卒中占全部急性腦血管病的70.0%,好發于中老年人群,是我國居民死亡的重要原因[2,3]。柳越研究表明[4]:腦部發生缺血后,活化的星形膠質細胞能通過多種不同的途徑、機制,發揮內源性保護作用。目前關于如何減輕星形膠質細胞的損傷成為研究熱點[5,6]。趙玥研究表明[7]:環狀RNA(circRNA)從多方面參與缺血性腦卒中的病理進展,且其所具有的共價連接的閉環結構,保證其在外周血腫穩定存在。細胞分裂周期14A(CDC14A)是真核細胞生物中廣泛表達的一種特殊的高度保守的雙重特異性磷酸酶,具有廣泛的作用,如:減數分裂、細胞質分裂、DNA損傷修復及對腦缺血/再灌注(ischemia/reperfusion,I/R)損傷所致的神經元凋亡具有保護作用[8]。因此,本研究以體外培養新生大鼠腦皮質星形膠質細胞為對象,探討CirCDC14A沉默通過調節miR-153-3p/JAK1軸保護星形膠質細胞免受氧糖剝奪/復糖復氧(oxygen deprivation/rehabilitation of sugar-oxygen,OGD/R)誘導的損傷機制,報道如下。
1 材料與方法
1.1 儀器及設備 倒置熒光顯微鏡,購自于日本Olympus公司;DMEM無糖培養基、胎牛血清,購自于美國Gibco公司;轉染試劑LipofectamineTMRNAiMAX Transfection Reagent及CirCDC14A siRNA,購自于美國賽默飛公司;CCK-8試劑盒,購自于碧云天生物公司;p53、Bax、Bcl-2抗體,購自于熒光Abcam公司;熒光素酶檢測試劑盒,購自于美國GeneCopeia公司。
1.2 星形膠質細胞培養及OGD/R誘導模型制備 (1)星形膠質細胞培養。購買SD乳鼠,出生于48 h內,雌雄隨機(購自于廣西醫科大學實驗動物中心)。將SD乳鼠常規采用濃度為75%乙醇連續進行3 min消毒,采用斷頸方式處死,取乳鼠腦部常規分離大腦皮質,剝離腦膜與血管,將獲得的組織剪碎后采用0.25%胰蛋白酶完成15 min消化,過濾后離心、吹打,并選擇合適的密度平鋪在多聚賴氨酸包被的培養瓶中,每2~3 d換液一次。同時,星形膠質細胞培養過程中采用差速貼壁、恒溫搖床方法進一步純化星形膠質細胞,培養基為89%DMEM/F12+10%FBS+1%青鏈霉素;(2)OGD/R誘導模型制備。取第三代培養后獲得的星形膠質細胞,調整培養基,更換為DMEM無糖培養基,并將其置于缺氧小室中,設定培養條件為5%O2、95%N2中,連續完成6 h培養,待上述操作完畢后更換DMEM無糖培養基為完全培養基,連續完成24 h培養后,收集獲得的細胞[9]。
1.3 星形膠質細胞的轉染及分組 (1)細胞的轉染。參考轉染試劑LipofectamineTMRNAiMAX Transfection Reagent及CirCDC14A siRNA說明,將干擾CirCDC14A表達的SiRNA、miR-153-3p抑制劑或JAK1過表達載體轉染星形膠質細胞,并以每孔2×105個細胞接種在6孔培養板中,待細胞融合到60.0%~80.0%時進行轉染,分別制備陰性對照組及siRNA CirCDC14A和LipofectamineTMRNAiMAX Transfection Reagent復合物,將上述復合物加入6孔板的對應孔中,轉染12 h后,更換培養基,連續完成48 h培養后收集細胞,用于后續試驗;(2)細胞分組。將獲得的細胞分為si-NC組、OGD/R組、OGD/R+Si+Con mimcs組、pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組。
1.4 檢測方法
1.4.1 CCK-8法檢測各組細胞活力 以每孔8×103個細胞將其接種在96孔培養板中,設定每孔細胞液體積為100 μl,每組設定平行孔5個,根據上述分組,向每孔中加入CCK-8液10 μl,并接種在細胞培養箱中,連續完成2 h培養,采用酶標儀完成各組吸光度值測定[10]。
1.4.2 細胞凋亡 采用Annexin V-FITC/PI染色檢測細胞凋亡情況,收集各組細胞,離心后完成細胞的重懸,并置入500 μl緩沖液中。待上述操作完畢后,吸取100 μl并放入新的EP管中,隨后加入Annexin V-FITC溶液和PI溶液各5 μl,充分混合均勻后,室溫下避光15 min孵育,染色孵育后涂片,并在熒光顯微鏡下觀察[11,12]。
1.4.3 p53、Bax、Bcl-2蛋白表達 采用Western blot法檢測各組p53、Bax、Bcl-2蛋白表達水平,常規采用RIPA試劑提取細胞中總蛋白,BCA法測定蛋白濃度,并完成定量測定。操作完畢后行10.0% SDS-PAGE電泳,電泳操作完畢后進行轉膜和封閉,并采用稀釋后的p53、Bax、Bcl-2和GAPDH一抗,過夜孵育洗膜完畢后,加入辣根過氧化酶標記的p53、Bax、Bcl-2二抗,最后滴加電化學發光試劑,避光顯影后,借助凝膠成像系統曝光后拍照,并采用Image J軟件完成p53、Bax、Bcl-2相對于GAPDH的表達量[13]。
1.4.4 CirCDC14A與miR-153-3p、miR-153-3p與JAK1的關系 采用雙熒光素酶報告基因實驗分析CirCDC14A與miR-153-3p、miR-153-3p與JAK1的關系。LncBase v.2預測顯示,CirCDC14A與miR-153-3p核苷酸序列存在連續結合位點;而TarBase v.8生物信息學軟件顯示,JAK1的3’非翻譯區(3’UTR)與miR-153-3p存在結合位點。將星形膠質細胞以1×105個/孔接種在6孔板中,共同轉染CirCDC14A WT、CirCDC14A-MUT、JAK1-WT與JAK1-MUT。轉染完畢后更換新鮮的培養基,繼續培養48 h后收集細胞。參考雙熒光素酶活性檢測試劑盒,檢測熒光素酶活性[14]。
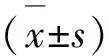
2 結 果
2.1 4組細胞活力比較 4組細胞均連續完成72 h培養,結果表明:隨著時間的延長細胞活性呈上升趨勢;pcDNA3.0 CirCDC14A+si JAK1組48 h及72 h細胞活力低于si-NC組、OGD/R組、OGD/R+Si+Con mimcs組(P<0.05);pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組細胞48h及7 h細胞活力低于si-NC組、OGD/R組(P<0.05)(見圖1)。
2.2 4組細胞凋亡水平比較 Annexin V-FITC/PI染色結果表明,僅被綠色熒光染色的為凋亡前細胞,同時被綠色和紅色雙染的為凋亡晚期或壞死細胞;與si-NC組相比,OGD/R組、OGD/R+Si+Con mimcs組、pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組細胞凋亡明顯增加,且pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組細胞凋亡高于GD/R+Si+Con mimcs組(P<0.05)(見圖2)。
2.3 4組p53、Bax、Bcl-2蛋白表達水平比較 Western blot結果表明:pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組p53、Bax、Bcl-2蛋白表達水平低于OGD/R組、OGD/R+Si+Con mimcs組和si-NC組(P<0.05);OGD/R+Si+Con mimcs組p53、Bax、Bcl-2蛋白表達水平低于OGD/R組、si-NC組(P<0.05)(見圖3)。
2.4 CirCDC14A與miR-153-3p、miR-153-3p與JAK1的關系 miR-153-3p mimic能降低CirCDC14A WT、JAK1-WT的熒光素酶活性(P<0.05);而對CirCDC14A-MUT、JAK1-MUT的熒光素活性無統計意義(P>0.05);pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組miR-153-3p水平低于于其余3組(P<0.05),JAK1蛋白水平高于其余3組(見圖4)。

圖1 4組細胞活力比較


圖2 4組細胞凋亡水平比較

注:圖中1為si-NC組;2為pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組;3為OGD/R+Si+Con mimcs組;4為OGD/R組

注:圖中1為si-NC組;2為pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組;3為OGD/R+Si+Con mimcs組;4為OGD/R組
3 討 論
腦缺血/再灌注損傷的發生和發展是一個復雜的病理過程,涉及氧化應激、鈣離子超載、興奮性毒性及炎癥反應,亦伴有細胞的凋亡等。而在神經細胞凋亡過程中,I/R損傷機制的研究對指導臨床治療具有重要的價值[15,16]。Ren研究表明[17]:在大鼠腦I/R模型中,小腦頂核電刺激能促進CirCDC14A的表達,增加的CirCDC14A對缺血神經元能發揮良好的保護作用,有助于促進缺血神經元的活性,但是CirCDC14A在腦缺血后星形膠質細胞損傷中的機制尚未闡明。本研究中,隨著時間的延長細胞活性呈上升趨勢;pcDNA3.0 CirCDC14A+si JAK1組48 h及72 h細胞活力低于si-NC組、OGD/R組、OGD/R+Si+Con mimcs組(P<0.05),從本研究結果看出,CirCDC14A基因沉默可能通過調控miR-153-3p/JAK1軸抑制OGD/R誘導星形膠質細胞細胞的增殖,影響細胞的活性。法鴻鴿研究表明[18]:CirCDC14A在I/R的過程中能抑制不同組織細胞的凋亡,且在急性心肌I/R模型中,過表達的線粒體CirCDC14A對小鼠心肌細胞、成纖維細胞和內皮細胞的凋亡具有良好的保護作用。本研究中,與si-NC組相比,OGD/R組、OGD/R+Si+Con mimcs組、pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組細胞凋亡明顯增加,且pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組細胞凋亡高于GD/R+Si+Con mimcs組(P<0.05),從本研究結果看出,CirCDC14A基因沉默可能通過調控miR-153-3p/JAK1軸抑制OGD/R誘導的大鼠星形膠質細胞凋亡。
近年來Janus激酶信號傳導(JAK)通路在腫瘤中研究相對較多,JAK為非受體型酪氨酸激酶,能直接參與轉錄激活蛋白(STAT)信號通路。國內學者在膀胱癌的研究中發現,過表達的miR-153-3p 能抑制JAK/STAT信號通路,抑制膀胱癌的細胞增殖和遷移[19]。miRNA是一種小的非編碼RNA,長度約為20~25個核苷酸,能作為抑癌基因或癌基因在腫瘤的發生和發展中發揮重要的作用。miRNAs屬于是一種表達明顯的腫瘤標志物,精確定位并處理miRNAs有助于疾病的輔助診療。JAK1作為人體重要的信號通路受到越來越多的關注。張藝馨研究表明[20]:抑制JAK1表達,能調節miR-153-3p,從而能抑制細胞的活性,抑制細胞凋亡。本研究中,Western blot結果表明:pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組p53、Bax、Bcl-2蛋白表達水平低于OGD/R組、OGD/R+Si+Con mimcs組和si-NC組(P<0.05),從本研究結果看出,CirCDC14A基因沉默可能通過調控miR-153-3p/JAK1軸降低p53、Bax、Bcl-2蛋白表達水平。為了進一步分析CirCDC14A與miR-153-3p、miR-153-3p與JAK1的關系,本研究中采用雙熒光素酶報告基因實驗分析,結果表明:miR-153-3p mimic能降低CirCDC14A WT、JAK1-WT的熒光素酶活性(P<0.05);pcDNA3.0-CirCDC14A+si JAK1+miR-153-3p mimcs組miR-153-3p水平低于于其余3組(P<0.05),JAK1蛋白水平高于其余3組(P<0.05),從本研究結果看出,CirCDC14A與miR-153-3p、JAK1存在緊密的聯系。但是,本研究中僅從細胞層面進行分析,后續研究需要通過裸鼠實驗進行分析,進一步確定可能的調控通路,為臨床診療提供參考依據。
綜上所述,CirCDC14A基因沉默可能通過調控miR-153-3p/JAK1軸抑制OGD/R誘導的大鼠星形膠質細胞凋亡,引起細胞活力及p53、Bax、Bcl-2蛋白表達水平降低。

