補體C5a受體1拮抗劑對小鼠腦缺血/再灌注的保護作用
石艷超, 韓 晉, 李 強, 孟虹媛
卒中是當今世界最常見的疾病之一,也是人類致殘和死亡的主要原因。缺血性腦血管病占卒中的70%~80%,與腦出血相比,其發病機制復雜、多樣。腦梗死引起的一系列病理生理過程會加重腦損傷,從而導致更嚴重的神經功能缺損、認知障礙。但是,目前腦梗死的確切分子學機制尚不完全明確[1,2]。對腦梗死患者的腦組織活檢發現,多種補體在梗死腦組織局部沉積,提示補體參與腦梗死的發病[3]。有研究發現,補體C3-C3aR在慢性腦缺血低灌注過程中可加重腦白質損傷[4],腦梗死后包含C5a在內的補體系統激活了多種生物活性分子,進一步加重腦梗死病情[5]。補體C5a主要通過與膜結合的G蛋白偶聯受體-C5a受體1(C5aR1)結合來發揮作用[6],補體將免疫細胞招募到受損組織后激活免疫細胞,誘導炎癥反應加重組織損傷[6]。補體C5a還可誘導體外培養的神經細胞自噬和凋亡,并且降低PI3K/Akt/mTOR通路相關蛋白的表達[7]。本文旨在探討C5aR1拮抗劑對腦缺血再灌注(cerebral ischemia-reperfusion,CIR)的保護作用,以期為缺血性腦血管病治療提供新的靶點。
1 材料與方法
1.1 主要試劑及儀器 C5aR1拮抗劑PMX53、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)、Trizol、緊密連接蛋白-1(zonula occludens-1,ZO-1)、激光多普勒血流儀(PF5010,Perrimed AB,中國北京)、魚線(北京沙東生物)。
1.2 實驗動物和分組 8~10周齡健康C57BL/6小鼠,體重(20±2)g,購自北京維通利華實驗動物技術有限公司[許可證號:SCXK(京)2016-0006]。將小鼠隨機分為假手術組、CIR組(模型組)和C5aR1拮抗劑組(PMX53組),假手術組32只,其余兩組各40只。造模前3 h、再灌注24 h及再灌注48 h,PMX53組予腹腔注射PMX53(1 mg/kg),假手術組及模型組予腹腔注射同體積生理鹽水。再灌注72 h處死小鼠,留取腦組織。
1.3 大腦中動脈CIR模型建立 參照Longa法建立大腦中動脈CIR模型[8]。以10%水合氯醛腹腔注射麻醉,仰臥位固定于恒溫電熱板上、覆蓋恒溫毯。頸部正中切口,分離右側頸總動脈、頸內動脈及頸外動脈。結扎頸總動脈近心端,夾閉頸總動脈遠心端及頸外動脈近心端,于頸總動脈分叉下方向頸內動脈插入頭端鈍化的魚線,推進約8~9 mm,感覺有阻力時停止,固定于頸總動脈60 min,取出線栓恢復血流。使用激光多普勒血流儀檢測術側額頂皮質區腦血流量(cerebral blood flow,CBF),評估大腦中動脈CIR造模成功與否。大腦中動脈CIR模型定義為:缺血時CBF較缺血前下降85%,再灌注時CBF較基線時升高80%[9]。假手術組僅做頸部正中切口,以及分離右側頸總動脈、頸內動脈及頸外動脈。
1.4 小鼠神經功能評分、腦梗死體積和腦組織含水量測定 采用改良Longa方法評估神經功能:0分,無神經功能缺損;1分,左前肢屈曲;2分,自發左旋;3分,向左傾倒;4分,意識喪失或無自發運動;5分,死亡。本研究中,對照組32只、模型組和PMX53組各40只,模型組及PMX53組采用評分1~3分的小鼠。腦再灌注72 h進行神經功能評分后,取對照組8只、模型組和PMX53組各10只,10%水合氯醛腹腔注射麻醉,20 ml 冰PBS(pH 7.4,4 ℃)經左心房灌洗后快速取腦組織。于視交叉水平,連續切取厚2 mm冠狀位的腦組織切片5片,浸泡于37 ℃環境2% TTC溶液中20 min,然后室溫下置于4%多聚甲醛溶液中1 h。正常腦組織呈紅色,梗死組織呈白色。對腦切片進行拍照,利用Image 軟件對各切片進行分析量化。腦梗死體積公式為:腦梗死體積(%)=[總的梗死體積-(同側半球體積-對側半球體積)]/對側半球體積×100%[10]。用干濕重法測定腦含水量作為腦水腫程度的指標,取對照組8只、模型組和PMX53組各10只小鼠的缺血側大腦半球,缺血側大腦半球腦組織含水量(%)=[(濕重-干重)/濕重]×100%[11]。以上由不同的人員盲法進行。
1.5 RT-PCR實驗 腦再灌注72 h,取對照組8只、模型組和PMX53組各10只小鼠,使用Trizol法進行缺血側大腦半球總RNA提取純化,用酶標儀測定RNA濃度后,取2 ug總RNA為模板,將RNA逆轉錄合成cDNA,取1 μl cDNA作為模板進行RT-PCR擴增反應。引物由上海碧云天生物有限公司合成,引物序列(見表1)。反應參數:95 ℃預變性30 s,接著95 ℃變性10 s,60 ℃退火20 s,72 ℃延伸15 s,共40個循環。以β-actin為內參,按2-△Ct方法,分別計算出IL-1β、TNF-α和內參β-actin mRNA的相對表達水平。每樣本重復檢測3次,求得平均值作為分析結果。β-actin mRNA的表達水平設定為1。
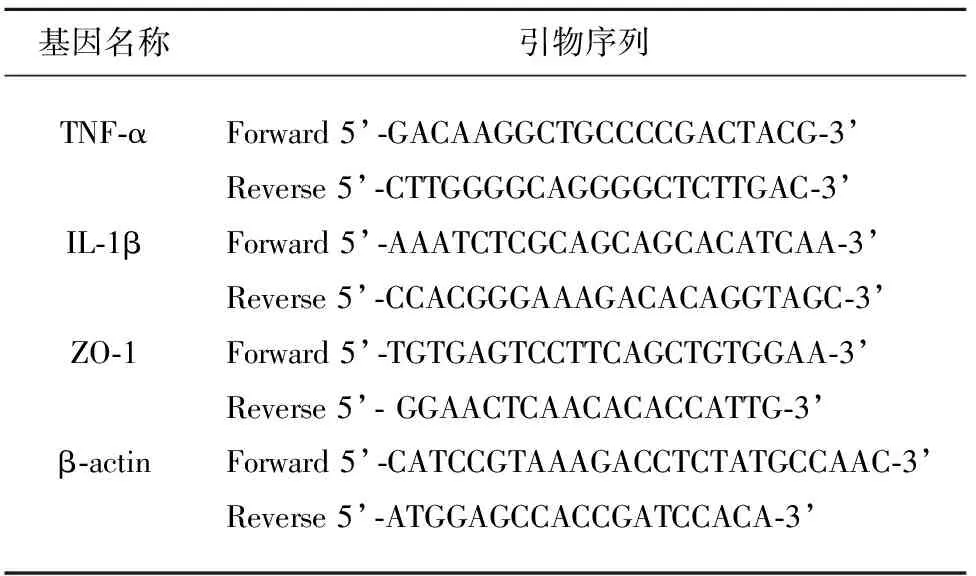
表1 引物序列
1.6 Western blot法檢測缺血側腦組織ZO-1的表達 腦再灌注72 h,取對照組8只、模型組和PMX53組各10只小鼠,腹腔注射麻醉后,冰PBS心臟灌流,提取缺血側大腦半球蛋白。取等量蛋白樣品(25 μg/孔)在10%SDS-PAGE上電泳分離,轉移到PVDF膜上,室溫下在1.5%脫脂牛奶中封閉1 h,然后與一抗在4 ℃下孵育過夜。隨后,將膜與辣根過氧化物酶結合的二抗一起室溫下孵育2 h。最后,使用增強化學發光劑對免疫條帶進行可視化處理。
2 結 果
2.1 神經功能評分 腦再灌注72 h,假手術組未出現神經功能缺損,3組間比較神經功能評分有顯著差異(P<0.05);與模型組比較,PMX53組神經功能評分降低,神經功能缺損癥狀減輕(P<0.05)(見表2)。

表2 腦再灌注72 h各組小鼠神經功能評分
2.2 腦梗死體積和腦含水量 假手術組小鼠未見腦梗死灶,模型組可見明顯腦梗死灶(P<0.05),與模型組相比,PMX53組梗死灶體積明顯減小(P<0.05)(見表3、圖1);3組間腦含水量有明顯差異(P<0.05),PMX53組腦含水量較模型組低(P<0.05) (見表3)。

表3 腦再灌注72 h各組小鼠腦梗死體積及腦含水量比較
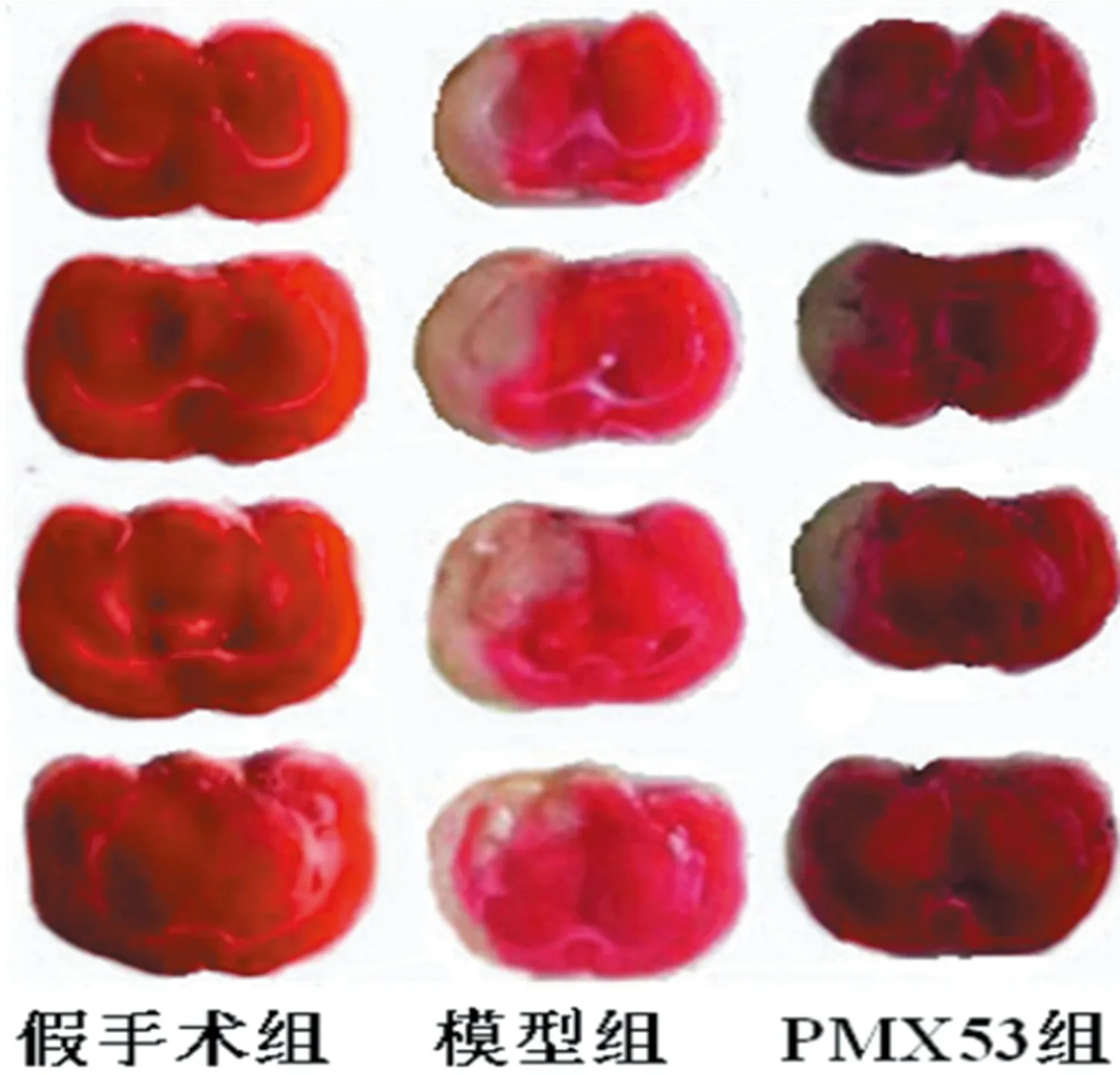
圖1 腦再灌注72 h各組小鼠腦梗死圖像
2.3 IL-1β和TNF-α mRNA的表達 3組間IL-1β和TNF-α mRNA相對表達有顯著差異(P<0.05),與模型組比較,PMX53組的IL-1β和TNF-α mRNA相對表達量明顯降低(均P<0.05)(見表4)。

表4 腦再灌注72 h各組小鼠腦組織IL-1β mRNA和 TNF-α mRNA相對表達量
2.4 ZO-1 蛋白的表達量 與假手術組比較,模型組和PMX53組的ZO-1表達明顯減少(P<0.05);與模型組比較,治療組ZO-1的表達增加(P<0.05)(見表5、圖2)。
表5 腦再灌注72 h各組小鼠腦組織ZO-1的相對表達量
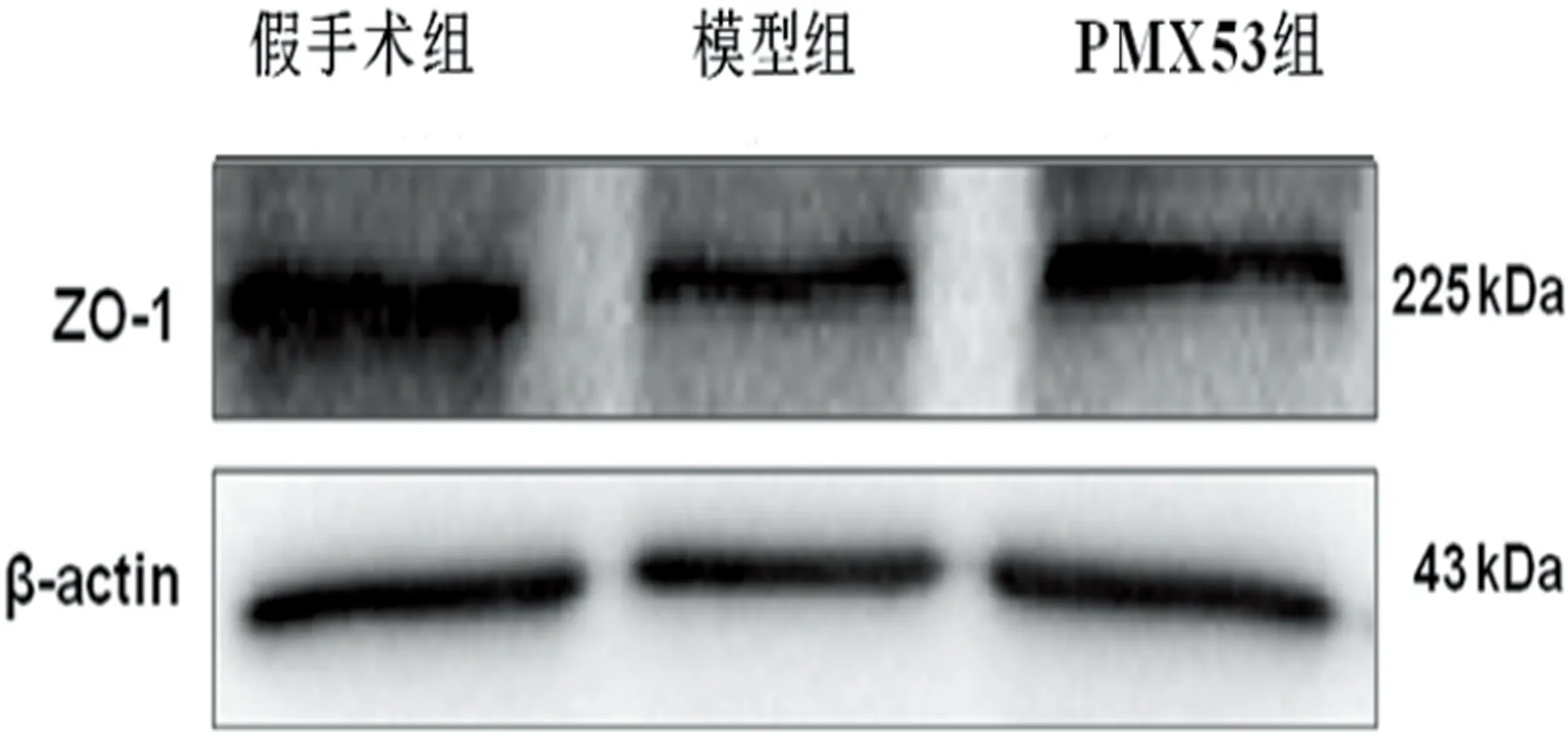
圖2 腦再灌注72 h各組小鼠梗死側腦組織ZO-1印跡條帶
3 討 論
補體系統是固有免疫反應的必要條件,在宿主防御和組織穩態中起著重要作用[12]。補體系統參與多種病理生理過程,越來越多的研究表明,補體系統的功能復雜、多樣,涉及多種免疫、炎癥、神經退行性、年齡相關性和缺血性疾病[2]。補體系統在缺血性卒中發病過程中起著至關重要的作用[13]。腦缺血、腦梗死后,由局部活化的內皮細胞、神經元和膠質細胞合成的補體成分,以及來自白細胞的補體,與疾病的進展密切相關[14]。2021年一項研究表明,缺血性卒中急性期血清補體C3升高與3個月不良臨床結局風險增加相關[15]。
補體C5a是一種高活性炎性肽,在內源性免疫反應中發揮著重要作用[16]。C5a可促進中性粒細胞和單核細胞向損傷或炎癥部位遷移,可增加促炎因子干擾素-γ的生成,加重組織損傷。C5a與C5aR1結合后可作用于多核細胞、單核細胞和巨噬細胞,誘導吞噬細胞釋放溶酶體酶、誘導促炎性細胞因子的分泌和促進活性氧的生成[1,17]。與C5aR1不同,C5a與C5aR2結合后,不能誘導經典的信號轉導(誘導細胞內鈣瞬間釋放)或生物細胞反應[18]。
腦梗死后C5a表達增加,過度表達的C5a與C5aR1結合后,導致單核細胞、巨噬細胞、嗜堿性粒細胞和中性粒細胞釋放促炎細胞因子(如TNF-α、IL-1β和IL-6),加重炎性反應[17,19]。兩項針對C5缺陷小鼠實施腦梗死的研究表明,C5缺陷對腦梗死神經細胞的損傷具有保護作用,可改善神經功能評分[20,21]。對C5aR1(-/-)腦梗死小鼠的研究也得出了同樣結論[22]。上述研究提示,阻斷C5aR1對神經細胞具有保護作用。本研究通過對CIR小鼠使用C5aR1拮抗劑PMX53后,發現小鼠神經功能障礙有所改善,腦梗死體積縮小,腦水腫程度減輕,促炎性因子生成減少。ZO-1是一種細胞質附著蛋白,位于脊椎動物緊密連接內皮細胞的胞質面。ZO-1表達下調常提示BBB的完整性受到損傷。本研究中,我們發現與模型組相比,PMX53組ZO-1蛋白表達上調,腦水腫程度減輕,提示C5aR1拮抗劑PMX53對BBB具有保護作用。
總之,諸多研究表明,補體系統作為機體固有免疫的重要組成部分,在組織損傷中起著重要作用[2,5,6,14]。因此,研究人員開發出了大量補體靶向藥物來調節補體激活,減輕組織損傷[2]。基于以上研究,本研究發現,C5aR1拮抗劑PMX53可減輕小鼠CIR損傷的程度,為臨床缺血性腦血管病的治療帶來了新的希望,但其在缺血性腦血管病患者中的作用尚不清楚,仍需進一步的研究。

