質譜成像新基質及其在分析生物樣本方面的研究進展
苗玉嬌 朱龍佼 許文濤
(中國農業大學營養與健康系 食品精準營養與質量控制教育部重點實驗室,北京 100193)
典型的MALDI-MSI 工作流程分為三步:制作組織切片、采集質譜數據、分析成像數據。在MSI 技術的實際應用中,質譜的掃描速度越快,相應的就要付出分辨率越低的代價,故而快速、高特異性、高空間分辨率和高靈敏度往往不能同時實現。雖然質譜掃描速率、空間分辨率和靈敏度主要由質譜硬件儀器決定,但適當的組織準備工作和高效的離子化技術也是MSI 獲取高質量數據的關鍵。在過去的幾十年中,MSI 技術不斷發展創新,包括新的實驗工作流程、改進的電離和采樣方法、空間和質量分辨率的進步、更可靠的數據處理方式以及強大的數據分析軟件的開發。本綜述將重點關注MALDIMSI 中新型基質的開發,并總結一些新型MSI 技術的最新應用和進展。最后,展望了MSI 技術的發展方向——單細胞水平化、絕對定量化、儀器便攜化(圖1)。

圖1 圖文摘要Fig.1 Graphical abstract
1 MALDI 新型基質的開發推進生物樣本的MSI
在MALDI-MSI 中,需要先在組織切片上沉積一層基質以在基質和樣品之間形成共結晶。基質通過吸收紫外或紅外激光能量被電離,同時提供羽流將分析物解吸到氣相,通過將電荷或活性離子轉移到分析物上而將其電離。由于可以保護分析物免受直接激光照射,基質在MALDI-MSI 中起著至關重要的作用,選擇合適的基質和合適的沉積方法可以避免丟失分析物或其他耗時的組織制備步驟。目前,一些針對蛋白質、脂質、碳水化合物的2,5-二羥基苯甲 酸(2,5-dihydroxy benzoic acid,DHB)[2]、α- 氰基-4-羥基肉桂酸(α-Cyano-4-hydroxycinnamic acid,CHCA)[3]和芥子酸(sinapic acid,SA)[4]等常規小分子有機基質在目前已得到廣泛應用[5]。且已經證明可以通過將吸電子基團加入到一些傳統基質的核心結構中來提高其性能,如通過用氯原子取代CHCA 的羥基從而獲得4-氯氰基肉桂酸(4-chloroalpha-cyanocinnamic acid,Cl-CCA),這種新型基質可以有效提高標準蛋白質胰蛋白酶消化的靈敏度[6]。
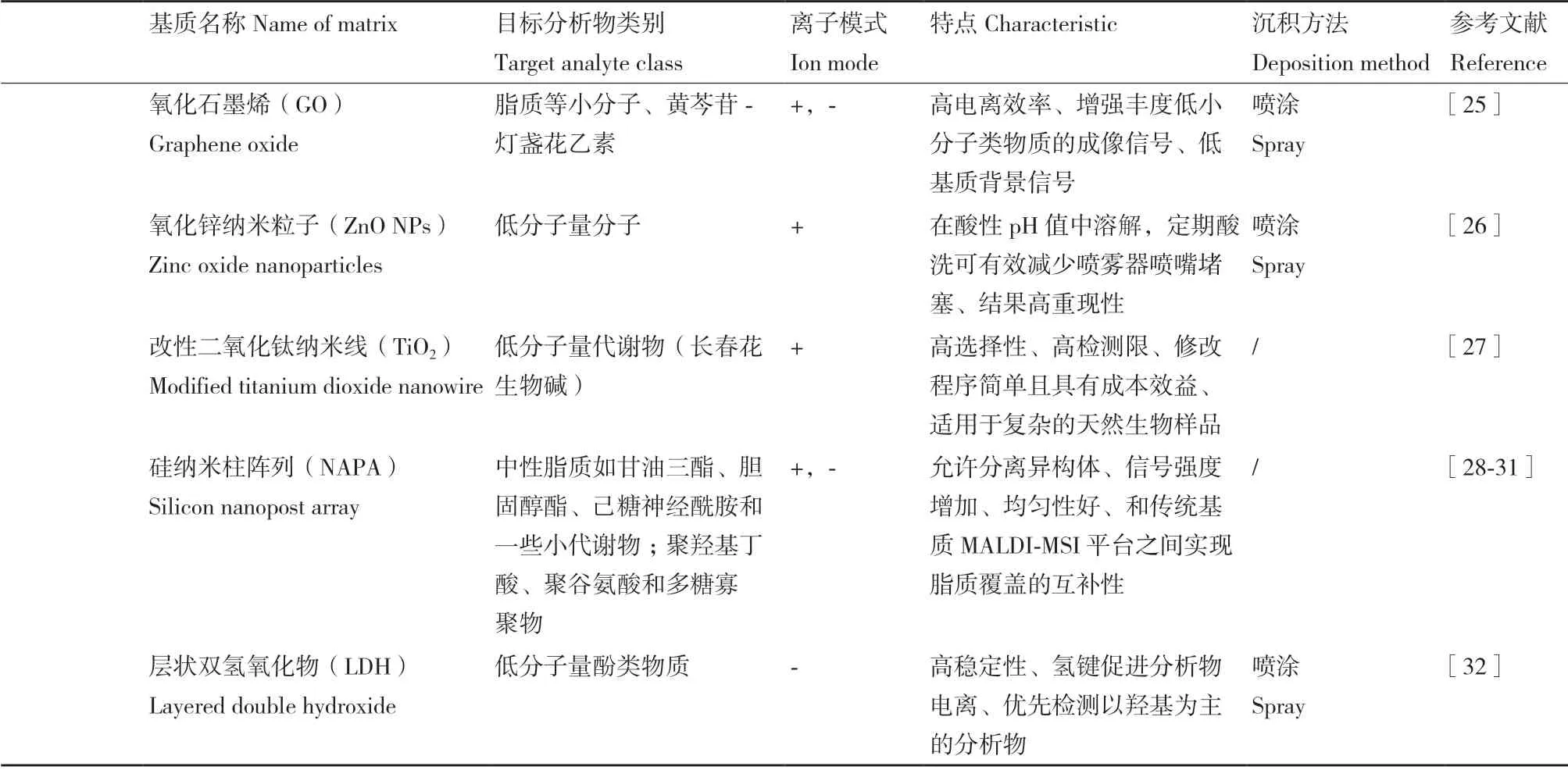
但總的來說,上述常規基質材料存在背景高、選擇性弱、對小分子物質(<600 Da)的電離效果差等問題,從而促進了研究者們對新型基質的開發,包括有機小分子基質和無機納米材料(表1)。這些新型基質一般具有共晶小、信號響應低、離子抑制低、耐鹽性好等特征。

表1 近幾年應用在MALDI-MSI 中的新型基質匯總Table 1 Summary of the novel matrixes used in MALDI-MSI in recent years
續表Continued
1.1 新型有機小分子基質
已經有相關綜述[33-34]總結了一些已被開發用于 MALDI-MSI 的新型有機小分子基質,如烷基化2,5-二羥基苯甲酸、1,8-二(哌啶基)-萘和4,5-(雙(二甲氨基)萘-1-基)呋喃-2,5-二酮(4-馬來酸酐質子海綿)等,本文僅選擇近5年來關于MALDI的新型有機小分子基質在生物組織MSI 中的最新研究成果進行綜述。
Enomoto 及其研究團隊[18]使用1,5-二氨基萘(1,5-diaminonaphthalene,DAN)作為MALDI-MSI 的基質在負離子模式下檢測成熟草莓果實中的原花青素及其單體,實現了不同類的B 型原花青素在草莓組織中獨特的空間分布的可視化,進一步闡明了類黃酮類化合物的生物學作用。此外,也有將以DAN作為基質的MALDI-MSI 和其他成像技術聯用以對單個腦組織切片中的脂質分子進行多模態化學成像的報道出現[19]。
基于CHCA 和三聯噻吩這兩種常用基質分別用于檢測不同類別分子的特性,Yerra 等[20]提出了一種“包含兩者有效電離官能團的分子可以同時作為質子和電荷轉移基質”的假設,并成功合成了2-氰基-3-(2-噻吩)丙烯酸(2-cyano-3-(2-thienyl)acrylic acid,CTA)基質,結果成功用于分析各類化合物如脂質、肽、蛋白質、糖類、天然產物、高分子量聚乙二醇(polyethylene glycol,PEG)和有機金屬等,與其他常規基質相比,所有使用CTA 研究的分析物的質譜都顯示出高信噪比和高分辨率,能將以前難以電離的較低濃度的高分子量PEG(>40 kD)陽離子化,并且CTA 還可以在MALDI-MSI 實驗中提供組織表面的完整輪廓。總的來說,相對于一直以來的使用特定基質來分析特定類別的分析物,CTA 可以用作分析大多數類別化合物的通用基質。
3-氨基鄰苯二甲酰肼(3-aminophthalhydrazide,3-APH,又稱魯米諾)是一種非常有效的化學發光底物。Li 等[10]根據固態紫外吸收、離子產率和種類以及雙極性檢測對5 種候選MALDI 新基質進行了評估,得到了3-APH 及其鈉鹽能夠比其他幾種候選物更好地檢測內源性代謝物的結論,在正/負離子模式下結合了傅里葉變換離子回旋共振(fourier transform ion cyclotron resonance,FTICR)的MALDIMSI 實驗中分別對159 和207 種小鼠的腦代謝物在組織上實現了無標記原位成像,從而展示了3-APH作為一種MALDI 新型基質在定位腦疾病生物標志物方面的應用前景。
在保證教學過程完整,體現素質教育教學觀念和樹立終身體育思想基礎上,按照教學目標,創造出多種教學模式。同時,學校應改進評價內容和方法,由單一的評價內容與方法向綜合考評內容與方法轉變,促進學生的多方面發展。
盡管上述許多新型有機小分子基質仍未設計用于更廣泛的應用,但其在許多方面均表現出優于傳統基質的結果,如真空穩定性、檢測靈敏度、分子覆蓋度、耐鹽性、基質背景信號、離子抑制和晶體形成等[35],證明了新型基質具有提高MSI 圖像質量和擴展MALDI-MSI 應用領域的潛力。
1.2 無機納米材料基質
目前,一些無機納米材料已被開發用來作為MALDI-MSI 的新型基質,材料包括金、銀、硅、碳(石墨烯、氧化石墨烯、碳納米點等)和金屬氧化物納米材料等。
金納米粒子(gold nanoparticles,AuNPs)已被證明可以實現肽、膽汁酸、碳水化合物、類固醇和其他脂質的原位可視化。已經發表了具有各種分析物相互作用的AuNPs 的多種應用,AuNPs 增強的組織成像現已能實現100 μm 的橫向空間分辨率[36]。聚乙烯吡咯烷酮封端的銀納米粒子(silver nanoparticles,AgNPs)可以通過選擇性銀陽離子化來提高含有 π 鍵的分析物的電離效率。基于此,Guan 等[24]使用聚乙烯吡咯烷酮封端的AgNPs 作為基質的MALDI-FTICR-MS 對小鼠或大鼠的大腦動脈閉塞模型進行可視化處理,改進了對脂肪酸、甘油脂等多種類脂質以及一些小分子代謝物的綜合分析,對各類脂質分子在大腦組織中的異質性分布提供了新見解。
碳材料,包括富勒烯、碳納米管、石墨烯(graphene,G)、氧化石墨烯(graphene oxide,GO)、碳納米點(carbon dots,CDs,又稱碳點)、納米金剛石、納米纖維和納米角,它們在激光波長下的強光吸收以及其他獨特的物理和化學特性,可以有效地輔助MALDI 過程。與經典有機基質相比,G 和GO 可簡化樣品制備、消除基質背景離子的干擾并提高每次實驗的重現性[37]。Wang 等[25]通過基于GO和咖啡酸(caffeic acid,CA)二元基質的MALDIMSI,對一種中藥黃芩苷——燈盞花乙素及其代謝物在腎組織切片中的原位空間分布進行了可視化。這種二元基質(GO/CA)顯著提高了燈盞花乙素及其代謝物的檢測效率,在組織切片上具有較高的靈敏度和選擇性。CDs 是一類新興的碳材料基質,極細微粒,幾乎各向同性,生物相容性好且易于后修飾[38]。Cai 等[39]探究了N、S 摻雜的碳點在鼠組織中雙酚S 成像中的應用。得益于CDs 極小的粒徑,該研究的成像分辨率達50 μm,且雙酚S 的檢出限低至pmol。
此外,硅納米柱陣列(silicon nanopost array,NAPA)已經被證明可以增強使用傳統有機基質難以檢測的特定脂質類別的電離,尤其是在存在磷脂酰膽堿,例如磷脂酰乙醇胺和甘油三酯的情況下[31,40]。在最新報道的研究中,Laith 等[29]還使用基于NAPA 基質的激光解吸電離質譜成像平臺(NAPA-LDI-MSI)和傳統 MALDI-MSI 平臺對大豆根瘤組織切片中特殊的生物聚合物聚羥基丁酸、聚谷氨酸和多糖的低聚物進行原位檢測和無標記分子成像。結果顯示,在NAPA-LDI-MSI 中,低聚物離子的平均信號強度比不同基質不同離子模式的幾種MALDI-MSI 平臺高出約7-65 倍。
雖然目前已經開發出了一系列新型無機材料基質應用于MSI 技術,但這些材料同時也存在著諸般問題。如對于無機碳材料來說,其在水或有機溶劑中的溶解性較差,難以均勻地沉積在樣品上,且在真空下高濃度的碳材料可能會從目標板逸出導致儀器污染。雖然將納米顆粒濺射到動植物組織切片上可以使生物分子成像成為可能,但同時也存在著如何濺射出具有一致尺寸的納米粒子和必要設備的可用性的問題。并且,目前我們對納米顆粒的電離機制尚未完全了解,這些未解決的問題和謎團亟待研究者們更進一步地深入研究。
2 不同的離子化技術助力生物組織的MSI
除了MALDI 這種被最廣泛地應用于MSI 的離子化技術外,二次離子質譜技術(secondary ion mass spectroscopy,SIMS)和常壓敞開式離子化技術(ambient mass spectrometry,AMS)的發展也十分迅猛,擴大了MSI 的應用范圍。表2從靈敏度、分辨率等方面對MSI 中常用的幾種離子化的方式進行了比較。下面簡要介紹這些離子化技術的原理以及在生物組織的MSI 方向的最新應用。

表2 3 種MSI 方法的對比Table 2 Comparison of three methods of MSI
2.1 二次離子質譜技術
二次離子質譜(SIMS)的原理是在真空條件下利用高能初級離子束撞擊樣本表面使樣品表面分子離子化為次級離子,再使用質量分析器根據不同的質荷比(mass-to-charge ratio,m/z)將其分離,隨后離子到達檢測器產生質譜圖。使用初級離子束逐像素掃描樣品表面并記錄光束的位置,即可在掃描區域內構建每個離子信號強度的彩色圖,從而獲得可以顯示離子在樣品表面分布情況的離子圖像[41]。此外,還可以從一系列連續的二維離子圖像中進行三維重建,從而使樣品表面下方的分子的分布可視化。
目前,SIMS 有兩個主要平臺,即飛行時間二次離子質譜(time of flight secondary ion mass spectrometry,TOF-SIMS)和納米級SIMS(nano SIMS),它們能夠分別在單細胞和細胞器水平上對不同類型的生物分子進行成像。同時,可用于SIMS 分析的生物組織樣品很多,包括各類動植物器官切片以及其他仿生生物結構體系等[42]。面對檢測樣品的復雜化和檢測要求的多樣化,近年來還出現了許多具有串聯、混合式質量分析器的SIMS 儀器,如Passarelli 等[43]開發出的具備TOF-Orbitrap 混合質量分析器的SIMS設備,稱為3D-OrbiSIMS,它具有在保持SIMS 微米至亞微米級空間分辨的優勢下兼具Orbitrap 質量分析器的強大物質鑒定能力,是目前最先進的SIMS 系統之一。
與其他質譜成像技術相比,SIMS 擁有目前質譜成像技術中最高的空間分辨率(100 nm)。但由于其初級離子束能量較高,破壞力較強,易產生碎片離子,所測的質量范圍較小,當分析物的分子量超過2 000 Da 時靈敏度顯著降低,因此更適用于小分子物質和樣品表面元素的質譜成像分析。研究發現,通過在組織樣本表面噴涂一薄層金屬原子或者化學基質,形成基質增強型SIMS[44],可以有效擴大SIMS 的檢測范圍并提高其靈敏度,目前已成功用于脂質、多肽等生物分子的成像研究。
2.2 常壓敞開式離子化技術
上述MALDI 和SIMS 是兩種重要的MSI 方法,然而兩者(除去大氣壓MALDI)都需要在真空環境中進行。為了克服這一挑戰,2004年首次發表的解吸電噴霧電離質譜分析(desorption electrospray ionization mass spectroscopy,DESI MS)技術,使得樣品無需預處理或僅需簡單的前處理即可在常壓條件下從各種載物的表面直接對固相或凝固相樣品進行原位分析[45],提高了質譜分析速度以及檢測通量。這一突破性技術大大簡化了分析過程,從而產生了多種常壓敞開式原位電離技術,加速了原位MSI 技術的發展。Javanshad 和Venter[46]還將原位電離的定義從經常被吹捧的“無樣品制備”更新為通過電離和分析步驟實時進行近端樣品制備加工,并提出了一種新的原位電離質譜技術分類方案。
目前,應用于MSI 的常壓敞開式離子化技術主要可分為以下3 類:基于激光(laser-based)、基于等離子體(plasma-based)和基于電噴霧(spraybased)的電離技術。基于激光輔助解吸的離子化技術,包括常壓基質輔助激光解吸電離(atmospheric pressure matrix-assisted laser desorption ionization,AP-MALDI)、激光刻蝕電噴霧電離(laser ablation electrospray ionization,LAESI);基于等離子體的離子化技術,包括實時直接分析(direct analysis in real time,DART),低溫等離子體探針(low temperature plasma,LTP)等;基于電噴霧的離子化技術有:解吸電噴霧電離(DESI)、液體萃取電噴霧電離(liquid extraction electrospray ionization,LEESI)等。其中,在MSI 實驗中最常用的是DESI 技術,這是對樣品破壞性最小的環境電離質譜組織成像方法之一,已被廣泛開發為用于分離各種組織病理學類別的組織區域以用于診斷應用的工具,并越來越多地被應用到揭示體內藥物分布的獨特模式、發現潛在可治療的生化途徑、揭示新的可藥物靶點上[47]。
對于DESI-MSI,樣品的離子化具體過程為施加有一定高電壓的噴霧溶劑從毛細管噴出,在外側霧化管所噴出的高速氣流的作用下霧化形成帶電的液滴,液滴加速作用于載體的樣品表面并濺射出溶解有多種分子的次級帶電液滴。次級液滴的溶劑快速蒸發,電荷轉移到待測分子使其形成氣態樣品離子,離子再通過離子傳輸管進入質譜分析器而被檢測。在最近的報道中,Marta 等[48]使用 DESI-MSI 對透明細胞腎細胞癌的代謝特征(游離脂肪酸、代謝物和復合脂質)進行成像和化學表征,結果證明了DESI-MSI 可以根據代謝特征的變化實現對腎細胞癌的快速診斷。而在另一項研究中,Yang 等[49]的團隊在脂質組學水平上成功構建了一種將DESI-MSI 與套索回歸模型(least absolute shrinkage and selection operator,LASSO)相結合的分子診斷模型,成像結果清楚地描繪了腫瘤和正常組織的空間分割,不僅能夠準確區分口腔鱗狀細胞癌手術不同切緣狀態,還能對口腔癌手術安全切緣距離進行個性化測量。
雖然DESI-MSI 在對小分子化合物成像時具有顯著的優勢,但DESI 空間分辨率較低,一般100-200 μm,盡管通過優化溶劑組成及流速可以將分辨率提高至12 μm,但其與SIMS 和MALDI-MSI 相比仍有一定差距;此外,由于蛋白質大分子和非極性物質較難解離,DESI 對此類物質的靈敏度相對較低。這些不足限制了DESI 在更多領域的應用。基于此,已經開發了一系列DESI-MSI 的變體技術,如納米DESI-MSI、氣流輔助解吸電噴霧電離質譜成像(air flow-assisted desorption electrospray ionization mass spectrometry imaging,AFADESI-MSI)等以擴大DESI在生物組織成像方面的應用。
2.3 離子淌度技術與MSI聯用
離子淌度譜(ionic mobility spectroscopy,IMS)是一種快速的氣相分離技術,其原理是帶電離子進入含有淌度氣體的淌度池后,由于質荷比、分子形狀和帶電荷數的不同,使離子跟碰撞室內的淌度氣體的碰撞截面積(collision cross section,CCS)不同而實現分離。經過淌度分離,可以得到離子的漂移時間和CCS,從而進行對離子形狀的判斷及定性分析。將IMS 與MS 聯用,在質量分析之前對具有相同或相似質荷比的離子進行有效分離,可以獲得一個新的數據維度,增強了異構體分離、擴大了分子覆蓋范圍、提高了信噪比以及準確觀察分子空間分布和定位的能力[50]。
目前,IMS 已與上述的MALDI、DESI、LAESI等多種MSI 技術集成,并成功用于生物樣本中小分子代謝物、藥物分子和脂質的原位成像[50-51]。如Fu等[52]使用MALDI-IMS-MSI 方法對淡水甲殼類動物組織切片中的等壓/異構脂質進行原位成像和鑒定,首次成功展示了3 種同量異位脂類在m/z為782.561處的明顯分布。Towers 及其研究團隊[53]利用DESI結合行波離子淌度譜(travelling wave ion mobility spectrometry,TWIMS)直接對大鼠組織切片中的蛋白質和肽進行成像,與常規DESI-MSI 相比,DESITWIMS-MSI 能夠分離高度復雜的重疊信號,顯著提高了信噪比和成像分辨率(150 μm)。還有研究者描述了一種通過LAESI-IMS-MS 直接分析和成像貼壁哺乳動物細胞中小分子代謝物和脂質的方案[54],通過結合IMS,可以在同一次LAESI 采集中分別提取和分離與背景、洗滌緩沖液和細胞信號相關的光譜特征。隨著技術不斷發展,IMS-MS 成像的前景一片光明,該技術強大的分離能力和越來越高的分辨率能夠給研究人員帶來關于生物樣本的更詳細的信息。
3 數據處理新方法助推生物組織的MSI
數據分析是MSI 的重要組成部分。然而隨著MSI 技術的發展以及質量分辨率和空間分辨率的提高,每個生物組織切片可能會產生幾百千兆字節的龐大原始成像數據,為后續的分析帶來了困難,這也是MSI 在實際應用的主要障礙。為了滿足MSI 數據處理的需要,需要開發許多特定的軟件包。
一種開放數據格式imzML 的引入使免費和開源軟件更加兼容[55]。目前常見的開源軟件包和免費開放的MSI 平臺包括 MSIReader[56]、OmniSpec[57]、BioMap 和Datacube[58]等。在最近的報道中,He 等[59]開發了一款名為MassImager 的新商業軟件用于MSI數據分析,可以實現交互式可視化、原位生物標志物發現和人工智能病理診斷等功能。由Cordes 開發的M2aia[60]是第一個可擴展的開源應用程序,它支持對MSI 大型數據集進行快速、用戶友好和交互式探索,實現3D 圖像重建。此外,許多研究人員還結合機器學習算法開發出了新的MSI 生物信息學平臺,如Kirill 等[61]引入了pyBASIS 計算平臺,使用機器學習和相關模式識別改進組織樣本的原位信息恢復和比較分析,使得大規模數據處理更容易,重復性更高。而Zhang 等[62]使用預訓練的神經網絡建立了一種深度學習方法模型,能夠從MSI 數據的離子圖像中提取高級特征,證明了使用神經離子圖像能更好地解釋離子圖像之間的局部顯著差異,從而在后續獲得更精細的聚類結果。
4 總結
原位質譜成像技術與其他傳統分子成像手段相比,可以對組織或細胞樣品實現直接、快速、無損的原位分析,無需標記或特異性的探針修飾,既簡化了處理,也避免了因標記引入的外源性或標記物本身的多親和力的影響。同時MSI 靈敏度較高,檢測范圍高覆蓋,可對目標或非目標分子同時進行成像分析,包括組織中的生物分子、藥物和完整的蛋白質等。種種優勢使得MSI 技術在生物醫藥、食品科學、植物學研究等領域越來越受到青睞,但目前從總體來看,MSI 技術還存在一些不容忽視的局限性和改進的空間,如較低的分子電離水平限制了更高的空間分辨率的實現,只能對分析物進行半定量和相對定量、除脂質外其他類代謝物如蛋白和肽目前還沒有成熟的方案用于常規分析等。將MSI 技術廣泛應用到生命科學基礎研究中任重而道遠,需要研究者們在此方面進行更加深入地研究。
5 展望
5.1 MSI單細胞水平化
未來,MSI 將會朝著更高的空間分辨率以實現單細胞或亞細胞水平分析的方向發展。最近的一些研究通過開發新的離子源、引入高能氣體團簇離子束、使用專用光學裝置等將各種MSI 技術的空間分辨率提高到亞微米級[63-65],在生物研究的各個方面提供了新的視角和可能性,如結合深度分析實現單細胞3D 成像[66],通過非靶向方法探索代謝途徑以及脂質-蛋白質、蛋白質-蛋白質和金屬-蛋白質在從亞細胞到整個生物體的復雜系統中的相互作用,以及綜合利用多模態成像和高精度監測技術來提供MSI 的亞細胞橫向分辨率。
5.2 MSI絕對定量化
隨著各領域的更深入研究,對提供定性信息的MSI 提出了更高的要求,需要開發新方法來發展定量MSI(quantitative mass spectrometry imaging,QMSI)[67]以提供更加準確且有意義的空間和豐度信息。為了在QMSI 實驗中進行準確定量,需要利用不同的策略來提高分析物分子的提取和電離效率,一方面要對基質效應進行補償,如開發規范化策略、更好的樣品制備步驟、選擇合適的基質、使用基質添加劑以及組織衍生化等手段;另一方面,需要降低信號變異性,目前已有的相關研究有使用串聯質譜(MS/MS)、優化激光能量和掃描速度以及改進數據分析方法等。
此外,近年來越來越多研究著眼于合成納米核@殼顆粒(如SiO2@Au nanoshells[68]等)新型材料輔助的表面激光解吸/電離質譜,有的還結合適配體以選擇性捕獲并富集目標分子,輔以信號放大策略,實現對生物流體中代謝物的準確定量分析[69],但目前還沒有出現將其應用到成像領域的報道。基于其優異性能,未來必然會成為MSI 領域的一大熱門研究方向,助力實現QMSI,以推動MSI 技術在空間組學和精準醫療等生物醫藥前沿領域的應用。
5.3 MSI儀器便攜化
需要不斷開發新型的小型便攜化MSI 儀器設備以使MSI 技術適用于更多的應用場景。同時,亟待著掌握計算機知識的復合型研究人才研發更開源、實用、強大的生物信息學工具以及數據處理新手段,助力MSI 技術實現從小分子到大分子,從亞細胞到多細胞,從器官到個體生物的更加廣泛全面的應用。

