新型冠狀病毒核蛋白N端結構域的表達純化以及晶體優化
陳鐸 劉永哲
(1.首都醫科大學附屬北京朝陽醫院呼吸與危重癥醫學科,北京 100020;2.首都醫科大學附屬北京朝陽醫院感染和臨床微生物科,北京 100020)
自2019年12月新型冠狀病毒(SARS-CoV-2)爆發以來,對全球的經濟社會造成了重大的影響,根據美國霍普金斯大學的統計,截至目前已經超過4.7 億人次感染新型冠狀病毒,超過600 萬人死于新冠肺炎感染[1-2]。面對日益增長的新型冠狀病毒感染病例,高效的檢測手段和有效的抗體治療是應對新型冠狀病毒的重中之重。
SARS-CoV-2 是目前發現的基因組較大的正鏈RNA 病毒,基因組大小約為30 kb,其5′端的基因主要編碼冠狀病毒的16 個非結構蛋白[3-5]。基因組3′端編碼冠狀病毒的4 種結構蛋白,包括核蛋白(nucleocapsid,N)、表面刺突蛋白(spike,S)、小包膜蛋白(envelope,E)和外膜蛋白(membrane,M)[6-8]。N 蛋白是冠狀病毒中含量最高的結構蛋白,位于病毒內部,具有較高的保守性。冠狀病毒N 蛋白包含了N 端結構域和C 端結構域,是一種具有較高免疫原性的磷酸化蛋白,在病毒內部與病毒RNA結合形成螺旋衣殼,穩定病毒的基因組[9-13]。因此,N 蛋白是重要的冠狀病毒檢測靶點,同時也是關鍵的抗體開發靶點蛋白。
雖然新型冠狀病毒的N 蛋白非常重要,但由于其蛋白中間存在柔性部分,全長蛋白并不穩定[14-15]。為了便于N 蛋白的結構生物研究和后續的抗體開發,本研究分析了N 蛋白全長的氨基酸序列,選取N 蛋白序列中的N 端結構域,約12 kD 的核酸結合序列作為靶蛋白,構建原核的表達質粒,在大腸桿菌中誘導表達新型冠狀病毒N 蛋白N 端結構域重組蛋白,N2+親和層析和分子篩凝膠層析探索N蛋白N 端結構域的純化方式從而獲得較高純度的目的蛋白,通過Hampton 晶體試劑盒優化得到質量較高的N 蛋白N 端結構域蛋白質晶體,為后續N 蛋白N 端結構域的結構生物學研究和抗體制備提供關鍵研究基礎。
1 材料與方法
1.1 材料
pET28b 原核表達質粒由本實驗室保存;N-N 蛋白(N 蛋白N 端結構域(47N-175G))基因由北京睿博生物科技有限公司進行優化合成;大腸桿菌表達菌株BL21(DE3)和質粒擴增菌株DH5α 購自北京全式金生物技術有限公司;卡那霉素、DTT 和IPTG誘導劑購自大連美侖生物技術有限公司;酵母粉和蛋白胨購自OXOID 公司;鹽酸、氯化鈉和咪唑購自北京化工廠;HEPES 和六水氯化鎂購自Amresco公司;DNA 膠回收試劑盒和小提質粒試劑盒購自杭州博日科技有限公司;SDS-PAGE 預制膠和Ni-NTA beads 購自南京金斯瑞生物科技有限公司;T4 連接酶和PCR mix 酶購自南京諾唯贊生物科技有限公司;限制性內切酶購自Thermo Fisher 公司;晶體篩選試劑盒購自Hampton 公司;16 孔晶體板購自天宇有機玻璃制品高分子有限公司;考馬斯亮藍R250 和G250 購自北京溪洋匯智科技有限公司;10 kD 超濾濃縮管(15 mL 和5 mL)購自Merck Millipore 公司;Superdex 75 10/30 GL 購自GE 公司。
1.2 方法
1.2.1 N-N 蛋白的序列合成和表達載體構建 通過NCBI 數據庫查詢新型冠狀病毒N 蛋白全長氨基酸序列(GenBank:MN908947.3),本實驗使用CLUSTALW 網站進行氨基酸序列對比,選取N-N 蛋白(47N-175G)129 個氨基酸相對應的基因序列為目的序列,經北京睿博生物科技有限公司進行原核系統密碼子優化并人工合成,N-N 蛋白的基因序列連入通用載體Topo。我們以Topo-N-N 為模板,N-N-F和N-N-R 為引物(表1),擴增新型冠狀病毒N 蛋白N 端結構域基因序列。擴增目的基因片段通過DNA膠回收試劑盒進行片段回收,之后和質粒pET28b分別通過雙酶切(NdeI 和XhoI)、T4 連接酶進行片段載體連接和轉化進入DH5α 感受態進行質粒擴增,培養皿挑選陽性單克隆并通過小提質粒試劑盒進行質粒提取,雙酶切和測序鑒定正確的重組目的質粒命名為pET28b-N-N。

表1 引物序列Table 1 Primer sequences
1.2.2 N-N 蛋白誘導表達 將構建好的pET28b-N-N質粒轉化到大腸桿菌表達菌株BL21(DE3)感受態細胞中。通過卡那霉素抗性平板篩選陽性的表達菌株,轉移至包含5 mL LB 培養基的小試管中并添加50 μg/mL 卡那霉素進行37℃ 220 r/min 過夜搖晃培養。第2 天將菌株轉入包含1 L LB 培養基的大瓶中并添加50 μg/mL 卡那霉素進行220 r/min 搖晃培養至菌液OD600nm為0.8 時,降低培養溫度至16℃,加入終濃度為0.4 mmol/L IPTG 進行過夜誘導,之后將菌液進行4 000 r/min 離心收集大腸桿菌,然后用lysis buffer(20 mmol/L HEPES,pH 7.0,150 mmol/L NaCl,4 mmol/L MgCl2)重懸并進行高壓均質破碎,12 000 r/min 離心后收集上清液進行后續的純化。
1.2.3 N-N 蛋白表達和純化 大量誘導表達N-N 蛋白,誘導結束后離心、收集大腸桿菌,重懸高壓均質破碎,高速離心獲得含有大量目的蛋白的上清液,然后進行Ni2+親和層析純化,上樣流速為1 mL/min,上樣后用wash buffer(20 mmol/L HEPES,pH 7.0,150 mmol/L NaCl,4 mmol/L MgCl2,20 mmol/L 咪唑)進行洗雜至G250 檢測不變藍,最后用Elution buffer(20 mmol/L HEPES,pH 7.0,150 mmol/L NaCl,4 mmol/L MgCl2,200 mmol/L 咪唑)洗脫目的蛋白并收集流出液。我們將流出液經過超濾濃縮管(截留蛋白分子量:10 kD)濃縮至1 mL,以1 mL/min 的流速上樣,進行分子篩凝膠色譜層析(Superdex 75),收集最要的蛋白質峰,即為新型冠狀病毒N-N 蛋白。通過SDS-PAGE 電泳對其進行純度檢測。
1.2.4 N-N 蛋白與RNA 相互作用的EMSA 分析 通過EMSA 試驗驗證N-N 蛋白與核酸的相互作用。采用體積分數為10%的Native 蛋白膠,合成序列為UCUUAGGAGAAUGAC 的RNA,按N-N 蛋白和RNA 摩爾比為1∶1.2 的比例預混蛋白和核酸,加上等比例的甘油,冰上孵育2 h 后上樣,冰浴電泳(7 mA,120 min)。結束后將蛋白膠放置到含有核酸染料的染液中染色10 min,在照膠儀上觀察條帶。
1.2.5 N-N 蛋白晶體優化 將分子篩純化的N-N 蛋白峰進行合并,經過超濾濃縮管(截留蛋白分子量:10 kD)濃縮至7 mg/mL 左右進行懸滴晶體生長條件篩選。晶體生長溫度為16℃,試劑條件包括Hampton 公司的index1-96、PEGRx 1、PEGRx 2、Crystal Screen、Crystal Screen 2、PEG/Ion Screen 和PEG/Ion 2 Screen 等試劑盒。最終在PEG/Ion Screen的23 號條件(0.2 mol/L Ammonium formate,20%W/V Polyethlene glycol 3350)初篩獲得N-N 蛋白質晶體,以此條件為基礎,進行晶體生長條件優化。優化手段包括以PEG/Ion Screen 的23 號條件為基礎,按4∶1 的體積比分別加入index1-96、Crystal Screen、Crystal Screen 2、PEG/Ion Screen 和PEG/Ion 2 Screen 等其他晶體篩選試劑,獲得較大晶體后再進行Additive Screen 和Detergent Screen 最終優化。
2 結果
2.1 N-N蛋白的序列選取
使用CLUSTALW 網站對SARS-CoV-2(QHD 43423.2)、SARS-CoV(NP_828858.1)和MERS-CoV(YP_009047211.1)進行N 蛋白氨基酸序列對比,可以看出在N 蛋白的N 端結構域3 種病毒的差異較大,特別是MERS-CoV 與其他兩種病毒的差異更大(圖1),因此本研究選取了新型冠狀病毒N-N 蛋白(47N-175G)129 個氨基酸序列作為目的蛋白序列,并在NCBI 查找對應的基因序列,通過生物公司進行基因合成構建原核表達重組載體,通過原核表達純化獲得性質較好特異性較高的N-N 蛋白。

圖1 SARS-CoV-2、SARS-CoV 和MERS-CoV 的N 蛋白氨基酸序列對比Fig.1 Comparison of N protein amino acid sequences of SARS-CoV-2,SARS-CoV and MERS-CoV
2.2 N-N蛋白表達質粒的構建和鑒定
以Topo-N-N 為模板,生物公司合成N-N-F 和N-N-R 進行擴增,獲得大小約350 bp 的目的基因片段,與預期的大小相符(圖2),通過NdeI 和XhoI雙酶切目的片段和載體,T4 連接酶22℃連接2 h 轉化到DH5α 感受態中,通過帶卡那霉素抗性的板子篩選獲得陽性克隆,再通過雙酶切鑒定和基因測序鑒定,獲得pET28b-N-N 重組原核表達質粒。

圖2 N-N 蛋白基因片段擴增結果Fig.2 PCR amplification result of N-N protein
2.3 N-N蛋白的純化
將pET28b-N-N 質粒轉化到大腸桿菌表達菌株BL21(DE3)中,按照1.2.2 中的方法培養誘導N-N 蛋白的大量表達,采用Ni2+親和層析柱和分子篩凝膠色75 譜層析柱純化N-N 蛋白。N-N 蛋白在Superdex 75 分子篩中的出峰位置為16.5 mL,符合Superdex 75 分子篩的出峰情況,其峰尖280 nm 的吸收值約為260 nm 的2 倍為正常的蛋白質比值(圖3-A),通過12% SDS-PAGE 蛋白質膠分析N-N 的純化情況,經過Ni2+親和層析柱和分子篩凝膠色譜層析柱的純化,通過Quantity One 軟件對蛋白膠進行積分定量分析,N-N 蛋白的純度達到90%以上(圖3-B)。

圖3 N-N 蛋白的表達純化Fig.3 Expression and purification of N-N protein
2.4 EMSA試驗驗證N-N蛋白與RNA相互作用
通過EMSA 試驗證明了N-N 蛋白與RNA 確實具有較強的相互作用(圖4),隨著N-N 蛋白濃度的提高,可以形成穩定分N-N 蛋白-RNA 復合物。進一步明確N-N 蛋白結合RNA 的能力,從側面驗證N蛋白N 端結構域結合病毒基因組,穩定病毒基因組的功能。但是EMSA 無法準確定量N-N 蛋白與RNA的結合比例以及N-N 蛋白與RNA 結合的具體方式,這些將在后續實驗中通過完整的N-N 蛋白-RNA 復合物結構來進一步驗證。
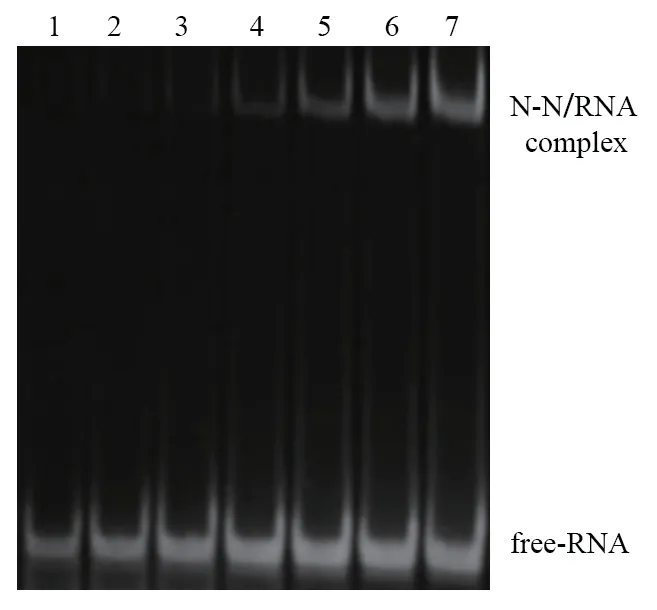
圖4 N-N 蛋白與RNA 結合的EMSA 結果Fig.4 EMSA result of binding of N-N protein and RNA
2.5 N-N蛋白的晶體篩選
將分子篩純化的N-N 蛋白濃縮至7 mg/mL,加入2 mmol/L 的DTT 還原劑后進行晶體生長篩選。在PEG/Ion Screen 的23 號(0.2 mol/L Ammonium formate,20% Polyethlene glycol 3350 W/V)池液生長條件獲得初篩N-N 蛋白晶體(圖5-A)。以PEG/Ion Screen 的23 號條件為基礎,按照4∶1 的體積比分別加入index1-96、Crystal Screen、Crystal Screen 2、PEG/Ion Screen 和PEG/Ion 2 Screen 等其他晶體篩選試劑,在添加Crystal Screen 的45 號(0.2 mol/L Zinc acetate dihvdrate,0.1 mol/L Sodium cacodylate trihydrate pH 6.5,18% Polyethlene glycol 8000 W/V)獲得較大的晶體(圖5-B)。之后再進行Additive Screen 和Detergent Screen 優化,最終在添加Additive Screen 25 號(1.0 mol/L Sodium malonate pH 7.0)下獲得質量較高的N-N 蛋白晶體(圖5-C)。

圖5 N 蛋白的晶體優化Fig.5 Optimization of N protein crystal
3 討論
冠狀病毒包含4 種結構蛋白,N 蛋白是冠狀病毒最重要的結構蛋白之一[16],負責穩定病毒的基因組,協助病毒的轉錄復制過程。此外,N 蛋白具有較強的免疫原性[17],可以誘導人體產生較強的免疫應答[18]。N 蛋白的抗體較S 蛋白的抗體更早出現[19],而且檢測率更高,維持時間更長,說明對于N 蛋白抗體檢測試劑盒的開發比S 蛋白更加有優勢[20-21]。由于N 蛋白全長序列中間存在柔性較大的部分,直接表達存在一定的困難[22],為了獲得大量穩定的N蛋白,本研究通過構建N 蛋白N 端結構域的原核表達系統,獲得了大量的可溶N-N 蛋白,為后續抗體檢測試劑盒開發[23]和抗體藥物[24]開發提供重要的研究基礎。
本研究參考Chatzileontiadou 等[25]的蛋白純化方法,在獲得大量的可溶N-N 蛋白基礎上,通過Hampton 晶體試劑盒進行晶體篩選。但與既往的研究不同,根據初篩條件還需要進一步摸索條件,如上述結果中所述,既往大部分研究將分子篩純化的N-N 蛋白濃縮至7 mg/mL,加入2 mmol/L 的DTT 還原劑,本研究為進行多輪晶體優化,最終獲得質量較高的N-N 蛋白晶體,故以PEG/Ion Screen的23 號條件為基礎,按照4∶1 的體積比分別加入index1-96、Crystal Screen、Crystal Screen 2、PEG/Ion Screen 和PEG/Ion 2 Screen 等其他晶體篩選試劑,在添加Crystal Screen 的45 號獲得較大的晶體,從而通過X 射線衍射試驗,獲得較好的衍射圖像。此步驟獲得的蛋白晶體,為N 蛋白N 端結構域三維結構的解析提供直接的研究基礎。為后續的N 蛋白結構生物學研究,以及N 蛋白穩定核酸機制的解釋提供了重要高純度蛋白。
本研究還通過EMSA 試驗定性驗證了N-N 蛋白與RNA 具有明確的相互作用。隨著N-N 蛋白濃度的提高,可以形成穩定分N-N 蛋白-RNA 復合物,該結果也被其他類似研究證實[26-29]。從側面證實了N蛋白N 端結構域在穩定病毒基因組中的作用,為后續的N 蛋白功能研究提供思路和依據。
N 蛋白主要兩大作用,一是結合在病毒的RNA,穩定病毒的基因組,二是可以結合轉錄復制形成N 蛋白的RNAP 復合物,促進基因組轉錄復制[30]。N 蛋白屬于結構蛋白,目前開發的抗體試劑盒也是針對N 蛋白或者S 蛋白[26-27]。本研究通過N-N蛋白的表達純化,主要是優化了后續的晶體生長條件,獲得質量較高的N-N 蛋白晶體,后續將以此為基礎解析N-N 蛋白晶體結構,為N 蛋白的結構生物學研究提供重要研究基礎。同時,N 蛋白具有較好的機體免疫原性,本研究提供了N 蛋白N 端結構域原核表達純化的方法,將為后續的抗體檢測試劑盒開發,以及靶點N 蛋白的抗體藥物研究提供關鍵的技術支撐。
4 結論
本研究提供了新型冠狀病毒N-N 蛋白表達純化的新方法,在大腸桿菌表達系統中高效的表達大量可溶N-N 蛋白。通過Ni2+親和層析和分子篩凝膠色譜層析可以獲得純度超過90%的N-N 蛋白。通過晶體篩選最終獲得質量較高的N-N 蛋白晶體,為后續的結構生物學研究提供重要理論基礎。

