Vero細胞基質流感疫苗研究進展
馬芳芳 康碧靜 馬春英 劉振斌 楊迪 喬自林 王明明 馬忠仁 王家敏
(1.西北民族大學生物醫學研究中心 甘肅省動物細胞技術創新中心,蘭州 730030;2.西北民族大學生物工程與技術國家民委重點實驗室,蘭州 730030;3.西北民族大學生命科學與工程學院,蘭州 730030)
流行性感冒(簡稱流感)是由流感病毒感染引起的病毒性傳染性呼吸道疾病。流感病毒屬于正黏病毒科,單股負鏈RNA 病毒,分為甲(A)、乙(B)、丙(C)、丁(D)4 型,其中甲型流感病毒和乙型流感病毒主要引起人流感(圖1)。甲型流感病毒(influenza A virus,IAV)感染宿主范圍廣,是導致季節性流感傳播的主要病原體[1],給社會帶來了嚴重的經濟損失。乙型流感病毒(influenza B virus,IBV)僅僅在人與人之間傳播,常引起局限性流行。由于流感病毒RNA 聚合酶校正功能缺失,變異快,曾造成4 次世界范圍內的大流行,分別為西班牙H1N1 流感、亞洲 H2N2 流感、中國香港H3N2 流感及2009年在全球暴發的H1N1 流感[2]。隨著病毒不斷變異,H5N1、H9N2、H7N9 和H10N8 亞型的人畜共患流感病毒被確定為將來潛在的流行毒株[3],勢必對人類和動物的健康造成嚴重威脅,同時對公共衛生及經濟帶來打擊。
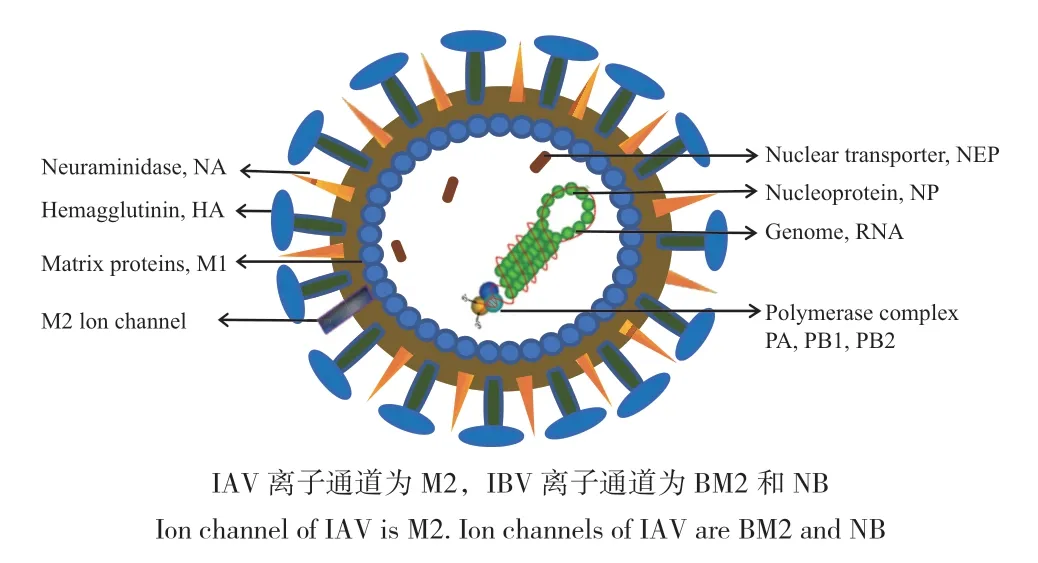
圖1 流感病毒Fig.1 Influenza virus
接種流感疫苗是預防流感最常用和最有效的手段。尤其自新型冠狀病毒肺炎(coronavirus disease 2019,COVID-19)暴發以來,因其癥狀與流感類似,且具有高致病性和傳染性,對全球公共衛生安全造成了巨大威脅,疫苗作為預防傳染性疾病最有效的策略之一再度成為研究熱點。值得注意的是,目前獲得批準使用的流感疫苗主要是雞胚基質流感疫苗,但是考慮到雞胚的局限性,科研人員逐漸關注哺乳動物細胞生產流感疫苗技術,而其中Vero(Vero simian Kidney epithelial)細胞是世界衛生組織和我國生物制品規程認可的僅用于人用疫苗生產的細胞系。現就流感疫苗研究進展及關于Vero 細胞基質制備流感疫苗研究作一概述,為細胞基質流感疫苗的研發提供參考。
1 流感疫苗的研究現狀
目前,我們熟知的流感疫苗有雞胚基質流感疫苗、細胞基質流感疫苗和重組流感疫苗。圖2展示了流感疫苗發展的歷史進程[4]。
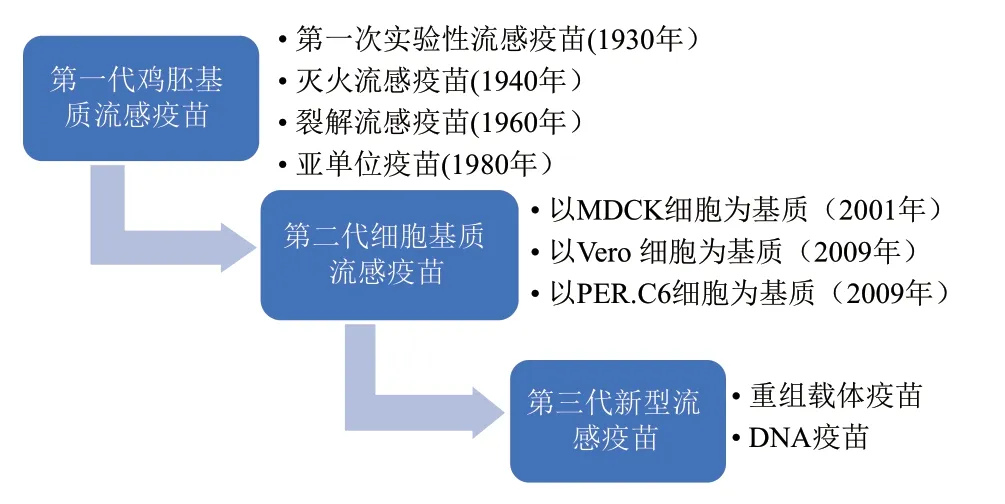
圖2 流感疫苗發展的歷史Fig.2 History of influenza vaccine development
雞胚苗的生產工藝已達70 余年,主要包括滅活疫苗(通常稱“流感疫苗”)和減毒(弱化)活疫苗(通常稱“鼻噴霧流感疫苗”)。基于雞胚基質流感疫苗生產技術仍在廣泛應用,表1總結了美國2020-2021 季節以雞胚為基質流感疫苗產品,主要為四價流感疫苗[5]。盡管以雞胚為基質生產流感疫苗是最成熟的方法,但雞胚苗存在以下缺陷[6]:第一,依賴于SPF 級雞胚,清潔程度高,生產過程繁瑣。首先,生產一劑人用流感疫苗需要1-2 個雞胚,每只雞胚可收獲尿囊液約10 mL,因此需要大量雞胚;此外,9-10日齡雞胚才可用于病毒接種,耗費時間長。第二,不適于某些病增殖,如H3N2 株,高致病性禽流感株H5N1,導致病毒滴度低。第三,不可控因素較多,如下游加工過程存在無菌風險。第四,雞胚蛋白的殘留,導致潛在的過敏反應。第五,若恰逢禽流感暴發,將面臨一時間內雞胚嚴重供應不足等問題,將嚴重阻滯流感疫苗生產。
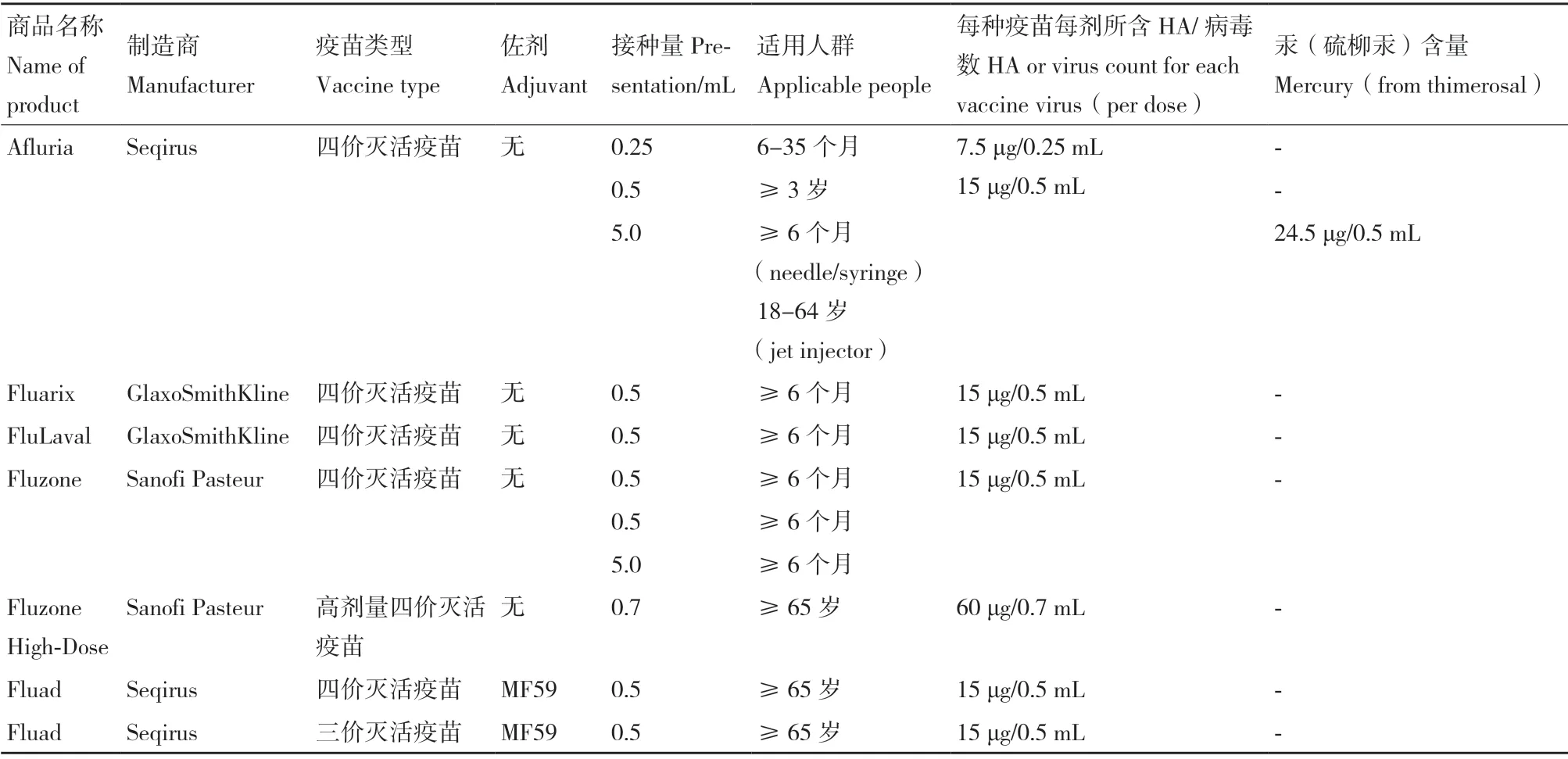
表1 2020-2021年美國FDA 批準的季節性雞胚基質流感疫苗Table 1 2020-2021 US FDA approved seasonal chicken embryo-based influenza vaccine
為克服雞胚生產的限制,細胞培養作為一種相對較新的技術相繼發展。1995年以來,美國FDA和WHO 積極推進使用細胞苗替代雞胚苗[7]。最初,該生產工藝使用的候選疫苗病毒是雞胚衍生的,直到2016年,FDA 批準 Seqirus(美國唯一一家獲得FDA 批準的基于細胞的流感疫苗制造商)開始使用細胞培養的候選疫苗病毒[8]。Flucelvax Quadrivalent是唯一獲得FDA 許可在美國使用的細胞基質滅活流感疫苗,主要適用于6 個月及以上人群[9]。與雞胚苗相比,細胞苗具有以下優點[10-11],(1)細胞便于儲存,并且細胞培養避免了對雞胚等原材料的依賴;(2)易于規模化生產;(3)在標準化制造過程中加強控制,細胞培養物、培養基和原材料的無菌性降低了最終產品微生物污染的風險;(4)避免對雞胚蛋白過敏;(5)疫苗病毒株在細胞中傳代突變幾率低,細胞衍生的疫苗株抗原性更接近自然流行株;(6)從生產的角度來看,利用哺乳動物細胞培養技術生產流感疫苗的方法更快、更廉價、更高效,有助于人類預防包括禽流感在內的流感的大規模暴發。同時環境友好,降低廢棄物排放,減輕制造商負擔,特別是在大流行等緊急情況下,應用細胞基質代替雞胚基質可有效緩解衛生壓力。綜上所述,細胞苗已成為流感疫苗研制的重要方向。
在培養流感病毒的細胞生產開發中,貼壁依賴性生長的MDCK 細胞、Vero 細胞和PER.C6 三個細胞系是目前最普遍的選擇[12](表2)。MDCK 細胞是培養和分離流感病毒最佳的哺乳動物細胞系,但其存在潛在成瘤性,使得其應用于疫苗生產顧慮重重;PER.C6 是流感病毒的敏感適應細胞系,但它屬于荷蘭抗體和疫苗公司專利所有。Vero 細胞是貼壁性連續傳代細胞系,由日本千葉大學的Y.Yasumura 和Y.Kawakita 從正常成年非洲綠猴的腎臟分離培養[13],與其他細胞基質相比,其安全性是Vero 細胞用于流感疫苗生產的最大優勢。但與MDCK 細胞相比,Vero 細胞表面唾液酸受體相對較少,對大多數流感病毒的敏感性較低[14],故選育流感病毒Vero 細胞高產適應株,成為Vero 細胞流感疫苗研發首當其沖的首要任務。另外,建立高效的流感病毒擴增系統是基于Vero 細胞培養的流感疫苗生產的第一步,最初細胞培養工藝研究主要采用含血清培養系統[15]。近年來,由于動物源性血清具有潛在的污染風險和不斷提升的質量監管要求以及微載體費用高等成本問題,采用無血清全懸浮培養成為流感病毒擴增工藝的主要趨勢[16]。基于MDCK 和Vero 細胞培養的流感病毒不同工藝研究比較(表3)。
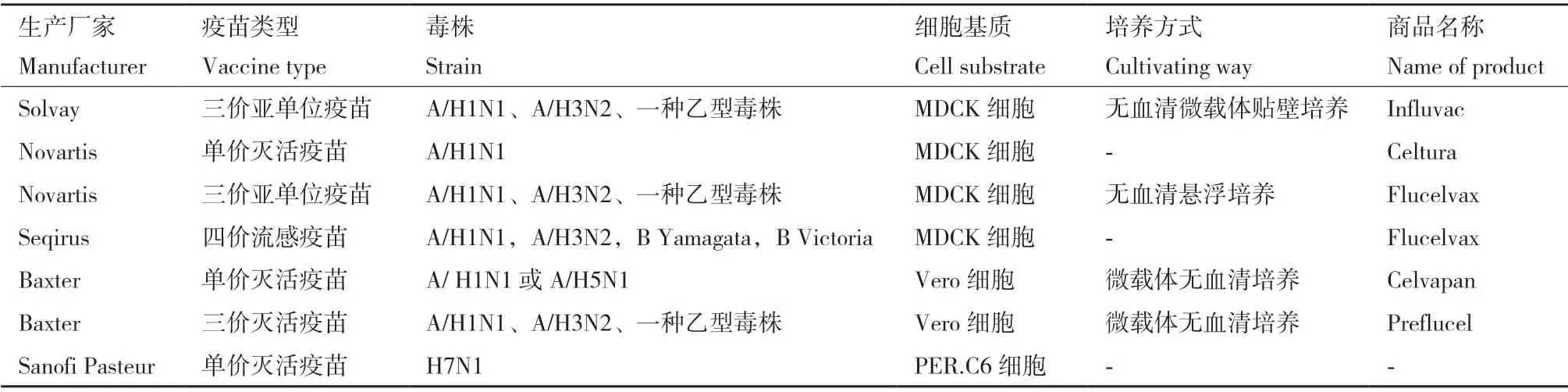
表2 細胞基質流感疫苗Table 2 Cell-based influenza vaccine
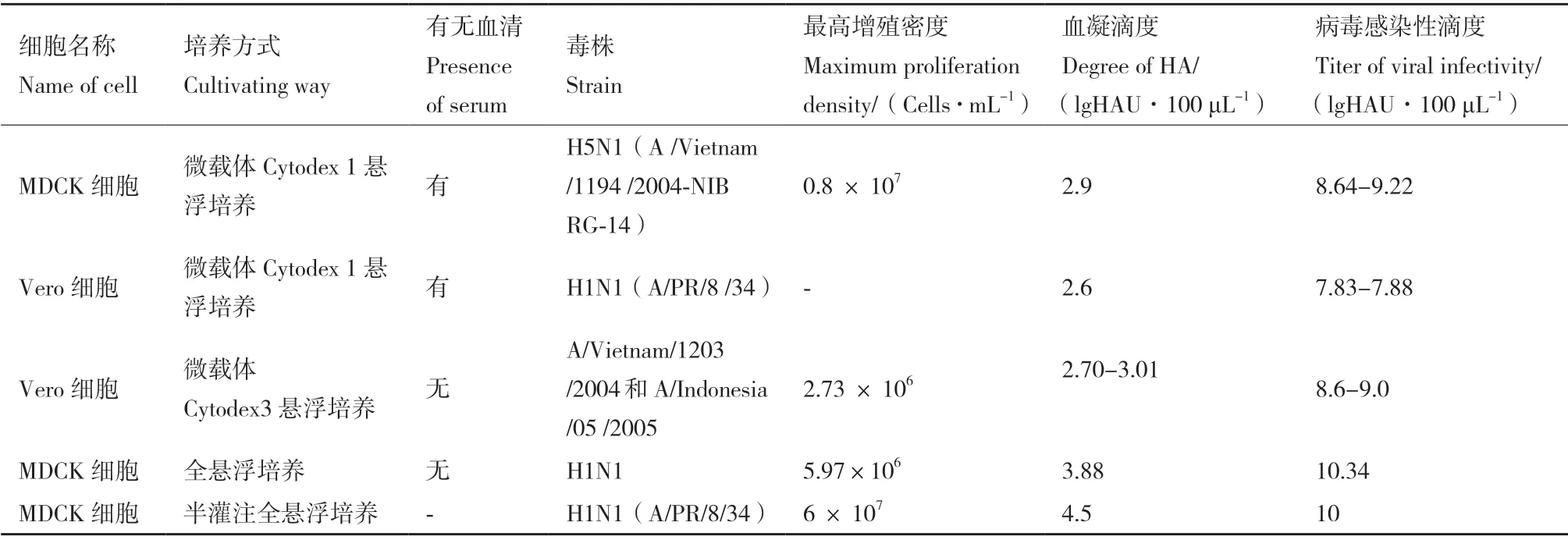
表3 MDCK 和Vero 細胞培養的流感病毒不同工藝研究比較Table 3 Comparison of different techniques of MDCK and Vero cell culture for influenza virus
2 Vero 細胞基質流感疫苗研究進展
自 20世紀 80年代以來,Vero 細胞被廣泛用于脊髓灰質炎、狂犬病、乙型腦炎以及新型冠狀肺炎等十多種人用病毒性疫苗的生產且被安全使用[17]。鑒于Vero 細胞是人用病毒性疫苗生產的良好細胞基質,近年來,基于 Vero 細胞培養的流感疫苗研究越來越多。圖3展示了Vero 細胞基質流感疫苗工藝流程,可以看到培養大量細胞是疫苗制備的基礎,而獲得Vero 細胞適應性且高產的流感病毒株是制備Vero 細胞流感疫苗的關鍵。
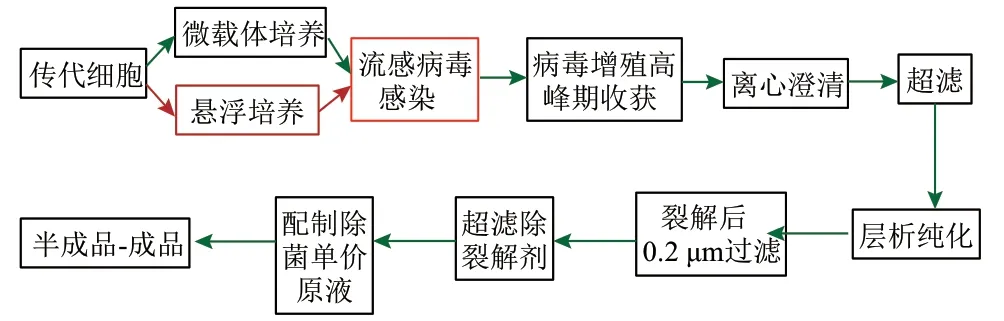
圖3 Vero 細胞基質流感疫苗工藝流程Fig.3 Technological process of Vero cell-based influenza vaccine
2.1 Vero細胞高產疫苗株
據報道,在2003年Hiroichi Ozaki 等[18]通過反向遺傳學技術建立了Vero 細胞高產甲型流感病毒毒株。他們通過將適應Vero 細胞的重組流感病毒株NS基因替換PR8 NS基因,獲得一種改良的A/Puerto Rico/8/34(PR8)流感病毒毒株,改善了在Vero 上病毒拯救和生長特性。與在標準PR8 毒株上挽救相同組合的病毒相比,在新毒株上挽救的H1N1、H3N2、H6N1 和H9N2 血凝素和神經氨酸酶組合的病毒動力學顯著增強。Legastelois 等[19]通過反向遺傳學產生了流感重組RG5,在雞胚和Vero 細胞上進行病毒種子擴增,該病毒種子可作為預防新高致病性禽流感毒株在人類傳播的疫苗毒株“文庫”。Shen等[20]通過基因重配法將Vero 細胞適應性流感病毒株A/Yunnan/1/2005/Va(H3N2) 和A/Anhui/1/2005(H5N1)共感染后,用抗 A/Yunnan/1/2005Va(H3N2)毒株的山羊抗體篩選重配體,獲得Vero 細胞適應型H5N1 流感病毒株,且重組前后單價活疫苗血清抗體滴度無顯著差異。Hu 等[21]通過連續傳代法使流感病毒株A/Puerto Rico/8/1934 適應Vero 細胞,20 代后獲得高增長毒株,經序列分析發現,該流感病毒適應株在NP、PB1、PA 和NS1 處均發生突變。綜上所述,通過篩選或重配等方法可獲得已適應Vero細胞的流感高產毒株,實現以Vero 細胞為基質生產流感疫苗指日可待。
2.2 懸浮培養型Vero細胞
為實現Vero 細胞高密度大規模工業化培養,研究者通過將懸浮培養和貼壁培養二者工藝優勢巧妙結合,建立了Vero 細胞生物反應器微載體懸浮培養工藝。但微載體懸浮培養工藝也有缺陷,如微載體價格昂貴、工藝繁瑣、細胞消化不完全、無法細胞計數等[22]。與之相比,全懸浮培養工藝恰好能夠彌補其不足之處,開發無血清全懸浮細胞培養工藝對流感疫苗的生產具有重要意義。1992年,Litwin[23]首次報道Vero 細胞在無血清培養基中以細胞聚團樣懸浮生長,而非單個細胞樣懸浮生長。在此之后,未見Vero 細胞懸浮培養相關報道,直到2009年,Paillet 等[24]通過逐步增加無血清培養基的比例,經120 d 左右的馴化,終于使Vero E6 細胞適應懸浮培養,并且比較了水泡口炎病毒、單純皰疹病毒和脊髓灰質炎病毒在貼壁型Vero 細胞和懸浮型Vero 細胞上的增殖。結果發現懸浮培養Vero 細胞上水泡口炎病毒的產率最高。單純皰疹病毒,感染后47 h 病毒滴度可達3.2×108TCID50/mL,與貼壁培養型Vero 細胞相似。盡管該研究發現Vero 細胞成功適應單細胞懸浮生長,并且開發了生物反應器工藝,但是該系統并未進一步開發應用。10年之后,Rourou[25]和Shen[26]兩個科研團隊描述了Vero 細胞在無血清培養基中懸浮生長的適應性。Rourou 等研究發現Vero 細胞最初在IPT-AFM 中以單個細胞懸浮培養,平均細胞密度達(2.1±0.4)×106個/mL,分傳第二代時出現中小不同程度的細胞聚團。Shen和團隊成功馴化貼壁型Vero 細胞適應無血清和動物源性成分IHM03 培養基并懸浮生長,但也觀察到一些聚集物,其倍增時間在40 h 和44 h 之間。Lee等[27]運用逐步適應法獲得了能夠在無血清培養基OptiPRO 中懸浮培養的Vero 細胞,并且腺病毒產量比貼壁培養的Vero 細胞高1.5 倍。此外,劉鵬等[28]使用自配的Vero 細胞懸浮培養基初步建立了Vero細胞的懸浮培養技術,并在懸浮Vero 細胞培養重組流感病毒H5N1 和H7N9 上獲得了較高的血凝素產量,為規模化生產大流行流感病毒株疫苗做鋪墊。這些結果顯示,懸浮培養型Vero 細胞系用于疫苗生產具有巨大潛力,值得進一步開發探索。
綜上所述,雖然已有成功懸浮培養的報道,但與流感病毒在懸浮培養型Vero 細胞上增殖的相關文獻報道鮮有,因此還需要研究來彌補懸浮培養型Vero 細胞的不足。根據已有大量文獻報道懸浮培養型動物細胞系的成功建立,例如懸浮培養型MDCK細胞系[29]、CHO 細胞系[30]、HEK293 細胞系[31]等,發現以上細胞系已有成熟的商品化培養基,而市面上Vero 細胞全懸浮培養基甚少。因此,盡管已有現有技術的支撐,但Vero 細胞的懸浮馴化及應用仍然極具挑戰。
3 總結與展望
由于流感病毒極易變異,其有效防控依然是人類和畜禽養殖業面臨的巨大挑戰。傳統的雞胚苗已無法滿足巨大的市場需求,故需進一步優化流感疫苗生產技術,細胞苗的研發是科研人員和醫療人員需要攻克的難題。另外,從動物細胞大規模培養的發展趨勢來看,反應器懸浮培養動物細胞技術、無血清培養技術等是當前世界各大生物公司產業化生產疫苗等生物制品的首要選擇和發展方向。
在過去30年里,Vero 細胞系已被廣泛研究,并獲得了WHO 的認可,用于人類疫苗生產。近年來,Vero 細胞基質流感疫苗研發取得了較大進展,基于Vero 細胞系生產大流行性和季節性流感疫苗的研究,顯示其具有良好的耐受性和免疫原性[32]。然而相對于成熟的MDCK 細胞基質流感疫苗生產工藝,Vero細胞基質流感疫苗在全懸浮細胞培養和高產疫苗毒株等配套體系建設、病毒滴度的提高、高效生產工藝研發與優化、Vero 細胞專用懸浮培養基的開發等研究方面尚面臨較多需要解決的問題,因此,Vero細胞基質流感疫苗研究工藝還需進一步深入研究。
除了加強對細胞基質流感疫苗的研發之外,還需探索新的流感疫苗研究技術,例如當前COVID-19大流行中強調的mRNA 疫苗,以解決流感疫苗生產能力的潛在不足。需值得注意的是,A(H1N1)pdm09 大流行期間一劑疫苗足以提供足夠的免疫保護,但對于其他流感亞型(例如H5N1)可能需要兩劑大流行疫苗才能引發足夠的免疫反應,而目前70%人口不足以滿足兩劑的接種目標[33]。另外,由于流感病毒的進化是一個復雜過程,涉及突變和重組以及多個宿主,因此,難以預測下一次流 感大流行何時發生以及確切的毒株是什么。鑒于面臨的以上困難,將來對通用型流感疫苗的研發也是及其有必要的。

