野生葛根與栽培葛根對慢性酒精中毒小鼠的護肝作用比較
姚 媛,蓋永強,陳鐵軍,王 喆,樸美子,2,*
(1.青島農業大學食品科學與工程學院,山東 青島 266109;2.青島海軍食品與營養創新研究院(青島特種食品研究院),山東 青島 266109)
酒精性肝損傷定義為長期或過量攝入酒精引起的肝臟損傷[1-2]。通常是由于長期飲酒,使肝臟持續處于被酒精刺激的狀態,導致肝臟功能逐漸下降,出現肝硬化、酒精肝等疾病,進而會導致脂質代謝紊亂、免疫功能下降,最終多器官、系統出現疾病,甚至危及生命[3]。世界上各個國家肝硬化患者中有近一半是由于大量飲酒導致[4],長期大量飲酒對人體的損傷不容忽視。
葛根(Pueraria lobataOhwi)為豆科植物野葛或粉葛干燥后的根[5],是藥食同源植物,最早記載于《神農本草經》,具有較高的藥用價值[6]。野生葛根和栽培葛根中均含有一定量的葛根素和異黃酮等功能性成分[7],具有良好的抗氧化、解酒護肝和降血糖等功效[8-9],能夠緩解大量飲酒時酒精對肝臟的損傷。研究表明葛根素對小鼠急性酒精中毒有一定功效,能有效降低血液中乙醇含量,縮短小鼠醒酒時間[10-11]。
目前,大多數研究是針對同一葛根的不同部位(葛根、葛花)或單一葛根進行解酒護肝活性研究,而對比野生葛根和栽培葛根在緩解酒精性肝損傷方面差異的研究較少。鑒于此,本實驗以野生葛根和栽培葛根為研究對象,對野生葛根和栽培葛根中基本成分進行分析,建立小鼠慢性酒精性肝損傷模型,對比不同劑量的野生葛根和栽培葛根對小鼠肝組織和血液中轉氨酶、脫氫酶、抗氧化指標和炎癥信號指標影響的差異,以期為后續基于野生葛根和栽培葛根開發解酒護肝產品提供理論依據。
1 材料與方法
1.1 動物、材料與試劑
昆明種SPF雄性小鼠,8 周齡,體質量(25±2)g,購自青島大任富城畜牧有限公司,生產許可證號:SCXK(魯)2019-0003。
野生葛根粉和栽培葛根粉均購自連云港市葛花葛藤粉食品有限公司,產地為江蘇省連云港市,生長年限為2~3 年;乙醇體積分數56%紅星二鍋頭 北京紅星股份有限公司。
葛根素標準品 北京索萊寶科技有限公司;復方鱉甲軟肝片 內蒙古福雞醫療科技股份有限公司;石蠟、蘇木精、伊紅 上海吉至生化科技有限公司;乙醇脫氫酶(alcohol dehydrogenase,ADH)、乙醛脫氫酶(acetaldehyde dehydrogenase,ALDH)、谷丙轉氨酶(alanine aminotransferase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、過氧化氫酶(catalase,CAT)檢測試劑盒 南京建成生物工程研究所;一氧化氮(NO)、腫瘤壞死因子α(tumor necrosis factor α,TNF-α)、白細胞介素1β(interleukin 1β,IL-1β)和IL-10酶聯免疫吸附測試試劑盒 上海通蔚實業有限公司。
1.2 儀器與設備
U3000型高效液相色譜(high performance liquid chromatography,HPLC)儀 美國賽默飛世爾科技公司;ELx808酶標儀 美國BioTek公司;TGL-16M型高速冷凍離心機 湘潭湘儀儀器有限公司;索氏提取器連云港光威石英制品有限公司;切片機 天美(中國)科學儀器有限公司;BX53型正置熒光顯微鏡 奧林巴斯(中國)有限公司。
1.3 方法
1.3.1 野生葛根和栽培葛根中成分含量的測定
參考GB/T 22251—2008《保健食品中葛根素的測定》,采用HPLC法測定葛根素質量分數;參考DB32/T 1277—2008《葛根中異黃酮含量的測定》,采用紫外分光光度法測定異黃酮質量分數;參考GB 5009.7—2016《食品安全國家標準 食品中還原糖的測定》,采用直接滴定法測定還原糖質量分數;參考GB 5009.4—2016《食品安全國家標準 食品中灰分的測定》,采用灼燒法測定灰分質量分數;參考GB 5009.6—2016《食品安全國家標準 食品中脂肪的測定》,采用索氏抽提法測定脂肪質量分數。參考GB 5009.5—2016《食品安全國家標準 食品中蛋白質的測定》,采用分光光度法測定蛋白質量分數;參考GB 5009.9—2016《食品安全國家標準 食品中淀粉的測定》,采用酶水解法測定淀粉質量分數。
1.3.2 野生葛根和栽培葛根溶液的制備
購買的野生葛根粉與栽培葛根粉每日建議食用量為25 g,根據基于體表面積折算法的動物與人類等效劑量換算,成人體質量以70 kg計,可換算出小鼠每天攝入量為3.25 g/kgmb,以此劑量為基準[12],設計野生葛根和栽培葛根低、中、高劑量分別為3.3、10、30 g/(kgmb·d)。取適量葛根粉,加入不同量85 ℃的水配制成低、中、高劑量的葛根粉溶液,備用。
1.3.3 小鼠的分組及飼喂
將SPF級小鼠隨機分成9 組,分別為空白組(CK)、陽性組(PC)、模型組(MC)及野生葛根低(WP-L)、中(WP-M)、高劑量組(WP-H),栽培葛根低(CP-L)、中(CP-M)、高劑量組(CP-H)。每組12 只,適應性飼養7 d。
空白組和模型組灌胃與給藥組等體積的生理鹽水,陽性組灌胃復方鱉甲軟肝片(0.78 g/(kgmb·d)),野生葛根低、中、高劑量組給藥量分別為3.3、10、30 g/(kgmb·d),30 min后,除空白組,其余組均灌胃乙醇體積分數56%白酒,灌胃劑量均為10 mL/(kgmb·d)。栽培葛根低、中、高劑量組灌胃方式同野生葛根組。實驗期間,小鼠每7 d稱量1 次體質量,并按體質量調整給酒及給藥體積,灌胃11 周。
1.3.4 血清指標測定
小鼠末次灌胃后,禁食12 h,眼球取血于離心管內,4 ℃、3 000 r/min離心15 min,取上層血清,分裝后4 ℃冷藏備用。使用相應試劑盒檢測血清中ALT、AST、ALDH和ADH活力,其中ALT、AST結果以蛋白質量計。
1.3.5 肝臟指標測定
小鼠斷頸處死并解剖,取肝臟,一半肝組織放入10%福爾馬林固定液中保存,備用。剩余肝組織利用研磨器加生理鹽水制備質量分數10%的肝組織勻漿。離心取上清分裝后,按照試劑盒說明書的方法測定肝臟組織中ALT、AST、CAT、GSH-Px、NO、TNF-α、IL-1β和IL-10水平。ALT、AST、CAT、GSH-Px活力及NO含量以蛋白質量計。
1.3.6 小鼠肝組織切片觀察
將固定好的小鼠肝臟取出,選擇結構完整的部分切取約0.5 cm厚薄片,于流水下沖洗24 h,在45 ℃恒溫箱中用梯度體積分數乙醇溶液脫水。脫水完成后用二甲苯透明處理,并進行石蠟切片制作,完成后進行蘇木精-伊紅(hematoxylin eosin,HE)染色并觀察[13-14]。
1.4 數據處理與分析
采用SPSS Statistics 24.0軟件進行數據統計分析,結果以表示;采用Duncan法進行差異顯著性分析,P<0.05表示差異顯著。
2 結果與分析
2.1 野生葛根和栽培葛根中成分含量測定
由表1可知,野生葛根中的葛根素、異黃酮、脂肪和蛋白質量分數均顯著高于栽培葛根(P<0.05),分別高出26.31%、25.63%、41.31%、25.00%;野生葛根中灰分和淀粉的含量顯著低于栽培葛根(P<0.05)。野生葛根中還原糖質量分數為6.57%,與栽培葛根相差較小,無顯著差異(P>0.05)。

表1 野生葛根與栽培葛根中基本成分比較Table 1 Analysis of basic components in wild and cultivated kudzu root
野生葛根與栽培葛根在主要成分含量上有一定差異,這與兩種葛根生長環境、栽培方式的不同有關,屬于正常現象。后續實驗進一步驗證主要成分含量是否會影響其功能特性。
2.2 野生葛根和栽培葛根對小鼠血清和肝臟中轉氨酶活力的影響
由表2可知,與空白組相比,模型組小鼠長期受酒精的刺激,血清中AST、ALT水平顯著升高(P<0.05)。與模型組相比,野生葛根組和栽培葛根各劑量組小鼠血清中AST和ALT水平均顯著降低(P<0.05),表明野生葛根和栽培葛根對于受長期酒精刺激的小鼠血清中AST、ALT活力具有一定的穩定作用,使其在受刺激時保持穩定狀態。綜合比較,中劑量野生葛根組和栽培葛根效果更佳,且野生葛根的保護效果優于栽培葛根。
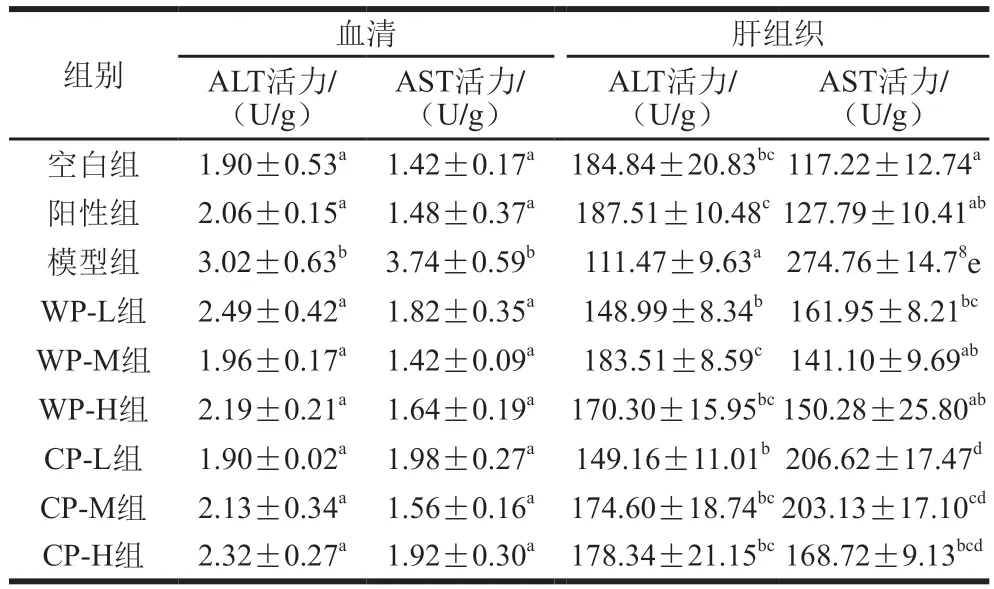
表2 葛根對小鼠血清和肝組織中轉氨酶活力的影響Table 2 Effect of kudzu root on the activity of transaminase in serum and liver of mice
模型組小鼠肝組織中ALT活力較正常組顯著降低(P<0.05),AST活力顯著增加(P<0.05),中劑量的野生葛根能夠有效減輕酒精對肝組織的損害,使肝臟AST和ALT活力保持在正常水平。
2.3 野生葛根和栽培葛根對小鼠血清中脫氫酶活力的影響
人體內對酒精起分解作用的關鍵酶是ADH和ALDH[15-16]。如表3所示,在長期酒精刺激下,陽性組、WP-M、WP-H組小鼠ADH活力仍具有較高水平,與空白組相當(P>0.05),說明陽性藥物和中、高劑量的野生葛根對肝臟起到了良好的保護作用,能夠穩定ADH活力,且中、高劑量野生葛根的功效能達到陽性藥物水平;CP-M、CP-H組小鼠ADH活力與模型組相比顯著提升(P<0.05),說明中、高劑量的栽培葛根同樣具有良好的穩定ADH活力的作用,但效果不及野生葛根組。模型組小鼠血清中ALDH活力顯著低于其他各組(P<0.05)。這是由于模型組小鼠長期受到酒精刺激,且無藥物輔助治療,肝組織損傷嚴重、功能下降,出現病癥,導致血清ALDH活力顯著降低;在同樣受到酒精刺激的情況下,小鼠在陽性藥物及一定劑量葛根作用下,ALDH活力能夠恢復至正常水平,與空白組無顯著差異(P>0.05)。綜合來看,中等劑量野生葛根的保護效果最佳。
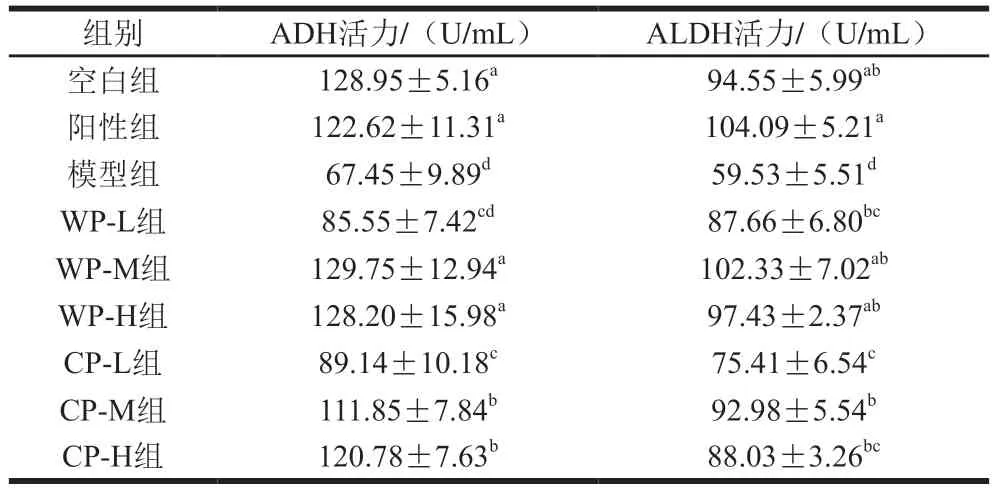
表3 葛根對小鼠血清中ADH和ALDH活力的影響Table 3 Effect of kudzu root on the activity of alcohol dehydrogenase and acetaldehyde dehydrogenase in serum of mice
2.4 野生葛根和栽培葛根對小鼠肝組織中抗氧化酶活力的影響
如表4所示,模型組小鼠肝組織中CAT活力顯著低于空白組和其他實驗組(P<0.05);與模型組相比,野生葛根和栽培葛根各劑量組CAT活力均顯著升高(P<0.05);WP-M、CP-L組CAT活力與正常組無顯著差異(P>0.05)。模型組小鼠肝組織勻漿中GSH-Px活力與空白組相比均顯著降低(P<0.05);與模型組相比,WP-M、WP-H、CP-L、CP-M和陽性組GSH-Px活力均顯著提高(P<0.05),與正常組無顯著差異(P>0.05)。說明葛根對慢性酒精損傷小鼠肝組織中GSH-Px活力有一定的提升作用,在一定程度上能減輕酒精對肝臟的損傷作用。
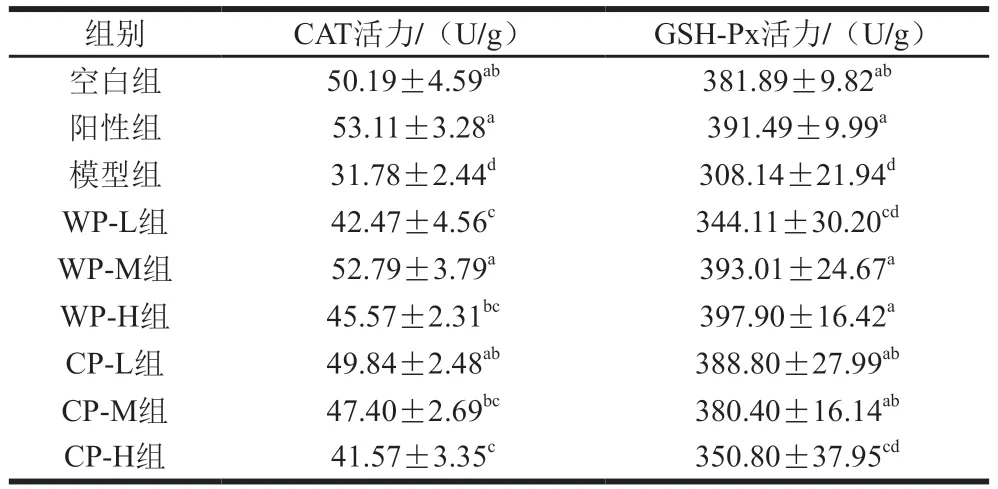
表4 葛根對小鼠肝組織中CAT和GSH-Px活力的影響Table 4 Effect of kudzu root on catalase and glutathione peroxidase in liver of mice
2.5 野生葛根和栽培葛根對小鼠肝組織中炎癥信號傳導的影響
如表5所示,模型組小鼠肝組織中NO含量為4.65 mmol/g,顯著高于空白組及其他實驗組(P<0.05);進一步驗證模型建立成功。實驗組小鼠雖長期受到酒精刺激,但在陽性藥物和相應劑量葛根的保護作用下,肝臟未出現功能受損的情況,NO含量均較模型組顯著降低;低、中劑量的野生葛根和栽培葛根對NO含量有穩定作用,但效果不明顯,與空白組相比差異顯著(P<0.05);高劑量野生葛根和栽培葛根組小鼠肝組織中NO含量與空白組差異不顯著(P>0.05)。

表5 葛根對小鼠肝組織中NO、TNF-α、IL-1β和IL-10水平的影響Table 5 Effect of kudzu root on NO, TNF-α, IL-1β and IL-10 levels in liver of mice
模型組小鼠肝組織中TNF-α質量濃度與空白組相比顯著升高(P<0.05);WP-M、WP-H、CP-H組小鼠受到長期酒精刺激后,通過一定劑量葛根的干預,肝組織TNF-α質量濃度與模型組相比分別降低了37.63%、34.92%、34.83%,且接近正常組(P>0.05)。
模型組小鼠長期灌胃酒精且不采取任何治療,導致肝功能受損,其肝組織中TNF-α質量濃度升高,引發炎癥,導致IL-1β質量濃度顯著升高(P<0.05);與模型組相比,WP-L、WP-M、WP-H、CP-M和CP-H組IL-1β質量濃度顯著降低(P<0.05),且WP-M組恢復至正常水平。
與空白組比較,模型組小鼠肝組織中IL-10質量濃度顯著降低(P<0.05);與模型組相比,WP-M、WP-H、CP-M和CP-H組IL-10質量濃度均顯著升高至接近正常水平(P<0.05)。
2.6 小鼠肝組織切片染色結果
由圖1可以看出,各組小鼠肝組織HE染色后呈現出不同的結構特征。空白組小鼠肝組織細胞排列規則整齊,細胞間空隙均勻,胞質豐富,細胞核圓潤、位于細胞中央,無病癥現象。模型組小鼠肝組織出現嚴重病理改變,細胞形態不規則,排列雜亂,細胞間隙不均勻,出現擠壓,細胞核仁增大,擠壓堆疊,細胞邊緣不規則,甚至出現細胞破碎現象。這是由于長期酒精刺激加重了肝臟的負擔,使模型組小鼠肝臟出現病變。陽性組、WP-M、WP-H和CP-H組小鼠肝組織切片與空白組較為接近,細胞邊緣平滑,核仁大多位于細胞中央,細胞無腫大及破損現象,說明一定劑量的葛根對于慢性酒精刺激下的肝臟有保護功效。WP-L、CP-L、CP-M組呈現出輕微病變,肝細胞輕度腫脹,部分細胞胞漿溢出,細胞邊緣不規則。
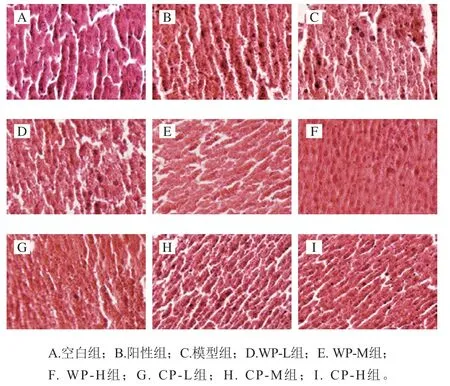
圖1 小鼠肝組織切片HE染色結果(×400)Fig. 1 Results of HE staining of liver tissue in mice (× 400)
3 討 論
野生葛根和栽培葛根對慢性酒精肝損傷小鼠血清及肝組織中轉氨酶水平具有穩定作用。ALT和AST是臨床上常用的肝功能評價指標,也是酒精所致肝損傷的最敏感指標[17]。因此,轉氨酶活力可以一定程度反映生物體內肝細胞的損傷程度。肝組織在大量酒精的刺激下,功能受損,出現急性肝炎,ALT和AST大量釋放,使血液中ALT和AST水平顯著提升[18]。本實驗證明一定劑量的葛根可以減輕過量酒精對肝組織的損傷,維持肝功能正常,從而降低血清中AST和ALT水平。
乙醇在人體內大部分氧化反應過程都有ALDH參與[19],肝臟在受到長期酒精刺激下,其功能受損,影響血清中ADH和ALDH活力[20]。若ALDH活性降低,導致血液中乙醛積累,其與黃嘌呤形成超氧化物,導致脂質過氧化,損壞細胞膜脂質,進而導致肝損傷[21]。陽性藥物和中、高劑量的野生葛根對肝臟具有良好的保護作用,能夠穩定ADH活力,且功效能達到陽性藥物水平。中、高劑量的栽培葛根同樣具有良好的穩定ADH活力的作用,但效果不及野生葛根。
抗氧化劑可以清除肝臟中堆積的過氧化物以降低氧化應激造成的肝損傷,保證機體細胞內穩態,對肝臟結構與功能的穩定發揮重要作用[22-23]。大量酒精被人體攝入,加重了肝臟負擔,同時會降低機體的抗氧化活性,抑制肝組織中GSH-Px活力,使乙醇的代謝分解速率低于吸收速率,進而引起代謝紊亂,機體免疫防御功能衰減[24]。野生葛根和栽培葛根具有增強小鼠肝組織抗氧化活性的功效。與空白組小鼠相比,模型組小鼠肝臟抗氧化能力顯著降低(P<0.05);相比于模型組小鼠,WP-M、CP-L和CP-M組小鼠CAT活力顯著提升接近正常水平,WP-M、WP-H、CP-L和CP-M組小鼠GSH-Px活力顯著提高至接近正常水平(P<0.05),表明野生葛根和栽培葛根在一定劑量下可以有效維持肝組織的抗氧化體系平衡狀態,減輕酒精引發的肝組織氧化損傷。
NO、TNF-α、IL-1β和IL-10是酒精性肝損傷的重要炎癥因子,能誘發肝臟細胞進一步壞死、凋亡、加重炎癥反應[25]。NO作為新型傳導因子,如果個體NO含量過高,將會導致多種器官出現病癥甚至衰竭[26]。TNF-α是一種促炎因子,其過表達可能會導致炎癥性腸病、免疫失調等病癥[27]。IL-1β是一種重要的炎癥介質,機體內IL-1β水平提高易加重炎癥反應[28]。IL-10是人體免疫反應中關鍵的抗炎因子,能抑制炎癥的產生[29]。本實驗中,慢性酒精肝損傷模型小鼠肝組織中炎癥明顯,灌胃一定劑量的野生葛根和栽培葛根能夠不同程度減輕小鼠體內炎癥,實驗結果與柏琳等[30]研究結果較為接近。證明一定劑量的野生葛根和栽培葛根均具有抑制NO、TNF-α、IL-1β的產生、提升IL-10水平以抑制炎癥的功效。
由小鼠肝組織切片HE染色結果可知,模型組小鼠肝組織出現細胞形態不規則、排列雜亂,細胞間隙不均勻、出現擠壓,細胞核仁增大、擠壓堆疊,細胞邊緣不規則,甚至出現細胞破碎等病理特征,表明肝臟出現明顯的炎癥性病理學改變,進一步證實小鼠酒精性肝臟損傷模型建立成功。野生葛根和栽培葛根干預組小鼠肝臟受保護明顯,僅出現輕微病變,但與正常小鼠仍有一定差異,表明一定劑量的野生葛根和栽培葛根對慢性酒精肝損傷實驗小鼠的肝組織均具有良好的保護功效,這與王書慶等[31]研究結果一致。
4 結 論
模型組小鼠長期受酒精的影響且無藥物治療,肝功能嚴重受損。一定劑量的野生葛根和栽培葛根可通過提升脫氫酶活力、穩定轉氨酶水平、提升肝臟抗氧化活性和抑制炎癥產生等途徑發揮良好的解酒護肝功效,有進一步研究開發的價值。野生葛根和栽培葛根均具有良好的解酒護肝功效,但綜合比較下野生葛根的保護功效優于栽培葛根,這可能與所含葛根素、異黃酮等主要功能成分含量差異有關。本研究不同劑量野生葛根和栽培葛根對各效應指標的影響未呈現一致的劑量效應關系,低劑量效果不佳。因此,有關葛根對小鼠慢性酒精性肝損傷干預的最佳有效劑量和確切機理還有待進一步研究。

