如何快速巧解蓋斯定律型反應熱的計算
文/封超燕
反應熱的計算是各省市高考化學中的高頻考點,近幾年題型特征也較為穩定,其中以蓋斯定律型反應熱的計算最為典型。這種題型不算太難,但如何從多個已知熱化學方程式中快速、準確地計算出待求方程式的反應熱,即如何快速、準確地找到已知方程式和待求方程式的關系存在一定難度。對于這一難點,作者將解題經驗總結如下:
解題思路
現以2022年全國乙卷28題第一問為例,介紹解題思路。
28.油氣開采、石油化工、煤化工等行業廢氣普遍含有的硫化氫,需要回收處理并加以利用,回答下列問題:
(1)已知下列反應的熱化學方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=-1036kJ·mol-1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH2=94kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-484kJ·mol-1
計算H2S熱分解反應的2H2S(g)=S2(g)+2H2(g)的ΔH4=________kJ·mol-1。
觀察待求反應方程式中反應物和生成物,找到在已知熱化學方程式中只出現一次的物質,設其為目標物。如上述反應中S2(g)和H2(g)分別只在已知熱化學方程式②和已知熱化學方程式③中出現,則S2(g)和H2(g)為我們選定的目標物。
對比已知方程式和待求方程式中目標物的系數和位置,根據“系數相同,同向加,異向減”的方法,對其所在的已知方程式的焓變系數進行調整,得出待求方程式的焓變的部分計算式。比如,S2(g)是已知方程式②的生成物,在方程式的右側,系數為3,而S2(g)是待求方程式的生成物,也在方程式的右側,與已知方程式中同向,系數為1,則計算式中ΔH2的系數調整為,同理,推出ΔH3的系數調整為-1,可得ΔH4的部分計算式為:ΔH2-ΔH3。
觀察上述所得部分計算式有無涉及所有已知方程式(如有超過3個已知方程式,這步不做參考,要具體分析,因這種情況少見,這里不考慮)。如果有,該部分計算式就是最終的計算式,直接計算答案即可;如果無,則要把未參與計算的方程式通過消元的方法參與進來,得到最終的焓變計算式。比如,通過觀察發現已知反應①沒參與進來,反應①中有氧氣參與反應,但待求反應方程式中最終沒有氧氣,說明通過方程式的加減消元了。③中反應通過第二步的調整氧氣在反應方程式的右側,系數為1,要想消除氧氣,①中的氧氣在左側,系數也要為1,也就是說ΔH1的系數要乘以,符號不變。最終的計算式為ΔH4=ΔH2-ΔH3+ΔH1=(ΔH1+ΔH2)-ΔH3,計算結果為ΔH4=170kJ·mol-1。在此,消元不一定消O2,其他的物質也可以(如SO2),盡量找只在兩個方程式中出現的物質消元,可以簡化計算。
另外,需注意的是每個焓變只能出現一次系數調整,也就是說如果一個已知方程式中有兩個或兩個以上的目標物,選其中一個即可,不需要重復調整系數。
解題口訣
根據解題思路,總結解題技巧口訣(圖1):

圖1 解題技巧口訣
為什么計算過程中可以完全不用寫加減后的熱化學方程式就能求出待求方程式的反應熱(焓變)呢?運算依據是什么呢?這就要我們進一步理解蓋斯定律的內涵本質。
反應熱的運算依據
能量的變化是以物質變化為基礎的,物質不發生變化,能量就不可能發生變化。也就是說,一個反應,只要反應物、生成物確定了,反應熱就確定了,與反應途徑無關。這也就是早期俄國化學家蓋斯經過多次實驗總結的蓋斯定律。
蓋斯定律:不管化學反應是一步完成或分幾步完成,其反應熱是相同的。換句話說,化學反應的反應熱只與反應體系的始態和終態有關,而與反應的途徑無關。
根據蓋斯定律和熱化學方程式的含義可知反應熱的運算規則(表1):

表1 反應熱的運算規則
(1)熱化學方程式乘以某一個數時,反應熱的數值必須也乘上該數。
(2)熱化學方程式相加減時,物質之間相加減,反應熱也必須相加減。
(3)將一個熱化學方程式顛倒時,ΔH的“+”“-”隨之改變,但數值不變。
理解反應熱的運算依據后,再結合解題思路,蓋斯定律型反應熱的計算可以更加靈活、快速。現以2020年全國卷Ⅱ28題第一問為例,介紹如何根據解題思路快速解決計算問題。
28.天然氣的主要成分為CH4,一般還含有C2H6等烴類,是重要的燃料和化工原料。
(1)乙烷在一定條件可發生如下反應:C2H6(g)=C2H4(g)+H2(g)ΔH,相關物質的燃燒熱數據如下表所示:
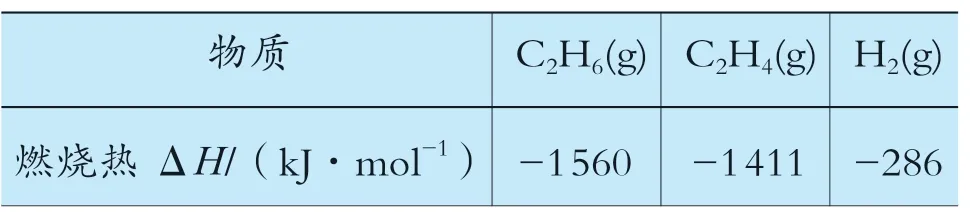
則ΔH= ________kJ·mol-1。
根據前面的解題思路,假設C2H6(g)的燃燒熱為ΔH1,C2H4(g)的燃燒熱為ΔH2,H2(g)的燃燒熱為ΔH3,根據燃燒熱的概念(在25℃,101kPa時,1mol可燃物完全燃燒生成穩定的化合物時所放出的熱量,叫作該物質的燃燒熱),可推出ΔH1=-1 560kJ·mol-1,對應的熱化學方程式中C2H6(g)的系數是1。以此類推,ΔH2=-1 411kJ·mol-1對應的熱化學方程式中C2H4(g)的 系 數 是1,ΔH3=-286kJ·mol-1對 應的熱化學方程式中H2(g)的系數也是1。則待求方程式的ΔH=ΔH1-ΔH2-ΔH3,計算結果為ΔH=137kJ·mol-1。
這種解題思路可以靈活運用,需要同學們加強鞏固,熟悉思路,做到快速且精準。

