黃牛骨肽對巨噬細胞及免疫低下小鼠的免疫調節作用
段毅超,郭汝悅,劉懷高,臧春華,馬夢雅,衣大龍*,任雪玲,3*
(1.鄭州大學 藥學院,河南 鄭州 450001;2.安徽國肽生物科技有限公司,安徽 宣城 242100;3.河南省腫瘤重大疾病靶向治療與診斷重點實驗室,河南 鄭州 450001)
免疫力是機體自身防御能力,惡性腫瘤、慢性腎炎、風濕等重大疾病的發生發展都與人體免疫失調密切相關[1-2]。因此維持機體免疫平衡至關重要。食源性生物活性肽是一類含有2個~20個氨基酸殘基的多肽混合物,通常由特定食物蛋白經酶解等方法制備得到。近年來,越來越多的研究表明,食源性生物活性肽除具有明確的營養價值之外,還可以通過多種機制調節機體免疫力,促進人體健康[3-4]。如紫蘇籽蛋白可以通過增加免疫低下小鼠的脾臟和胸腺指數、促進T/B淋巴細胞的增殖、提高半數溶血值、自然殺傷細胞殺傷力、巨噬細胞吞噬能力及白細胞介素(interleukin,IL)-2含量等從而發揮其免疫調節作用[5]。Li等[6]發現從蠶蛹蛋白水解物中分離出的多肽可以促進脾淋巴細胞增殖,刺激IL-6、IL-12等免疫因子的產生,具有免疫調節活性。因此,利用食源性生物活性肽促進機體免疫平衡是一種有效的方法,同時也為抵抗疾病侵襲提供了一種有益的選擇。
黃牛骨肽(cattle bone peptide,CBP)是一種以秦川牛、南陽牛等牛骨骼為來源制備得到的食源性生物活性肽,具有來源廣泛,易消化吸收,營養價值高、抗原性弱等優點,在食品領域具有廣泛應用[7-10]。已有研究表明,包括CBP在內的來源于動物骨骼的生物活性肽通常具有調節骨代謝、抗骨質疏松等生物活性[11-12]。基于分子水平的研究發現,骨肽抵抗骨質疏松的作用機制與核因子 κB(nuclear factor kappa-B,NF-κB)信號通路密切相關[13-15],而NF-κB信號通路在免疫系統中起著至關重要的作用,這表明動物骨肽或許具有一定免疫調節功能。有研究發現來源于豬骨、羊骨或牦牛骨的生物活性肽具有一定的免疫調節活性[16-18],但是關于CBP的免疫調節活性鮮有報道。
本研究以CBP為原料,基于巨噬細胞RAW264.7和氫化可的松所致免疫低下小鼠分別在細胞水平和動物水平考察其免疫調節活性,檢測指標包括細胞增殖率、小鼠的體質量變化、相對免疫器官指數、外周血白細胞相對數量、碳廓清能力、吞噬熒光微球能力、耳腫脹法遲發型變態(delayed type hypersensitivity,DTH)反應。本研究將為CBP的免疫調節作用提供數據支撐,也為CBP在食品及醫藥領域的進一步應用提供科學依據。
1 材料與方法
1.1 材料與試劑
小鼠源巨噬細胞株RAW264.7:鄭州大學藥學院保存;SPF級雄性BALB/c小鼠,6周~8周齡,體質量(18±2)g,生產許可證號:SCXK(豫)2017~0001。
CBP(新鮮牛骨經生物酶降解制得的生物活性肽,平均分子量為962.0 Da):安徽國肽生物科技有限公司;氫化可的松(hydrocortisone,HCT)注射液:山西省芮城縣紅寶獸藥有限責任公司;二硝基氟苯(2,4-dinitrofluorobenzene,DNFB):上海凜恩科技發展有限公司;綿羊紅細胞(sheep red blood cell,SRBC)、DMEM培養基、噻唑藍[3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,MTT]:北京索萊寶科技有限公司;磷酸鹽緩沖液(phosphate buffer saline,PBS):武漢賽維爾生物科技有限公司;胎牛血清:浙江天行生物科技有限公司。
1.2 儀器與設備
倒置顯微鏡(IX53型):日本Olympus公司;全自動血液分析儀(BC-2800):上海泰益醫療儀器設備有限公司;CO2細胞培養箱(E191型):美國SIM公司;全波長酶標儀(Spectra Mr型):美國DYNEX公司;紫外分光光度計(UV-2600):日本SHIMADZU公司;流式細胞儀(FACS Calibur型):美國BD公司。
1.3 方法
1.3.1 CBP對RAW264.7細胞增殖的影響
將指數生長期的RAW264.7細胞消化為單細胞懸液,以 1.000×104個/孔接種于 96孔板中,于 37℃,5%CO2細胞培養箱中過夜培養,棄去舊培養基,分別加入含 1.6、8.0、40.0、200.0、1 000.0 μg/mL CBP 的培養基100 μL,空白對照組加入100 μL未含有CBP的培養基,每組5個復孔。將細胞繼續正常培養24 h,采用MTT法檢測細胞增殖率。
1.3.2 CBP對RAW264.7細胞吞噬作用的影響
將RAW264.7細胞在含不同濃度CBP(濃度范圍同1.3.1)的培養基中常規培養24 h后,按照每孔100 μL的劑量加入含0.05%中性紅的無菌PBS溶液,置于培養箱中繼續培養4 h,PBS溶液洗滌3次,每孔加入200 μL 細胞裂解液(無水乙醇∶乙酸=1∶1,體積比),于4℃靜置過夜,細胞完全裂解后于540 nm處測定OD值,按照以下公式計算吞噬率。其中空白對照組為不經CBP處理組。

1.3.3 動物分組與給藥
實驗動物均飼養于20℃~26℃、明暗周期12 h/12 h的恒溫恒濕室內,實驗期間,正常飼喂,自由飲水。48只BALB/c小鼠適應性喂養一周后,按體質量隨機分為4組,每組12只,分籠飼養。按照人體推薦量的1倍、5倍和10倍設置CBP低(CBP-L)、中(CBP-M)、高(CBP-H)劑量干預組,劑量分別為 1.20、6.00、12.00g/kg,并以給予與給藥組相同體積生理鹽水為免疫低下對照組(HCT),每日口服灌胃給藥一次,共連續干預30 d。在CBP干預的第21天,各組小鼠分別按照40.00 mg/kg隔天肌肉注射氫化可的松,共注射5次,建立免疫低下小鼠模型。末次給藥結束后,各組小鼠禁食不禁水12h,進行后續指標的檢測。
1.3.4 小鼠相對體質量變化及免疫器官相對臟器指數
實驗期間,每3 d對各組小鼠進行稱重并記錄,相對體質量為各組小鼠的體質量與HCT組小鼠體質量均值的比值。實驗結束后,脫頸椎處死小鼠,剝離胸腺、脾臟組織,生理鹽水清洗干凈后用濾紙將水分吸干并進行稱重,按照以下公式計算臟器指數。相對臟器指數為各組小鼠的臟器指數與HCT組小鼠臟器指數均值的比值。

1.3.5 小鼠外周血白細胞計數
由小鼠眼眶靜脈叢采血,利用血液分析儀對各組小鼠外周血白細胞進行計數分析,小鼠的相對白細胞數量為各組的白細胞數量與HCT組白細胞數量均值的比值。
1.3.6 小鼠碳廓清能力的測定
參考文獻[19]中方法,將墨汁稀釋液按照0.1mL/10 g的劑量經尾靜脈注射至各小鼠體內,分別于注射后2 min和10 min時,由小鼠眼眶靜脈叢采血20.0 μL,加入2.00 mL Na2CO3溶液,渦旋混勻。用紫外分光光度計測定600 nm波長處的吸光度。小鼠脫頸椎處死后,剝離肝臟和脾臟,生理鹽水清洗干凈后用濾紙將水分吸干并稱量。按照下列公式計算吞噬指數a,相對吞噬指數為各組小鼠的a與HCT組小鼠a均值的比值。

式中:k為吞噬速率(未經校正的吞噬指數);A1、A2分別是2 min和10 min的吸光度;t1=2 min,t2=10 min。
1.3.7 小鼠腹腔巨噬細胞吞噬熒光微球實驗
小鼠處死前4 d,經腹腔注射0.2 mL 2.0%SRBC。脫頸椎處死后提取腹腔巨噬細胞,以2.000×105個/孔接種于12孔板中,常規培養過夜后,更換為含熒光微球新鮮培養基繼續培養2 h,棄去培養基,PBS洗滌3次,使巨噬細胞重懸于1.00 mL PBS內,采用流式細胞儀進行檢測,熒光微球相對吞噬率為各組小鼠巨噬細胞熒光微球吞噬率與HCT組小鼠巨噬細胞熒光微球吞噬率均值的比值。
1.3.8 耳腫脹法DTH反應
參考文獻[19]中方法,小鼠腹部經脫毛處理后,均勻涂抹50.0 μL DNFB進行致敏。5 d后,在小鼠右耳內外均勻涂抹10.0 μL DNFB進行攻擊。24 h后,處死小鼠,取下小鼠左右耳殼,用打孔器取下直徑約8 mm的耳片,稱量,以兩側耳片質量的差值表示DTH程度,相對耳腫脹度為各組小鼠的耳腫脹度值與HCT組小鼠耳腫脹度值均值的比值。
1.3.9 血清溶血素的測定
參考文獻[20]中方法,利用2.0%SRBC對小鼠進行腹腔免疫,4 d后,通過眼眶靜脈叢采血,經生理鹽水倍比稀釋后,分別取100.0 μL加入微量血凝實驗板內,隨后加入100.0 μL 0.5%SRBC并混勻。37℃恒溫孵育3 h后,觀察血球凝集程度并計算抗體積數。抗體積數越大,表示小鼠體內抗體水平越高。
血球凝集程度分為5級(0~Ⅳ),0級:紅細胞全部下沉,在孔底集中并形成致密圓點狀,周圍液體清晰。Ⅰ級:紅細胞大部分沉集在孔底成圓點狀,周圍有少量凝集的紅細胞。Ⅱ級:凝集的紅細胞在孔底形成薄層,中心有一個明顯疏松的紅點。Ⅲ級:凝集的紅細胞均勻地鋪散在孔底形成一薄層,中心隱約可見一個小紅點。Ⅳ級:凝集的紅細胞均勻地鋪散在孔底形成一薄層,凝塊有時可成卷折狀。依據下列公式計算抗體積數。相對抗體積數為各組小鼠的抗體積數與HCT組小鼠抗體積數均值的比值。
抗體積數=(S1+2S2+3S3+……nSn)
式中:1、2、3……n分別代表對倍稀釋的指數,S代表凝集程度的級別。
1.4 數據統計與分析
采用Origin 2019b軟件進行統計學分析和圖表繪制,處理所得數據用平均值±標準差表示,采用t檢驗比較組間差異,P<0.05表示差異具有統計學意義。
2 結果與分析
2.1 CBP的體外免疫活性
巨噬細胞是構成機體免疫系統的重要細胞,主要通過其吞噬功能對機體的非特異性免疫進行調節,也是用于檢測食源性生物活性肽是否具有免疫調節活性的主要細胞模型[21-22]。因此首先以巨噬細胞株RAW264.7為模型,通過體外細胞實驗對CBP的免疫調節活性進行初步探究。體外免疫實驗中,與空白對照組相比,不同劑量的CBP對巨噬細胞的增殖能力和吞噬能力均有不同程度的促進作用,具體結果如圖1所示。
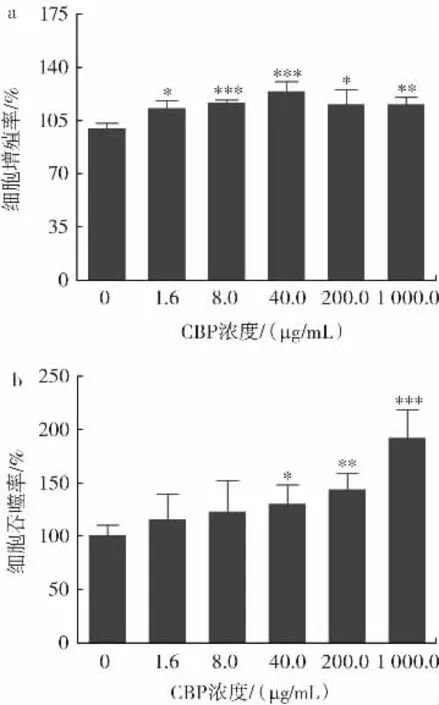
圖1 CBP對RAW264.7細胞增殖和吞噬能力的影響Fig.1 Effects of CBP on the proliferation and phagocytosis of RAW264.7 cells
由圖1a可知,與空白對照組相比,CBP在1.6μg/mL~1 000.0 μg/mL濃度內均能夠顯著增強RAW264.7細胞的增殖活性。當濃度為40.0 μg/mL時,巨噬細胞增殖率最高,可達(123.9±6.5)%。此外,由圖 1b可知,CBP可以提高RAW264.7細胞的吞噬能力,且呈劑量依賴性增長,當濃度增加至1 000.0 μg/mL時,其吞噬率為空白對照組的1.920倍。表明CBP能夠促進免疫相關巨噬細胞的增殖作用,且可以增強巨噬細胞的吞噬作用,在體外細胞水平具有一定的免疫調節活性,之后在動物水平對CBP的免疫調節作用進行考察。
2.2 小鼠的生長狀況
不同劑量的CBP對免疫低下小鼠生長狀況的影響情況如圖2所示。

圖2 CBP對小鼠生長狀況的影響Fig.2 Effects of CBP on growth of mice
體質量變化是反映機體健康狀態的一個重要指標,通常免疫力低下都會伴隨著體質量下降。如圖2a所示,免疫抑制之前,各組小鼠相對體質量隨時間延長不斷增加。第21天,經肌肉注射免疫抑制劑氫化可的松后,各組小鼠相對體質量均明顯下降。由圖2b可知,第30天時,與免疫低下對照組相比,CBP中劑量組和高劑量組的小鼠相對體質量顯著增加(P<0.05),增長率分別為(110.74±9.20)%和(113.65±14.43)%。因此,CBP可以改善氫化可的松對體質量的抑制作用,延緩小鼠體質量下降,有助于改善小鼠的免疫功能。
2.3 CBP對小鼠免疫器官臟器指數的影響
不同劑量的CBP對免疫低下小鼠免疫器官的影響情況如圖3所示。
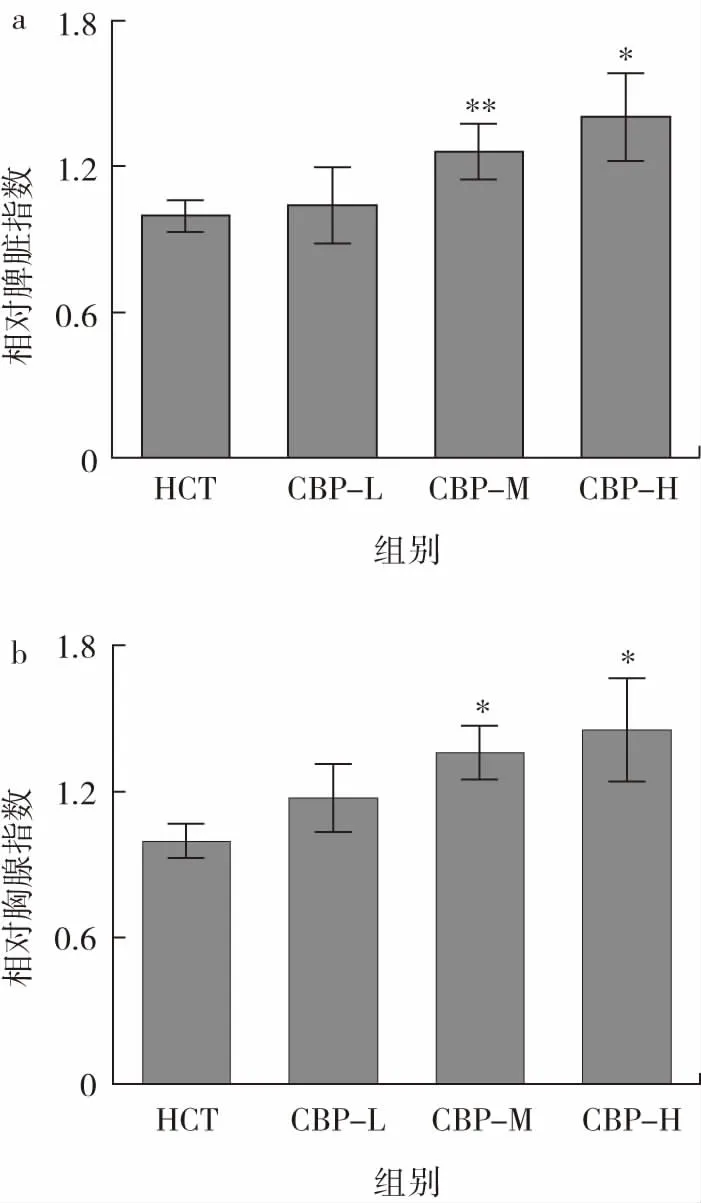
圖3 免疫組織相對臟器指數Fig.3 Relative organ index of immune tissues
臟器指數,尤其是免疫器官臟器指數的變化能直接反映機體免疫功能的改變[23-24]。脾臟和胸腺是機體內重要的免疫器官,其臟器指數的變化能夠有效反映機體免疫狀態。如壇紫菜中分離的R-藻紅蛋白肽可以通過提高小鼠的脾臟和胸腺指數改善免疫低下小鼠的免疫活性[25]。由圖3可知,與免疫低下對照組相比,CBP中劑量組(P<0.01)和高劑量組小鼠(P<0.05)的相對脾臟指數顯著增加,相對胸腺指數也表現出相似的顯著性差異(P<0.05)。結果表明,CBP可以改善免疫低下小鼠的脾臟指數和胸腺指數,這有助于改善免疫低下小鼠的免疫調節能力。
2.4 CBP對小鼠非特異性免疫的影響
不同劑量的CBP對免疫低下小鼠白細胞相對數量的影響情況如圖4所示。
由圖4可知,CBP處理組小鼠白細胞相對數量呈劑量依賴性增長,與免疫低下組小鼠相比,中劑量組(P<0.05)和高劑量組(P<0.01)小鼠白細胞相對數量顯著增加。實驗結果表明CBP可以增加免疫低下小鼠的白細胞數量,改善小鼠的非特異性免疫調節能力。
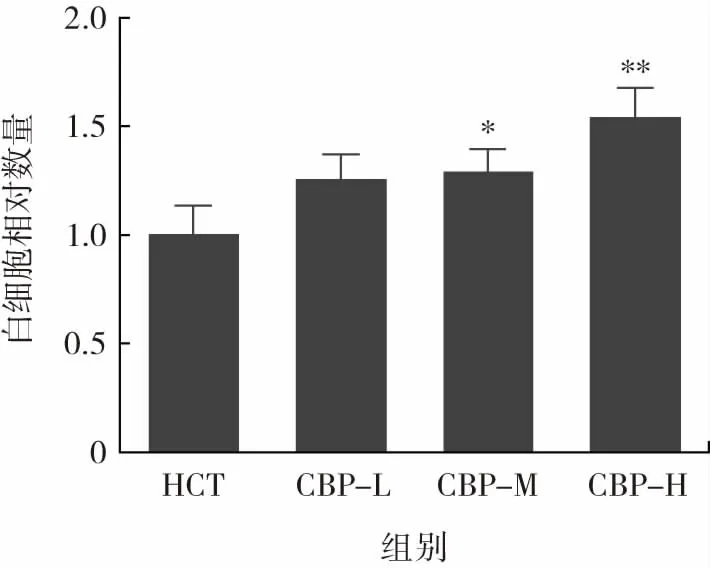
圖4 小鼠白細胞相對數量Fig.4 Relative count of white blood cells in mice
巨噬細胞是除淋巴細胞外免疫系統中另一主要的細胞群,其吞噬能力越強,說明細胞的免疫活性越強。有研究發現骨酶解產物可以提高吞噬細胞清除碳顆粒能力,這是衡量生物活性肽非特異性免疫調節活性的重要指標[17]。因此,本研究重點考察基于腹腔巨噬細胞的免疫調節活性,采用小鼠碳廓清實驗和腹腔巨噬細胞吞噬熒光微球實驗考察小鼠單核/巨噬細胞的吞噬能力,進而探究CBP對小鼠非特異性免疫的影響。不同劑量的CBP對免疫低下小鼠單核/巨噬細胞吞噬能力的影響見圖5。

圖5 CBP對小鼠非特異性免疫的影響Fig.5 Effects of CBP on non-specific immunity of mice
由圖5a可知,CBP低、中、高劑量組的相對吞噬指數均高于免疫低下對照組,呈劑量依賴性,且低劑量組(P<0.05)與高劑量組(P<0.001)具有顯著差異,說明CBP可提高小鼠腹腔巨噬細胞的碳廓清能力。由圖5b可知,CBP中劑量組和高劑量組的腹腔巨噬細胞的熒光微球相對吞噬率顯著高于免疫低下對照組(P<0.01),且呈現劑量依賴關系。結果表明,CBP可使免疫低下小鼠單核/巨噬細胞的吞噬、清除異物的能力增強,改善免疫低下小鼠的非特異性免疫功能。
2.5 CBP對小鼠特異性免疫的影響
當機體與特異性抗原接觸后,響應性地產生針對該抗原的特異性免疫,該類免疫應答也稱為適應性免疫,主要由T淋巴細胞和B淋巴細胞介導完成,是機體抵抗病原體感染的主要方式[26-27]。遲發型變態反應是T細胞介導的一種細胞免疫應答,其反應強度反映了機體細胞免疫應答水平。不同劑量的CBP對免疫低下小鼠特異性免疫功能的影響見圖6。
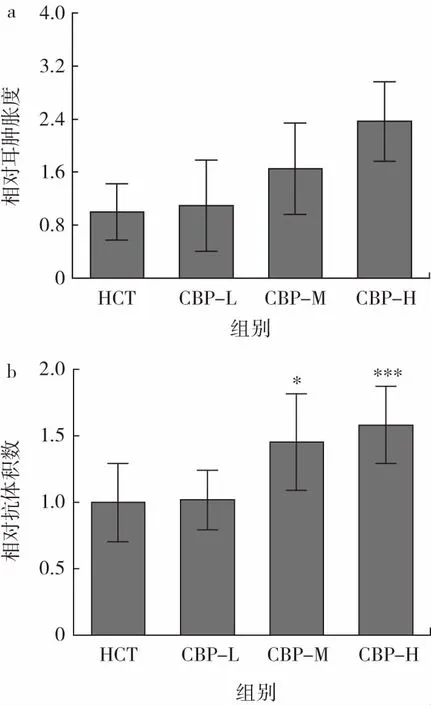
圖6 CBP對小鼠特異性免疫的影響Fig.6 Effects of CBP on specific immunity of mice
由圖6a可知,CBP組小鼠的相對耳腫脹程度均高于免疫低下對照組,雖無顯著性差異,但呈劑量依賴性增長。血清溶血素抗體水平反映小鼠體液免疫功能,以抗體積數表示血清溶血素的水平,抗體積數越高表明小鼠的特異性體液免疫能力越強。由圖6b可知,與免疫低下對照組相比,CBP高劑量組(P<0.001)和中劑量組(P<0.05)小鼠相對抗體積數顯著增加。結果表明,CBP能提高機體的特異性體液免疫功能,改善小鼠的特異性免疫功能。
3 討論與結論
研究結果表明,黃牛骨肽(cow bone peptide,CBP)可促進RAW264.7細胞的增殖及吞噬作用,證明了其在體外細胞水平具有一定的免疫調節活性,而后系統考察CBP對免疫低下小鼠的免疫調節活性。機體免疫應答是一個非常復雜的過程,一般可以分為固有免疫和適應性免疫。固有免疫是機體抵抗病原體的首道防線,主要是皮膚及黏膜的物理阻擋作用,以及非特異性免疫效應細胞和免疫分子對抗原的清除作用[28]。改善固有免疫是食源性生物活性肽發揮免疫調節的最主要方式。如豬骨活性肽可以顯著促進小鼠脾臟淋巴細胞增殖活性[16];山藥蛋白肽可以提高免疫低下小鼠的體質量及免疫器官指數[29]。研究結果表明CBP可以緩解由于免疫抑制造成的小鼠體質量下降,增加小鼠相對脾臟指數和胸腺指數,提高外周血中白細胞相對數量,與豬骨活性肽和山藥蛋白肽的免疫調節活性相似。此外,與免疫低下組小鼠相比,高劑量CBP組小鼠的碳廓清能力及熒光微球吞噬能力可提高至1.43倍和1.44倍,顯著增加腹腔巨噬細胞活性。充分表明CBP具有較好的固有免疫調節活性。部分食源性生物活性肽在強化機體固有免疫的同時,可以激活機體適應性免疫[30-31]。如牦牛骨生物活性肽可以有效緩解環磷酰胺引起的小鼠免疫力下降,除小鼠臟器指數、白細胞計數等非特異性免疫指標明顯改善之外,B細胞介導的免疫球蛋白A、免疫球蛋白G含量,以及IL-1β、IL-6和腫瘤壞死因子-α等細胞因子含量也明顯升高,表明牦牛骨肽可以通過激活小鼠適應性免疫應答表現其免疫調節活性。本研究結果中,與免疫低下小鼠相比,中劑量和高劑量組CBP小鼠的血清溶血素抗體水平顯著增加,表現出明顯的體液免疫活性。以相對耳腫脹度為指標的細胞免疫活性并沒有顯著變化。表明CBP可能通過體液免疫調節小鼠適應性免疫應答活性。綜上所述,CBP在體內外均有較好的免疫調節活性,為CBP的進一步開發利用提供了理論依據。

