轉錄組及代謝組聯合解析茄子果色上位遺傳效應
孫保娟,汪瑞,孫光聞,王益奎,李濤,宮超,衡周,游倩,李植良
轉錄組及代謝組聯合解析茄子果色上位遺傳效應
孫保娟1,汪瑞2,孫光聞2,王益奎3,李濤1,宮超1,衡周1,游倩1,李植良1
1廣東省農業科學院蔬菜研究所/廣東省蔬菜新技術研究重點實驗室,廣州 510640;2華南農業大學園藝學院,廣州 510642;3廣西壯族自治區農業科學院蔬菜研究所,南寧 530027
【目的】茄子果色與商品果外觀品質和價值密切相關,花青素是決定茄子果色的重要天然色素之一。通過基因表達和代謝物差異比較,解析上位基因互作調控茄子果皮花青素合成的作用機制,為不同果色茄子選育提供理論基礎。【方法】以花青素合成結構基因突變的白果色母本19141、花青素合成關鍵調控基因突變的白果色父本19147及其紫紅果色F1代E3316茄子為試驗材料,對商品果期果皮進行轉錄組測序和廣靶代謝組分析。【結果】轉錄組測序分析表明,19141_vs_19147的差異表達基因(DEGs)最多,其次是E3316_vs_19141,兩個比較組DEGs均在類黃酮途徑富集程度最高;E3316_vs_19147篩選到的DEGs最少,未在類黃酮途徑富集。廣靶代謝組共檢測分析到218個代謝物。E3316_vs_19141共檢測到差異代謝物(DAMs)113個,E3316_vs_19147共檢測到差異代謝物98個。轉錄組和代謝組聯合分析發現花青素生物合成關鍵結構基因和,關鍵調節基因、和,修飾基因、、和,還有轉運基因()相對表達量均為19141>E3316>19147;果皮呈色相關的花青素類代謝物矢車菊素(CAS:528-58-5)、矢車菊素3,5-二葡萄糖苷(CAS:20905-74-2)含量為E3316>19147>19141。上位基因調控下,茄子果皮中同時表達與,但是表達水平遠高于。E3316花青素含量高于親本,綠原酸含量低于其親本。【結論】上位性基因互作控制果色的遺傳背景下,親本突變基因類型決定了花青素代謝通路基因表達趨勢和果皮呈色抑制方式。兩個白果色親本雜交F1代果皮呈紫紅色是由于花青素生物合成途徑兩個互作突變基因位點功能互補;高水平表達是合成矢車菊型花青素的主要原因;果皮花青素和綠原酸生物合成間存在競爭關系。
茄子;果色;上位基因;花青素;轉錄組;代謝組
0 引言
【研究意義】茄子以果實為產品,是WHO推薦的世界十大健康蔬菜之一。茄子屬于茄科茄屬,在茄科蔬菜生產中占有重要的地位。茄子果皮顏色(以下統稱果色)豐富多樣,有紫黑、紫紅、綠、白、粉紅等顏色,不同區域對果色選擇具有不同的消費習慣。茄子果色是決定商品外觀品質和價值的重要因素,因此,果色是茄子育種過程中的一個重要選育目標。筆者在育種過程中發現茄子果色上位性遺傳效應,即2個白果色茄子親本雜交,F1為紫紅果,F2紫紅果色和白果色單株分離比符合9﹕7。在此基礎上,從轉錄組和代謝組水平對2個親本及其F1進行比較分析,將有助于從基因表達和代謝產物差異方面解析茄子果色的上位遺傳效應。【前人研究進展】100多年前,英國生物學家Bateson和Punnett用2個純白花的豌豆品種雜交,F1后代均為紫花,F2后代中紫花和白花的分離比約9﹕7;為了解釋這種不符合孟德爾分離比的現象,1909年Bateson提出了上位性的概念,來定義一個基因對另一個基因的遮蓋作用;許多動植物重要性狀受2對以上的上位基因控制[1]。茄子果色遺傳是受多基因控制的復雜性狀。花青素是決定茄子果色的主要色素,關于茄子果色與花青素關系的遺傳研究中,TIGCHELAAR等[2]發現茄子果皮內花青素由3個顯性基因(、和)決定,其濃度調節則由少數基因控制。NUNOME等[3]和DOGANLAR等[4]以數量性狀分析法和現代分子標記技術結合,成功定位了少數與果色相關性較高以及與花青素在果實內合成與含量相關的QTL,進一步證實了茄子果色遺傳的多基因效應。龐文龍等[5]的研究結果表明,主基因+多基因效應是決定茄子果色表型變異的主要因素,環境因素起較小作用。LIAO等[6]開發了茄子果皮紫紅和紫黑果色SCAR標記。花青素經由苯丙烷途徑(phenylpropanoid pathway)和類黃酮生物合成途徑(flavonoids biosynthetic pathway)生成[7]。花青素合成的關鍵結構基因包括苯丙氨酸解氨酶基因、4-香豆酸-CoA連接酶、查爾酮合成酶基因、查爾酮異構酶基因、黃烷酮3-羥化酶基因、黃酮3′-羥化酶基因′、黃酮3′,5′-羥化酶基因′′、二氫黃酮醇4-還原酶基因和花青素合成酶基因等。F3′H和F3′5′H決定了花青素合成的分支和類型。黃烷酮3-羥化酶(F3H)將柚皮素轉化為二氫莰非醇(dihydrokaempferol,DHK),之后若被黃酮3′-羥化酶(F3′H)催化則生成二氫櫟皮黃酮(dihydroquercetin,DHQ),進一步被DFR、ANS和UFGT催化生成矢車菊類花青素;若被黃酮3′,5′-羥化酶(F3′5′H)催化則生成二氫楊梅黃酮(dihydromyricetin,DHH),進一步被DFR、ANS和UFGT催化生成飛燕草類花青素。除了結構基因,轉錄調控因子(transcription factor,TF)也參與調控花青素合成,其中MYB轉錄因子、bHLH轉錄因子和WD40轉錄因子是發揮核心作用的TF,它們以MBW(MYB-bHLH-WD repeat)復合體的形式調控結構基因的轉錄[8-9]。李翔等[10]通過同源克隆得到茄子花青素5-糖苷轉移酶基因(),發現其在云南紫長茄和云南圓白茄所有檢測組織中都有表達,但在云南紫長茄的紫色花瓣和商品期紫色果皮中的表達量略大于云南圓白茄。2016年WANG等[11]綜合生物信息學和轉錄組數據分析發現(Sme2.5_ 05099.1_g00002.1)為參與茄子花青素生物合成的關鍵轉錄因子,其在紫茄的莖、葉、花和果皮中的表達量顯著高于其在白茄中的表達量。2015年STOMMEL等[12]在茄子上的研究表明花青素生物合成途徑關鍵基因表達水平與花青素含量呈正相關,紫果皮中表達量比白果皮中高。花青素控制茄子果色呈粉紅、淺紫、紫紅、紫黑、甚至黑色,茄子中主要花青素類型為飛燕草素[13]。【本研究切入點】筆者在茄子育種實踐中發現2對上位性效應基因控制的茄子果色遺傳現象。白果色父本19147[14]和白果色母本19141[15]雜交F1代E3316果色為紫紅色(圖1),F2代紫紅果色和白果色植株分離比為9﹕7,說明其果皮著色受到具有上位性互作的2個基因位點(和)控制,2個白果色茄子是由于控制花青素生物合成過程的2個獨立而又互補的上位基因位點分別失活引起。通過F2群體單株SLAF-Seq構建遺傳圖譜,定位了控制茄子果色的上位基因位點[14]和[15],初步確定和分別為[16]和位點候選基因[17]。然而,兩個上位基因互作對花青素代謝途徑基因表達模式以及代謝產物的影響尚不清楚。【擬解決的關鍵問題】借助轉錄組學和代謝組學對白果色父本19147、白果色母本19141以及它們雜交產生的紫紅色果色F1代E3316商品果果皮進行差異基因和差異代謝物分析,進一步揭示茄子果皮著色的上位性遺傳效應。
1 材料與方法
1.1 試驗材料
茄子材料為白果色父本19147、白果色母本19141及其雜交得到的紫紅果色F1E3316(圖1)。父本來源于1998年粵北山區進行蔬菜種質資源考察時收集到的紫花白茄資源YC-212,經6代自交純化獲得穩定白茄自交系;母本來源為2009年初在廣州市廣東省農業技術推廣中心柯木塱示范基地的茄子品種展示田中,收集到的茄子雜交一代組合‘優美長茄’的種果。2009年秋季,種植該雜交品種的種果后代群體共150株,編號為2911,發現其后代分離出現紫花紫黑皮、紫花紫褐皮、紫花紫紅皮、白花綠皮、白花白皮等多種類型。其中1株綠皮茄子果實表現較突出,2010年春季種植該綠茄后代,從中分離獲得1個白花白果色單株,自2010年秋季起,對該白花白果色株系進行定向選育,于2011年秋季獲得白色果皮穩定自交系“2911-1-2”,后于2019年改編號為“19141”。父、母本及其F1于2019年7月育苗,8月種植于廣州市白云區鐘落潭鎮廣東省農業科學院基地內,10月取商品果期果實,刮取茄子果皮(厚度約為0.2 mm),稱取2 g,用錫紙包裹并用液氮速凍,-80℃保存,用于后續轉錄組測序分析及代謝組檢測分析。共3組樣品:19141(白果皮)、19147(白果皮)、E3316(紫紅果皮)。轉錄組測序設3個生物學重復,共9個樣品。RNA提取完成并檢測合格后,委托北京諾禾致源生物信息科技有限公司進行轉錄組測序。廣靶代謝組分析設5個生物學重復,共15個樣品,由蘇州帕諾米克生物科技有限公司提供廣靶代謝組檢測分析。

圖1 研究所用茄子材料果實圖片
1.2 轉錄組測序分析
1.2.1 cDNA文庫構建及轉錄組測序 采用NEB Illumina測序文庫制備試劑盒(NEBNext? Ultra? RNA Library Prep Kit for Illumina?)構建cDNA文庫。首先通過Oligo(dT)磁珠富集mRNA,隨后用二價陽離子在NEB Fragmentation Buffer中將mRNA隨機打成短片段,以此為模板用隨機引物在M-MuLV逆轉錄酶體系中合成cDNA第一條鏈,然后在DNA polymerase催化下PCR合成cDNA第二條鏈,純化PCR產物,進行末端修復,加A尾和測序接頭,然后利用AMPure XP beads篩選250—300 bp的片段,再進行PCR擴增、純化,得到cDNA文庫,最后使用IlluminaHiSeqTM2500測序儀進行測序。
1.2.2 基因功能注釋 原始序列過濾掉接頭序列、低質量序列、過短多N序列等,得到干凈序列(clean reads)。使用HISAT2軟件將clean reads與茄子基因組中數據(https://db.cngb.org/search/project/CNP0000734/:國家基因庫生命大數據平臺,accession number CNP0000734)進行比對,獲得其在參考基因組定位信息。應用BLAST軟件將基因數據庫序列與蛋白質數據庫KEGG和GO進行序列比對,得到Unigene的注釋信息。
1.2.3 基因表達量計算及差異基因篩選 用FPKM值(每100萬條序列中每個基因以1 000個堿基為單位,與參考基因組序列比對上的序列數量)衡量基因表達水平。FPKM值越大,基因表達水平越高。通過FDR(false discovery rate)設定閾值的方法來篩選差異基因。兩組對比中,差異表達基因(DEGs)篩選標準為|log2fold change|>0,FDR≤0.05。
1.3 果皮代謝組的測定及分析
1.3.1 代謝物的提取 精確稱量樣本50 mg(±1%)于2 mL EP管中,準確加入0.6 mL 2-氯苯丙氨酸(4 mg·L-1,用-20℃甲醇配制),渦旋振蕩30 s;加入100 mg玻璃珠,放入TissueLysisⅡ組織研磨儀中,25 Hz研磨60 s;室溫超聲15 min;12 000 r/min 25℃離心10 min,取上清液300 μL過0.22 μm過膜濾,濾液加入到檢測瓶中,進行LC-MS上機檢測;從每個待測樣本各取20 μL混合成QC樣本,用來校正混合樣品分析結果的偏差以及由于分析儀器自身原因所造成的失誤;用剩余待測樣本進行LC-MS檢測。
1.3.2 LC-MS液相質譜分析 本試驗采用ACQUITY UPLC? HSS T3(2.1 mm×150 mm,1.8 μm)色譜柱進行分析,自動進樣器溫度設為8℃,以0.25 mL?min-1的流速,柱溫40℃,進樣2 μL進行梯度洗脫,流動相組成為A:0.1%甲酸水+0.1%甲酸乙腈,B:5 mmol?L-1甲酸銨水+乙腈。質譜分析使用Thermo Q Exactive Focus質譜儀,采用正離子和負離子檢測模式的ESI電離方式,質量掃描范圍為81—1 000 m/z。
1.3.3 質譜數據分析 質譜掃描獲得的原始數據通過ProteoWizard軟件轉換成mzXML格式,然后利用R(v3.3.2)語言的XCMS程序包進行峰識別、峰過濾、峰對齊,得到質核比、保留時間和峰面積等信息組成的數據矩陣;將正離子模式獲得的29 461個前體分子和負離子模式獲得的19 340個前體分子數據,導出至Excel進行后續分析。對數據進行峰面積的批次歸一化,以便不同量級的初始數據比較。利用SIMCA-P軟件進行PCA-DA(偏最小二乘法判別分析)主成分分析。
1.3.4 數據分析和圖片處理 采用一維方差分析,-value≤0.05且VIP≥1相結合的方法篩選差異代謝物,并計算出差異代謝物在兩組間的差異變化倍數FC(fold change),通過差異變化倍數判斷差異代謝物的上調或者下調。用R語言(v3.3.2)中pheatmap程序包對數據集進行縮放,得到代謝物相對定量值層次聚類圖。借助MetPA數據庫分析,識別差異代謝物相關的KEGG通路,根據代謝通路中鑒定代謝物的相對響應值和降維算法,獲得代謝通路的相對響應值。
2 結果
2.1 親本及其F1代果皮轉錄組分析
2.1.1 親本及其F1代果皮差異表達基因分析 轉錄測序結果顯示,在供試茄子父、母本及其F1代之間的3個比較組中,19141_vs_19147即母本和父本相比,篩選到的差異基因最多,共3 064個,其中上調基因1 436個,下調基因1 628個;其次是E3316_vs_19141,即F1與母本相比,篩選到差異基因共2 531個,其中上調基因1 340個,下調基因1 191個;E3316_vs_19147,即F1代與父本相比,篩選到的差異基因最少,共1 213個,其中上調651個,下調562個(圖2)。
2.1.2 親本及其F1代果皮差異表達基因KEGG富集情況 對3個比較組19141_vs_19147、E3316_vs_19141和E3316_vs_19147的DEGs進行KEGG富集分析發現,19141_vs_19147的DEGs顯著富集于類黃酮生物合成、芪類二苯基庚酮生物合成代謝途徑;E3316_ vs_19141的DEGs顯著富集于類黃酮生物合成、芪類二苯基庚酮生物合成、RNA聚合酶、苯丙烷生物合成代謝途徑;E3316_vs_19147的DEGs沒有顯著性富集的代謝途徑(圖3)。
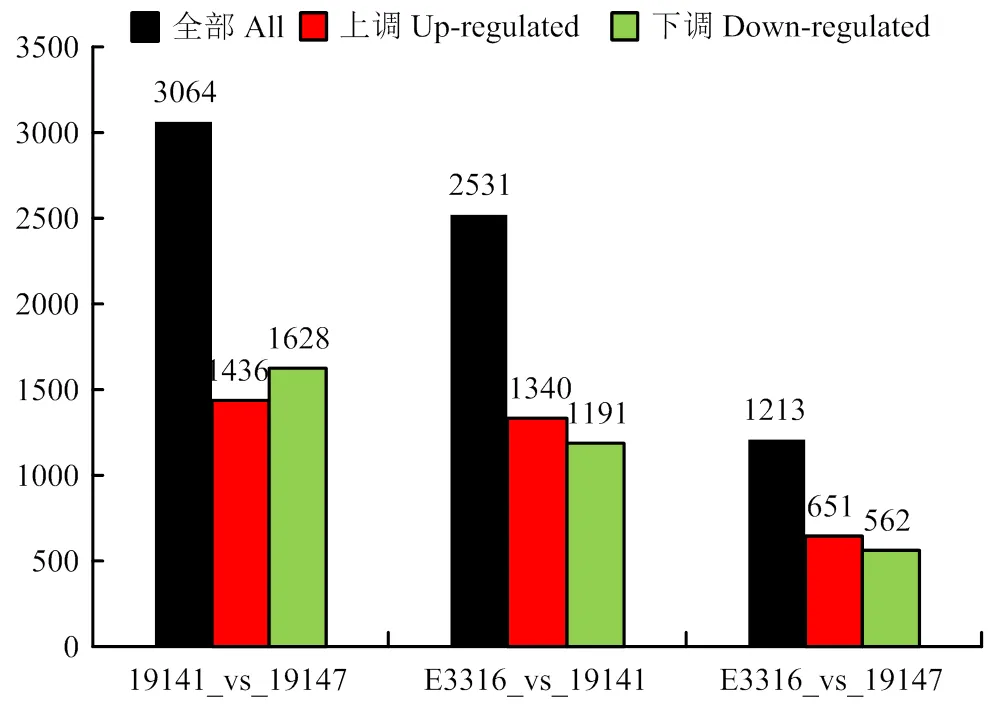
圖2 不同對比組差異表達基因統計
2.1.3 類黃酮代謝途徑相關基因在茄子親本及其F1果皮表達情況 類黃酮生物合成途徑的一個重要分支是合成花青素,與植物各個組織部位呈色密切相關。由于E3316_vs_19147的DEGs沒有在類黃酮途徑發生顯著富集,因此僅對E3316_vs_19141和19141_vs_19147兩個比較組在類黃酮生物途徑顯著富集基因進行分析(表1)。E3316_vs_19141在類黃酮生物途徑富集了15個差異基因,其中4個基因上調,為綠原酸支路的羥基肉桂酰轉移酶基因(EGP13381、EGP07013、EGP32043和EGP10080);11個基因下調,包括花青素代謝通路關鍵基因(EGP22200)、(EGP24232)、(EGP30923)、(EGP32037)、、(EGP18904)和花青素O-甲基轉移酶基因(EGP16482),綠原酸支路的基因(EGP05102、EGP30738、EGP01163)和羥基肉桂酰輔酶A奎尼羥基肉桂轉移酶基因(EGP02613)。由于花青素代謝通路的在轉錄組數據分析結果中未發生富集,因此根據已克隆的序列與參考基因組序列進行對比,發現參考基因組注釋的(EGP31017)存在嵌合基因,影響了基因定量和富集結果,因此表1列出的數據為校正后結果。白茄親本比較組19141_vs_19147差異基因在類黃酮生物途徑發生了顯著性富集,其中11個基因上調,包括、、、、、、和(EGP16482),綠原酸支路的反式肉桂酸4-單加氧酶基因(EGP24021)、(EGP05102和EGP30738)和(EGP16482);4個基因下調,包括花青素代謝通路(EGP06309)和綠原酸支路的(EGP13381)、(EGP07013和EGP32043)。
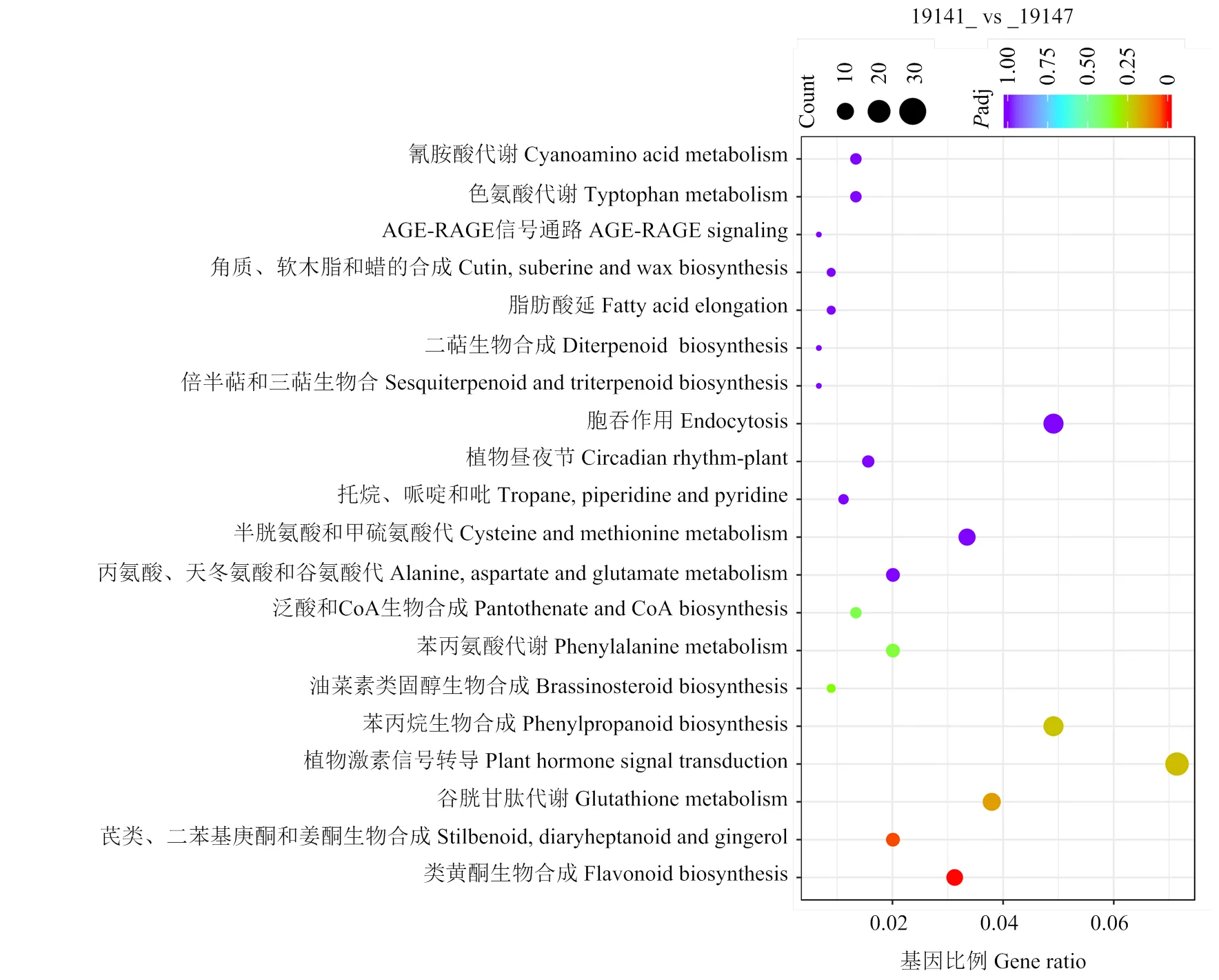
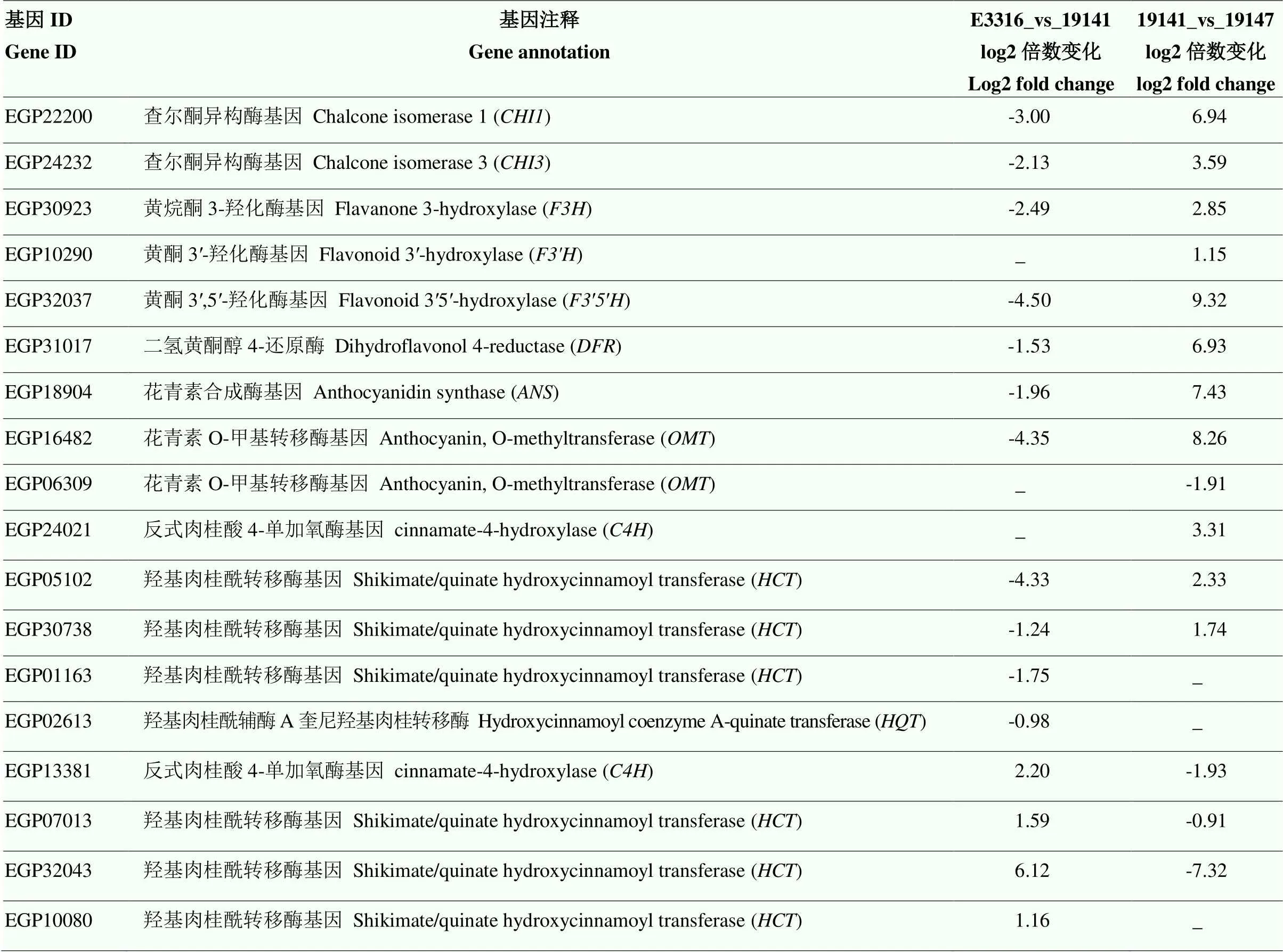
表1 不同比較組類黃酮生物合成途徑差異基因富集情況
比較組差異表達基因篩選標準為|log2倍數變化|>0,FDR≤0.05;“-”表示該比較組中該基因未發生顯著富集;E3316_vs_19141比較組沒有顯著富集的差異基因,所以未列出
The screening criteria of DEGs in the comparison group were |log2 fold change|>0, FDR≤0.05. “-” indicate that the gene was not significantly enriched in the comparison group. E3316_vs_19141 had no significantly enriched DEGs, so it was not listed
2.2 代謝組分析
2.2.1 代謝組的多元統計分析 利用SIMCA-P軟件對測得的白果色茄子母本19141、白果色茄子父本19147及其紫紅色F1代E3316的果皮代謝組數據主成分分析(principal component analysis,PCA)結果表明,無論是正離子模式下還是負離子模式下,白果色茄子母本19141、白果色茄子父本19147及其紫紅色F1代E3316等3組樣本數據產生明顯分離,且各組生物學重復樣本緊密地聚集在一起(圖4)。正離子模式下,第一主成分(PC1)和第二主成分(PC2)分別占總變量的36.6%和21.4%;負離子模式下,第一主成分(PC1)和第二主成分(PC2)分別占總變量的39.4%和21.4%。PC1值越大,說明不同品種間的遺傳變異程度越高。主成分分析結果顯示3個茄子材料間存在顯著差異。
2.2.2 樣本間代謝物差異及代謝通路分析 本試驗利用液相色譜-質譜聯用技術,共檢測到茄子果皮代謝物218個。依據OPLS-DA模型第一主成分VIP值>1、-value<0.05,篩選得到不同樣本組間(E3316_vs_ 19141和E3316_vs_19147)的DAMs。E3316_vs_19141比較組共檢測到113個DAMs,其中54個上調,59個下調,注釋到42個代謝通路上,影響因子排名前5位的通路分別為-苯丙酸代謝、異喹啉生物堿生物合成、酪氨酸代謝、-亞麻酸代謝、泛酸和CoA生物合成(圖5);E3316_vs_19147比較組共檢測到98個DAMs,其中24個上調,74個下調,注釋到49個代謝通路上,影響因子排名前5位的通路分別為苯丙氨酸代謝,單帖生物合成,異喹啉生物堿生物合成,丙氨酸、天冬氨酸和谷氨酸代謝及半胱氨酸和蛋氨酸代謝(圖5)。
2.2.3 樣本間差異代謝物層次聚類分析及類黃酮生物合成途徑差異代謝物 根據差異代謝物的相對含量,對其進行層次聚類分析。從19141、19147和E3316樣本間84個DAMs聚類分析結果可見(圖6),白果色父本19147和紫紅果色E3316絕大多數DAMs含量更相近,它們要么顯著高于白果色母本19141,要么顯著低于白果色母本19141。總體來看,3組比較樣本代謝物差異趨勢與基因表達差異趨勢相似,都表現為母本比父本較E3316的差異大。與兩個白果色親本相比,紫紅果色F1E3316有19種代謝物上調,包括與果皮呈紫紅色相關的矢車菊素(cyanidin,CAS:528-58-5/13306-05-3)、矢車菊素3,5-二葡萄糖苷(cyanin,CAS:20905-74-2/2611-67-8),苯丙烷類代謝物香豆素(coumarin);-丙氨酸代謝相關的代謝物-丙氨酸、精胺(spermine);生物堿假木賊堿(Anabasine)等;顯著下調的類黃酮代謝物包括對香豆酰奎寧酸(p-Coumaroyl quinic acid)和綠原酸(Chlorogenic acid,CGA,CAS:327-97-9)。
2.3 轉錄組和代謝組聯合分析上位性基因控制的果皮花青素合成
白果色父母本與其紫紅色F1果皮呈色不同主要是由于花青素引起的,因此,對花青素生物合成途徑相關基因表達和代謝物進行聯合分析(圖7)。根據已知花青素生物合成途徑相關結構基因、調控基因、修飾和轉運基因(圖7-A),基于19141、19147及E3316果皮轉錄組相應基因FPKM值構建表達熱圖(圖7-B),由圖7-B可見,、、、、′′、和等花青素合成關鍵結構基因,花青素3-糖苷轉移酶(anthocyanin 3-glycoside transferase,),花青素5-糖苷轉移酶(anthocyanin 5-glycoside transferase,),花青素酰基轉移酶(anthocyanin acyltransferase,),花青素-甲基轉移酶(anthocyanin-methyl transferase,)等花色苷形成和修飾基因,以及花青素轉運基因()的表達都為19141高于E3316,E3316高于19147。花青素合成途徑關鍵調節基因、和的表達模式與結構基因、修飾基因及轉運基因相似,表現為19141高于E3316,E3316高于19147。在3個樣品中相對表達量均較高,且顯著高于,這可能是上位性基因調控下合成的花青素是矢車菊素類型的主要原因。
從圖7-C看,廣靶代謝組共檢測到3種花青素合成相關的代謝產物,分別為柚皮素、矢車菊素和矢車菊糖苷;與茄子果皮著色密切相關的代謝物矢車菊素和矢車菊素3,5-二葡萄糖苷相對含量表現為E3316>19147>19141。
綜合轉錄組和代謝組數據來看,兩個白果色親本雜交后,E3316花青素代謝通路相關基因表達水平居中,能夠進行正常的轉錄和翻譯,催化花青素合成及轉運,因此,E3316果皮呈紫紅色。
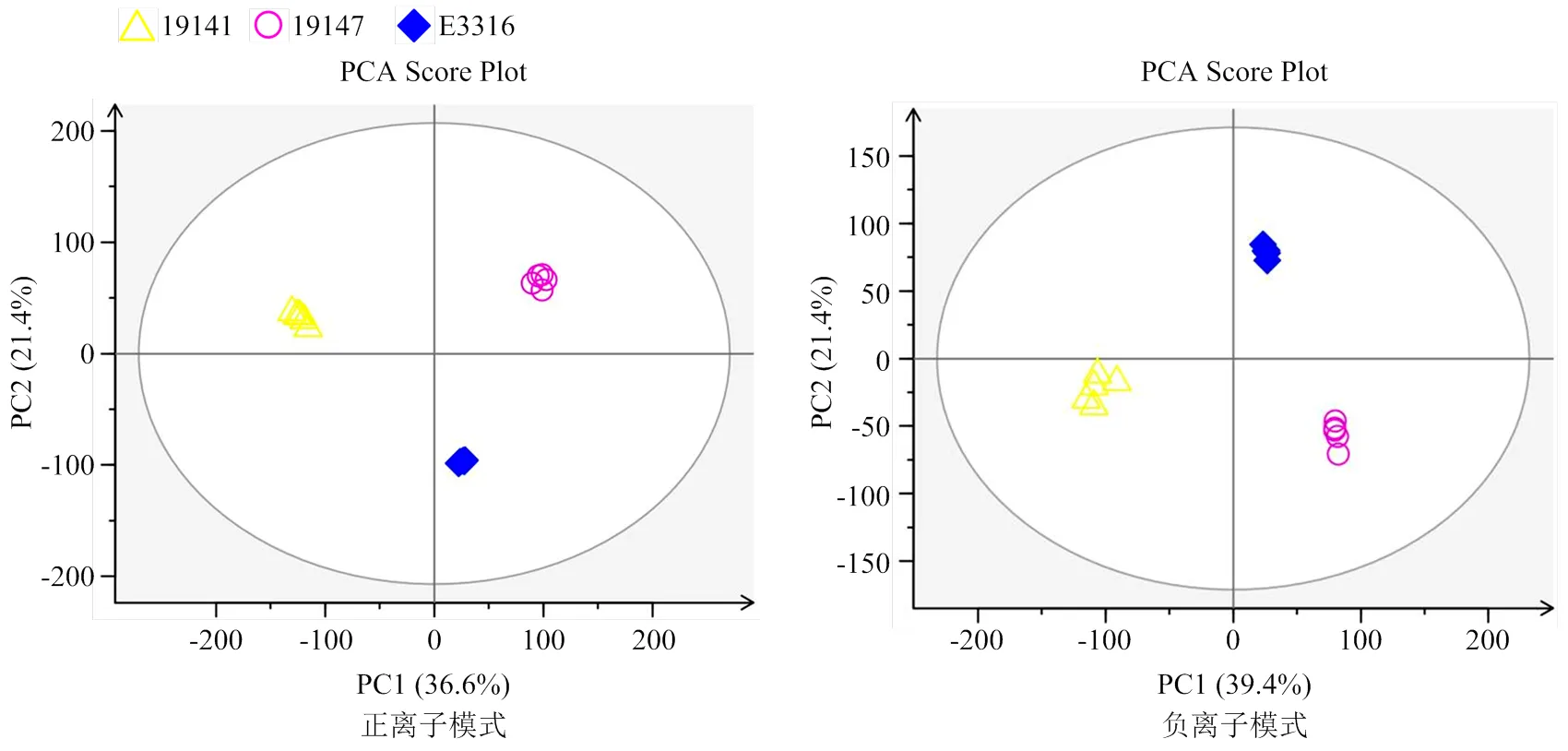
圖4 19141、19147和E3316茄子果皮代謝物PCA得分圖
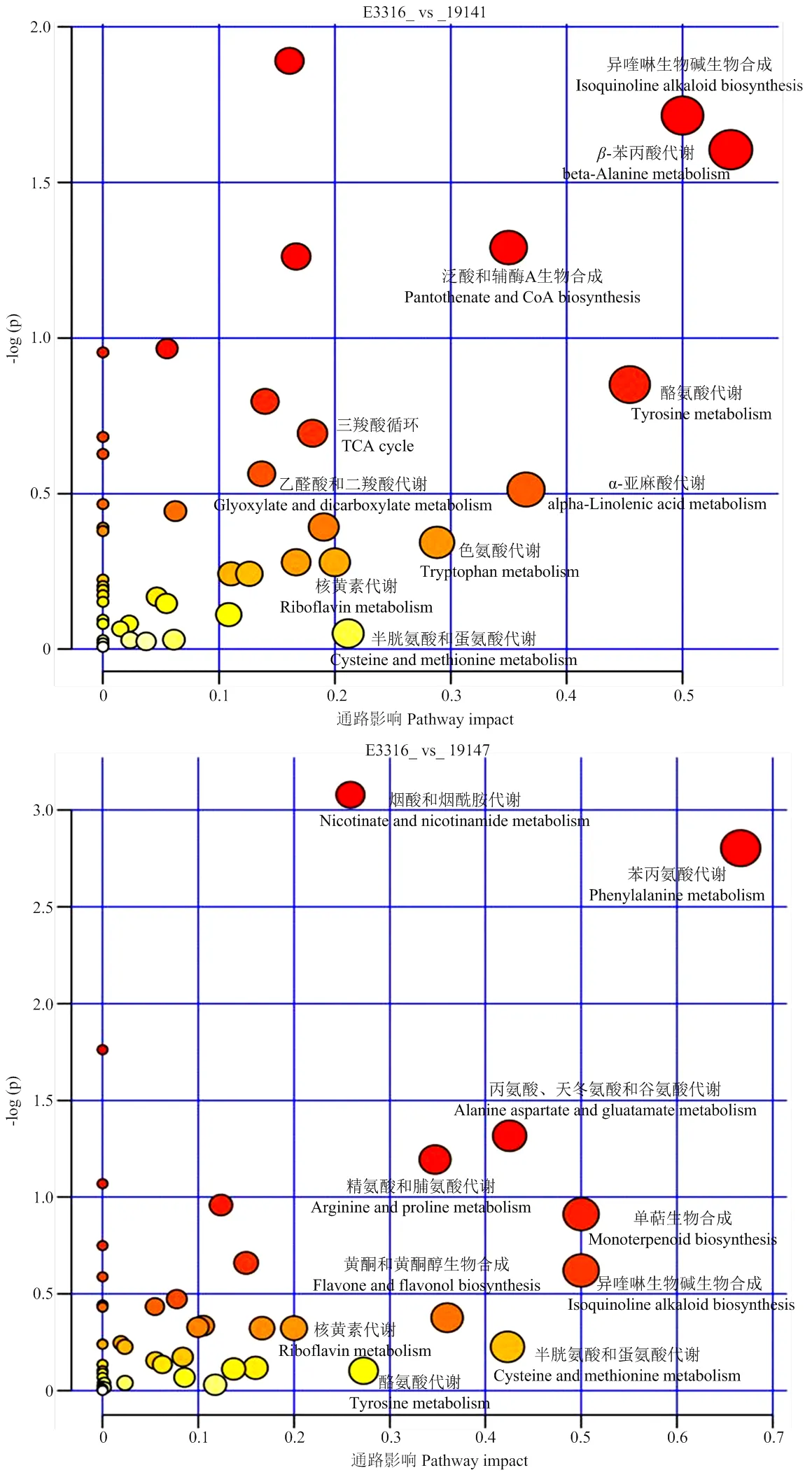
圖5 差異代謝物的KEGG通路富集氣泡圖
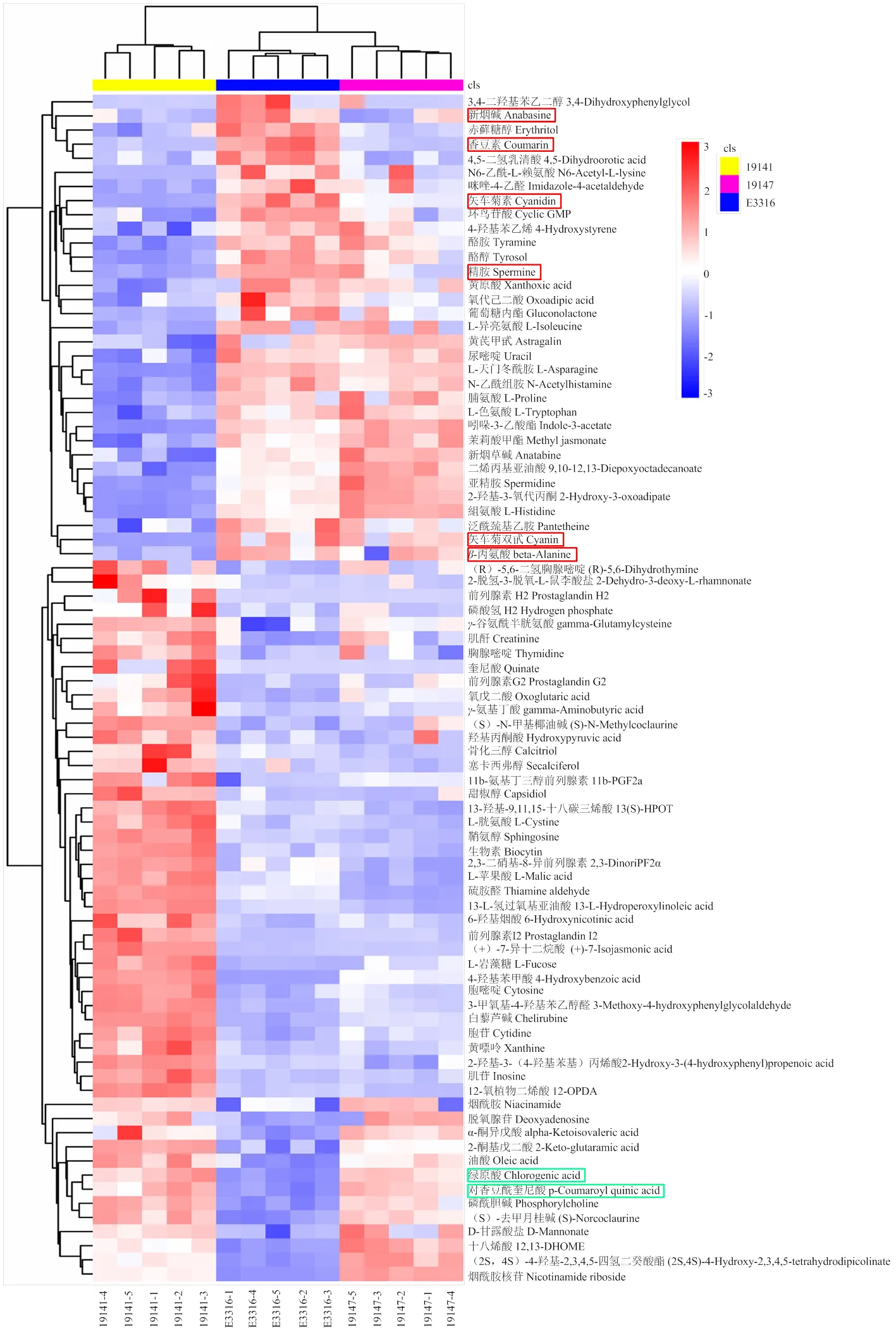
紅色框內代謝物為E3116較親本上調,綠色框內代謝物為E3316較親本下調
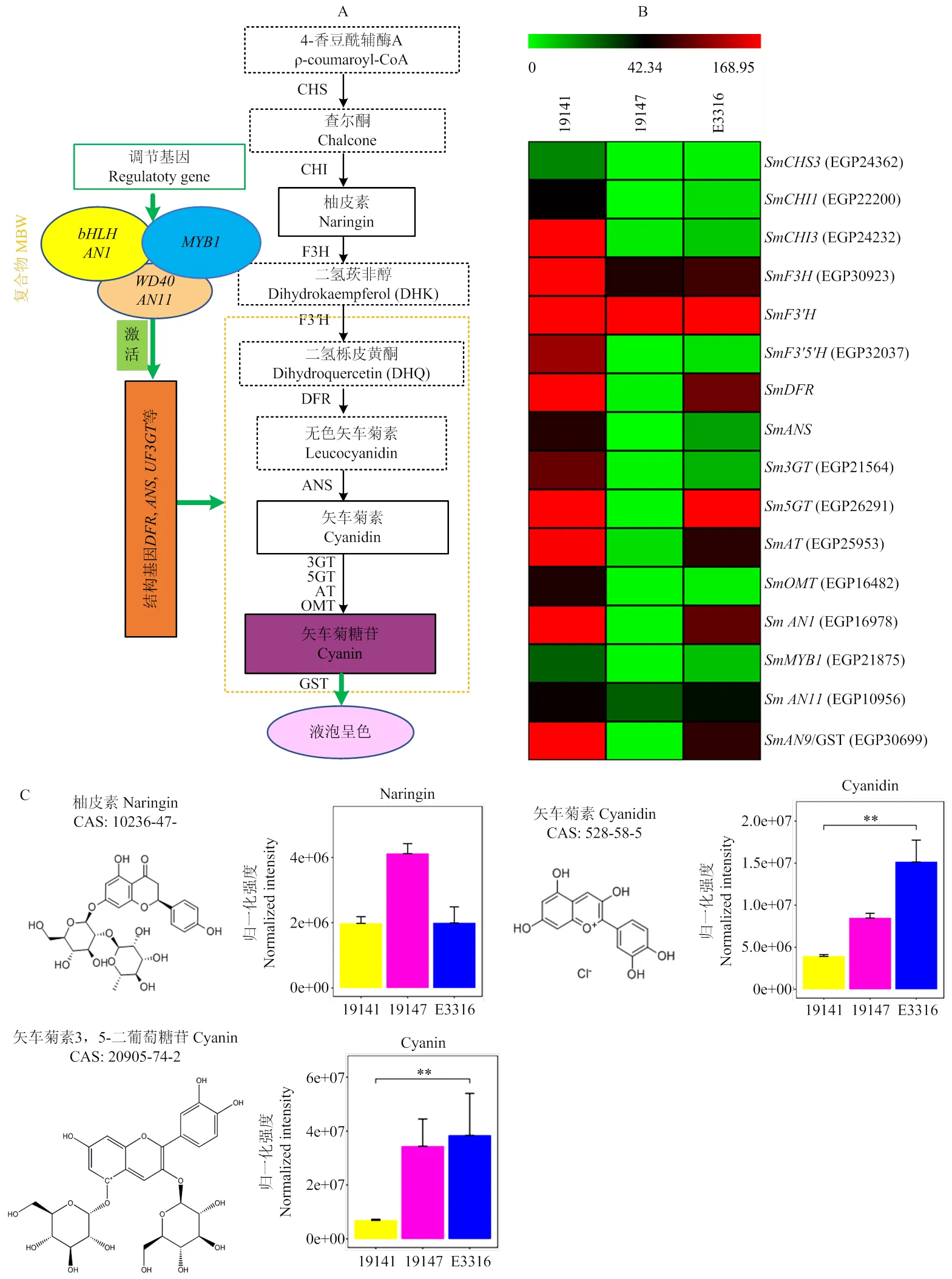
A:花青素生物合成途徑圖解;B:根據花青素生物合成途徑相關基因FPKM值構建的熱圖;C:廣靶代謝組檢測到的花青素生物合成相關代謝物結構及相對含量
3 討論
3.1 果色上位性基因調控下基因表達與代謝產物間的關系
本研究采用的白果色父本材料為突變體[16],白果色母本材料19141為突變體[17]。主要作用是將無色的原花色素氧化產生有色的花青素,該產物是花青素合成途徑中的第一個有色產物,對植物顯色形成至關重要的作用[18]。茄子上的研究表明表達水平與花青素含量呈正相關,紫果皮比綠果皮[19]和白皮[20]的表達量高。本研究上位基因互作背景下,白果色母本19141果皮中表達量顯著高于紫紅果色E3316。是控制茄子花青素合成的重要轉錄因子之一,對大多數促進花青素生物合成的轉錄因子而言,都會上調結構基因表達,從而導致大量花青素積累[21-22]。研究表明除調控花青素生物合成,還調控綠原酸CGA生物合成,刪除端的9個三聯體密碼子,突變體花青素合成途徑被破壞,CGA還可以積累[23]。
在2對雙隱性上位基因互作的遺傳背景下,花青素合成途徑基因的相對表達量與代謝產物含量間的關系非孟德爾遺傳條件下的簡單對應關系。ZHANG等[20]研究發現、、、、、、等7個結構基因和、、、等4個轉錄因子在紫茄皮的表達量都顯著高于白茄皮。本研究中白果色母本19141果皮中花青素生物合成途徑相關基因表達量顯著高于紫紅果色F1E3316。與茄子果皮著色密切相關的代謝物氯化矢車菊素和矢車菊素3,5-二葡萄糖苷相對含量表現為E3316>19147>19141。這可能是由于19141突變方式為花青素合成關鍵結構基因發生無義突變,終止密碼子提前,雖然整個通路的基因表達未受到影響,但由于基因翻譯提前終止,無法行使功能,導致代謝通路中斷,因此矢車菊色素和矢車菊雙甙含量最低;19147突變方式為花青素合成關鍵調控基因,其下調表達使花青素生物合成途徑結構基因整體下調,所以各基因相對表達量均最低,但還有一定量的花青素合成,可能由于表達量也很低而無法行使把花色苷轉運到液泡呈色的功能。E3316中和兩個上位性基因位點呈雜合,基因功能互補,花青素合成通路關鍵結構和調控基因的表達量居中,花青素合成恢復,果皮呈紫紅色。
3.2 上位性基因調控下果皮合成花青素類型
茄子果色與茄子果皮中的色素種類和含量相關。茄子果皮一般含花青素和葉綠素兩種色素,花青素控制茄子果色呈粉紅、淺紫、紫紅、紫黑,甚至黑色,葉綠素控制茄子果色呈綠色[24]。紫色茄子中主要花青素為飛燕草素3-p-香豆酰蕓香糖苷5-葡萄糖苷(CAS: 28463-30-1,nasunin,茄色甙);飛燕草素3-蕓香糖苷(CAS:58585-26-0,D3R,山慈姑花苷),少數茄子和部分野生茄子的花青素中具有飛燕草素-3-葡萄糖苷(CAS:6906-38-3)、矮牽牛素3-(p-香豆酰鼠李糖苷)-5-葡萄糖苷、飛燕草素3-咖啡酰基鼠李糖苷-5-葡萄糖苷等[25-26]。本研究中檢測到的花青素類代謝物為矢車菊素3,5-二葡萄糖苷(CAS:20905-74-2/2611- 67-8,cyanin),其使E3316果皮表現為紫紅色,這與以往報道中茄子主要花青素為飛燕草素衍生物有所不同。在葡萄上的研究表明,果皮中同時表達與,它們的比例控制著葡萄皮中花青素的組成,表達水平高的品種,果皮中矢車菊類花青素累積多,表達水平高的品種,飛燕草素類花青素累積多[27]。本研究茄子果皮相對表達水平高于,這可能是檢測到的花青素種類為矢車菊素的重要原因。
3.3 果色上位性基因調控下花青素和綠原酸生物合成間的關系
花青素和綠原酸生物合成都是經由苯丙素代謝途徑合成的,其在類黃酮合成途徑的p-Coumaroyl-CoA處發生分支,分別被CHS和HCT酶催化進入花青素和綠原酸生物合成途徑。綠原酸CGA是茄子果實中主要的抗氧化酚類代謝物[28-29],其在茄子中含量分別比番茄和馬鈴薯高出10倍和100倍[30]。在馬鈴薯上的研究發現通過RNAi抑制綠原酸代謝途徑的HQT基因降低綠原酸含量,增加了花青素含量[31]。本研究中與綠原酸合成相關的代謝物對香豆酰奎寧酸和綠原酸CGA含量趨勢為白果色親本高于紫紅果色E3316,這可能是由于CGA合成與花青素合成存在底物競爭關系,當紫紅果色E3316花青素合成恢復后,CGA合成受到競爭性調控而含量下調。
4 結論
2對隱性上位基因互作控制茄子果色的遺傳背景下,親本突變基因的類型決定了整個花青素代謝通路基因表達的趨勢和花青素類代謝物合成及呈色的抑制方式。親本突變的基因位點為結構基因,整個花青素合成通路基因表達不會受到影響,但關鍵酶功能缺失造成代謝通路中斷阻礙花青素積累;親本突變的基因位點為MYB轉錄因子基因,其幾乎下調整個花青素合成通路基因,雖然可以合成一定量的花色苷,但可能由于轉運受阻而不能在液泡呈色。兩個白果色親本雜交后代果皮呈紫紅色可能是花青素生物合成途徑兩個不同突變基因位點功能互補的結果;表達水平顯著高于,促進矢車菊型花青素合成;果皮花青素和綠原酸生物合成間存在競爭關系。
[1] MIKO B I, WRITE P D, RIGHT S, EDUCATION N. Epistasis: Gene interaction and phenotype effects. Nature Education, 2011, 6(2008): 1-6.
[2] TIGCHELAAR E C, JANICK J, ERICHSON H T. The genetics of anthocyanin coloration in eggplant (L.). Genetics, 1968, 60: 475-491. doi: 10.1093/genetics/60.3.475.
[3] NUNOME T, ISHIGURO K, YOSHIDA T, HIRAI M. Mapping of fruit shape and color development traits in eggplant (L.) based on RAPD and AFLP markers. Breeding Science, 2011, 51: 19-26. doi: 10.1270/jsbbs.51.19.
[4] DOGANLAR S, FRARY A, DAUNAY M C, LESTER R N, TANKSLEY S D. Conservation of gene function in the Solanaceae as revealed by comparative mapping of domestication traits in eggplant. Genetics, 2002, 161(4): 1713-1726. doi: 10.1093/genetics/161.4.1713.
[5] 龐文龍, 劉富中, 陳鈺輝, 連勇. 茄子果色性狀的遺傳研究. 園藝學報, 2008, 35(7): 979-986.
PANG W L, LIU F Z, CHEN Y H, LIAN Y. Genetic study on fruit color traits of eggplant. Acta Horticulturae Sinica, 2008, 35(7): 979-986. (in Chinese)
[6] LIAO Y, SUN B J, SUN G W, LIU H C, LI Z L, LI Z X, WANG G P, CHEN R Y. AFLP and SCAR markers associated with peel color in eggplant (L.). Scientia Agricultura Sinica, 2009, 8(12): 1466-1474.
[7] HOLTON T A, CORNISH E C. Genetics and biochemistry of anthocyanin biosynthesis. The Plant Cell, 1995, 7(7): 1071-1083. doi: 10.1105/tpc. 7.7.1071.
[8] 宮硤, 薛靜, 張曉東. 植物花青素合成途徑中的調控基因研究進展. 生物技術進展, 2011, 1(6): 381-390.
GONG X, XUE J, ZHANG X D. Regulation genes in plant anthocyanin synthesis pathway. Current Biotechnology, 2011, 1(6): 381-390. (in Chinese)
[9] ALBERT N W, DAVIES K M, LEWIS D H, ZHANG H B, MONTEFIORI M, BRENDOLISE C, BOASE M R, NGO H, JAMESON P E, SCHWINN K E. A conserved network of transcriptional activators and repressors regulates anthocyanin pigmentation in eudicots. The Plant Cell, 2014, 26(3): 962-980. doi: 10.1105/tpc.113.122069.
[10] 李翔, 劉楊, 李懷志, 王中彥, 陳火英. 茄花青素5-O糖基轉移酶基因克隆與表達特征分析. 上海交通大學學報(農業科學版), 2011, 29(6): 1-5, 23.
LI X, LIU Y, LI H Z, WANG Z Y, CHEN H Y. Cloning and expression characterization of the anthocyanin 5-O glucosyltransferase in eggplant. Journal of Shanghai Jiao Tong University (Agricultural Science), 2011, 29(6): 1-5, 23. (in Chinese)
[11] WANG S J, CHEN Z, JI T, DI Q H, LI L J, WANG X F, WEI M, SHI Q H, LI Y, GONG B, YANG F J. Genome-wide identification and characterization of the R2R3MYB transcription factor superfamily in eggplant (L.). Agri Gene, 2016, 2: 38-52.doi: 10.1016/j.aggene.2016.09.006
[12] STOMMEL J R, DUMM J M. Coordinated regulation of biosynthetic and regulatory genes coincides with anthocyanin accumulation in developing eggplant fruit. Journal of the American Society for Horticultural Science, 2015, 140(2): 129-135.
[13] SAKAMURA S, WATANABE S, OBATA Y. The structure of the major anthoeyanin in eggplant. Agricultural and Biological Chemistry, 1963, 27(9): 663-665. doi: 10.1080/00021369.1963.10858161.
[14] 孫保娟, 李植良, 黎振興, 羅少波, 徐曉美. 茄子果色上位性基因的定位及其InDel分子標記開發與應用. 中國, ZL2016 1 1128459.5. 2018-03-02.
SUN B J, LI Z L, LI Z X, LUO S B, XU X M. Mapping of eggplant fruit color epistatic gene, and InDel molecular marker development and application. China, ZL2016 1 1128459.5. 2018-03-02. (in Chinese)
[15] 孫保娟, 李植良, 黎振興, 羅少波, 吳俊. 與茄子果色上位性基因緊密連鎖的InDel分子標記及應用.中國, ZL201810018063.8. 2018-10-02.
SUN B J, LI Z L, LI Z X, LUO S B, WU J. InDel molecular marker closely linked with epistatic geneof eggplant fruit color and application of InDel molecular marker. China, ZL201810018063.8. 2018-10-02. (in Chinese)
[16] 李慧敏. 茄子果色上位D基因[D]. 廣州: 華南農業大學, 2020.
Li H M. Cloning of epigenetic D genecontrolling peel color and its function in anthocyanin synthesis in eggplant [D]. Guangzhou: South China Agricultural University, 2020. (in Chinese)
[17] 吳俊. 茄子果色上位基因基因分子標記開發及候選基因分析[D]. 廣州: 華南農業大學, 2020.
Wu J. Molecular marker development and candidate gene analysis of epistasisgene controlling fruit color in eggplant (L.) [D]. Guangzhou: South China Agricultural University, 2020. (in Chinese)
[18] SPRINGOB K, NAKAJIMA J, YAMAZAKI M, SAITO K. Recent advances in the biosynthesis and accumulation of anthocyanins. Natural Product Reports, 2003, 20(3): 288-303. doi: 10.1039/ b109542k.
[19] GISBERT C, DUMM J M, PROHENS J, VILANOVA S,STOMMEL J R. A spontaneous eggplant (L.) color mutant conditions anthocyanin-free fruit pigmentation. Hortscience, 2016, 51(7): 793-798.doi: 10.21273/HORTSCI.51.7.793.
[20] ZHANG Y J, HU Z L, CHU G H, HUANG C, TIAN S B, ZHAO Z P, CHEN G P. Anthocyanin accumulation and molecular analysis of anthocyanin biosynthesis-associated genes in eggplant (L.). Journal of Agricultural and Food Chemistry, 2014, 62(13): 2906-2912.
[21] 邵文婷, 劉楊, 韓洪強, 陳火英. 茄子花青素合成相關基因SmMYB的克隆與表達分析. 園藝學報, 2013, 40(3): 467-478.
SHAO W T, LIU Y, HAN H Q, CHEN H Y. Cloning and expression analysis of an anthocyanin-related transcription factor gene SmMYB in eggplant. Acta Horticulturae Sinica, 2013, 40(3): 467-478. (in Chinese)
[22] 王海竹, 曲紅云, 周婷婷, 徐啟江. 茄萼花色苷合成相關基因DFR和MYB克隆及表達分析. 中國農業科學, 2017, 50(14): 2781-2792.
WANG H Z, QU H Y, ZHOU T T, XU Q J. Cloning and expression analysis of anthocyanin biosynthesis-associated DFR and MYB genes inof eggplant (L.). Scientia Agricultura Sinica, 2017, 50(14): 2781-2792. (in Chinese)
[23] DOCIMO T, FRANCESE G, RUGGIERO A, BATELLI G, DE PALMA M, BASSOLINO L, TOPPINO L, ROTINO G L, MENNELLA G, TUCCI M. Phenylpropanoids accumulation in eggplant fruit: characterization of biosynthetic genes and regulation by a MYB transcription factor. Frontiers in Plant Science, 2015, 6: 1233. doi: 10.3389/fpls.2015.01233.
[24] DAUNAY M C, AUBERT S, FRARY A, DOGANLAR S, LESTER R N, BARENDSE G, VAN DER WEERDEN G, HENNART J W, HAANSTRA J, DAUPHIN F, JULLIAN E. Eggplant () fruit color: pigments, measurements and genetics// Proceeding of the 12 Eucarpia Meeting on Genetics and Breeding of Capsicum and Eggplant, 2004: 108-116.
[25] AZUMA K, OHYAMA A, IPPOUSHI K, ICHIYANAGI T, TAKEUCHI A, SAITO T, FUKUOKA H. Structures and antioxidant activity of anthocyanins in many accessions of eggplant and its related species. Journal of Agricultural and Food Chemistry, 2008, 56(21): 10154-10159. doi: 10.1021/jf801322m.
[26] 張映, 趙悅琪, 陳鈺輝, 連勇, 劉富中. 茄子紫色形成的分子研究進展. 園藝學報, 2019, 46(9): 1779-1796.
ZHANG Y, ZHAO Y Q, CHEN Y H, LIAN Y, LIU F Z. Progress in molecular research on purple formation of eggplant. Acta Horticulturae Sinica, 2019, 46(9): 1779-1796. (in Chinese)
[27] JEONG S T, GOTO-YAMAMOTO N, HSSHIZUME K, ESAKA M. Expression of the flavonoid 3’-hydroxylase and flavonoid 3’5’ hydroxylase genes and flavonoid composition in grape (). Plant Science, 2006, 17(1): 61-69. doi: 10.1016/j.plantsci.2005.07. 025.
[28] GRAMAZIO P, PROHENS J, PLAZAS M, ANDúJAR I, HERRAIZ F J, CASTILLO E, KNAPP S, MEYER R S, VILANOVA S. Location of chlorogenic acid biosynthesis pathway and polyphenol oxidase genes in a new interspecific anchored linkage map of eggplant. BMC Plant Biology, 2014, 14: 350. doi: 10.1186/s12870-014-0350-z.
[29] MENNELLA G, LO SCALZO R, FIBIANI M, D'ALESSANDRO A, FRANCESE G, TOPPINO L, ACCIARRI N, DE ALMEIDA A E, ROTINO G L. Chemical and bioactive quality traits during fruit ripening in eggplant (L.) and allied species. Journal of Agricultural and Food Chemistry, 2012, 60(47): 11821- 11831. doi: 10.1021/jf3037424.
[30] DOCIMO T, FRANCESE G, RUGGIERO A, BATELLI G, DE PALMA M, BASSOLINO L, TOPPINO L, ROTINO G L, MENNELLA G, TUCCI M. Phenylpropanoids accumulation in eggplant fruit: characterization of biosynthetic genes and regulation by a MYB transcription factor. Frontiers in Plant Science, 2015, 6: 1233. doi: 10.3389/fpls.2015.01233.
[31] PAYYAVULA R S, SHAKYA R, SENGODA V G, MUNYANEZA J E, SWAMY P, NAVARRE D A. Synthesis and regulation of chlorogenic acid in potato: Rerouting phenylpropanoid flux in HQT- silenced lines. Plant Biotechnology Journal, 2015, 13(4): 551-564. doi: 10.1111/pbi.12280.
Transcriptome and Metabolome Integrated Analysis of Epistatic Genetics Effects on Eggplant Peel Color

1Vegetable Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Key Laboratory for New Technology Research of Vegetables, Guangzhou 510640;2College of Horticulture, South China Agricultural University, Guangzhou 510642;3Institute of Vegetable, Guangxi Academy of Agricultural Sciences, Nanning 530007
【Objective】Peel color is closely related to the appearance and value of eggplant. Anthocyanin is one of the natural pigments that determines an eggplant’s peel color. Through the comparison of gene expression and metabolites as well as the analysis on the mechanism of epistatic gene interaction and regulation of anthocyanin synthesis in eggplant peel, this paper provided a theoretical basis for eggplant breeding with different peel colors.【Method】The white-peel female parent 19141 with mutation at the structural geneof anthocyanin biosynthesis pathway, white-peel male parent 19147 with mutation at regulatory geneof anthocyanin biosynthesis pathway, and their F1hybridE3316 with reddish-purple-peel were used as test materials, while transcriptome sequencing and wide-targeted metabolome analysis were performed on peels of commercial eggplant.【Result】The transcriptome sequencing analysis showed that: 19141_vs_19147 had the most differentially expressed genes (DEGs), followed by E3316_vs_19141. The two comparison groups both had the significant enrichment of DEGs in the flavonoid pathway. The DEGs of E3316_vs_19147 were the least and were not enriched in the flavonoid pathway. A total of 218 metabolites were detected by wide-targeted metabolomeanalysis. A total of 113 differentialaccumulated metabolites (DAMs) were detected in E3316_vs_19141, and total 98 DAMs were detected in E3316_vs_19147. The combined analysis of transcriptome and metabolome found that the relative expression levels of key structural genes,,,and, key regulatory genes,and, modifier genes,,and, and transporter gene() involving anthocyanin biosynthesis pathway had the relation of 19141>E3316>19147. The contents of anthocyanin metabolite cyanidin (CAS: 528-58-5) and cyanin (CAS: 20905-74-2)related to peel coloration had the relation of E3316>19147>19141. The combined analysis of transcriptome and metabolome bothshowed that the difference of E3316_vs_19141 was bigger than E3316_vs_19147. Under the regulation of epistatic genes,andgenes were expressed simultaneously in eggplant peel, but the expression level ofwas much higher than that of. The anthocyanin content of E3316 was higher than that of its parents, while the chlorogenic acid content was lower than that of its parents. 【Conclusion】Under the interaction of epistatic genes with controlling the peel color, the locus (type) and mutation mode of mutant gene in parent determined the trend of gene expression in the whole anthocyanin metabolism pathwayand the inhibition mode of peel pigmentation. The reddish-purple-peel F1hybrid of two white-peel parents was the result of the function complementation of two mutated gene involved in anthocyanin biosynthesis pathway.The highly expressedwas the main cause for synthesis of cyanidin, and the relationship between anthocyanin and chlorogenic acid biosynthesis was competitive in peels.
eggplant; peel color; epistatic genes; anthocyanins; transcriptome; metabolome

10.3864/j.issn.0578-1752.2022.20.011
2022-01-20;
2022-06-06
國家自然科學基金(31501755)、廣東省現代農業產業技術體系(2021KJ110,2021KJ106)、廣東省自然科學基金(2021A1515012490)、廣東省農業科學院農業優勢產業學科團隊建設項目(202114TD,R2020PY-JX003)
孫保娟,Tel:020-38469456;E-mail:sunbaojuan@hotmail.com。通信作者李植良,E-mail:vri_li@163.com
(責任編輯 趙伶俐)

