初探酰胺質子加權聯合mDixon-Quant 序列評估前列腺癌骨轉移的價值
李茜瑋,陳麗華,王楠,宋清偉,孫鵬,王家正,劉愛連,3
(1.大連醫科大學附屬第一醫院放射科,遼寧 大連 116011;2.飛利浦醫療,北京 100016;3.大連市醫學影像人工智能工程技術研究中心,遼寧 大連 116011)
前列腺癌(Prostate cancer,PCa)是我國老年男性好發的惡性腫瘤之一,并且隨著老齡化趨勢的發展,在我國的發病率逐年增加[1]。骨轉移為中晚期PCa 常見的轉移方式之一,相較于國外,我國老年PCa 患者發生骨轉移的幾率更高[2]。PCa 骨轉移為一種全身性疾病,嚴重影響患者預后。骨掃描(Emission computed tomography,ECT)和正電子發射斷層成像-X 線計算機體層成像(Positronemissiontomography-computed tomography,PET-CT)是檢查PCa骨轉移的主要方法[3],但由于成本高及核素限制了其在骨轉移患者中的廣泛應用。常規MRI 檢查雖然對于早期骨髓腔內的病變具有一定的敏感性,但仍存在成像局限性[4]。因此,需要尋找一種無創且精準地評估PCa 骨轉移的方法。
酰胺質子加權成像(Amide proton transferweighted,APTw)作為一種定量成像技術,能檢測病變組織內蛋白質及多肽的含量,對疾病的鑒別診斷具有一定的價值[5]。MR 多回波Dixon 定量成像技術(mDixon-Quant)作為一種新型脂肪定量成像技術,通過定量參數脂肪分數(FF)值、表觀弛豫率(R2*)值及橫向弛豫時間(T2*)值,可以無創且快速地評估組織脂肪含量及順磁性物質的含量[6-7]。目前尚無研究分析以上兩種序列在評估PCa 骨轉移中的價值。本研究旨在探究APTw 聯合mDixon-Quant 序列評估PCa 骨轉移的價值。
1 資料與方法
1.1 研究對象
該回顧性研究獲得本院醫學倫理委員會批準(批件號:PJ-KS-XJS-2021-20(X)),免患者知情同意。回顧性收集2019 年5 月—2022 年1 月于本院因臨床懷疑PCa 行3.0T MRI 掃描的46 例患者的資料。入組標準:①經穿刺(29 例)、電切(3 例)及根治術(14 例)證實為PCa;②MRI 檢查診斷為PCa 骨轉移的患者于MRI 檢查后15 d 內行ECT 檢查進一步證實;③MRI 掃描序列完整,包括APTw 及mDixon-Quant 序列;④圖像質量好,無偽影。排除標準:①除PCa 外伴有前列腺炎的患者;②檢查前行手術、內分泌治療及放化療等。最后入組:PCa 骨轉移19例,年齡61~85歲,平均(72.10±7.25)歲,非骨轉移27例,年齡54~87歲,平均(70.70±7.96)歲。入組流程圖見圖1。
1.2 檢查設備與方法
本研究采用飛利浦公司3.0T MR 掃描儀(Ingenia CX,Philips,Holland)進行前列腺掃描。患者禁食,掃描前囑患者排尿。采取仰臥位,雙側髂前上棘連線與線圈中心線重合。采用32 通道腹部線圈,掃描序列包括T1WI、T2WI、DWI(b 值=0、1 200 s/mm2)、APTw 及mDixon-Quant。掃描方位包括冠狀位、矢狀位及軸位。掃描參數詳見表1。
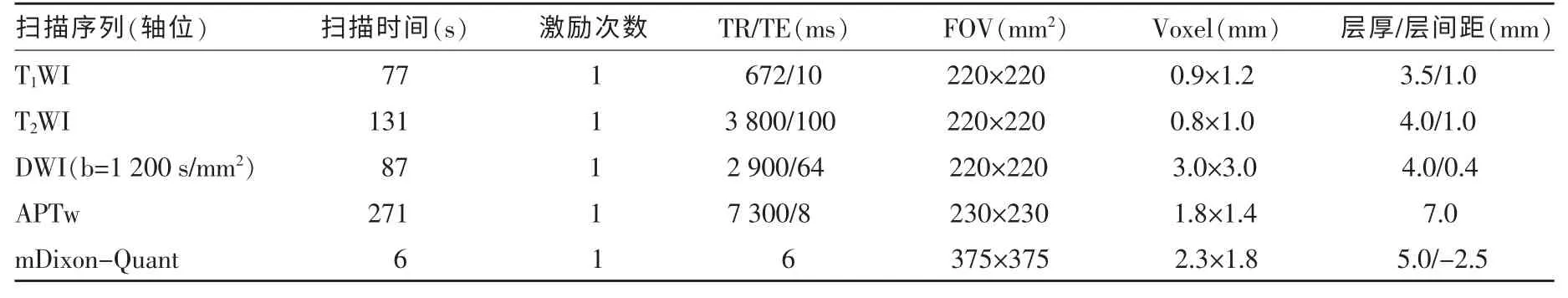
表1 掃描參數表
1.3 臨床及病理資料
記錄患者臨床及病理資料,年齡、總前列腺特異性抗原(Total prostate specific antigen,tPSA)、神經侵犯及Gleason 評分見表2。
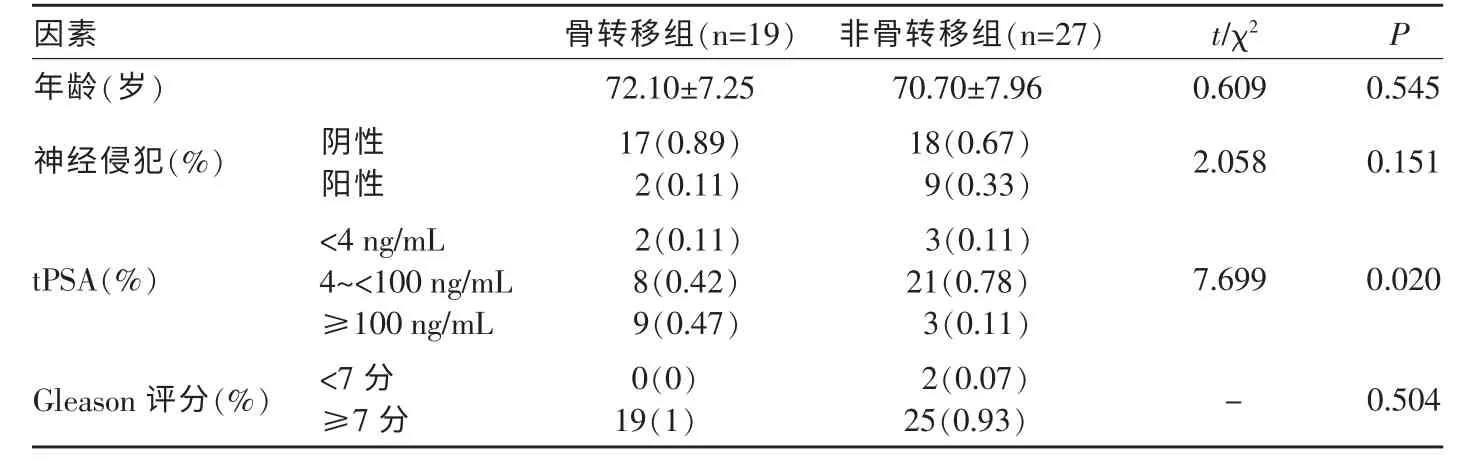
表2 PCa 骨轉移與非骨轉移臨床一般資料分析
1.4 圖像處理與測量
獲得APTw 及mDixon-Quant 掃描原始圖像后,將原始圖像上傳至ISP(IntelliSpacePortall,Philips Healthcare)工作站,經后處理生成APTw 及FF 圖、R2*圖。參考DWI 圖像尋找病變結節顯示最大的層面,并分別將DWI 與APTw 及FF 圖、R2* 圖融合生成相應的偽彩圖。由兩名觀察者(前列腺MRI 讀片經驗分別為1 年及5 年)在未知患者病理的情況下,于融合后的偽彩圖上結節顯示最大層面放置感興趣區(ROI)(面積約為40 mm2),進行病灶勾畫并記錄APTw 值、FF 值及R2*值,勾畫病灶時應避開囊變區及壞死區(圖2,3)。
1.5 統計學分析
獲得的數據采用SPSS 23.0 及Medcala 15 軟件進行統計學分析。采用Bland-Altman 圖評估兩名觀察者之間APT 值及FF 值、R2* 值測量的一致性,若大部分散點均勻分布在+1.96 與-1.96 線內則代表一致性好。取一致性良好的參數值的平均值進行后續分析。采用Kolmogorov-Smirnov 檢驗數據的正態性,符合正態分布的數據,表示為均值±標準差();不符合正態分布的數據,表示為中位數(25百分位數,75 百分位數)。采用獨立樣本t 檢驗或Mann-Whitney U 檢驗比較兩組間APT 值及FF 值、R2* 值的差異。采用Logistic 回歸計算APTw 及mDixon-Quant 序列聯合參數模型的預測值。采用受試者工作特征(Receiver operator characteristic,ROC)曲線評估有差異的參數單獨或聯合鑒別兩組疾病的效能,并計算各參數鑒別兩組疾病的曲線下面積(AUC)、敏感性、特異性及閾值。采用Delong 檢驗兩兩比較有差異參數單獨或聯合鑒別兩組疾病的ROC 曲線。采用獨立樣本t 檢驗、Pearson’s 卡方檢驗及Fisher 確切概率法評估PCa 骨轉移相關臨床一般資料。
2 結果
2.1 臨床一般資料
PCa 骨轉移組及PCa 非骨轉移組的臨床病理資料見表2。研究結果發現:PCa 骨轉移組與PCa 非骨轉移組的tPSA 差異有統計學意義(P=0.020);余臨床與病理資料兩組間差異無統計學意義。
2.2 兩名觀察者各參數測量一致性評估
兩名觀察者APTw 值及FF 值、R2* 值測量的一致性好,表現為Bland-Altman 圖中大部分散點均勻分布在+1.96 與-1.96 線內(圖4)。
2.3 兩組病例各序列參數值的比較
兩組病例各序列參數值的比較結果見表3。骨轉移組的APT 值及R2*值大于非骨轉移組,差異具有統計學意義(P<0.05)。骨轉移組與非骨轉移組的FF 值間比較無統計學差異(P>0.05)。
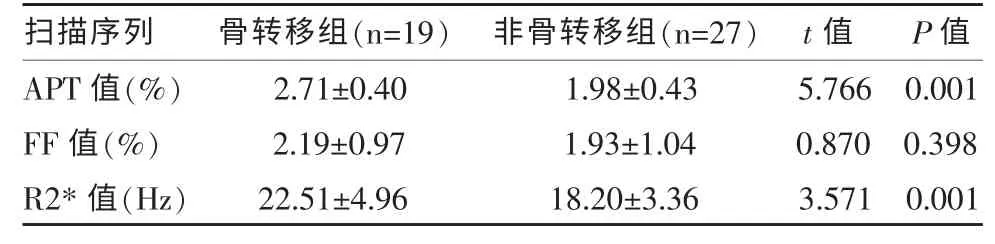
表3 兩組病例各序列參數值的比較
2.4 兩組病例APT 值、R2*值及APT-R2*值聯合診斷效能評估
利用APT 值、R2* 值及APT-R2* 聯合參數模型鑒別兩組疾病的AUC 值分別為0.887、0.768 及0.902(表4,圖5);其中兩兩比較APT 值、R2* 值及APT-R2* 聯合參數模型的ROC 曲線,發現R2* 值與APT-R2*聯合參數模型鑒別兩組疾病的AUC 差異有統計學意義(P=0.0259),余APT 值與R2* 值、APT 值與APT-R2* 聯合參數模型鑒別兩組疾病的AUC 差異無統計學意義(P=0.125 7、0.528 6)。

表4 APT、R2* 值及APT-R2* 聯合參數模型診斷效能評估
2.5 APT 值與R2*值相關性分析
APT 值與R2* 值呈正相關(r=0.47,P<0.05),結果見圖6。
3 討論
中晚期PCa 易發生骨轉移,癌細胞可通過Baston 脊椎靜脈叢轉移至骨盆及脊柱[8-9]。因此,早期PCa 患者多無明顯臨床癥狀,而隨著病變的進展,多數患者可繼發骨痛、病理性骨折及脊髓壓迫等,最終導致神經功能減退、生活質量下降甚至縮短患者壽命[10]。MRI 是一項無創評估PCa 骨轉移的檢查技術,由于轉移至骨髓中的腫瘤細胞使正常骨髓中的脂肪含量及水分子含量發生了變化,因此通過信號強度的改變診斷PCa 骨轉移具有一定的敏感性。但Park等[11]研究發現骨髓良性紅細胞增多癥和骨髓多發腫瘤細胞的信號強度存在重疊,因此常規MRI 檢查仍存在一定的局限性。近年來,隨著多參數磁共振成像(Mult-parameter MRI,mp-MRI)的發展,定量參數成像在疾病的鑒別診斷方面具有很好的潛力,目前在直腸、子宮、前列腺等部位疾病的診斷中均有應用[12-14]。
APTw 基于游離水和蛋白質、多肽之間化學交換飽和轉移效應的存在,其可以檢測出腫瘤中豐富的酰胺質子成分[15],結果受蛋白濃度及酸堿度的影響。APTw 在腦缺血、腦腫瘤、乳腺癌和宮頸癌以及神經退行性疾病的評估中顯示出了強大的性能[16-20]。目前,有學者已經證明APTw 能夠為PCa 與前列腺增生的鑒別診斷提供幫助[21],但尚無研究將APTw用于評估PCa 骨轉移。本研究中,兩名觀察者測量的APT 值及R2*值一致性良好,證明數據穩定,可用于評估PCa 骨轉移;研究結果示PCa 骨轉移組的APT 值大于非骨轉移組,其原因可能為:PCa 骨轉移組腫瘤的惡性程度增加,腫瘤增值速度增快,導致腫瘤細胞所含蛋白質及多肽的含量增加,化學交換飽和轉移效應增強,進而使得PCa 骨轉移組的APT 值大于非骨轉移組。此外,Kulanthaivelu等[22]研究發現腦膠質瘤瘤周組織的APT 值較高,推測與瘤周血腦屏障破壞導致血管內蛋白滲漏到血管外空間有關。因此,我們推測腫瘤新生血管形成或血管內皮受損致血管通透性增大也可能是造成本研究中PCa 骨轉移組APT 值大于非骨轉移組的原因之一。最后腫瘤乏氧使得微環境PH 值減低,通過影響蛋白質的結構及酶促反應,進一步引起APT 值的變化。tPSA對于PCa 的診斷具有一定的價值,本研究中兩組tPSA 有差異,與韓躍輔等[23]的研究結果一致,同時該研究表明,對于部分分化極差、惡性程度極高的PCa,其對tPSA 的表達程度低,致血清tPSA 水平較低,因此利用tPSA 鑒別PCa 是否發生骨轉移仍面臨挑戰。
采用6 個回波、7 個脂肪峰模型的mDixon-Quant 成像技術在定量檢測脂肪的研究中具有一定價值[23],能獲得定量FF 值、R2* 值。近年來,也有研究應用該序列定量參數R2* 值鑒別Ⅰ期子宮內膜癌與子宮內膜息肉等,顯示出很好的價值[7]。mDixon-Quant 成像技術中的定量參數R2* 值指一段時間脈沖回聚的橫向弛豫速率,T2* 值指橫向弛豫時間,兩者關系為R2*=1/T2*。R2*值反映了組織的氧合水平,可以定量評估組織細胞順磁性物質的含量,通過分析組織細胞微環境來評估不同疾病的病理生理狀態[24]。本研究中,PCa 骨轉移組的R2*值大于非骨轉移組,其原因可能為:PCa 骨轉移組腫瘤細胞增值速率更快,耗氧量增加致組織脫氧血紅蛋白含量增加,作為一種順磁性物質,脫氧血紅蛋白加快了橫向磁化矢量由同相位向矢相位的轉變,進而橫向弛豫時間縮短,T2* 值減小,R2* 值增大;此外,推測由于骨轉移組較非骨轉移組腫瘤新生血管數量增加,腫瘤出血及血液瘀滯可能同樣使得順磁性物質如脫氧血紅蛋白及含鐵血紅素增加,破壞磁場均勻性,最終導致T2*值減小,R2*值增大。
本研究中,APT 值與R2* 值呈正相關,原因可能為:首先,隨著APT 值的升高,即水分子與蛋白質、多肽的化學交換飽和轉移效應增強,預示腫瘤增值的能力更強,此時腫瘤耗氧量的增加使腫瘤微環境中順磁性物質含量增加,進而導致T2* 值減小,R2*值增大;其次,腫瘤乏氧可導致腫瘤微環境中PH值減低,而PH 值通過調節蛋白質的結構及酶的作用進而影響化學交換速率,最終致APT 值減低[25-26]。
總之,APT 值、R2* 值及APT-R2* 值均能很好地鑒別PCa 骨轉移,且APT-R2* 值的鑒別效能顯著提升。APTw 和mDixon-Quant 序列從分子及代謝水平為預估PCa 骨轉移提供全新的成像技術。
本研究仍存在一定的局限性:①研究樣本量較小,有待后續擴大樣本量深入研究;②ROI 勾畫僅限于腫瘤最大層面,未對腫瘤全域進行分析,不能全面反映腫瘤的異質性。

