灘羊肉宰后成熟期間ATPase活力變化對微觀結構及保水性的影響
姬 琛,羅 輝,劉吉娟,羅瑞明,,*
(1.寧夏大學農學院,寧夏 銀川 750021;2.寧夏大學食品與葡萄酒學院,寧夏 銀川 750021)
灘羊是分布于陜西、甘肅、寧夏的優質特色畜種,由于其肉質鮮美、營養豐富備受消費者喜愛。保水性是衡量灘羊肉品質的重要指標之一,可用滴水損失表征[1]。宰后成熟過程中肌肉會發生復雜的生理生化變化,對肉的保水性有重要影響。目前,宰后成熟過程中過度的汁液流失仍是影響灘羊肉外觀、營養價值、經濟價值的主要問題之一。因此,研究宰后成熟過程中滴水損失的形成對于指導灘羊肉生產加工具有重要意義。
宰后成熟過程中肉品的保水性受諸多因素影響,如成熟條件、糖酵解、肌肉pH值等,最終由結構蛋白的降解程度及空間排列決定,這些因素通過引起肌纖維和肌細胞的收縮來調節水分貯留[2-3]。鈣蛋白酶(Calpains)與細胞凋亡酶——胱天蛋白酶(Caspases)是目前公認宰后成熟過程中水解結構蛋白質的主要酶類[4]。Koohmaraie[5]認為Calpain-1對結構蛋白水解起主要作用。然而,由于宰后Calpain逐漸失活,其水解作用受限。慕妮[6]的研究結果表明雞肉成熟9 h時Calpain-1基本完全失活,但結構蛋白的降解仍在發生。近些年,細胞凋亡理論被引入宰后肉品品質形成研究中,Caspases被認為是宰后肌纖維骨架蛋白降解的主要貢獻者,尤其是Caspase-3,研究證實其是宰后成熟過程中調控肌原纖維蛋白降解程度的主要酶之一,其活性主要受細胞凋亡相關通路調控。Huang Ming等[7]研究發現Caspase-3可體外降解雞肉中的伴肌球蛋白、伴肌動蛋白和α-輔肌動蛋白,并弱化Z線與I盤的連接。Chen Lin等[8]研究發現Caspase-3可體外降解雞肉中的肌鈣蛋白-T。宰后成熟期間ATPase可調控引發細胞凋亡的相關通路,通過級聯反應激活Caspase-3,從而水解結構蛋白。Chaves等[9]發現Na+-K+-ATPase通過改變膜通透性,釋放細胞色素c,啟動Caspases級聯反應,影響肌肉細胞的凋亡和纖維化,破壞肌質網結構,從而影響肉的保水性。Sierra等[10]闡明了宰后Ca2+-ATPase通過向細胞外泵出Ca2+,促使H+流入細胞內,引起細胞內離子穩態失衡,導致線粒體膜通透性改變,啟動細胞凋亡,激活Caspase-3降解肌纖維蛋白。
本實驗選取灘羊背最長肌為研究對象,成熟8 d,通過測定ATPase活力、Caspase-3活力、微觀結構與品質指標變化,確定灘羊肉保水性對ATPases活性變化的響應,以期為指導灘羊肉生產加工提供理論依據。
1 材料與方法
1.1 材料與試劑
灘羊背最長肌由寧夏鹽池縣大夏牧場食品有限公司提供,選取9 只體質量相近的6 月齡公灘羊,屠宰前統一管理。屠宰后立即采集胴體右側背最長肌,剔除可見脂肪與結締組織后放置于保鮮袋中,于4 ℃、風速3 m/s、相對濕度85%條件下成熟0、4、8 d。
1.2 儀器與設備
DW3.0.1型超低溫冰箱 無錫冠亞恒溫制冷技術有限公司;352型酶標儀 芬蘭Labsystems Multiskan MS公司;AC8型洗板機 芬蘭ThermoLabsystems公司;TG16W型離心機 湖南湘儀實驗室儀器開發有限公司;GNP-9080型恒溫培養箱 上海昕儀儀器儀表有限公司;Leica UC7型超薄切片機 德國徠卡公司;HT7700型透射電子顯微鏡 日本Hitachi公司;便攜式pH計 上海德圖儀器國際貿易有限公司。
1.3 方法
1.3.1 樣品采集
采集成熟0、1、2、4、8 d的灘羊背最長肌約200 g,用于測定pH值與滴水損失率;采集不同成熟時間樣品各20 g置于-30 ℃保存,用于測定蛋白溶解度;采集不同成熟時間樣品各5 g封裝于滅菌冷凍管中,置于-80 ℃保存,用于測定酶活力。
1.3.2 pH值測定
去除樣品可見脂肪,使用pH計測定肌肉pH值。使用前pH計以3 種標準緩沖液(pH 9.18、6.86、4.0)進行校準。
1.3.3 滴水損失率測定
參照左惠心[11]的方法并稍作修改。取約60 g樣品準確稱質量后用繩子懸掛于自封袋中,確保樣品與自封袋無接觸,置于4 ℃冰箱中,24 h后用紙巾吸干樣品表面水分后重新稱質量。滴水損失率以兩次稱量的質量差占肉塊初始質量的百分比表示。
在屋里做飯的媳婦聽見孩子的哭聲,急忙從屋里出來,邊走邊在圍裙上擦著手,嘴里吆呼著:“狗蛋咋啦?狗蛋咋啦?”看見哥們兒朝洛蒙背著雙肩包在黑地里高粱桿似的戳著。媳婦把狗蛋從地上抱起來,顛著哄:“奧奧奧,狗蛋別哭,狗蛋別哭,我們的狗蛋不哭。”
1.3.4 微觀結構觀察
參考Li Ke等[12]的方法,取不同成熟時間樣品切成20 mm×20 mm×20 mm塊狀,戊二醛溶液預固定4 h后用磷酸緩沖液(0.1 mol/L、pH 7.4)漂洗3 次,每次15 min。再加入含1%鋨酸的磷酸緩沖液(0.1 mol/L、pH 7.4)室溫固定2 h,用磷酸緩沖液(0.1 mol/L、pH 7.4)漂洗3 次,每次15 min。乙醇梯度脫水,環氧樹脂滲透包埋,用超薄切片機切成厚60 nm的超薄切片,鈾鉛雙染色(2%醋酸鈾飽和乙醇溶液、枸櫞酸鉛各染色15 min),切片室溫干燥過夜,用透射電子顯微鏡進行拍照觀察。
1.3.5 蛋白溶解度測定
參照李升升[13]的方法并稍作修改。準確稱取1 g肉樣剪碎置于10 mL離心管中,加入SDS溶液(85 ℃、50 g/L、1 mL),12 000 r/min均質3 min(每30 s間歇10 s)后15 000 r/min離心20 min,上清液即為總可溶性蛋白。
準確稱取1 g肉樣剪碎置于10 mL離心管中,加入1 mL超純水,12 000 r/min均質2 min后15 000 r/min離心5 min,上清液即為水溶性蛋白溶液。收集上一步驟沉淀,加入1 mL低鹽溶液(含0.116 9 g NaCl、0.038 0 g EGTA、0.305 0 g MgCl2、0.077 1 g二硫蘇糖醇、0.003 5 g苯甲基磺酰氟、0.040 8 g NaH2PO4、0.042 9 g Na2HPO4),4 ℃、12 000 r/min均質2 min后,15 000 r/min離心5 min并收集上清液,即為低鹽溶性蛋白溶液。收集低鹽溶性蛋白溶液剩余的沉淀,加入1 mL高鹽溶液(含0.19 g EGTA、0.305 g MgCl2、0.077 1 g二硫蘇糖醇、0.003 5 g苯甲基磺酰氟、2.659 g Na2P2O7),4 ℃、12 000 r/min均質2 min后15 000 r/min離心20 min,上清液即為高鹽溶性蛋白溶液。采用考馬斯亮藍法測定蛋白質量濃度。
1.3.6 Caspase-3、Na+-K+-ATPase及Ca2+-ATPase活力測定
根據試劑盒說明書,采用酶聯免疫吸附測定法測定Caspase-3、Na+-K+-ATPase及Ca2+-ATPase活力。稱取1 g切碎肌肉樣品加入9 mL磷酸鹽緩沖液(pH 7.2、0.01 mol/L)于4 ℃勻漿,然后4 ℃、5 000 r/min離心15 min,收集上清液。將上清液與共軛試劑(多聚半乳糖醛酸酶、果膠甲基酯酶)于37 ℃孵育30 min后采用蒸餾水梯度稀釋加入96 孔微量滴定板中。加入酶標試劑并于37 ℃反應30 min。將50 μL顯色液A(醋酸鈉、檸檬酸、過氧化氫)和50 μL顯色液B(EDTA-Na、檸檬酸、甘油、四甲基聯苯胺)依次加入滴定板,37 ℃于避光處孵育15 min,最后加入50 μL硫酸溶液(1 mol/L)終止反應。使用酶標儀在450 nm波長處檢測吸光度。采用梯度稀釋法,用0.01 mol/L磷酸鹽緩沖液稀釋共軛試劑,繪制標準曲線,根據標準曲線方程計算酶活力(U/L)。以成熟0 d時初始酶活力為1,計算各成熟時間樣品中Caspase-3、Na+-K+-ATPase及Ca2+-ATPase相對活力。
1.4 數據處理與分析
每個指標重復測定3 次,結果以平均值±標準差表示。采用SPSS軟件對數據進行方差分析,P<0.05表示存在顯著差異。采用Origin軟件繪圖。采用SPSS軟件計算各指標間的皮爾遜相關性系數。
2 結果與分析
2.1 灘羊肉宰后成熟過程中pH值及滴水損失率的變化
由圖1可知,宰后成熟期間灘羊背最長肌滴水損失率隨成熟時間延長呈先升高后降低的趨勢(P<0.05),并于成熟2 d時達到最大值(7.57%)。滴水損失率越高,肉的保水性越差,表明成熟2 d時灘羊肉的保水性較差,隨著成熟時間的延長,肉中可流失水分含量總體減少,因此滴水損失率亦減小。本研究結果與惠小洋等[14]對4 ℃成熟過程中黃牛×西門塔爾雜交牛背最長肌滴水損失率變化規律的研究結果一致。肌肉中的水分可分為結合水、自由水、不易流動水,其中自由水儲存于細胞間隙,最易流失;結合水由于與蛋白質緊密結合而不易受宰后成熟過程的影響;不易流動水約占肌肉水分含量的80%,由于其被固定在肌纖維結構中,但并不與蛋白質結合,因此最易受到肌原纖維蛋白降解和蛋白質電荷變化的影響[1],故肉品的保水性雖受諸多因素影響,但最終由細胞骨架蛋白的結構及其空間排列的變化決定。灘羊背最長肌保水性的變化表明宰后成熟過程中肌肉結構的完整性遭到破壞,肌肉中潴留的水分減少,成熟初期肌細胞間隙的自由水首先在重力作用下流失,隨著成熟時間的延長,肌細胞收縮、肌原纖維蛋白降解及肌肉pH值下降,導致不易流動水流失,并在重力作用下形成滴水損失;成熟后期,由于絕大多數自由水及不易流動水已轉化為滴水損失,肉中的水分含量總體減少,因此可轉化為滴水損失的水分亦減少。
由圖2可知,成熟0~2 d,灘羊肉pH值顯著降低(P<0.05),并于成熟2 d時降至最低(5.55),2~4 d變化不顯著(P>0.05),4 d后顯著升高至5.63(P<0.05)。既往研究表明,宰后成熟初期家畜肌肉pH值可降至5.4~6.3[15-16],本研究結果符合這一規律。宰后成熟過程中,肌肉pH值下降的速率和程度顯著影響代謝酶的活性,對于肉色、嫩度、保水性和風味前體的形成有重要影響[3]。糖原被認為是宰后成熟過程中肌肉中唯一的碳水化合物來源,研究表明宰后成熟初期肌肉中腺苷酸活化蛋白激酶活力升高,己糖激酶、果糖磷酸激酶、丙酮酸激酶、乳酸脫氫酶等被激活[17-18],進而促進糖原轉化為乳酸,導致乳酸積累,該過程是引起肌肉pH值降低的主要原因。肌肉pH值被認為是宰后重要的品質評價指標之一,除影響肌原纖維蛋白降解相關酶活性外,蛋白質與水分的結合也受其影響,當肌肉pH值降至蛋白等電點時,蛋白對水分的吸引力降低[11],其主要機制為不易流動水儲存于細胞內蛋白質交聯所形成的空間內[1],pH值降低至一定程度會引起儲存水分的蛋白質變性(如肌球蛋白頭部)[19],導致存儲水分的空間減小,從而引起滴水損失增加,造成肌肉保水性下降。成熟2 d時灘羊肉保水性較差可能與pH值降至最低時引起的肌球蛋白頭部等蛋白變性有關,而成熟后期滴水損失有所降低可能與pH值偏離蛋白質等電點有關。因此,宰后成熟過程中肌肉pH值的變化對滴水損失有重要影響。
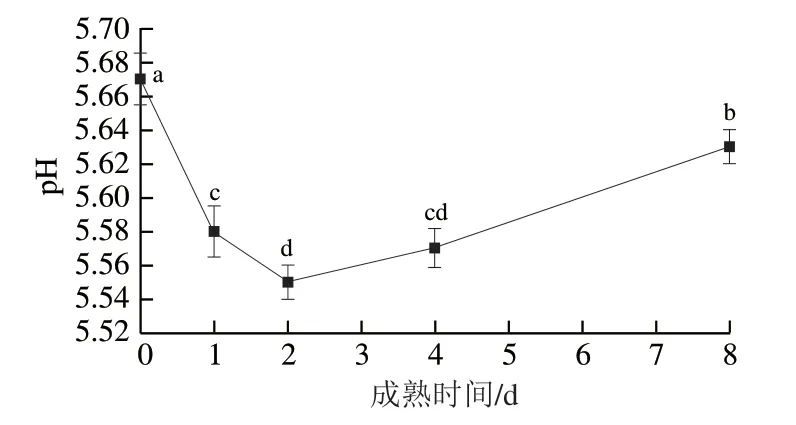
圖2 灘羊肉宰后成熟期間肌肉pH值的變化Fig. 2 Variation in pH of Tan sheep meat during postmortem aging
2.2 宰后成熟期間灘羊背最長肌微觀結構變化及肌原纖維蛋白降解情況
如圖3所示,成熟0 d時,灘羊背最長肌肌原纖維排列緊密,相鄰肌纖維間隙很小,肌纖維結構清晰、排列整齊;Z線結構清晰、排列整齊;H帶結構清晰、連續;大部分肌纖維膜與肌原纖維緊密相連,相鄰肌原纖維之間沒有明顯間隙。成熟4 d時,肌細胞整體呈中度水腫,肌纖維排列整齊、結構致密,分布略顯稀疏,間隙明顯增寬,肌節呈對稱分布。Z線結構清晰、排列整齊,沒有明顯斷裂;H帶結構清晰;肌原纖維間隙較小,肌膜大部分與肌原纖維分離。成熟8 d時,肌細胞整體呈重度水腫,肌纖維結構稀疏、排列松散、邊緣模糊,較多肌絲發生斷裂、溶解現象,肌纖維不連續;Z線局部斷裂、不連續;H帶結構模糊、消失。
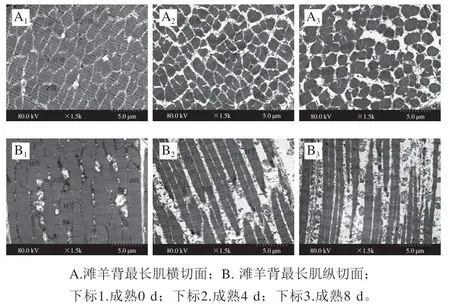
圖3 宰后成熟過程中灘羊肉微觀結構的變化Fig. 3 Variation in microstructure of Tan sheep meat during postmortem aging
以上結果表明,成熟0~4 d內僅部分肌原纖維蛋白發生降解,構成粗絲及細絲的肌動蛋白、肌球蛋白等可能被蛋白水解酶降解;隨著成熟時間延長,Z線斷裂、H帶消失、肌纖維斷裂、肌原纖維結構松散、肌纖維及肌膜之間形成間隙,可能是因為肌間線蛋白等結構蛋白在成熟后期發生了降解,且肌球蛋白、肌動蛋白等蛋白的持續降解導致肌絲之間的間隙擴大,這些間隙的形成為肉中水分的流失提供了通道。另外,研究表明宰后成熟過程中肌膜中整聯蛋白的降解使肌原纖維和肌膜之間形成間隙[20-21]。因此,肌纖維與肌膜之間間隙的形成除了受肌原纖維蛋白降解的影響之外,可能還與成熟后期整聯蛋白的降解有關。
由于水分主要儲存于肌肉結構中,且微觀結構的變化主要由結構蛋白的降解引起,因此,測定蛋白降解情況對于研究肉品保水性十分重要,而蛋白溶解度是衡量蛋白降解程度的重要指標。肌肉中的蛋白根據溶解性可分為水溶性蛋白、低鹽溶性蛋白及高鹽溶性蛋白,其中,水溶性蛋白與低鹽溶性蛋白均屬于肌漿蛋白,包括肌紅蛋白、糖酵解酶、三羧酸循環酶、氧化磷酸化酶等[22];高鹽溶性蛋白屬于肌原纖維蛋白,包括肌球蛋白、肌動蛋白、原肌球蛋白、肌聯蛋白等[23]。如圖4A所示,灘羊背最長肌總可溶性蛋白質量濃度隨成熟時間延長由28.01 μg/μL降至19.92 μg/μL(P<0.05),可能是內源酶降解蛋白所致。如圖4B、C所示,水溶性蛋白質量濃度在成熟0~2 d變化不顯著(P>0.05),第8天時顯著降至2.09 μg/μL,低鹽溶性蛋白在成熟0~8 d期間持續下降至2.14 μg/μL,可能是因為隨著pH值的下降及成熟時間的延長,內源酶逐漸變性所致;如圖4D所示,高鹽溶性蛋白質量濃度在宰后成熟過程中呈顯著下降趨勢,由13.82 μg/μL降低至9.96 μg/μL,表明肌原纖維蛋白在整個成熟期內均發生降解。
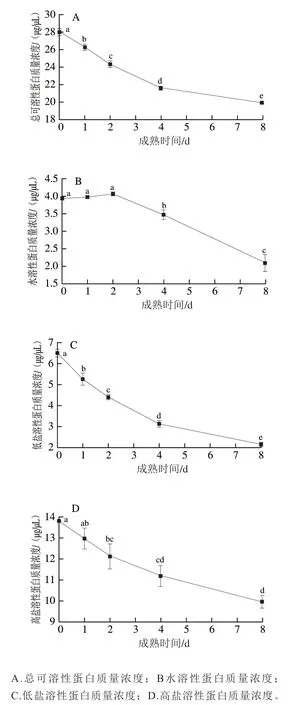
圖4 灘羊肉宰后成熟期間蛋白質溶解度的變化Fig. 4 Variation in protein solubility of Tan sheep meat during postmortem aging
2.3 灘羊肉宰后成熟過程中ATPase及Caspase-3活力變化
如圖5所示,宰后灘羊背最長肌細胞中Na+-K+-ATPase相對活力整體呈先上升后下降的趨勢(P<0.05),成熟1 d時達到最高值,為0 d時的1.04 倍,8 d時降至最低,為0 d時的56%。Na+-K+-ATPase是哺乳動物細胞膜上進行離子轉運的跨膜載體蛋白,負責維持細胞膜內Na+/K+電化學梯度[24],且可以加速降解ATP。本研究結果顯示Na+-K+-ATPase活力于成熟1 d后顯著降低,表明灘羊肉肌細胞在1 d內可能啟動了離子交換系統,通過改變線粒體膜通透性啟動細胞凋亡影響Caspase-3活力。研究表明宰后成熟過程中,Na+-K+-ATPase啟動Na+與K+在線粒體膜、內質網膜兩側對向移動,激活Na+-H+、K+-H+交換系統,形成膜內外H+梯度差,從而改變線粒體膜通透性,釋放細胞色素c,啟動細胞凋亡[25]。此外,Na+-K+-ATPase有助于ATP水解,而ATP水解產物的積累可能也與成熟初期肌肉pH值的下降有關。Ca2+-ATPase介導Ca2+跨膜運輸,其活力在0~1 d顯著升高(P<0.05),并于1 d時升至最大值,為0 d的1.42 倍,1~2 d顯著下降(P<0.05),2~4 d有所回升,4~8 d又顯著降低(P<0.05)。宰后成熟初期Ca2+-ATPase活力顯著升高,表明成熟初期大量離子交換導致Ca2+-ATPase被激活,Ca2+被Ca2+-ATPase泵出,導致細胞內Ca2+超載,1~2 d內其活力下降可能與pH值的降低有關。Ca2+-ATPase活力于宰后1 d達到最大值,表明灘羊肉肌細胞在宰后1 d內可能由于Ca2+超載啟動了細胞凋亡級聯反應。王琳琳等[26]研究發現宰后12 h牦牛背最長肌中Ca2+-ATPase活力達到最大值,本研究結果與其不一致,可能是由于物種不同。
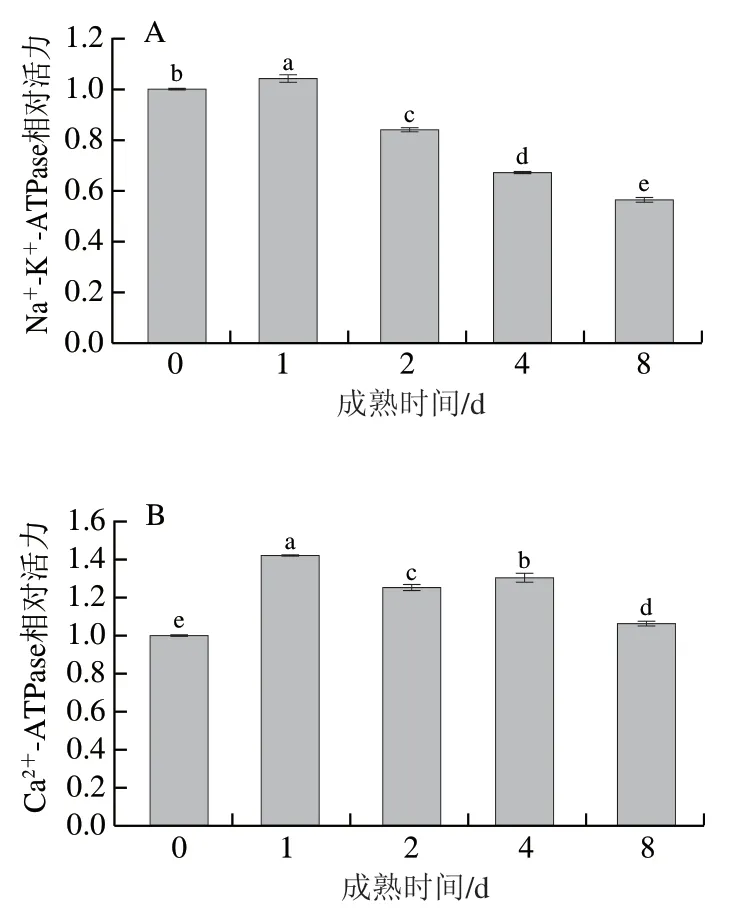
圖5 灘羊肉宰后成熟期間ATPase活力的變化Fig. 5 Variation in the activity of ATPase in Tan sheep meat during postmortem aging
如圖6所示,成熟0~2 d,Caspase-3活力顯著升高至最大值,為初始值的1.52 倍(P<0.05),2 d后其活力顯著降低(P<0.05),宰后8 d降至0 d時的1.19 倍。王琳琳[4]的研究結果表明宰后成熟7 d時牦牛背最長肌中Caspase-3活力高于0 d時,與本研究結果一致。Caspase-3活力的變化趨勢表明宰后2 d內灘羊肌細胞啟動了細胞凋亡,并激活了凋亡效應酶Caspase-3。動物宰后受缺血、缺氧信號的調節,肌肉中糖原分解、代謝物積累、ATP消耗,從而引起細胞凋亡,這一過程依賴于內源線粒體信號途徑[27]。牦牛肉在宰后成熟過程中活性氧的產生和Ca2+超載可能導致細胞色素c的釋放,從而激活Caspase-3[28-29]。本研究結果表明,宰后成熟初期肌細胞內Na+-K+-ATPase與Ca2+-ATPase活力變化可能引起了細胞內離子失衡及Ca2+超載,促使細胞色素c從呼吸鏈上游離并釋放至胞漿中,最終形成凋亡小體并激活下游Caspase-3。Caspase-3被認為有助于肌原纖維的水解,弱化Z盤與I盤的連接[7]。研究發現Caspase-3可以促進宰后成熟過程中西門塔爾牛肌肉中肌動蛋白、伴肌動蛋白和肌鈣蛋白-T的降解[30]。另外,酸化的細胞環境有利于維持Caspase-3活力[31],因此,成熟后期肌肉組織內間隙增多可能與Caspase-3降解結構蛋白有關,并且較低的肌肉pH值維持了較高的Caspase-3活力。
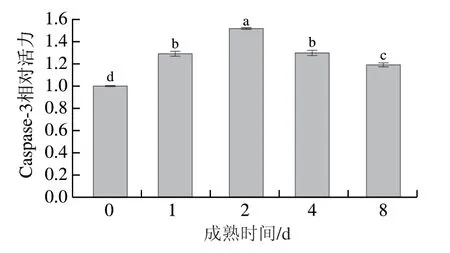
圖6 灘羊肉宰后成熟期間Caspase-3活力的變化Fig. 6 Variation in the activity of caspase-3 in Tan sheep meat during postmortem aging
2.4 宰后成熟期間ATPase在灘羊肉保水性變化中的作用
對灘羊肉宰后成熟期間肌肉pH值、滴水損失率及Na+-K+-ATPase、Ca2+-ATPase、Caspase-3活力進行相關性分析,由表1可知,灘羊肉滴水損失率與肌肉pH值呈極顯著負相關(P<0.01),與Na+-K+-ATPase及Caspase-3活力均呈極顯著正相關(P<0.01);灘羊肉pH值與Na+-K+-ATPase、Ca2+-ATPase及Caspase-3活力均呈極顯著負相關(P<0.01)。Caspase-3活力與Na+-K+-ATPase及Ca2+-ATPase活力均呈極顯著正相關(P<0.01)。相關性分析結果表明,Na+-K+-ATPase與Ca2+-ATPase活力的變化會影響肌細胞內Caspase-3活力,進而調控肌原纖維蛋白的水解過程,影響肌肉結構的完整性,最終影響肉的保水性。而肌肉pH值與Na+-K+-ATPase、Ca2+-ATPase及Caspase-3活力均呈極顯著負相關,可能是因為能量效應酶與宰后細胞內代謝相關,影響肌肉pH值下降的速率與程度,反之,pH值又會影響酶活性。Ca2+-ATPase活力與滴水損失率無明顯相關性可能是由于Ca2+-ATPase通過影響肌肉pH值間接影響灘羊肉的保水性。

表1 灘羊肉Na+-K+-ATPase、Ca2+-ATPase、Caspase-3活力及pH值、滴水損失率的相關性Table 1 Correlation between activities of Na+-K+-ATPase, Ca2+-ATPase and caspase-3 and drip loss rate in Tan sheep muscle
3 結 論
灘羊肉4 ℃成熟過程中Na+-K+-ATPase與Ca2+-ATPase活力均先升高后降低,并于1 d時達到最大值;Caspase-3活力先升高后降低,2 d時達到最大值;滴水損失率先升高后降低,肌肉pH值先降低后有所回升;總蛋白、低鹽溶性蛋白及高鹽溶性蛋白質量濃度均逐漸減少,水溶性蛋白質量濃度于成熟2 d后顯著降低;成熟至8 d時,肌原纖維斷裂,肌纖維之間、肌束之間、肌纖維及肌膜之間形成間隙,Z線斷裂、H帶消失。灘羊肉宰后成熟過程中Na+-K+-ATPase與Ca2+-ATPase活力變化可能促使下游Caspase-3激活;肌肉pH值的降低可能使Caspase-3活力維持在較高的水平;Caspase-3水解結構蛋白促使肌肉組織在不同部位形成間隙;在重力作用下肌肉中的水分流入結構蛋白降解所形成的間隙中,引起灘羊肉滴水損失率升高,致使灘羊肉的保水性變差。

