固相萃取-液相色譜/串聯質譜法測定靜寧燒雞中14種雜環胺含量
田鑄,陳敬敬,張丹,張珍,陳騁,師希雄*
1(甘肅農業大學 食品科學與工程學院,甘肅 蘭州,730070)2(甘肅農業大學,甘肅省干旱生境作物學重點實驗室,甘肅 蘭州,730070)
傳統燒雞風味獨特、營養全面,深受當地消費者的青睞。燒雞制作一般經過生雞預處理、整形、油炸、鹵煮等工藝[1-2]。靜寧燒雞有別于傳統燒雞,作為甘肅百年老字號,其主要使用陳年老鹵湯鹵煮,鹵制過程中老湯賦予雞肉獨特的風味[3]。由于鹵煮時間長,加之老湯重復使用,靜寧燒雞中可能會產生一定量的雜環胺(heterocyclic aromatic amines,HAAs)[4]。HAAs是由富含蛋白質的食品經過熱加工由蛋白質、氨基酸熱解產生的一類具有多環芳香族結構的致癌致突變化合物[5-6]。HAAs能夠誘導人體發生氧化應激,以及細胞生物活性功能損害,最終增加人體慢性疾病發生的概率[7]。因此,有必要研究靜寧燒雞中HAAs的檢測方法。
肉制品中由于HAAs含量低(ng/g)、種類多,且成分復雜,因此準確定量肉制品中的每種HAAs化合物及其困難[8]。此外,HAAs類化合物水溶性強,揮發性低,有部分HAAs缺乏紫外生色團結構,還有部分HAAs沒有熒光特性,如何快速、準確、高效檢測并定量HAAs一直是近幾年研究的熱點[9-10]。目前,我國發布的關于食品中HAAs含量檢測標準僅有GB 5009.243—2016 《食品安全國家標準 高溫烹調食品中雜環胺類物質的測定》,其主要適用于烤魚、烤肉及其制品中5種HAAs的測定。2021年11月由中國農業農村部發布的NY/T 3904—2021 《肉及肉制品中雜環胺檢測液相色譜-串聯質譜法》主要適用于肉及肉制品中13種HAAs的測定。我國現階段對于食品中HAAs的限量標準還尚未建立,同時也缺乏對醬鹵肉制品中的HAAs專一的測定方法研究。
目前,食品中檢測HAAs的方法主要有氣相色譜(gas chromatography,GC)、氣相色譜-質譜聯用(gas chromatograph-mass spectrometer,GC-MS)、液相色譜(liquid chromatograph,LC)、液相色譜-質譜聯用(liquid chromatograph mass spectrometer,LC-MS)等[11-13]。由于HAAs大多不具有揮發性,應用GC或GC-MS方法檢測,須先將其衍生為揮發性物質再進行檢測,而目前衍生化技術操作繁瑣,檢測靈敏度較差,限制了上述檢測方法的普及[14]。LC-MS靈敏度高,選擇性強,是當前用于測定HAAs的首選方法[15]。
李可等[7]采用LC-MS技術對醬鹵雞腿老湯中的HAAs進行檢測。結果表明,10種HAAs標準品在2~200 μg/L線性范圍良好,在不同濃度標準品的添加水平下回收率為55.6%~100.2%。魏晉梅等[16]建立了LC-MS快速檢測醬鹵肉制品中5種HAAs的方法,5種HAAs的加標回收率為76.9%~127.7%,檢出限為0.01~0.1 μg/kg,定量限為0.025~0.25 μg/kg,能滿足醬鹵肉制品中HAAs的檢測需求。目前采用LC-MS檢測靜寧燒雞中HAAs的方法未見文獻報道。因此,本文旨在通過固相萃取-液相色譜/質譜法(solid-phase extraction-liquid chromatography mass spectrometry,SPE-LC/MS)建立靜寧燒雞中14種HAAs的檢測方法,以便為HAAs控制研究奠定理論基礎。
1 材料與方法
1.1 材料與儀器
標準品:Harman(1-甲基-9 H-吡啶并[3,4-b]吲哚)、Norharman(9 H-吡啶并[3,4-b]吲哚)、PhIP(2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶)、Trp-P-1(3-氨基-1,4-二甲基-5 H-吡啶并[4,3-b]吲哚)、Trp-P-2(3-氨基-1,4-二甲基-5 H-吡啶[4,3-b]吲哚乙酸)、MeIQx(2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉)、4,8-DiMeIQx(2-氨基-3,4,8-三甲基咪唑并[4,5 -f]喹喔啉)、AαC(2-氨基-9 H-吡啶并[2,3-b]吲哚)、IQ(2-氨基-3-甲基咪唑并[4,5-f]喹啉)、Glu-p-1(2-氨基-6-甲基二吡啶并[1,2-a:3′,2′-d]咪唑)、IQx(2-氨基-3-甲基咪唑并[4,5-f]喹喔啉)、7,8-DiMeIQx(2-氨基-3,7,8-三甲基咪唑并[4,5-f]喹喔啉)、DMIP(2-氨基-1,6-二甲基咪唑并[4,5-b]吡啶)、MeIQ(2-氨基-3,4-二甲基咪唑并[4,5-f]喹喔),純度均不低于99.9%,加拿大Toronto Research Chemicals公司;乙酸乙酯、甲醇、乙腈、甲酸、二氯甲烷均為色譜純,天津市科密歐化學試劑有限公司。
樣品采集:靜寧燒雞購買自甘肅靜寧縣燒雞店。肉樣采集后,將雞胸部位雞肉與雞皮分開,分別用組織搗碎機搗碎成肉糜,在-18 ℃下保存待用。
LC-MS/MS Agilent 1290—6460液相色譜串聯三重四極桿質譜儀,配有電噴霧離子源(electrospray ionization,ESI),美國安捷倫公司;RE-52C旋轉蒸發儀,鄭州市亞榮儀器有限公司;FSH-2A型可調高速勻漿機,江蘇省金壇市友聯儀器研究所;TGL-16MC型冷凍離心機,湖南湘儀集團;KH3200B型超聲波清洗器昆山禾創超聲儀器有限公司;Milli-Q超純水系統,Millipore公司;固相萃取柱Cleanert PS(500 mg/6mL)、Cleanert MCX(500 mg/3mL)、Strata-X(500 mg/3mL)、Cleanert PRS(500 mg/3mL)、Cleanert S C18(500 mg/6mL),天津博納艾杰爾科技有限公司。
1.2 實驗方法
1.2.1 標準溶液的配制
準確稱取14種HAAs標準品各5 mg,標準品用甲醇溶解,并在棕色容量瓶中定容至50 mL,配制成質量濃度均為100 mg/L的單標儲備液。按實際檢測要求,準確移取相同體積的各儲備液制備成混合標準品溶液,用甲醇將混標液分別稀釋成10、20、50、100、500 μg/L。所有的標準溶液保存在-18 ℃。
1.2.2 樣品前處理方法
樣品前處理根據董學文[11]的方法稍作修改。稱取2 g肉樣與10 mL乙酸乙酯和2 mL 1 mol/L的NaOH混合,在冰浴條件下均質30 s(10 000 r/min)后以6 000×g的轉速離心10 min。將上清液收集,沉淀按上述步驟重復提取2次并合并上清液。除去位于上清液下層的水溶液后,將上清液在旋轉蒸發儀中濃縮,濃縮完成后使用6 mL二氯甲烷重新溶解提取物。將5 mL二氯甲烷加入丙磺酸(propanesulfonic acid,PRS)柱使之活化,將提取物加入活化后的PRS柱中。隨后,依次加入4 mL 0.1 mol/L HCl,6 mL甲醇鹽酸混合液[V(甲醇)∶V(0.1 mol/L HCl)=1∶1]和2 mL蒸餾水洗脫PRS柱,收集含有非極性HAAs的部分。將收集的洗脫液加入0.26 mL氨水后,將其加入活化后的C18柱中(活化:2 mL甲醇、5 mL蒸餾水)。仍然留在PRS柱中的極性雜環胺使用20 mL 0.5 mol/L乙酸銨(pH 8.5)洗脫。最后,吸取溶液1.5 mL[V(甲醇)∶V(氨水)=19∶1]分別沖洗2個C18柱。將收集的3 mL洗脫液通過0.22 μm有機濾膜后收集,待LC-MS上機檢測。
1.3 檢測條件
1.3.1 色譜條件
色譜柱:ZORBAX Eclipse XDB-C18色譜柱(150 mm×2.1 mm,5 μm),柱溫35 ℃,流動相A為0.1%(體積分數)甲酸水溶液,流動相B為甲醇-0.1%(體積分數)甲酸,流速0.3 mL/min,進樣量2 μL,梯度洗脫程序見表1。
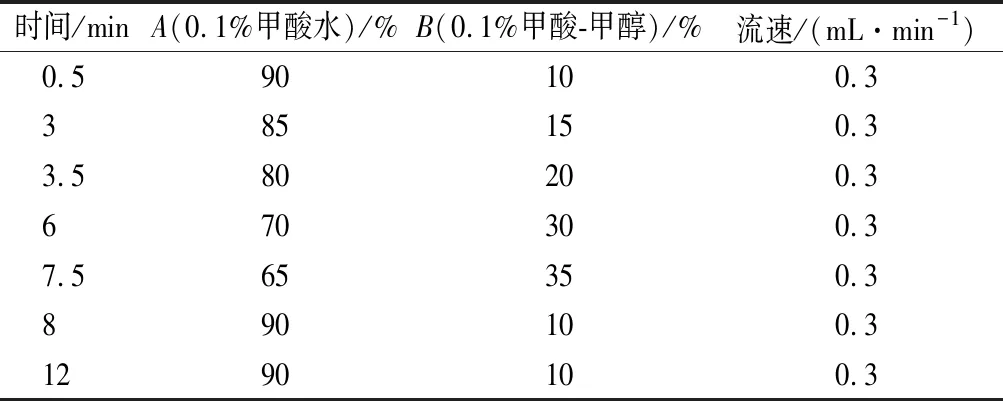
表1 十四種HAAs分離的梯度洗脫程序Table 1 Gradient elution program for 14 kinds of HAAs
1.3.2 質譜檢測條件
質譜檢測條件參考魏晉梅等[16]的方法并做修改。電噴霧離子源(ESI),正離子掃描、多反應監測(multiple reaction monitoring,MRM)模式;毛細管電壓+ 3.2 kV;錐孔電壓+1 kV;離子源溫度120 ℃;脫溶劑溫度350 ℃;噴霧氣為氮氣(0.31 MPa);載氣流速10 L/min,350 ℃;鞘氣流速11 L/min,350 ℃;脫溶劑氣流速500 L/h;錐孔反吹氣流速50 L/h;質量掃描范圍(m/z):80~1 000;掃描時間0.05 ms,其他質譜信息見表2。
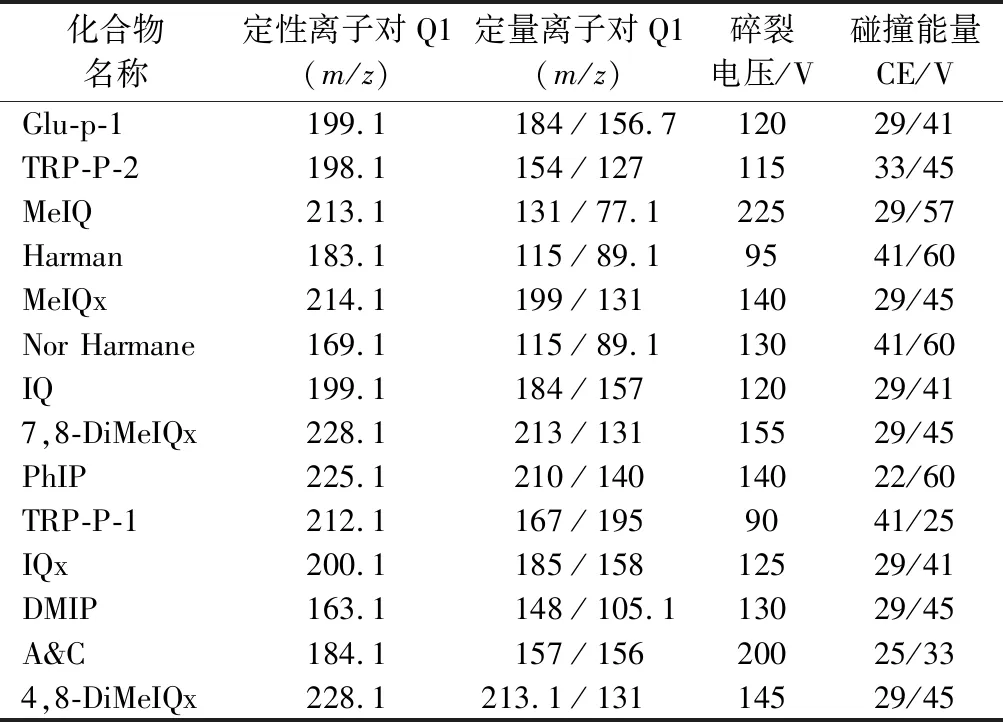
表2 十四種HAAs優化的特征離子與質譜參數Table 2 MS parameters of the characterization of14 HAAs
1.4 方法學評價
本研究對LC-MS檢測方法線性范圍、檢測限(limit of detection,LODs)、定量限(limit of quantita- tion、LOQs)、加標回收率、精密度等方法學參數進行分析。HAAs加標回收率:在靜寧燒雞空白樣品中添加20、50、100 μg/L 3個濃度的HAAs混合標準溶液,按照1.2 和1.3節方法檢測分析,計算回收率和精密度。以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)為該方法對各種HAAs的LODs和LOQs,單位為ng/g。
1.5 數據分析
采用儀器自帶的Agilent MassHunter軟件對LC- MS所得的數據進行采集和峰面積積分處理。試驗數據使用SPSS 20.0試驗統計軟件對數據進行顯著性分析(P<0.05),并使用Origin 2017作圖,每組試驗重復3次。
2 結果與分析
2.1 質譜條件的優化
取質量濃度為1 μg/mL的14種HAAs標準品在LC-MS上以0.3 mL/min的流速進樣,調節毛細管電壓和碰撞電壓,考察14種HAAs標準品最佳的質譜條件。由于HAAs中含有氨基和亞氨基,根據其電離特性,本研究選擇正離子模式進行檢測[17]。通過LC-MS自帶的Masslynx 4.1自動調諧功能進行調諧,分別對14種HAAs的MRM參數進行優化。在MRM模式下,質譜通常通過篩選目標化合物的母離子和定量離子來定性并且定量待測化合物,以提高質譜檢測的選擇性和靈敏度。因此,基于肉樣品基質的復雜性,為更好地對靜寧燒雞中痕量HAAs進行檢測,本研究通過比較各定性定量碎片離子所產生的質譜信號的強弱,選擇相對豐度最高的離子碎片作為定量離子,14種HAAs的定性與定量特征離子及優化的質譜參數見表2。
2.2 色譜條件的優化
2.2.1 色譜柱的選擇
反相色譜柱是LC-MS/MS分析中最常用的柱子,實驗選取了ZORBAX Eclipse XDB-C18色譜柱,對比了兩種規格(150 mm×2.1 mm,5 μm)、(50 mm×2.1 mm,5 μm)對14種HAAs實際分離效果,結果表明,50 mm規格的色譜柱響應值低、峰形不能區別開,150 mm的色譜柱具有良好的分離效果,可供檢測14種HAAs。
2.2.2 流動相的選擇
流動相的比例能夠在一定程度影響目標化合物在色譜柱上的分離和保留行為。14種HAAs大多為弱堿性化合物,其在流動相中的分離能力和溶解性因流動相的變化而變化。在流動相中添加有機酸類溶液如甲酸、甲酸銨和乙酸銨等能夠提高HAAs的離子化效率,改善峰形,提高檢測的靈敏度[10]。根據LC-MS儀器自身條件的局限,本研究分別考察了甲醇、乙腈、0.1%甲酸水、甲酸銨(2.5、5、10 mmol/L)對14種HAAs分離效果的影響,同時還對有機相中添加甲酸進行研究,結果發現,0.1%甲酸水和甲醇-0.1%甲酸作為流動相進行梯度洗脫時,色譜峰峰形尖銳,對稱性好,在12 min內能夠完全快速分離HAAs,因此,本研究選取0.1%甲酸水和甲醇-0.1%甲酸作為流動相條件。
2.2.3 柱溫的選擇
柱溫箱能夠通過調控溫度維持色譜柱的穩定性,有利于色譜峰分離的程度,確保待測化合物檢測結果的準確性和重現性。為此,本研究考察了不同的柱溫箱溫度(25、30、35、40 ℃)對14種HAAs標準品的分離效果。結果表明在35 ℃條件下,14種HAAs混標峰形尖銳,分離度好,并且具有較高的響應值,因此,本研究將柱溫箱溫度設定為35 ℃進一步研究。
2.3 樣品前處理條件的優化
2.3.1 固相萃取柱的選擇
不同的提取溶劑所得的提取液往往會產生不同程度的基質干擾,影響定量的準確性。因此,在優化提取方法的同時,必須選擇與之配套的固相萃取條件[18]。如圖1所示,基于檢測樣品可能存在的基質差異,本研究分別對比了PS、MCX、Strata-X、PRS 4種固相萃取柱與C18固相萃取柱串聯使用來選擇回收率最高的固相萃取柱。結果表明,當PRS固相萃取柱與C18柱串聯使用其加標回收率顯著高于其他3種串聯使用的固相萃取柱,這可能是由于PRS柱中的填料丙磺酸鍵合硅膠對弱堿性化合物HAAs具有良好的保留能力。因此本研究選用PRS柱(60 mg/3mL)與C18柱進行富集、凈化。
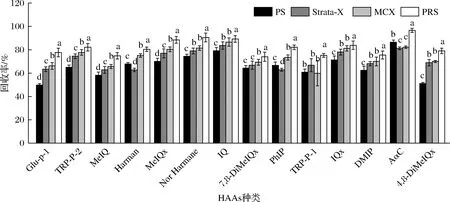
圖1 固相萃取柱種類對HAAs回收率的影響Fig.1 Influences of different solid phase extraction columns on recoveries of HAAs注:不同小寫字母表示差異顯著(P<0.05)(下同)
2.3.2 提取溶劑的選擇
HAAs屬于堿性有機化合物,其親水性或疏水性取決于所處介質的酸堿性,當pH <3時,HAAs上的氨基帶正電荷,使其表現為親水性,隨后,HAAs隨著所處介質pH的升高逐漸表現出疏水性[11]。因此在靜寧燒雞肉樣提取HAAs的過程中先用NaOH堿化處理后,再通過有機溶劑進行提取。HAAs化合物在有機溶劑和水中均可以溶解,如圖2所示,本研究考察了二氯甲烷、乙酸乙酯、甲醇及乙腈作為提取溶劑并加入NaOH溶液(1 mol/L)進行提取時的加標回收率。結果表明,二氯甲烷由于密度較大,與肉樣均質混合離心后分層效果不明顯,乙腈提取回收率較低且不易揮發,用乙酸乙酯提取時大部分HAAs化合物的回收率顯著高與其他的提取溶劑,且在濃縮時揮發速度快,對人體危害較小。因此,本試驗確定乙酸乙酯作為HAAs的提取溶劑。
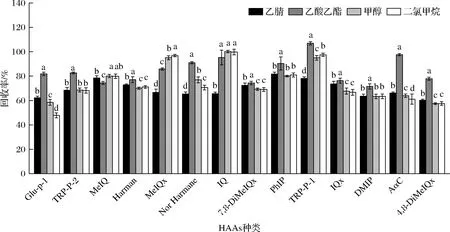
圖2 提取溶劑種類對HAAs回收率的影響Fig.2 Influences of different extraction solvents on recoveries of HAAs
2.3.3 PRS柱洗脫液比例的選擇
本研究主要是檢測靜寧燒雞中的HAAs,而靜寧燒雞中主要在100 ℃以下的鹵湯中熟制,其主要存在非極性HAAs,因此本試驗對非極性HAAs的洗脫過程進行優化。PRS柱作為強陽離子極性交換柱,乙酸乙酯將HAAs溶解后通過該固相萃取柱,從而將HAAs吸附在丙基磺酸鈉中,此時為正相萃取模式,而試驗中的非極性HAAs要想被洗脫下來必須在反相洗脫條件下,因此要先用鹽酸淋洗轉換洗脫模式,再以甲醇/鹽酸洗脫得到非極性HAAs[11]。本試驗分別采用2、3、4、6 mL鹽酸(0.1 mol/L)以及3、5、6、9 mLV(甲醇)∶V(鹽酸)=1∶1對固相萃取柱進行洗脫,對比其回收率,如圖3所示。結果表明,洗脫液為4 mL鹽酸和6 mL甲醇/鹽酸時HAAs的回收率達到最高,隨著添加比例加大,部分HAAs的回收率反而有所降低,這可能是由于洗脫液體積過多,導致在C18柱中洗脫時不能很好保留而被損失。因此本試驗在洗脫過程以4 mL鹽酸和6 mL甲醇/鹽酸對PRS柱進行洗脫,以便進一步優化。
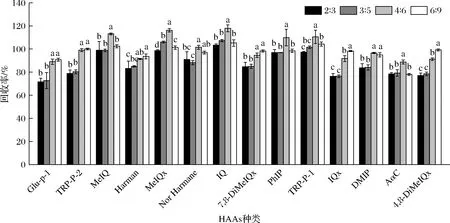
2∶3、3∶5、4∶6、6∶9為鹽酸∶甲醇/鹽酸(體積比)圖3 PRS柱洗脫液比例對HAAs回收率的影響Fig.3 Influences of different eluent ratio of PRS solid phase extraction column on recoveries of HAAs
2.3.4 C18柱洗脫液種類的選擇
洗脫液是影響凈化效果和回收率的重要因素,如圖4所示,本研究考察了二氯甲烷-氨水、甲醇-氨水、二氯甲烷以及甲醇對HAAs回收率的影響,結果表明,氨水作為堿性溶液與甲醇結合用作洗脫液洗脫后的雜質較少,且回收率顯著高于其他3種洗脫液。因此,本研究以V(甲醇)∶V(氨水)=19∶1作為C18固相萃取柱的洗脫液。
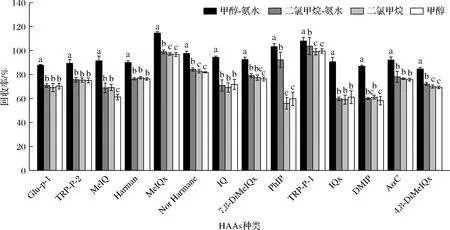
圖4 C18柱洗脫液種類對HAAs回收率的影響Fig.4 Influences of different C18 solid phase extraction column eluent on recoveries of HAAs
2.4 方法學評價
2.4.1 標準曲線、方法的檢出限和定量限
以各種HAAs的濃度為橫坐標,峰面積為縱坐標繪制標準曲線,其線性關系如表3。結果顯示,各HAAs標準曲線的決定系數r2均大于0.999,各組化合物在1~500 μg/L范圍內線性良好,可以滿足定量分析的需要。
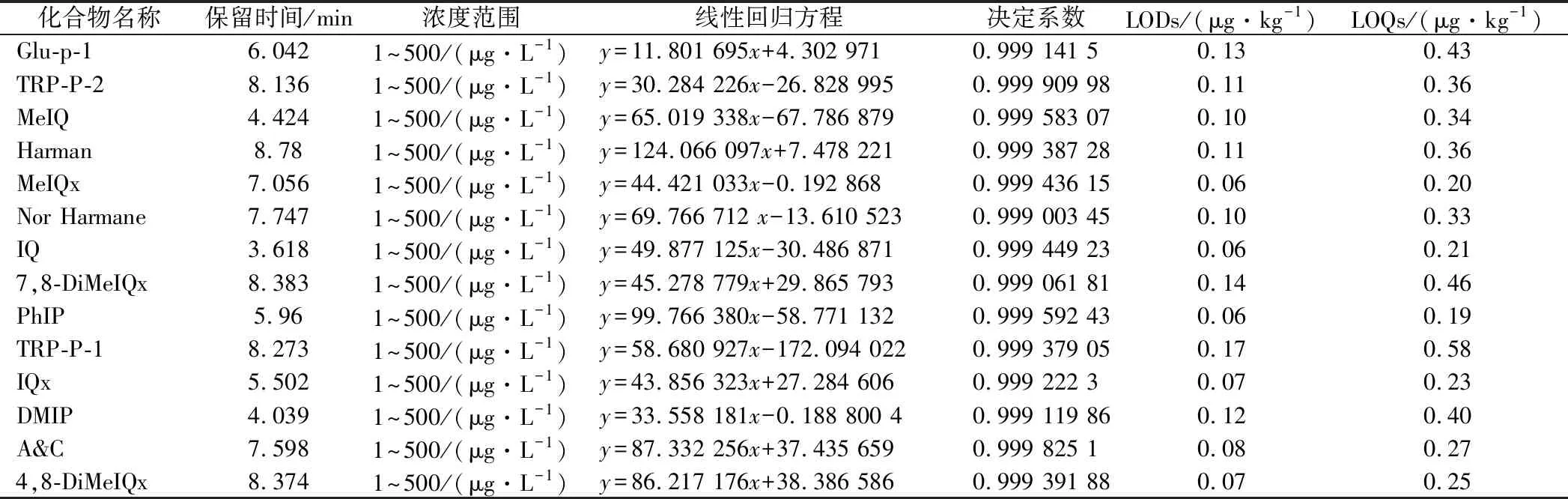
表3 十四種HAAs的線性范圍、回歸方程、決定系數及檢測限Table 3 Linear ranges,regression equations,correlation coefficients(r2),limits of detection and quantitation of 14 HAAs
2.4.2 回收率和精密度
回收率采用在不含待測組分的空白肉樣中添加測定,添加3個質量濃度水平(20、50、100 μg/L)100 μL體積混合標準液,每個水平重復測6次,結果見表4,結果表明,14種HAAs的加標回收率為83.04%~103.78%,相對標準偏差均低于10%,精密度良好,能夠滿足靜寧燒雞中HAAs含量的檢測要求。
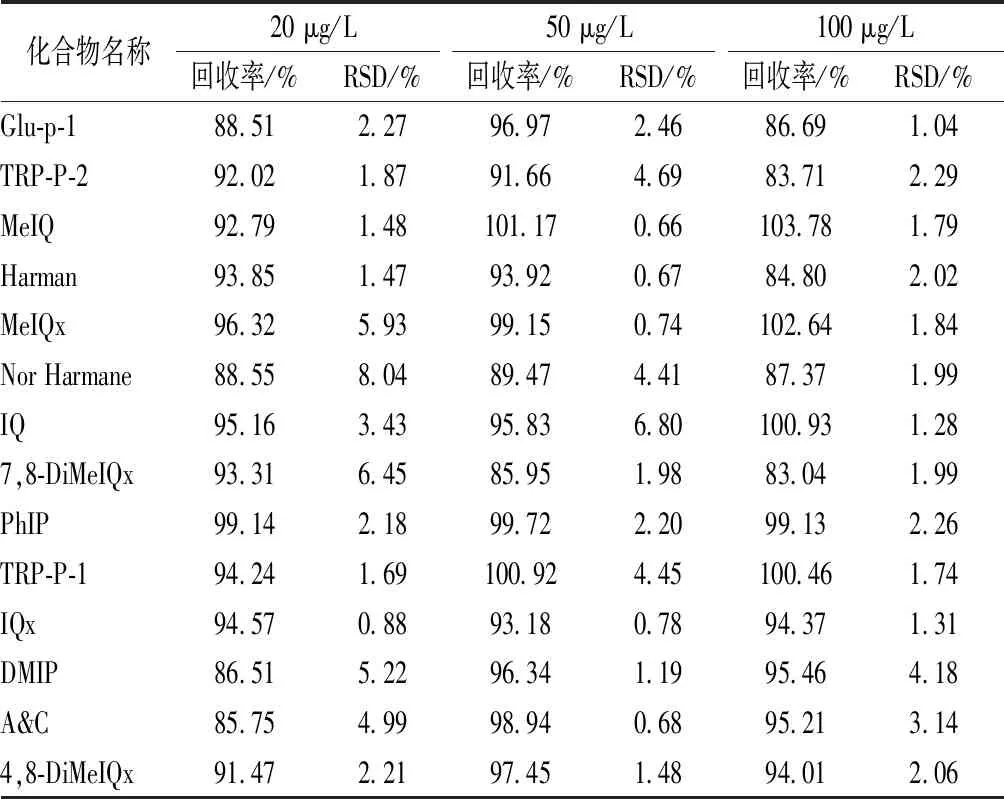
表4 十四種HAAs的回收率和精密度(n=6)Table 4 Recoveries and precisions of14 HAAs in meat samples(n=6)
2.5 實際樣品分析
采用上述優化出來的HAAs檢測方法對3家燒雞店靜寧燒雞中的HAAs進行檢測,結果如表5所示。結果表明,靜寧燒雞中共檢測出9種HAAs,3家燒雞的HAAs總量為8.38~12.35 ng/g。李可等[7]通過檢測市售傳統肉制品中4種HAAs的含量發現,醬鹵雞肉HAAs總量在2.53~3.65 ng/g,邵斌[19]采用優化后的HAAs檢測方法對國內6種燒雞中的HAAs進行檢測,結果表明HAAs總含量高達108.84 ng/g。本試驗結果與上述研究報道相近,靜寧燒雞中HAAs含量的生成可能是由于鹵煮過程中鹵湯的反復使用以及添加醬油導致的。

表5 不同購買來源靜寧燒雞中HAAs的含量 單位:ng/g
3 結論
以靜寧燒雞中雞皮和雞肉作為檢測樣本,優化和選擇了SPE-LC/MS對14種HAAs檢測的儀器參數和樣品前處理方法。該方法線性關系良好,加標回收率為83.04%~103.78%,相對標準偏差為0.42%~7.66%,且前處理提取HAAs操作簡單,用時較短,安全性較高,檢測儀器LC-MS的靈敏性強,定量準確,應用范圍廣,能夠滿足靜寧燒雞中HAAs的檢測要求,可為靜寧燒雞中HAAs的形成規律以及控制等相關研究提供理論基礎。

