適應性治療策略的研究進展*
房凌旭 楊麗娜 江 川 盧中一 李 艷
1 廣東省深圳市前海蛇口自貿區醫院口腔科 518067; 2 深圳大學高等研究院深圳市海洋微生物組工程重點實驗室
適應性治療策略(Adaptive therapy)是一種基于演化博弈理論(Evolutionary game theory)提出的新型治療理念,其初衷是為了解決或緩解在臨床上化學藥物療法治療癌癥的后期,癌組織迅速產生的藥物耐受問題[1-2]。不同于常規的持續可耐受最大劑量(Maximum tolerated dose)給藥模式,適應性治療通過間隔性可調劑量的給藥模式在不引起癌細胞群體迅速演化出耐藥表型的前提下,將患者的腫瘤負荷控制在較低水平,從而盡可能提高患者生存率并改善其生存質量[3]。本文將從理論基礎和實驗模型等方面介紹適應性治療策略的研究進展,并進一步探討該治療策略在臨床中的應用前景。
1 適應性治療策略的理論基礎
演化博弈理論主要源于Neumann等人在20世紀50年代提出了解釋社會經濟學問題的博弈理論[4],由Smith等[5]將其應用于解釋生物的動態演化框架中的博弈和生存策略問題;隨后,Tomlinson等[6]進一步將演化博弈理論引入到癌治療領域,探討了癌的異質性在癌演化中的潛在作用。即認為癌中的細胞群體往往具有不同的遺傳特性,因而可分化為具有不同的代謝特征的細胞亞群;并且這些無限增殖的癌細胞亞群在相對有限的組織環境中會產生競爭和合作等多種博弈行為,而這些博弈行為最終決定了癌發生及發展路徑[7]。例如,Kaznatchev等[8]在體外構建了分別對艾樂替尼(Alectinib)敏感和耐受的非小細胞肺癌細胞博弈模型,并發現通過添加艾樂替尼或癌相關成纖維細胞(Cancer-associated fibroblasts)等方式改變培養條件,對共培養的上述兩種非小細胞肺癌細胞生長率有明顯影響,提示不同治療方式可顯著干預癌中不同細胞亞群的生長特點,從而改變腫瘤對藥物的響應程度。
癌細胞群體對抗癌化學藥物通常可分為藥物敏感性亞群和藥物耐受性亞群。其中對抗癌藥物耐受的癌細胞亞群產生于固有性耐藥或獲得性耐藥;例如,臨床上20%~30%的EGFRm+非小細胞肺癌對表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKIs)具有固有耐藥性;此外,癌細胞具有遺傳不穩定性特點,因而在藥物壓力下極易產生耐藥性,例如藥物壓力誘導MET的擴增也可導致對EGFR-TKIs產生獲得性耐藥[9-11]。此外,現有研究認為,相比于藥物敏感性癌細胞亞群,藥物耐受癌細胞在細胞代謝等方面通常需要更多的“代償(trade-offs)”效應來維持耐藥特征,因而其在生長和增殖方面具有劣勢[12-13]。因此,在常規治療方案中,持續高劑量的化學藥物壓力將使癌組織中的藥物耐受癌細胞亞群將迅速獲得選擇優勢,這些優勢體現在:(1)藥物耐受癌細胞亞群的生存競爭者消失;(2)藥物耐受癌細胞亞群獲得了更多的資源和生存空間。而以上情況最終導致了臨床治療后期出現的癌耐藥問題。
針對以上問題,適應性治療作為一種新型的癌治療備選方案被提出[1]。其理論基礎包括(見圖1):(1)在抗癌化學藥物壓力下,癌細胞群的異質性使其分化為藥物敏感性癌細胞亞群和藥物耐受性癌細胞亞群(或存在的固有耐藥性);(2)由藥物耐受性產生的“代償效應”將削弱癌細胞在無藥物壓力下的生存競爭力;(3)通過間隔性和適當的藥物壓力可維持藥物敏感性癌細胞亞群相對于藥物耐受性癌細胞亞群的競爭優勢,從而抑制癌組織整體發展路徑,最終延緩或控制患者的腫瘤負荷的發展。
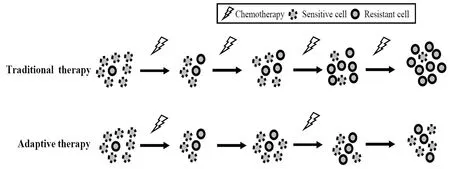
圖1 癌癥治療中的適應性治療策略與常規治療策略
2 適應性治療策略的論證
早期的適應性治療策略的論證包括模擬計算和實驗研究。例如,Gatenby等通過數學模型分析發現,當癌組織中細胞以藥物敏感性亞群為主時,常規化學治療癌策略中使用的可耐受最大劑量可在初期迅速清除癌細胞,并可減少癌組織體積。但當藥物敏感性亞群消失后,如果藥物耐受性亞群為“代償型”(比敏感性細胞需要更多底物或能量),其增殖率會明顯增強和產生的癌組織體積會增加。而上述情況在適應性治療策略下可得到緩解,并可明顯延長患者的存活時間;隨后該研究小組用OVCAR-3細胞在免疫缺陷小鼠體內進行了研究,論證了適應性治療策略在小鼠模型中的可行性[1]。
此外,Das Thakur等[14]在2013年的一項研究顯示,當使用黑色素瘤抑制劑維莫非尼(Vemurafenib)對模型小鼠進行間隔給藥后發現其生存時間是持續給藥組約2倍,其所在的研究小組推測這是由于藥物敏感細胞亞群維持了相對藥物耐受細胞亞群的種群優勢,從而預先阻止了具有致死性的藥物耐受細胞群的快速增殖。而在另一項研究中,Gallaher等利用人乳腺癌細胞MCBZ建立了癌細胞競爭模型,隨后通過實驗結果及數據計算指出常規治療方式只有在癌組織中不存在藥物耐受細胞亞群才可避免癌癥復發的可能,但通過引入適應性治療方式可以在較小藥物劑量下控制異質性腫瘤的發展[15]。
值得注意的是,除上述模擬計算和實驗研究外,Zhang等[16]發現通過在阿比特龍(Abiraterone)治療轉移性前列腺癌引入適應性治療策略,可以顯著減緩絕大多數受試者腫瘤負荷發展,使其中位無進展生存期由16.5個月延長至27個月,同時藥物使用劑量下降至常規治療方案的47%,因而從臨床實踐方面首次論證了適應性治療策略在治療癌癥中潛在的社會和經濟效益。
3 適應性治療策略的應用前景
適應性治療策略早期的提出,是為了提高癌癥患者的存活率并提高其生存質量[1]。現有研究認為,該策略在臨床中更適合治療轉移癌類的治療;這是因為在目前常規治療方案中,需要在最大可耐受劑量下不斷地施用單一藥物或聯用藥物進行治療,直至患者產生藥物毒性反應或癌癥惡化;但從演化博弈角度看,這種極易造成藥物耐受癌細胞亞群迅速產生選擇優勢的治療方案并不明智。此外,適應性治療策略也可被靈活應用;例如,Wang等發現由BRAF和MEK抑制劑在誘導黑色素瘤細胞產生耐受性的同時,其活性氧的水平明顯提高;因而在小鼠動物模型中,該研究小組在BRAF和MEK聯合給藥致使黑色素瘤細胞產生耐受性細胞亞群后便停止給藥,并嘗試替換組蛋白脫乙酰酶抑制劑伏立諾他(Vorinostat),使藥物耐受黑色素瘤細胞亞群死亡;他們據此推測,采用間隔性給藥方案可控制甚至消除所有黑色素瘤細胞[17]。但需要指出的是,由于癌細胞具有遺傳不穩定性,并非所有癌細胞在產生藥物耐受性均伴隨存在“代償效應”,因而適應性治療策略在臨床癌癥治療中的應用需進一步探討。
除應用于癌癥治療,適應性治療策略在感染治療中的前景也值得探討。現有研究認為,細菌產生的抗生素耐受等機制存在“代償效應”;例如,Basra等[18]分析了從臨床中分離到的39株大腸桿菌(Escherichia coli)生長速率后發現,這些大腸桿菌對抗生素的耐受強度與生長速率呈負相關,提示抗生素敏感菌群在無藥物壓力下對抗生素耐受菌群的生長優勢。此外,Blair等[19]發現鼠傷寒沙門氏菌(Salmonella Typhimurium)外排泵AcrB的G288D突變可導致對環丙沙星(Ciprofloxacin)耐受性明顯增強,但該突變同時導致菌株對米諾環素(Minocycline)等多種抗生素敏感性明顯升高,因而在臨床中可以利用細菌的這種“代償效應”設計更合理的抗感染方案。最近,Pinheiro等[20]基于理論模型探討了細菌多種抗生素耐受機制的“代償效應”,他們發現細菌的抗生素抗性機制往往導致細胞膜通透性改變和細胞靶點蛋白突變;此外,這些機制與細胞代謝紊亂具有潛在聯系,可能造成細菌在無抗生素壓力下生長速率的下降。由上所述,在臨床中抗感染治療時,常規的持續高劑量的給藥方式可能造成抗生素耐受菌群的選擇優勢;而采用適應性治療策略的間隔給藥方式可能會維持藥物敏感菌群相對于藥物耐受菌群的優勢,從而延緩或遏制在臨床治療過程中存在的細菌抗生素耐受現象的發展。
4 展望
隨著生物信息學、分子生物學和生物化學等技術的不斷發展,人們對生物學上的動態演化規律及群體的博弈行為有了更加深入的認識。這些認識也不斷指導人們在醫學、環境修復及工業生產中的實踐。在臨床上,持續高劑量給藥方式在治療腫瘤、感染等方面效果并不理想,其中重要原因是在治療后期迅速出現的細胞或微生物耐藥問題;而基于演化博弈理論提出的適應性治療為緩解或消除這種臨床耐藥現象提供了一種可能性。
目前的適應性治療方案論證主要基于模擬計算和實驗室研究,在臨床中的可行性仍需進一步探討,這是因為:(1)適應性治療策略的前提是癌細胞或病原微生物產生耐受性會出現“代償效應”,進而在無藥物壓力下相對于敏感細胞群或菌群有競爭劣勢,但是現有證據顯示并非所有的細胞或病原微生物耐藥機制均伴隨“代償效應”;(2)現有模擬計算和實驗研究條件較為單一,無法精確評估在復雜體內環境中的演化博弈行為;(3)不同藥物半衰期、人體因素和細胞(或病原微生物)等差異導致難以準確量化間隔給藥時間。因此,在未來的研究中,基于宏基因組技術、數據建模和動物實驗模型的綜合研究及臨床上數據分析可能是論證適應性治療策略的重要突破口。

