lncRNA KCNQ1OT1表達下調對高糖誘導腎小球系膜細胞增殖、凋亡及纖維化的影響
李佳,路華,王麗,李慶超,謝震,石紅光,李楠
1中國人民解放軍海軍第九七一醫院腎臟病科,山東青島 266071;2中國人民解放軍海軍第九七一醫院干部保健科
糖尿病腎病是糖尿病最常見的并發癥之一,20%~40%的糖尿病患者可合并糖尿病腎病。近年來,與糖尿病相關的終末期腎病已成為腎功能衰竭的重要原因,并嚴重影響糖尿病患者的生存和預后。現有臨床治療措施僅能部分延緩糖尿病腎病進程,但不能從根本上治愈。目前尚無更有效的檢測手段可以滿足糖尿病腎病早期診斷的需求,所以亟需發現新的標志物及治療靶點。KCNQ1OT1是一個位于KCNQ1位點的長鏈非編碼RNA(lncRNA),既往研究表明,KCNQ1OT1參與糖尿病視網膜病變、糖尿病心肌病變等病理過程,可能在糖尿病及糖尿病并發癥中起重要作用,但KCNQ1OT1在糖尿病腎病中的作用機制尚不明確。2020年12月—2021年12月,本課題組觀察了KCNQ1OT1在高糖誘導的腎小球系膜細胞中的差異表達情況,觀察KCNQ1OT1表達變化對高糖誘導的腎小球系膜細胞增殖、凋亡及纖維化的影響。現報告如下。
1 材料與方法
1.1 實驗細胞與主要材料小鼠腎小球系膜細胞株購于ScienCell公司。轉染試劑Lipofectamine3000購自Thermo Fisher公司。TRIzol、逆轉錄試劑盒和SYBR Green試劑購自TaKaRa公司。去內毒素質粒小提試劑盒購自Omega公司。胎牛血清購自上海生工生物工程股份有限公司。SDS-PAGE相關試劑及細胞裂解液、BCA蛋白定量試劑盒購自上海碧云天生物技術有限公司。PVDF膜購自美國Millipore公司。兔抗Notch1、Hes1、Bcl-2/Bax、纖連蛋白(FN)、Ⅰ型膠原蛋白(ColⅠ)、Ⅳ型膠原蛋白(ColⅣ)、β-actin均購自Abcam公司。
1.2 高糖誘導腎小球系膜細胞中KCNQ1OT1表達觀察將腎小球系膜細胞株HMCs接種于含10%胎牛血清的DMEM完全培養液中,置于5% CO2、37℃孵育箱中培養。將細胞分為高糖組、低糖對照組、高滲對照組。高糖組在高糖(30 mmol/L葡萄糖)DMEM培養基中培養,低糖對照組在低糖(5.5 mmol/L葡萄糖)DMEM培養基中培養,高滲對照組在含24.5 mmol/L甘露醇的低糖DMEM培養基中培養。培養24 h后,將細胞接種于6孔板,24 h后提取細胞RNA。采用qRT-PCR法檢測KCNQ1OT1。以GAPDH為內參。KCNQ1OT1上游引物序列為5'-CGTATAGGGTCCGCACATGG-3',下游引物序列為5'-TGTGGGACTGGAAGTGCTTG-3';GAPDH上游引物序列為5'-GAATGGGCAGCCGTTAGGAA-3',下游引物序列為5'-AAAAGCATCACCCGGAGGAG-3'。收集各組細胞,以TRIzol試劑提取總RNA,微量核酸測定儀檢測RNA純度,使用Primer-ScriptTM反轉錄試劑盒將RNA逆轉錄成cDNA,以cDNA為模板進行qRT-PCR反應。PCR反應條件:95℃10 min;95℃15 s、60℃30 s、72℃30 s,共40個循環。以2-ΔΔCt表示目的基因相對表達量。
1.3 KCNQ1OT1對高糖誘導腎小球系膜細胞增殖、凋亡及細胞纖維化的影響觀察
1.3.1 細胞分組與操作將HMCs細胞分為si-KCNQ1OT1組、NC組、HG組、NG組。si-KCNQ1OT1組、NC組、HG組細胞以高糖DMEM培養基培養,NG組以低糖DMEM培養基培養。si-KCNQ1OT1組、NC組培養24 h后,將細胞接種于6孔板,待75%~80%融合時,采用Lipofectamine3000分別轉染si-KCNQ1OT1(5'-AUAUAAAAGGCUAUUUGACCU-3')、si-NC(5'-AAGACAUUGUGUGUCCGCCTT-3'),5 h后換為含15%血清的培養基,24 h后提取細胞。
1.3.2 細胞增殖能力檢測調整細胞密度為1×104/mL,加入96孔板,每孔100μL,24 h后更換新培養液并加入0.5 mg/mL的MTT,4 h后加入100μL的DMSO,采用ELISA法檢測570 nm波長處的光密度(OD)值,表示細胞增殖能力。實驗重復3次。
1.3.3 細胞凋亡率測算按Invitrogen凋亡試劑盒說明書進行。將各組細胞以低血清培養基培養24 h,加入預冷的PBS洗滌2次,重懸于200μL的結合緩沖液中,調整細胞密度為1×106/mL。加入AnnexinV及10μL PI,37℃避光孵育15 min,緩沖液稀釋細胞,上流式細胞儀,用488 nm激發光檢測并計算細胞凋亡率。實驗重復3次。
1.3.4 細胞凋亡、纖維化相關蛋白及Notch信號通路相關蛋白檢測將各組細胞常規消化后,以蛋白裂解液重懸細胞,沉淀于冰上放置30 min,超聲破碎1 min,共5次,以12 000 r/min離心10 min,BCA試劑盒測定蛋白濃度,-70℃保存備用。將蛋白樣品進行SDS-PAGE電泳后轉至PVDF膜,5%脫脂奶粉封閉液室溫封閉1 h;分別加入兔抗Notch1、Hes1、Bcl-2、Bax一抗(1∶500稀釋),兔抗FN一抗(1∶200稀釋),兔抗ColⅠ一抗(1∶1 000稀釋),兔抗ColⅣ一抗(1∶2 000稀釋),內參β-actin(1∶5 000稀釋),孵育過夜,TBST洗膜;加入山羊抗兔IgG二抗(1∶2 000)孵育2 h,TBST洗滌;加入化學發光試劑反應5 min,用Bio-Rad凝膠成像檢測系統觀察并照相,分析灰度值。實驗重復3次。
1.4 統計學方法采用SPSS19.0統計軟件。符合正態分布的計量資料以±s表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 KCNQ1OT1在高糖誘導的腎小球系膜細胞中表達變化高糖組、低糖對照組、高滲對照組細胞中KCNQ1OT1相對表達量分別為2.90±0.27、1.01±1.10、0.99±0.07,高糖組KCNQ1OT1表達高于低糖對照組和高滲對照組(P均<0.05)。
2.2 si-KCNQ1OT1對高糖誘導腎小球系膜細胞增殖、凋亡及纖維化的影響
2.2.1 各組細胞增殖能力比較NG組、HG組、NC組、si-KCNQ1OT1組細胞OD值分別為1.01±0.09、1.56±0.09、1.54±0.11、1.16±0.06,HG組細胞增殖能力高于NG組,si-KCNQ1OT1組細胞增殖能力低于NC組(P均<0.05)。HG組與NC組差異無統計學意義。
2.2.2 各組細胞凋亡率及凋亡相關蛋白表達比較NG組、HG組、NC組、si-KCNQ1OT1組細胞凋亡率 分 別 為42.73%±3.25%、4.13%±0.57%、15.89%±1.18%、39.91%±1.37%,HG組細胞凋亡率低于NG組,si-KCNQ1OT1組細胞凋亡率高于NC組(P均<0.05)。HG組Bax蛋白表達低于NG組,Bcl-2蛋 白 表 達 高 于NG組(P均<0.05);si-KCNQ1OT1組Bax蛋白表達高于NC組,Bcl-2蛋白表達低于NC組(P均<0.05)。HG組與NC組Bcl-2、Bax蛋白表達差異無統計學意義。詳見表1。
表1 NG組、HG組、si-KCNQ1OT1組、NC組細胞中Bcl-2、Bax蛋白表達比較(±s)
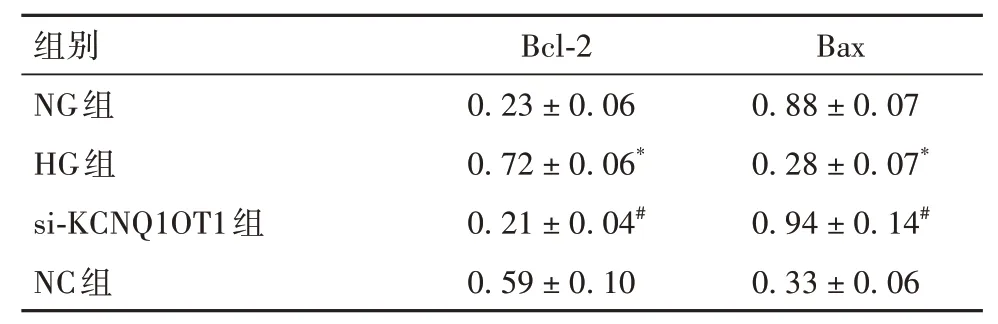
表1 NG組、HG組、si-KCNQ1OT1組、NC組細胞中Bcl-2、Bax蛋白表達比較(±s)
注:與NG組相比,P<0.05;與NC組相比,#P<0.05。
組別NG組HG組si-KCNQ1OT1組NC組Bcl-2 0.23±0.06 0.72±0.06*0.21±0.04#0.59±0.10 Bax 0.88±0.07 0.28±0.07*0.94±0.14#0.33±0.06
2.2.3 各組細胞纖維化相關蛋白表達比較HG組FN、ColⅠ、ColⅣ蛋白表達高于NG組,si-KCNQ1OT1組FN、ColⅠ、ColⅣ蛋白表達低于NC組(P均<0.05)。HG組與NC組FN、ColⅠ、ColⅣ蛋白表達差異無統計學意義。詳見表2。
表2 NG組、HG組、si-KCNQ1OT1組、NC組細胞中纖維化相關蛋白表達比較(±s)

表2 NG組、HG組、si-KCNQ1OT1組、NC組細胞中纖維化相關蛋白表達比較(±s)
注:與NG組相比,*P<0.05;與NC組相比,#P<0.05。
組別NG組HG組si-KCNQ1OT1組NC組FN 1.02±0.03 2.77±0.09*1.43±0.13#2.74±0.15 ColⅠ1.02±0.02 2.71±0.06*1.33±0.15#2.80±0.12 ColⅣ0.98±0.01 2.97±0.21*1.25±0.21#3.11±0.19
2.2.4 各組細胞Notch信號通路相關蛋白表達比較HG組Notch1、Hes1蛋白表達高于NG組,si-KCNQ1OT1組Notch1、Hes1蛋白表達低于NC組(P均<0.05)。HG組與NC組Notch1、Hes1蛋白表達差異無統計學意義。詳見表3。
表3 NG組、HG組、si-KCNQ1OT1組、NC組細胞中Notch1、Hes1蛋白表達比較(±s)
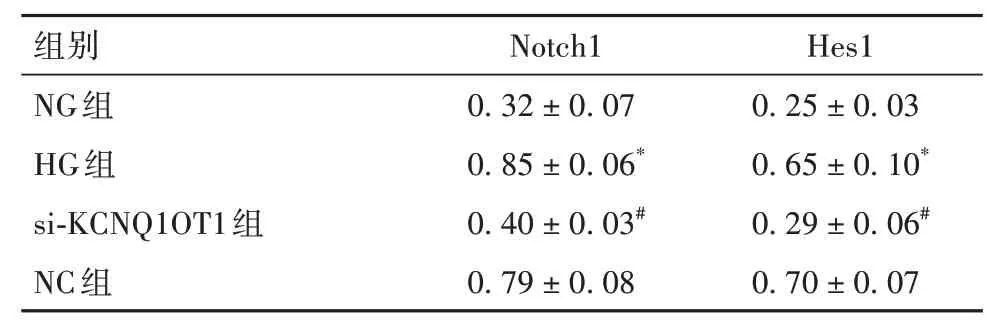
表3 NG組、HG組、si-KCNQ1OT1組、NC組細胞中Notch1、Hes1蛋白表達比較(±s)
注:與NG組相比,*P<0.05;與NC組相比,#P<0.05。
組別NG組HG組si-KCNQ1OT1組NC組Notch1 0.32±0.07 0.85±0.06*0.40±0.03#0.79±0.08 Hes1 0.25±0.03 0.65±0.10*0.29±0.06#0.70±0.07
3 討論
目前對糖尿病腎病發病機制的研究已取得一定進展。蛋白激酶C、多元醇通路和非酶糖基化產物受血糖及其代謝產物的激活,參與損傷腎臟的結構和功能[1]。腎小球系膜細胞位于腎小球毛細血管環之間,是腎小球中的主要細胞群,在維持腎小球系膜基質穩態中起重要作用。系膜細胞外基質包裹系膜細胞,細胞外基質組成和數量的變化直接影響系膜細胞功能。腎小球中系膜細胞外基質堆積是糖尿病腎臟受累的特征性病理改變。研究表明,抑制高糖誘導下腎小球系膜細胞的細胞外基質堆積有利于預防或延緩腎小球硬化進展[2]。糖尿病導致腎小球損傷后,系膜基質蛋白過度增生,可能是由FN、ColⅣ、蛋白多糖、糖胺聚糖等膠原蛋白和非膠原糖蛋白合成增多或降解減少造成的。FN、ColⅠ、ColⅣ蛋白表達與細胞外基質沉積水平具有密切聯系[3]。
高糖還可影響腎小球系膜細胞凋亡。Bcl-2是重要的凋亡抑制因子,可抑制線粒體釋放Cyt-C,抑制Caspase級聯反應,從而抑制細胞凋亡。Bax可與Bcl-2結合形成二聚體,拮抗Bcl-2對細胞凋亡的抑制作用。另一方面,Bax還可激活Caspase-3,促進Ca2+釋放,進而導致細胞凋亡。Bcl-2/Bax可反映細胞凋亡情況,Bcl-2/Bax升高表明細胞凋亡減少[4]。現已發現哺乳動物的Notch受體有4種,分別為Notch1、2、3、4;已發現的人類Notch配體有5種,分別為Delta-like1、Delta-like3、Delta-like4、Jagged1及Jagged2。在腎臟發育過程中,Notch家族各成員都具有重要作用。研究顯示,高糖可通過上調系膜細胞中Notch信號通路相關分子表達,導致腎臟纖維化和糖尿病腎病的發生[5]。高糖能抑制腎小管上皮細胞存活,促進凋亡,可能與Notch信號通路調控有關。研究顯示,db/db2糖尿病腎病模型中Notch1、Notch2和靶基因Hes1表達增加,提示糖尿病腎病狀態下Notch通路被激活[6]。Hes1是Notch信號通路重要的下游基因,其表達水平代表Notch信號通路的激活狀態。有學者發現,Notch信號在糖尿病腎病中異常活化,Notch1可能全程參與腎纖維化,并與纖維化程度和腎小球硬化程度相關[7]。但Notch信號通路參與糖尿病腎病發病的具體機制尚不明確。
lncRNA可從表觀遺傳、轉錄及轉錄后水平調控基因表達[8]。研究表明,lncRNA參與糖尿病腎病的發病過程,但確切機制仍不清楚[9]。有學者發現,靶向lncRNA MGC的化學修飾寡核苷酸可抑制糖尿病小鼠腎小球細胞外基質堆積,減輕腎小球肥大程度[10]。DUAN等[11]發現,lncRNA TUG1可拮抗miR-377的作用,減少細胞外基質在腎小球系膜細胞內的積聚。還有研究顯示,CYP4B1-PS1-001和CYP4A12A可通過影響腎小球系膜細胞的增殖和纖維化從而干預糖尿病腎病的進程[12]。KCNQ1OT1作為印跡基因,只表達父源等位基因,其可調控多個目的基因轉錄,參與生長發育過程[13]。以往研究表明,KCNQ1OT1與多種疾病的發生發展相關。在高糖環境下,KCNQ1OT1表達明顯上調,參與糖尿病視網膜病變的發生發展[14]。YANG等[15]通過生物信息學分析發現,KCNQ1OT1在糖尿病心肌病患者的心臟組織中顯著上調,沉默KCNQ1OT1可通過上調miR-214-3p、抑制Caspase-1表達,抑制糖尿病心肌細胞凋亡。李瑩等[16]研究發現,糖尿病腎病患者血清KCNQ1OT1水平高于正常對照組,且合并大量蛋白尿患者高于微量蛋白尿患者,血清KCNQ1OT1水平與腎小球濾過率呈負相關。以上研究提示,KCNQ1OT1可能在糖尿病及糖尿病并發癥的發生過程中起重要作用。
本研究用高糖培養的HMCs構建糖尿病腎病細胞模型,證實KCNQ1OT1在高糖誘導的腎小球系膜細胞中高表達,提示KCNQ1OT1可能參與了高糖介導的腎小球系膜細胞損傷。在高糖誘導下,HMCs活力增強且凋亡率降低,Notch1蛋白及FN、ColⅠ、ColⅣ等纖維化相關蛋白表達增加,表明高糖可誘導細胞外基質堆積和纖維化。下調KCNQ1OT1表達后,HMCs增殖能力降低,凋亡率增高,Notch1、Hes1、Bcl-2、FN、ColⅠ、ColⅣ蛋白表達降低,Bax蛋白表達增高,表明下調KCNQ1OT1表達可抑制高糖誘導的腎小球系膜細胞的增殖并促進細胞凋亡,下調KCNQ1OT1可調控Notch信號通路Notch1和Hes1表達,抑制細胞外基質堆積。大量研究已證實,KCNQ1OT1介導了多種競爭性內源RNA調節機制。目前認為,lncRNA與mRNA都具有miRNA結合位點,lncRNA可與miRNA結合形成lncRNA-miRNA-mRNA軸,導致所調控的蛋白質表達發生變化,從而影響細 胞功 能[17],如KCNQ1OT1/miR-138-5p/ABCB1、KCNQ1OT1/miR-124-3p/TRIM14、KCNQ1OT1/miR-701-3p/FGFR3等[18-20]。我們將在今后研究中進一步探索KCNQ1OT1可能競爭性結合的miRNA或KCNQ1OT1與蛋白質的相互作用,深入分析KCNQ1OT1在糖尿病腎病發生發展中的可能作用機制。

