黃芩素通過TLR4/NF-κB信號通路對小鼠結腸炎的干預作用
邵曉曉,王偉中,馬國龍,金穎莉,史睿昕,蔣益
1.溫州醫科大學附屬第二醫院育英兒童醫院 消化內科,浙江 溫州 325027;2.溫州醫科大學 第二臨床醫學院,浙江 溫州 325035
潰瘍性結腸炎(ulcerative colitis,UC)確切病因未知[1],臨床上缺乏特異性、有效的治療藥物。UC患者病情常遷延反復,因此尋找安全有效的治療藥物迫在眉睫。研究證實核因子-κB(nuclear factor-kappa B,NF-κB)在UC患者體內呈過度活化狀態,參與UC的發生和發展[2]。Toll樣受體4(Tolllike receptor 4,TLR4)通過外來刺激因子和TLR4結合之后激活固有免疫系統,啟動NF-κB信號通路,導致炎癥反應發生[3]。
黃芩素(分子式C15H10O5)是中藥黃芩的主要有效成分,具有抗炎、抗菌、免疫調節等作用[4]。《傷寒論》認為以黃芩為主藥的黃芩湯有清熱燥濕、和中止痛的作用,近年來研究發現,黃芩湯對治療炎癥性腸病具有較好療效,但機制不明[5]。研究還發現黃芩素能夠通過調節NF-κB的活性達到抗炎效果[6]。因此,本研究通過觀察黃芩素對葡聚糖硫酸鈉(dextran sulfate sodium,DSS)誘導的實驗性結腸炎小鼠的治療作用,研究黃芩素是否通過干預TLR4/NF-κB信號通路發揮作用,旨在為黃芩素治療UC提供實驗和理論依據。
1 材料和方法
1.1 材料
1.1.1 主要試劑:黃芩素購自上海Aladdin公司,DSS(相對分子質量36~50 kDa)購自美國MP Biomedicals公司,羥甲基纖維素鈉、蘇木素-伊紅(HE)染色試劑盒、二脒基苯基吲哚(DAPI)染料購自北京Solarbio公司,RNAsimple總RNA提取試劑盒購自美國Invitrogen公司,PrimeScript反轉錄試劑盒購自美國Roche公司,iTaqTMUniversal SYBR?Green Supermix購自美國Bio-Rad公司。山羊抗小鼠NF-κB p65抗體購自上海Rndsystems公司、兔抗小鼠EPCAm抗體購自美國Affinity公司,驢抗山羊(Alexa Fluor488標記)熒光二抗購自英國Abcam公司,驢抗兔(Cy3標記)熒光二抗購自武漢Servicebio公司。
1.1.2 動物:6~8周齡SPF級雄性C57BL/6小鼠,體質量18~22(21.7±0.16)g,均購自北京維通利華實驗動物技術有限公司,并在溫州醫科大學SPF級實驗動物中心適應性飼養1周后用于實驗,實驗動物使用許可證號為SYXK(浙)2018-0017。小鼠飼養具體環境條件如下:溫度22~25 ℃,相對濕度45%,光照和黑暗環境各12 h循環。本動物實驗研究獲溫州醫科大學實驗動物倫理委員會批準(編號wydw2017-0019)。
1.2 方法
1.2.1 動物分組及處理:將C57BL/6品系小鼠按照隨機數字表法分為5組,即對照組、結腸炎組、黃芩素低劑量(Ba-L)治療組[10 mg/(kg·d)]、黃芩素高劑量(Ba-H)治療組[25 mg/(kg·d)]和5-氨基水楊酸(5-amino-salicylic acid,5-ASA)治療組,每組各12 只。對照組小鼠自由飲用清水,其余小鼠連續7 d自由飲用3.5% DSS溶液,構建實驗性結腸炎模型。藥物劑量和給藥方式參照ZHONG等[7]的方法:在開始飲用DSS溶液7 d前予實驗組小鼠藥物(黃芩素或5-ASA)灌胃連續7 d,在開始飲用DSS溶液后,繼續給予藥物(黃芩素或5-ASA)灌胃7 d,每日灌胃1次,每次0.2 mL。所有藥物均溶于0.5%羧甲基纖維素鈉溶液中制成混懸液,對照組小鼠連續14 d每日灌胃0.5%羧甲基纖維素鈉溶液0.2 mL。造模后定期觀測、記錄小鼠的體質量變化、糞便性狀和便血等情況,并評估小鼠疾病活動指數(disease activity index,DAI)[8]。在造模第7天,采用頸椎脫臼法處死小鼠,收集小鼠結腸組織并測量結腸長度,選取距離小鼠肛門1~2 cm處的結腸組織,予以常規組織脫水、石蠟包埋。組織連續切片后予以HE染色,采用組織學活動度評分(histology activity index,HAI)[9]對結腸組織進行病理學評估炎癥程度和組織損傷。
1.2.2 實時熒光定量PCR:檢測小鼠結腸組織中炎癥細胞因子[γ干擾素(interferon-γ,IFN-γ)、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)]的水平,反映小鼠腸道炎癥的程度。檢測小鼠結腸組織中TLR4、髓樣分化因子88(myeloid differentiation factor 88,MyD88)、NF-κB p65的相對表達水平,間接反映TLR4/NF-κB信號通路的激活程度。根據RNAsimple總RNA提取試劑盒說明書從小鼠結腸組織中提取總RNA,采用分光光度計檢測RNA濃度、純度,根據PrimeScript反轉錄試劑盒說明書制備cDNA樣品,采用iTaqTMUniversal SYBR?Green Supermix定量PCR檢測。總反應體系10 μL,包括上下游引物各0.4 μL,SYBR Green 5 μL,cDNA 1 μL,ddH2O 3.2 μL。反應條件:95 ℃預變性30 s,95 ℃ 5 s,60 ℃ 30 s,共40 個循環。引物由上海生工生物工程有限公司設計合成,見表1。以標準管家基因(GAPDH)為參照,采用2-ΔΔCT法計算目的基因mRNA的相對表達量。

表1 實時熒光定量PCR采用的引物序列
1.2.3 免疫熒光技術檢測腸上皮細胞NF-κB p65入核率:檢測小鼠結腸上皮細胞中NF-κB p65的入核率,評價NF-κB信號通路的激活程度。小鼠結腸組織石蠟切片,經過脫蠟、水化之后,枸櫞酸鈉抗原熱修復,用0.3% Triton X-100破膜15 min。PBS洗滌后,用3% BSA封閉1 h,滴加一抗(山羊抗小鼠NF-κB p65抗體和兔抗小鼠EPCAm抗體),置于濕盒中4 ℃孵育過夜。次日,PBS洗滌后,滴加熒光二抗[驢抗山羊(Alexa Fluor 488 標記)熒光二抗和驢抗兔(Cy3標記)熒光二抗],室溫避光孵育1 h后,用DAPI復染細胞核。PBS洗滌,滴加自發熒光淬滅劑,予以抗熒光淬滅封片劑封片,將切片放置于熒光顯微鏡下觀測并采集相應圖像。采用Image Pro Plus 6.0(IPP)圖像分析軟件對所得圖像進行定量分析。DAPI染色標記細胞核,EPCAm抗體標記小鼠結腸上皮細胞,NF-κB p65抗體標記p65蛋白,在高倍鏡視野下,統計腸上皮細胞中p65的入核率。
1.3 統計學處理方法 采用SPSS26.0統計處理軟件分析數據。計量資料用表示,多組間比較采用單因素方差分析,兩兩比較采用Tukey檢驗(方差齊)或Tamhane’s T2檢驗(方差不齊)。P<0.05為差異有統計學意義。
2 結果
2.1 小鼠結腸炎嚴重程度評估 在整個實驗過程中,對照組小鼠無腹瀉和便血等癥狀,總體精神狀態良好,體質量輕微上升;其余4組小鼠均在飲用3.5% DSS溶液后的第3天開始出現體質量下降、腹瀉、便血等表現。在第7天時,結腸炎組小鼠體質量和小鼠結腸長度都明顯低于對照組,差異有統計學意義(均P<0.01);而Ba-L治療組、Ba-H治療組以及5-ASA治療組小鼠體質量和結腸長度均明顯高于結腸炎組,差異有統計學意義(均P<0.01),見圖1。各治療組小鼠體質量變化率差異無統計學意義(均P>0.05);而Ba-L治療組小鼠結腸長度顯著短于5-ASA治療組,差異有統計學意義(P<0.01)。造模第7天時,Ba-L治療組、Ba-H治療組以及5-ASA治療組小鼠DAI均顯著低于結腸炎組小鼠,差異有統計學意義(均P<0.05),見圖1;HAI評分均顯著低于結腸炎組,差異有統計學意義(均P<0.01);光鏡下表現為隱窩結構更加完整,黏膜潰瘍面積更小,炎性細胞浸潤更少,見圖2、圖3。
2.2 小鼠炎性細胞因子相關mRNA相對表達水平結腸炎組小鼠的結腸組織中IFN-γ、TNF-α、IL-1β的mRNA表達水平明顯高于對照組小鼠,差異均有統計學意義(均P<0.01)。Ba-H治療組結腸組織中IFN-γ、TNF-α、IL-1β的mRNA表達水平顯著低于結腸炎組小鼠,差異有統計學意義(均P<0.01)。3個治療組間比較,這些炎性細胞因子mRNA表達水平差異無統計學意義(均P>0.05),見表2。
2.3 TLR4/NF-κB信號通路相關mRNA相對表達水平結腸炎組小鼠結腸組織中MyD88、NF-κB p65、TLR4的mRNA水平均高于對照組,差異有統計學意義(均P<0.01)。Ba-L治療組、Ba-H治療組和5-ASA治療組小鼠結腸組織中MyD88、NF-κB p65、TLR4的mRNA水平均低于結腸炎組,差異有統計學意義(均P<0.05);各治療組之間上述指標表達差異無統計學意義(均P>0.05),見表2。
表2 各組小鼠結腸組織mRNA相對表達量(每組n=12,)
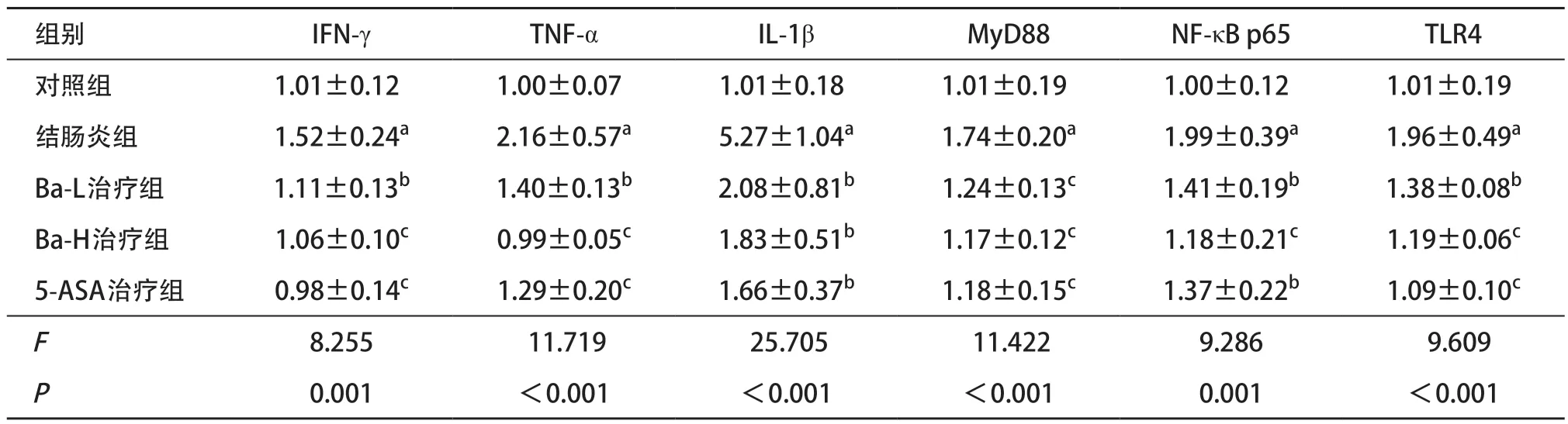
表2 各組小鼠結腸組織mRNA相對表達量(每組n=12,)
與對照組比:aP <0.01;與結腸炎組比:bP <0.05,cP <0.01
2.4 免疫熒光檢測腸上皮細胞中NF-κB p65的入核率 結腸炎組腸上皮細胞中NF-κB p65的入核率顯著高于對照組小鼠,差異有統計學意義(P<0.01)。Ba-L治療組、Ba-H治療組以及5-ASA治療組的腸上皮細胞中NF-κB p65的入核率均顯著低于結腸炎組,差異有統計學意義(均P<0.01),見圖4。
3 討論
西醫理論認為UC是遺傳、免疫、環境、微生物等因素綜合作用于遺傳易感者,使機體產生異常免疫反應,最終導致腸組織炎癥性損傷[10]。祖國傳統醫學將UC歸屬于“赤沃”“泄瀉”“久痢”等疾病范疇[11]。目前UC仍缺乏特異性治療藥物,而祖國傳統醫藥對于治療胃腸道慢性疾病常顯示出獨到的療效。現代藥理學研究表明,提取自中藥黃芩的黃芩素具有抗感染、調節免疫等藥理作用,參與調節多種炎癥信號通路,兼具高效、無毒、經濟等優點,有望成為治療UC的潛在藥物。
本研究發現小鼠飲用3.5%的DSS溶液后會出現明顯的急性結腸炎表現,如嚴重的腹瀉、便血、體質量下降、結腸短縮等,這與既往的報道基本相符[8]。5-ASA作為經典的UC治療藥物,被多項動物研究用于治療DSS誘導的急性結腸炎,并具備一定的療效。本研究發現,口服黃芩素和5-ASA能夠顯著改善結腸炎小鼠的腸道炎癥,增加小鼠體質量及結腸長度,降低DAI和HAI評分。本研究還發現,結腸炎組小鼠較對照組結腸黏膜結構破壞嚴重,出現的腸道潰瘍更大,炎性細胞浸潤數目更多、程度更深、范圍更廣,且結腸炎組小鼠的結腸組織中IFN-γ、TNF-α、IL-1β及MyD88、NF-κB p65、TLR4的mRNA表達水平明顯高于對照組小鼠。本研究還發現Ba-H治療組結腸組織中IFN-γ、TNF-α、IL-1β的mRNA表達水平顯著低于結腸炎組小鼠,且Ba-L治療組、Ba-H治療組和5-ASA治療組小鼠結腸組織中MyD88、NF-κB p65、TLR4的mRNA水平亦均低于結腸炎組,但Ba-L治療組、Ba-H治療組和5-ASA治療組間上述炎性細胞因子和TLR4/NF-κB信號通路相關蛋白的mRNA表達水平差異無統計學意義。上述研究結果提示黃芩素和經典藥物5-ASA在該模型中顯示出相似的治療效果,各治療組間DAI、HAI以及結腸炎癥細胞因子水平差異均無統計學意義。
在UC的發病過程中,腸上皮細胞和單核巨噬細胞中異常激活的TLR4/NF-κB信號是重要的炎癥啟動因素,會導致大量炎癥細胞因子的釋放,如TNF-α、IL-1β、IL-6、IL-8 等,最終引起不可逆的腸道炎癥反應[12]。多項研究發現,黃芩素可通過抑制NF-κB信號在多種炎癥性疾病中發揮作用。WANG等[13]研究發現黃芩素可以通過抑制NF-κB信號通路抑制炎癥反應進程,在阻塞性腎病過程中發揮抗纖維化效應。研究還發現,黃芩素可能通過抑制NF-κB信號通路緩解小鼠腸缺血/再灌注導致的急性肺損傷[14]。黃芩素還可能抑制哮喘的免疫-過敏-炎癥反應而有望成為治療哮喘的新型候選藥物[15]。此外,HE等[16]發現黃芩素能通過抑制NF-κB活化緩解脂多糖誘導的急性乳腺炎。本研究不僅發現各治療組小鼠結腸組織中MyD88、NF-κB p65、TLR4的mRNA水平均低于結腸炎組,而且進一步研究發現結腸炎組小鼠結腸組織中腸上皮細胞中NF-κB的入核率均高于對照組,5-ASA治療組、Ba-L治療組及Ba-H治療組的結腸組織中腸上皮細胞中NF-κB的入核率均低于結腸炎組。目前黃芩素對于結腸炎的治療作用也開始逐漸受到重視。李敏瑤等[17]研究提示黃芩湯中的黃酮類化合物可能通過調節炎癥通路在UC治療中發揮重要作用。王繼森等[18]在研究黃芩湯對UC大鼠的作用中發現其有效成分通過降低細胞因子TNF-α、IL-1β和IL-6水平抑制實驗性結腸炎大鼠的腸道炎癥。研究還發現黃芩素不僅可以修復結腸炎小鼠的結腸組織黏膜屏障,還可以通過抑制NF-κB的活性,下調炎癥因子的表達而達到抗炎效應[19]。
本研究結果和上述學者的研究共同提示,黃芩素可能通過TLR4/NF-κB信號通路抑制小鼠結腸炎。
本研究發現,黃芩素可能通過TLR4/NF-κB信號通路抑制DSS誘導的結腸炎癥。本研究中黃芩素在對小鼠的治療中發揮顯著的抑炎作用,并且黃芩素相較于傳統的5-ASA制劑具有安全、無毒等優勢,未來可能在UC的臨床治療中發揮潛在的應用價值。

