基于宏基因組的保安湖浮游動物多樣性研究
羅 帥 劉真誠 王 粟 谷思雨 王雪艷 姜傳奇 鮑少攀 方 濤 繆 煒* 熊 杰*
(1. 大連海洋大學, 大連 116023; 2. 中國科學院水生生物研究所, 武漢 430072; 3. 中國科學院大學, 北京 100049)
保安湖(30°12′—30°18′N,114°39′—114°46′E)位于湖北省大冶市西北部, 屬梁子湖水系, 為長江中游南岸的一個中型淺水草型湖泊, 全湖面積約為39.3 km2, 由主湖區、肖四海、扁擔塘和橋墩湖等湖區組成。其水域面積大, 生物餌料資源豐富, 水域生態環境優越, 有條件建設成為湖北省重要的水產養殖基地, 并為地區經濟的發展, 做出積極的貢獻。從區域經濟發展的角度分析, 保安湖所在的區域, 為湖北省重要的工業基地, 農業生產則顯得薄弱, 水產養殖業比較后進, 與其眾多的水面, 豐富的湖泊資源很不對稱。迄今為止, 保安湖漁業生產主要可以分為如下幾個階段: (1) 20世紀50—60年代,漁業高產期; (2) 70年代, 生態失調, 漁業嚴重下降期;(3) 80年代后, 開發期; (4) 2000s初, 保安鎮污水過量流入, 水體嚴重污染期; (5) 2000s末, 逐步弱化漁業功能; (6) 2010s, 全面退化漁業, 加強生態恢復的保護期。盡管20世紀70年代以來, 眾多的水產科技工作者對一些富營養類型的水體, 主要是中、小型藻型湖泊, 進行了漁業增產綜合實驗, 卓有成效。但是長期以來, 對大、中型草型湖泊的開發、利用仍處于落后狀態, 不但對于這類生態系統基本規律掌握不夠, 漁業利用也處于盲目狀態。特別是在1972—2000年, 保安湖先后經過了大規模的河蟹養殖及保安鎮污水的過量排入, 根據2006年中國科學院水生生物研究所的調查結果顯示, 保安湖深度由1993年的2.36 m降至1.87 m, 透明度由1993年的1.48 m降至0.58 m。2002年前, 保安湖東西兩港還可行船, 如今水道污泥淤積, 航行嚴重受阻。自2002年開始整治湖水后, 保安湖的污染仍在不斷加劇, 已呈地表水三類水質。而從20世紀90年代至今,有關保安湖流域生物類群的研究較少, 且主要集中于大型底棲動物[1]、魚類[2,3]、浮游植物[4]和沉水植物等[5], 而罕有浮游動物類群的研究。
浮游動物作為湖泊生態系統中的重要類群, 是物質能量循環的重要環節。不僅是湖泊漁業中各經濟魚類優秀的生物餌料, 而且能夠靈敏地響應環境的變化情況, 同時其生物多樣性及群落結構研究對于評估、監測湖泊等水體的承載力水平、生態系統健康狀況及其精細化管控意義重大[6,7]。但開展浮游動物的相關研究還存在著諸多困難, 如浮游動物體型較小, 在顯微鏡下只能分辨較大的類群,很難鑒定到種, 而有關浮游動物形態描述的系統性文獻比較少, 對鑒定人員的專業程度要求很高。
近十幾年來, 隨著高通量測序技術的發展, 浮游動物中各類群的組學研究也逐步開展。但是, 由于大部分原生動物都難以培養, 無法獲得足夠數量的細胞用于組學測序分析, 使得組學研究在原生動物中難于開展[8]。而擴增子測序又存在著擴增偏好、擴增錯誤的引入、獲得的分子標記基因片段短等問題, 如18S V4和V9區域對真實群落結構的分析可能不準確。因此宏基因組測序技術應運而生[9]。通過宏基因組測序, 可以全面、真實地獲取湖泊浮游動物多樣性等信息, 同時, 還可以對浮游動物與環境之間的關系、物種功能基因組等進行分析。迄今為止, 宏基因組測序已成為全面了解環境中生物群落特征, 挖掘生物遺傳資源的一種方法。隨著測序成本的逐漸下降, 宏基因組方法也越來越多地應用于湖泊浮游動物的相關研究中[10—12]。
浮游動物生活在水體中, 水環境中各種理化因素和生物因素的變動, 都會影響浮游動物的群落結構。因此, 浮游動物種類和豐度的變化一方面受著水生植物季節性變化的影響, 如水生植物凋謝死亡可為浮游動物提供營養物質; 另一方面其他環境因子, 如光照、溫度、pH和溶氧等, 也會同時影響浮游動物類群的季節變化。本研究通過在2019—2020年春、夏、秋、冬四季對保安湖浮游動物群落進行定期定點的采樣調查, 采用宏基因組方法, 在優化物種鑒定和豐度計算方法的基礎上, 分析了保安湖浮游動物種類、群落組成結構及時空變化特征, 獲得了保安湖浮游動物多樣性的基礎資料并闡明了浮游動物的季節變化規律。
1 材料與方法
1.1 采樣點的設置
根據保安湖的自然條件和生態特點, 將全湖劃分為4個湖區, 其中主體湖區面積為26.7 km2, 該區共設置10個采樣點; 橋墩湖面積為8.0 km2, 該區共設置4個采樣點; 扁擔塘面積為3.3 km2, 該區共設置3個采樣點; 肖四海面積為1.3 km2, 該區共設置3個采樣點; 全湖共設置20個采樣點 (圖1)。目前, 肖四海、扁擔塘與橋墩湖已先后被圍欄堤斷, 但仍有水道與主體湖相通保持水循環[13]。

圖1 保安湖采樣點分布Fig. 1 Sampling stations in Bao’an Lake
1.2 樣品采集與制備
在2019—2020年度春、夏、秋、冬四季, 每季度采1次樣, 分別在4月、7月、10月和1月中旬, 其中10月份秋季樣品設置了3次平行采樣。采用采水器, 采取1 m水深的水樣2 L, 并用200 μm濾網過濾掉大顆粒。于室溫下搖晃混勻, 每個樣點取350 mL水樣并加入1000個嗜熱四膜蟲(SB210細胞株)后抽濾至0.22 μm PC膜上(Millipore, USA)保存于–80℃冰箱, 用于之后高通量測序。
采用CTAB法提取濾膜上的環境DNA。首先將濾膜上的微生物沖洗下來, 然后加入CTAB 分離緩沖液將DNA溶解出來, 再經氯仿-異戊醇抽提除去蛋白質后使用1%的瓊脂糖凝膠分析DNA的降解程度和潛在污染。DNA純度使用納米光度計(IMPLEN, CA, USA)測定, DNA濃度使用Qubit dsDNA Assay Kit在Qubit2.0熒光儀(Life Technologies, CA,USA)中測定, 濃度大于1 μg的合格DNA被用來構建文庫。對于質量合格的DNA, 經Covaris破碎儀打斷為長度350 bp左右的片段, 補齊末端后向3′端加“A”尾, 使用T4連接酶將Illumina測序接頭連接至文庫DNA兩端, 檢驗文庫質量合格后, 所有樣品均基于Illumina HiSeq 4000平臺進行測序。
1.3 數據處理
數據分析流程如圖 2所示, 先對測序所得的原始序列用fastQC (v0.11.9)進行質量評估, 然后使用Fastx_trimmer (v0.0.14)移除低質量堿基, 將經過質控的序列轉換為Fasta格式后, 通過BLASTN比對至SILVA數據庫, 設置e值閾值為1e-5, 篩選出rDNA相關的讀段(Reads), 使用MEGAHIT (v1.1.3)對rDNA測序讀段進行組裝, 得到全部樣本的rDNA疊連群(Contigs)。基于16S和18S的hmm profile, 利用nhmmer比對確定所有組裝得到的rDNA contigs中屬于16S和18S的區域, 并使用腳本進行截取。經97%相似度聚類后得到最終的16S或者18S rDNA參考序列并用于物種鑒定。通過使用bwa (0.7.17-r1188)將每個樣品的rDNA reads分別比對至參考序列, 使用featureCounts (v1.6.0)對比對結果進行統計, 并用RPKM(Reads Per Kilobase per Million mapped reads)的方式進行標準化得到OTU(Operational Taxonomic Units)豐度表。
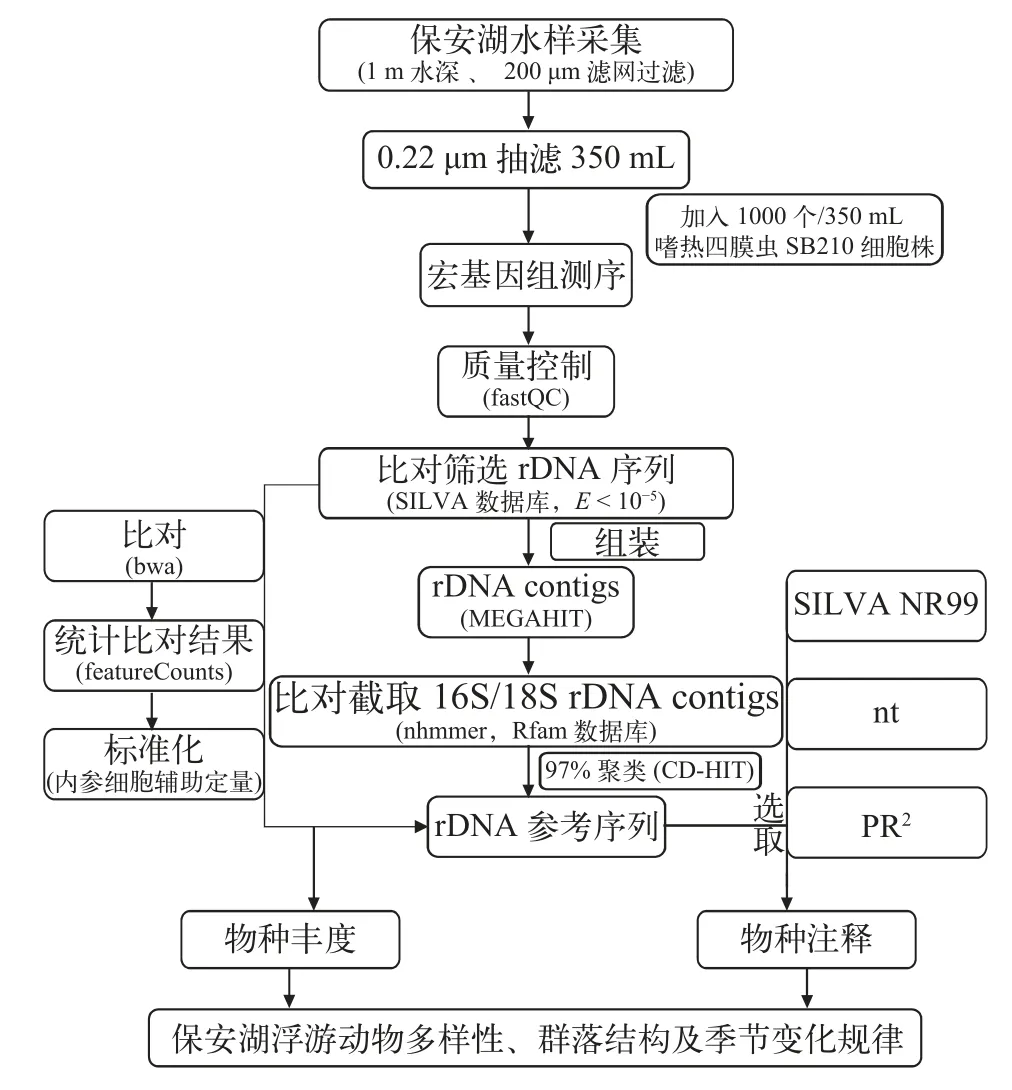
圖2 保安湖浮游動物多樣性分析流程Fig. 2 The pipeline of zooplankton diversity analysis in Bao’an Lake
1.4 注釋結果的選取標準及內參細胞定量
考慮到宏基因組法在物種鑒定上的精度受制于參考數據庫, 于是我們將4192個OTUs的代表序列, 分別與SILVA NR99 (https://www.arb-silva.de/)、PR2(https://github.com/vaulot/pr2_database/)、nt (https://www.ncbi.nlm.nih.gov/)數據庫進行比對并對注釋結果進行選取, 以此來提高注釋精度。篩選標準如下: (1)依據序列一致性和覆蓋度對結果進行篩選, 優先選取序列一致性較高的注釋結果, 其次比較覆蓋度。(2)如3個庫注釋結果不一致, 而序列一致性與覆蓋度均相近, 則選取多庫注釋支持的結果。(3)如比對SILVA庫的注釋結果只注釋到了較高的階元, 但未明確注釋到下一級階元的, 而與其他庫的比對結果在與其較高階元注釋結果相同時,選取注釋到最低階元的注釋結果。
由于RPKM等算法的準確性受到樣本之間物種豐度差異以及數據批次效應的影響, 為了提高浮游動物豐度計算的準確性, 在每份樣品中加入1000個嗜熱四膜蟲SB210細胞(Tetrahymena thermophilaSB210)作為內參細胞, 來提高豐度計算的準確性。通過將reads比對至嗜熱四膜蟲大核基因組來計算不同樣品之間內參細胞的豐度, 并以內參細胞的豐度值為基準, 對不同樣品中各OTU的豐度進行均一化(Normalization)。
1.5 測序結果
基于Illumina高通量測序技術, 對117個湖泊水樣樣本的濾膜進行了宏基因組測序, 共得到1.7T數據, 樣本測序數據量從11—23 Gb不等, GC含量在44%—53%, 經質量控制移除低質量堿基后, 通過比對SLIVA SSURef tax數據庫提取出rDNA reads, 經組裝及97% 聚類后共得到4192個OTUs。
1.6 統計分析
根據已得到的OTU豐度表在OTU水平分析不同樣點的群落組成及季節變化。基于 Bray-Curtis距離算法計算Beta多樣性, 并通過主坐標分析(PCoA)分析不同湖區浮游動物的多樣性差異[14]。使用R軟件“Vegan”包和“indicspecies”包計算保安湖浮游動物多樣性及指示物種。選取全部浮游動物的OTU進行共發生網絡分析, 使用R軟件“Hmisc”包, “psych” 包和“igraph”包計算Spearman秩相關性,并以秩相關性系數R值大于 0.6, 顯著性P值小于0.05 來作為確定物種間存在相互作用關系的閾值,使用“Gephi”軟件繪制無向網絡圖。所有圖表均使用 R 軟件“ggplot2”包和進行繪圖[15]。
2 結果
2.1 注釋結果的優化與內參細胞輔助定量
只通過比對SLIVA數據庫對OTUs進行物種注釋時, 其注釋結果會存在誤差, 如在保安湖水樣中,我們加入的內參細胞為T. thermophilaSB210, 但在SLIVA庫的注釋結果中為T.farahensis, 而與PR2和nt數據庫的注釋結果則為T. thermophila。可見, 通過多庫比對檢索能提高物種注釋的精度。因此, 本研究所獲得的4192個OTUs分別與SILVA、PR2、nt數據庫進行了比對, 依據序列一致性和覆蓋度對比對結果進行篩選, 共優化注釋結果549個, 其中矯正注釋錯誤419個, 優化注釋精度130個, 占全部OTUs的13.1%(圖3A)。
為了評估內參細胞對豐度計算的效果, 本研究對2019年秋季的20個樣品所采集的樣品設置了3次重復。由圖 3B可知, 對于同一個點的不同重復來說, 其內參細胞的豐度值變異較小(標準差均比較小), 說明加入的內參細胞具有較好的重復性, 可用于提高浮游動物豐度的計算結果。同時, 從圖 3B可知, 保安湖各湖區(扁擔塘、肖四海、橋墩湖和主體湖)樣點之間內參細胞的豐度值差異較大, 說明了不同樣點所采集的水樣中浮游動物的豐度變化較大, 也間接說明了內參細胞對豐度計算的重要性。
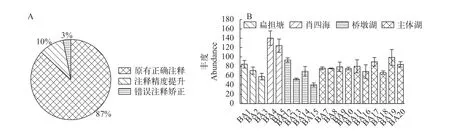
圖3 浮游動物種類注釋和豐度計算的優化結果Fig. 3 Optimization of species identification and abundance estimationA. 種類注釋優化結果; B. 基于內參細胞輔助的浮游動物豐度計算優化結果A. The optimized result of species identification; B. The optimized result of the abundance of zooplankton based on reference cells
2.2 保安湖浮游動物多樣性分析
對保安湖全湖宏基因組分析所獲得的4192個OTUs進行注釋后, 其中60%的OTUs為細菌(圖4A),而浮游動物則占據了全部OTUs的17% (原生動物14%、輪蟲1%、枝角類1%和橈足類1%)。在保安湖原生動物群落中, 又以纖毛蟲(Ciliophora, 39%)、眼蟲(Euglenozoa, 29%)、絲足蟲(Cercozoa, 12%)和頂復門(Apicomplexa, 5%)為主, 占到了全部原生動物OTUs的85% (圖4B)。

圖4 保安湖浮游動物物種組成Fig. 4 The composition of zooplankton in Bao’an Lake
基于內參細胞均一化后的OTUs豐度表, 計算了保安湖不同季節下各樣點Alpha多樣性指數、指示物種及進行Beta多樣性分析。在OTU水平上, 保安湖浮游動物多樣性以夏季最高, 秋季第二, 春季次之, 冬季最低(表1)。

表1 各季節保安湖浮游動物多樣性指數Tab. 1 Diversity index of zooplankton in Bao’an Lake in four seasons
在不同季節下, 保安湖浮游動物的指示物種類群也存有較大差異(表2)。在春季, 保安湖浮游動物指示物種主要為枝角類和原生動物, 其中枝角類主要為溞屬(Daphnia)、低額溞屬(Simocephalus)和盤腸溞屬(Chydorus)等, 原生動物則以(Salpingoeca)屬為主。在夏秋兩季, 保安湖浮游動物指示物種則以原生動物為主, 主要為苔扭蟲屬(Bryometopus)、格魯博蟲屬(Gruberia)、Vorticellides屬、波豆蟲屬(Bodo)、網紋蟲屬(Favella)等。而在冬季, 保安湖浮游動物指示物種則以橈足類為主, 主要為劍水蚤屬(Cyclops)和小劍水蚤屬(Microcyclops)。其中, 在春夏季均有觀測到喜好分布于富營養環境或α-中污帶的浮游動物[16], 如在春季觀測到枝角類圓形盤腸溞(Chydorus sphaericus), 在夏季觀測到原生動物舞行波豆蟲(Bodo saltans)等, 而在秋冬季節并無觀測到明顯的水污染指示生物。

表2 不同季節下保安湖浮游動物指示物種Tab. 2 Indicator species of zooplankton in Bao’an Lake
2.3 保安湖浮游動物季節變化
對保安湖浮游動物群落進行 Beta多樣性分析(圖5)。通過基于Bray-Curtis距離算法的PCOA分析揭示了不同季節下浮游動物不同的聚類模式, 對于2019年保安湖浮游動物數據, 季節因素是浮游動物的主要解釋變量(R=0.7275,P=0.001)。而湖區對浮游動物群落結構的影響較小(R=0.2982,P=0.001)。
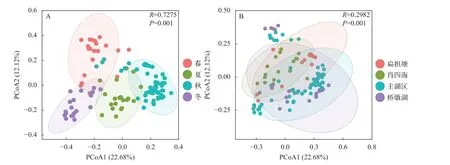
圖5 保安湖浮游動物Beta多樣性分析結果Fig. 5 Beta diversity of zooplankton in four season and lake areasA. 季節; B. 湖區A. Seasons; B. Lake areas
隨后, 我們進一步分析了保安湖浮游動物的季節變化趨勢。從觀測到的浮游動物OTU數目上來看, 在肖四海和主體湖區可觀測到更多的浮游動物種類。從浮游動物總數來看, 保安湖浮游動物以冬季最高, 春、夏季次之, 秋季最低, 并主要分布于扁擔塘與肖四海(圖6)。
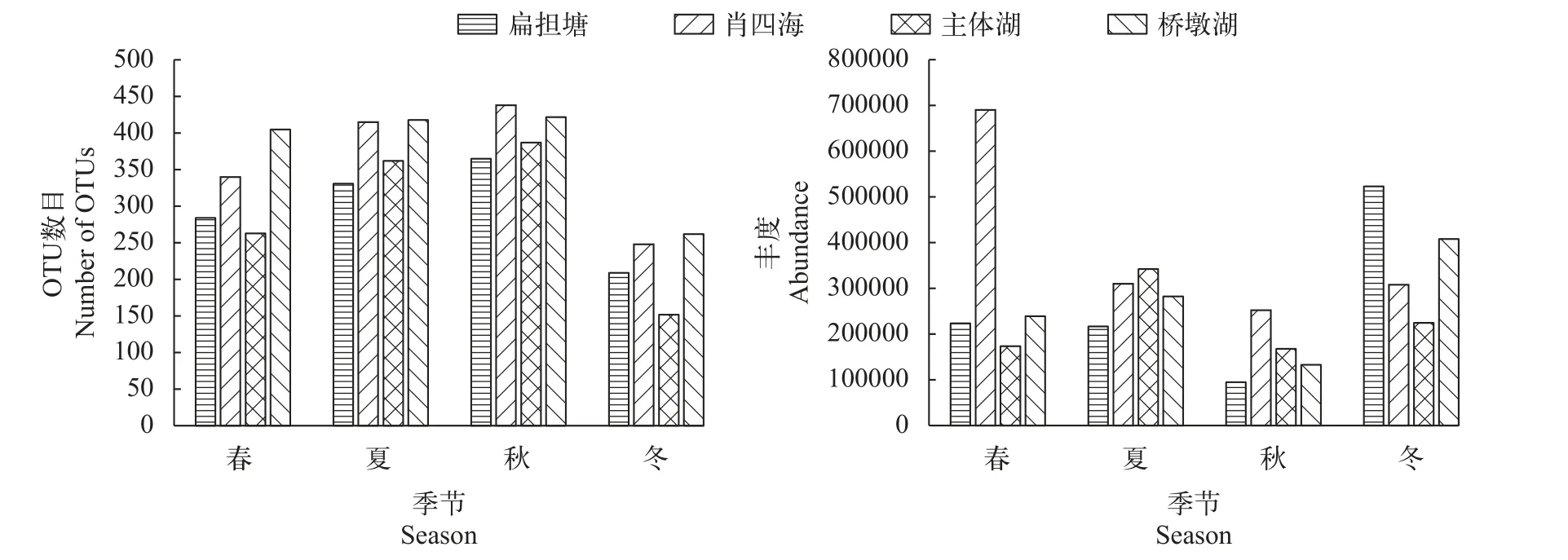
圖6 不同湖區浮游動物OTU數目和豐度的季節變化Fig. 6 Seasonal changes of the numbers of zooplankton OTUs and abundance in different lake areasA. OTU數目; B. 豐度A. Number of OTUs; B. Abundance
2.4 保安湖浮游動物群落與環境因子的關系
選取保安湖豐度前十的原生動物類群、輪蟲、枝角類和橈足類與環境因子進行冗余分析和Spearman秩相關性分析。保安湖浮游動物群落與環境因子的冗余分析表明: 溫度、pH、溶氧、氨氮、葉綠素a和硝氮對保安湖浮游動物群落結構有較大的影響(圖7)。在不同季節, 環境因子對保安湖浮游動物群落有著不同的相互作用。春、冬季節的樣點主要分布于第三、第四象限, 說明在本次調查中春冬季節的浮游動物群落與溫度、pH、葉綠素a濃度呈負相關。而夏、秋季節的樣點主要分布于第一象限, 說明在本次調查中夏秋季節的浮游動物群落與溫度、pH、葉綠素a濃度呈正相關。保安湖浮游動物群落與環境因子的Spearman秩相關性分析表明: 保安湖不同類群的浮游動物與環境因子的相互作用關系有所不同, 其中N、P作為合成蛋白質、核酸等物質的關鍵元素, 其含量與浮游動物各類群均有顯著的正相關, 而溫度、pH、葉綠素a、溶氧與浮游動物的關系則更為復雜。根據聚類關系主要可以分為五類: 纖毛蟲(Ciliophora)、絲足蟲(Cercozoa)和輪蟲(Rotifer)主要與硝氮、化學需氧量呈正相關, 與溫度、氨氮呈負相關; 帕金蟲(Perkinsozoa)和變形蟲(Amoebozoa)則主要與化學需氧量、總磷呈正相關, 與正磷酸根呈負相關; 而領鞭毛蟲(Choanoflagellata)和雙環門(Bigyra)則與多數環境因子并無明顯的相關性關系; Aphelidea和頂復門 (Apicomplexa)等則與溫度、葉綠素a、pH呈正相關; 橈足類與枝角類主要與硝氮呈正相關, 與溶氧、溫度和葉綠素a呈負相關。
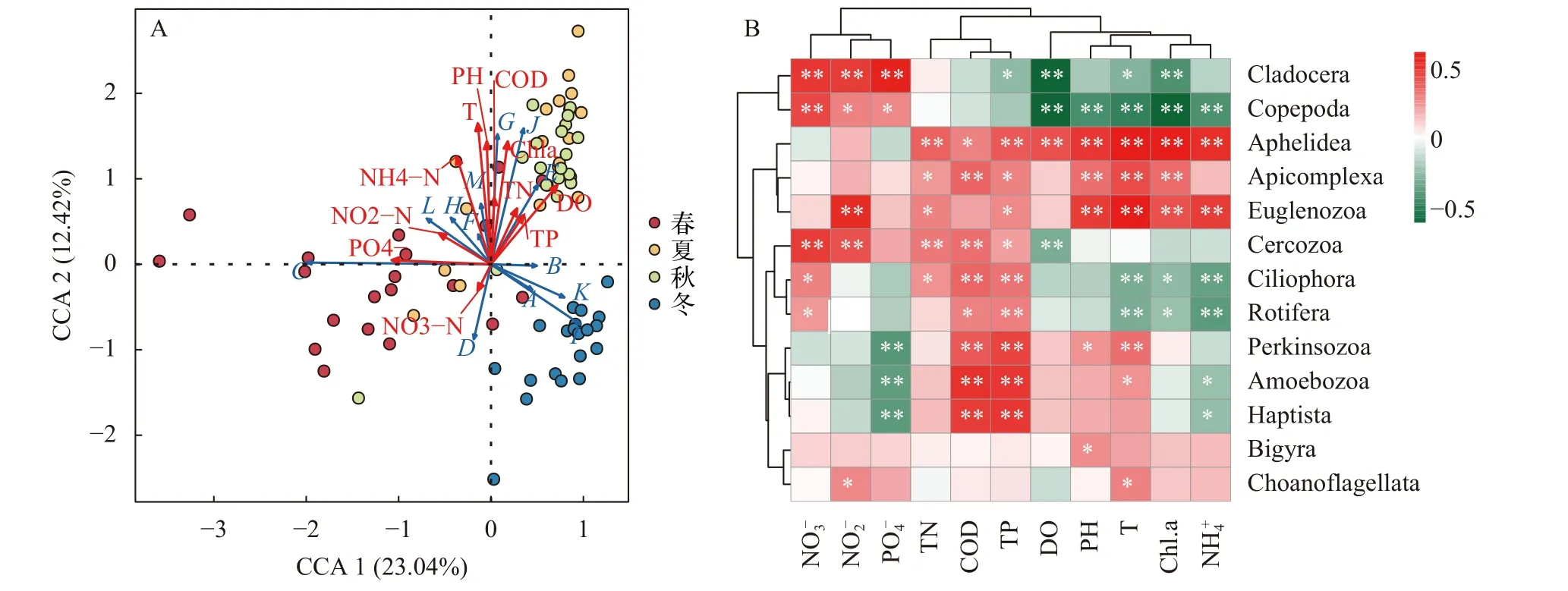
圖7 保安湖浮游動物多樣性與環境因子的相關性分析Fig. 7 Correlation analysis between zooplankton diversity and environmental factors in Bao’an Lakea. 典范對應分析; 紅色箭頭代表 11種環境因子, 藍色箭頭代表不同的浮游動物群落; A. 纖毛門; B. 輪蟲門; C. 枝角目; D. 橈足類;E. 帕金蟲門; F. 絲足蟲門; G. 眼蟲門; H. 雙環門; I. 定鞭藻門; J. Aphelidea; K. 變形蟲門; L. 領鞭蟲綱; M. 頂復門; b. spearman秩相關系數的熱圖。根據spearman秩相關系數計算相關性矩陣; *P<0.05; **P<0.01; 紅色和綠色分別代表正相關和負相關, 顏色越深, 相關性越強a. The canonical correlation analysis. The red arrows represent 11 environmental factors, the blue arrows represent different zooplankton communities; A. Ciliophora; B. Rotifer; C. Cladocera; D. Copepoda; E. Perkinsozoa; F. Cercozoa; G. Euglenozoa; H. Bigyra; I. Haptista;J. Aphelidea; K. Amoebozoa; L. Choanoflagellata; M. Apicomplexa; b. The heatmap correlation coefficients. The matrix was calculated using spearman’s correlation coefficients; *P<0.05; **P<0.01; Red and green represent positive and negative correlations, and the darker the color, the stronger the correlation
2.5 保安湖浮游動物群落結構季節變化及作用關系
選取不同季節浮游動物OTUs的豐度數據計算兩兩OTU之間的spearman秩相關系數, 并以此繪制2019年不同季節保安湖浮游動物的共發生網絡(圖8)。其中節點代表OTUs, 邊代表存在的相互作用。保安湖春季浮游動物共發生網絡共包含了617個節點和8130條邊, 夏季共發生網絡包含669個節點和4407條邊, 秋季共發生網絡包含686個節點和3013條邊, 冬季共發生網絡包含418個節點和4255條邊。對不同季節的共發生網絡進行模塊化計算, 并統計其網絡特征參數可以發現, 保安湖秋季浮游動物共發生網絡平均聚集系數最高, 而平均連通度和模塊性最低, 說明相比于其他季節, 保安湖秋季浮游動物形成了一個“小世界網絡”, 而保安湖夏季浮游動物共發生網絡的網絡拓樸結構參數則與此相反, 而春、冬兩季的網絡拓樸結構參數則介于夏、秋季之間(表3)。從各季共發生網絡的模塊劃分上來看, 保安湖浮游動物共發生網絡主要可以分為8個主要的模塊(只統計了OTU占比大于1%的模塊), 其中模塊代表的是一組能位于同一生態位的物種的集合, 他們之間可能發生密切的相互作用。結果表明保安湖浮游動物群落結構響應季節變化動態而呈現出時間網絡動態, 秋季最為簡單,夏季最為復雜, 也與夏季具有較高原生動物多樣性相對應。從秋季到夏季, 保安湖浮游動物群落結構存在著由簡單向復雜的變化趨勢。
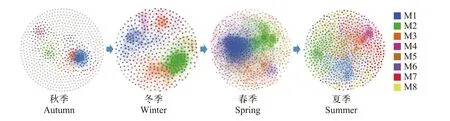
圖8 保安湖浮游動物共發生網絡Fig. 8 Co-occurrence network of zooplankton in Bao’an Lake
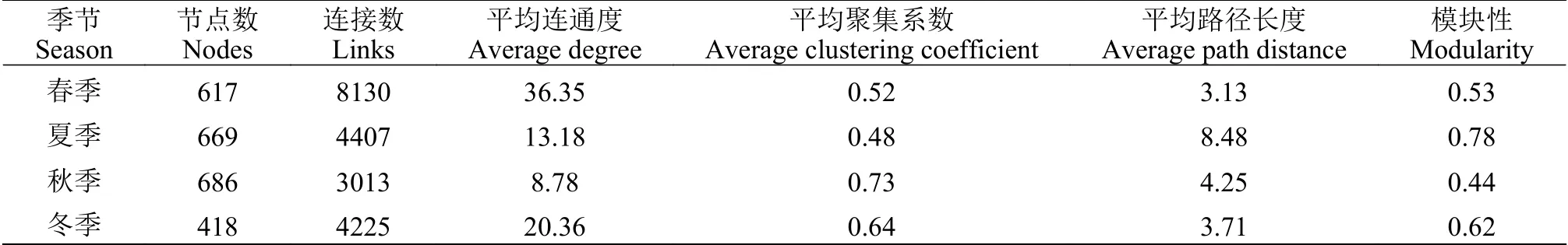
表3 微生物共生網絡特征參數Tab. 3 Characteristic parameters of the molecular ecological network of organism
3 討論
3.1 宏基因組法在浮游動物調查中的優點
本研究利用宏基因組測序, 從分子水平開展2019年度4個季節保安湖浮游動物多樣性和群落結構研究。針對浮游動物中部分類群體型微小難以鑒定的特點, 我們通過宏基因組法建立了一套基于rDNA基因序列的物種分類流程及標準, 通過提取樣本中的rDNA信息并與SLIVA NR99、PR2、nt數據庫進行比對, 選取注釋更準確, 精度更高的結果。最終的分類結果表明, 在浮游動物中通過宏基因組法優化注釋結果的類群主要為纖毛蟲、眼蟲和變形蟲等。
通過在不同樣品中加入定量的嗜熱四膜蟲, 在保證宏基因組測序深度相近的前提下, 根據四膜蟲的定量結果, 矯正了因樣品個體差異所導致的豐度計算誤差, 使樣品間的比較結果更加可靠。
3.2 保安湖浮游動物群落的時空分布
2019年全年保安湖浮游動物共鑒定出浮游動物OTUs 374種, 種類組成主要以原生動物為主, 枝角類次之, 橈足類和輪蟲最少。在20世紀90年代基于形態學方法對保安湖浮游動物鑒定的結果中, 浮游動物主要為纖毛蟲, 本研究采用的宏基因組方法很大地提升了浮游動物鑒定能力, 除纖毛蟲外, 肉足蟲、鞭毛蟲和孢子蟲等門類均可鑒定到。同時,兩次保安湖浮游動物的調查數據顯示, 保安湖浮游動物的物種組成和季節動態變化也存在差異。造成這種差異的因素有很多, 保安湖湖泊類型的轉變和氣溫升高可能是比較重要的兩個因素。同20世紀90年代相比, 2019年保安湖各站點的總氮、總磷(春季)的平均值較歷史數據提升了約2倍, 湖泊類型由貧營養型轉變為中富營養型, 浮游植物承擔的初級生產力增加, 浮游動物的食物源相對擴大[17,18],同時浮游動物組成中藻食性種類相對增多[19—21], 形成了保安湖浮游動物種群數量春夏高峰的季節變化。受強暖冬影響, 在夏季達到種群高峰的臂尾輪蟲數量下降, 導致類群間競爭減少, 而疣毛輪蟲對溫度的適應性較強, 其種群數量增加, 因此冬季保安湖浮游動物種群數量較高但種類較為單一[22]。因此, 保安湖浮游動物現存量的季節變化受浮游植物與水生植物季節性變化的雙重影響, 以及其他環境因子如溫度、pH和溶氧等也同時影響種群的季節變化, 其結果便形成了保安湖浮游動物種群數量春夏冬高峰的季節變化。
而在空間上, 在肖四海和主體湖區可觀測到更多的浮游動物種類。從不同湖區浮游動物總數來看, 除原生動物在保安湖全湖均有較高的數量分布外, 其余類群的浮游動物均主要分布于扁擔塘與肖四海。而這可能與在20世紀90年代, 根據肖四海水淺, 面積小, 主要生物元素氮、磷含量低的特點, 采取施化肥、投青料的強化培育措施有關。從湖的理化性質上來看, 保安湖是一個較好的漁業水體,水質呈弱堿性, 透明度大, 為中營養型湖泊, 且春、夏季的富營養化程度高于秋、冬季節。而從浮游動物的種類數量和豐度來看, 保安湖浮游動物集中分布于肖四海。綜合來看, 保安湖肖四海湖區群落結構多樣性良好, 同時在中富營養水體中, 由于營養鹽類較多, 可以為浮游植物提供較為豐富的營養物質, 因此也促進了浮游動物的生長[23]。因此, 保安湖肖四海湖區有著較高的漁業生產潛力, 可放養一些濾食性魚類如鰱、鳙等[24]。
3.3 浮游動物群落對環境因子的響應
浮游生物群落結構一般受多種環境因子影響,在不同的湖泊水體中, 影響群落結構的環境因子也存在差異[25]。杜明勇等[26]對太湖流域的研究顯示,影響浮游動物群落變化的主要環境因子為硝氮、總氮和溫度。為了確定水體理化因子對浮游動物群落組成的影響, 本研究進行了Spearman秩相關性分析, 其中溫度、pH、硝氮和葉綠素a是影響保安湖浮游動物群落的主要環境因子。pH很大程度上依賴于浮游藻類的豐度(與葉綠素a濃度相關), 因此, pH與浮游動物之間可能是間接相關。在本研究中, 原生動物優勢種主要為混合營養的纖毛蟲、絲足蟲和肉足蟲, 且原生動物群落與總氮、水溫有明顯的相關性與Sun 等[27]和Cai等[28]在先前發表的結果相似。因為浮游動物都有一個利于生存的最適溫度, 所以溫度往往是潛在的限制性因素[29,30], 而在楊宇峰等[31]研究顯示, 浮游動物密度和生物量都隨水體富營養化程度增加而增加, 而在相關性分析結果中, 纖毛蟲、枝角類、橈足類、輪蟲均與溫度和硝氮具有明顯的相關性, 這與之前的研究相符[32]。
3.4 浮游動物群落的互作模式
生物群落中各種生物之間存在共生、合作、競爭、掠食等相互作用, 這些相互作用決定了生物共存的模式[33]。微生物共生模型是評價微生物群落功能的重要工具。它可以揭示微生物之間潛在的相互作用[34], 并被廣泛用于研究自然環境中微生物之間的共存關系[35]。在保安湖秋季的共發生網絡中, 其所包含的節點數與邊數均低于其他3個季節, 表明與其他季節相比, 秋季浮游動物的群落復雜度最低, 浮游動物之間的相互作用更簡單或生態位的重疊更低。而秋季保安湖氮、磷、有機物的含量均較低, 同時隨著水位的降低, 保安湖水動力通量減小, 由此形成營養濃度較低的環境, 可能是造成秋季浮游動物群落簡單的主要因素。而營養物質相對豐富, 則可能導致相互作用更加復雜, 生態位重疊, 網絡結構緊密。例如, Zhang等[36]在分析大陸尺度土壤與大豆根際微生物共生格局差異時,華南地區的降水量和氣溫高于北方地區, 導致大豆根際土壤微生物共生網絡更為復雜, 生態位重疊程度高于南方地區。而在秋末冬初, 隨著保安湖水生植物的腐敗凋零, 堆積在湖底的有機物逐漸開始腐敗分解, 同時2019—2020年冬季平均氣溫較同期偏高1.5℃, 為分解者的活動提供了有利條件。而分解出來的營養物質促進了細菌的生長, 也就促進了纖毛類和輪蟲的生長繁殖。因此, 保安湖其余季節的營養物質相對豐富, 也就造成了保安湖浮游動物群落復雜度在春夏較高, 冬季其次, 秋季最低的季節性變化規律。
3.5 江湖阻隔下保安湖浮游動物多樣性變化
歷史上, 長江流域的湖泊均與長江自然連通,從而形成典型的江湖復合生態系統。近幾十年來,由于大規模的圍墾造田、修筑堤壩等人類活動的干擾, 嚴重地破壞了江湖復合的生態系統, 而保安湖也于1964年為便于控制水位, 即以隔斷梁子湖而建設東溝閘。同1986年調查數據相比, 保安湖浮游動物種類數量呈上升趨勢, 而這可能與洄游及半洄游魚類消失和保安湖營養水平增加兩方面因素所致。受江湖阻隔的影響, 保安湖漁業多樣性降低,魚類對浮游動物攝食的能力降低[37]。另外, 江湖阻隔影響了湖泊的水文節律、換水周期, 大大增加了流域內入湖污染物在湖體的滯留時間, 使得湖區富營養化加重, 從而影響了保安湖浮游動物的種類數量[38, 39]。
4 結論
本研究基于宏基因組測序技術揭示保安湖湖泊系統中浮游動物的物種多樣性, 展現出其檢測低豐度稀有物種的潛力, 彌補了傳統形態分類學方法的不足[40]。而宏基因組測序技術在分析環境樣品生物多樣性中存在一些不足, 例如, 不同類群的18S rDNA 基因的拷貝數存在很大差異, 因此18S豐度只能反映環境中DNA的豐度, 而不能真實反映物種個體的絕對數目; 物種注釋對rDNA數據庫的完整性存有很大依賴, 部分類群的序列信息的缺乏會影響分類的準確性及種類數量的評估[41]。未來, 通過優化現有的數據庫、篩選其他的 DNA條形碼等途徑建立一套鑒定精度更高的分析方法, 將對環境樣品生物多樣性和群落結構研究具有重意義。

