OptiPrep密度梯度分離液分離培養小鼠原代肝星狀細胞的實驗研究
黃會芳, 鄧志華, 嚴 微, 黃 卓, 姚佳心
1.山西醫科大學第一醫院消化科, 山西 太原 030001; 2.山西醫科大學第二醫院消化科
肝星狀細胞(hepatic stellate cells,HSC)位于肝竇周圍的間隙內,在生理情況下呈靜止狀態,是維生素A的主要儲存處,參與維生素A的代謝,另外還有調節血管和肝竇血流的作用。在病理條件下HSC受多種細胞因子的作用,表達α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA),出現肌成纖維母細胞(myofibroblast,MFB)樣表型轉化,出現細胞增殖,合成細胞外基質(extracellular matrix, ECM)增加等,活化的HSC成為肝纖維化發生發展的關鍵因素[1]。近年來HSC的免疫學特征也逐漸被人們認識,活化的HSC具有免疫細胞特征,并分泌具有免疫調節功能的細胞因子,直接參與肝臟的免疫調控[2-3]。目前研究發現,HSC可作為非專職抗原提呈細胞,可獲得肝內、肝外抗原提呈功能,發揮免疫調節作用,誘導反應性T細胞凋亡,活化的HSC表達MHCⅡ、MHCⅠ、CD80、CD86,在肝臟移植中,活化的HSC以IL-2依賴的方式可選擇性誘導擴增異基因Treg細胞,提高Treg細胞的免疫耐受和免疫抑制作用,減少肝細胞移植的免疫反應,提高肝細胞移植的存活率[4-6]。因此,對HSC的研究是目前科學界逆轉肝纖維化和治療免疫性肝病的希望所在。分離培養原代HSC成為科學界對HSC研究的關鍵,獲得足夠的有活力的原代HSC是順利開展肝纖維化、免疫性肝病、肝移植等相關研究的重要保證。
HSC位于Disse間隙內,緊貼肝竇內皮細胞(sinusoidal endothelial cells,SEC)和肝細胞,常伸出數個星狀胞突包繞肝血竇,由于HSC是肝臟非實質細胞,只占肝細胞總體數目的5%~8%及總體體積的1.4%[7],且與其他細胞如肝臟Kupffer細胞密度接近,分離培養技術要求高,活體肝臟灌注消化分離HSC非常困難,分離小鼠的HSC相比分離大鼠的HSC更困難。OptiPrepTM分離液的主要成分是碘克沙醇,碘克沙醇是一種高親水性非離子的物質,這就決定了OptiPrepTM分離液是一種高密度、低黏度的溶液,在加入適當濃度的基本培養基或緩沖液,如PRMI、蔗糖或Hepes后,可將OptiPrepTM配制成連續的或不連續的等滲密度梯度溶液,它的密度和滲透性成線形關系,可用于各種細胞、細胞器、脂蛋白的分離[8-10]。
經過摸索研究,本實驗選用了制作方便、密度準確的OptiPrepTM密度梯度離心分離液,結合肝臟原位手工灌注法,并對分離過程的諸多細節反復摸索、改進,探索出一套得率高、純度高、存活率高的小鼠原代HSC的提取、培養方法。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物:BALB/c小鼠(見圖1A),SPF級,雄性,6~8周齡,體質量25~30 g,由山西醫科大學實驗動物中心提供,均予普通飼料喂養,自由進食,飼養環境為清潔級。
1.1.2 主要試劑:小鼠α-SMA單克隆抗體(Mouse Anti-α-SMA)(BM0002)、小鼠結蛋白單克隆抗體(Mouse Anti-Desmin)(BM0036)購自武漢Boster公司,膠原酶Ⅳ(Collagenase Ⅳ)(C8160)購自美國Solarbio公司,油紅O染色試劑(Oil Red O Staining Kit)(G1260)購自美國ScienCell公司,DNase I(Deoxyribonuclease I)(D8071)購自Sigma公司,OptiPrepTM分離液(1114542)購自挪威Axis-shield公司,胎牛血清(fetal bovine serum,FBS)(0510)購自美國Gibco公司,青鏈霉素混合液100×(青霉素10 000 U/ml,鏈霉素10 mg/ml)(P1400-100)購自美國Solarbio公司,DMEM(高糖)培養液(PYG0073)、0.25%胰蛋白酶(PYG0086)、Hanks緩沖液(PYG0081)、D-Hanks緩沖液(不含酚紅)(PYG0079)、SABC試劑盒(SA0025)均購自武漢Boster公司。
1.2 實驗方法
1.2.1 肝臟手工灌注消化:采用3%戊巴比妥鈉(60 mg/kg)腹腔注射麻醉,起效后固定小鼠于超凈工作臺,75%乙醇洗浴消毒腹部,剖腹,充分暴露門靜脈、下腔靜脈。用兒科止血鉗夾閉肝上下腔靜脈,手持24G套管針穿刺入肝下下腔靜脈,手術縫線固定套管針,剪開門靜脈(見圖1B)。手持50 ml注射器連接24G套管針,手工注入37 ℃預熱的D-Hanks液約50 ml,以5~7 ml/min的速度灌入,肝臟顏色逐漸變黃變白,門靜脈流出的血液變為無色液體后,換為37 ℃預熱的HBSS液(含0.4 mg/ml膠原Ⅳ)約50 ml,以3~5 ml/min的速度推注灌注液,灌注過程中肝臟顏色逐漸變黃變白,表面變軟變脆,表面皺縮,壓之凹陷不易恢復時(見圖1C),停止灌注,拔出套管針,取下夾閉肝上下腔靜脈的血管鉗。
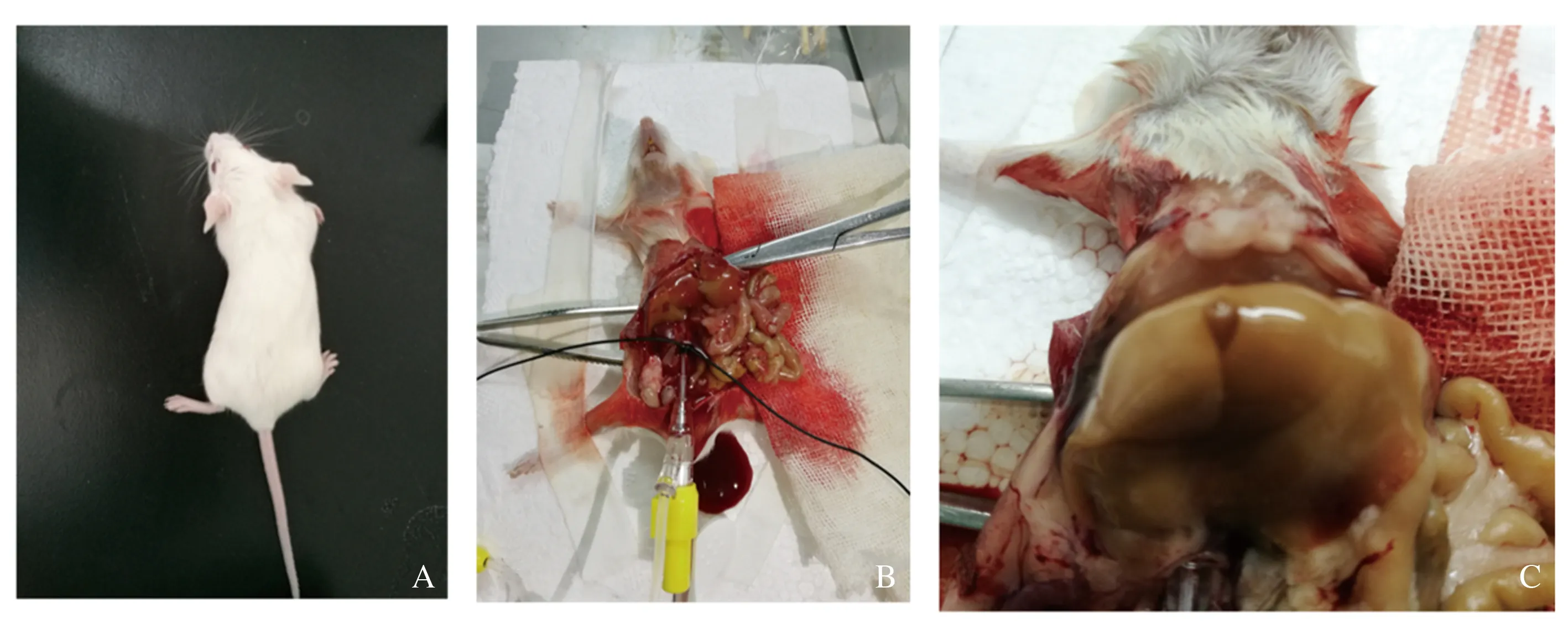
注:A:實驗用的BALB/c小鼠;B:血管鉗夾閉肝上下腔靜脈,24G套管針穿刺入肝下下腔靜脈,固定套管針,剪開門靜脈,肝下下腔靜脈灌入灌注液;C:肝臟顏色逐漸變黃變白,表面皺縮,灌注成功。
1.2.2 細胞分離培養:(1)細胞分散:用止血鉗鉗夾肝門部韌帶將血管提起,小心剪斷肝門部血管韌帶、膽囊、下腔靜脈,小心剝離肝臟周圍韌帶,迅速將肝臟移入消毒器皿內,HBSS液10 ml沖洗,在培養細胞的超凈工作臺面,充分細致剪碎肝組織成勻漿狀,加入配制好的HBSS液20 ml(含0.4 mg/ml膠原Ⅳ,20 μg/ml DNase I),恒溫水浴振蕩器中38.5 ℃震蕩消化20 min,若有未消化完全的顆粒狀物,可適當延長5 min。
在比較法上,對于應收賬款質押合同的形式的要求不盡相同。其中我國的臺灣地區和意大利、瑞士的立法明確要求當事人在設立質權時必須要簽訂書面合同;而日本、法國和德國的立法則沒有此項的強制規定,即口頭或者書面形式都可以。
(2)細胞分離:細胞懸液中加入4 ℃ HBSS液(含20% FBS)20 ml混勻終止消化,經200目濾網過濾入50 ml離心管中;將過濾過的細胞懸液分裝入4個15 ml離心管中,600g,4 ℃離心10 min,吸管吸出上清液至離心管2.5 ml處;混合至兩個15 ml離心管,加入DNaseⅠ酶20 μg/ml,重懸,再加入HBSS至12 ml,重懸,600g,4 ℃離心10 min,吸管吸出上清液棄掉;15% OptiPrep 4 ml(含DNaseⅠ20 μg/ml)重懸肝臟非實質細胞(兩個離心管液體混合),重懸之后實際為12.5%,上層再小心用1 ml注射器貼壁小心加入11.5% OptiPrep 4 ml,再上層用1 ml注射器貼壁小心加入3 ml HBSS液;4 ℃ 1 400g離心18 min,在HBSS與11.5% OptiPrep之間可見白色界面層細胞(見圖2A),小心用1 000 U槍頭吸出界面層細胞入4 ml HBSS液,重懸;4 ℃ 650g離心10 min,吸去上清棄掉,可見管底少量沉淀物為分離到的原代HSC(見圖2B)。

圖2 分離到的白色界面層細胞(A)及管底少量沉淀物(B) Fig 2 Isolated white interface layer cells (A) and a small amount of sediment at the bottom of the pipe (B)
(3)細胞傳代:分離到的原代HSC中加入含20% DMEM-高糖培養液(含1%青鏈霉素混合液100×)5 ml,活細胞鑒定后,裝入30 ml培養瓶,放入37 ℃孵箱(含體積分數為5%的CO2)培養;培養12 h有部分細胞貼壁,24~48 h細胞貼壁增多,PBS清洗2遍,加入含10%FBS的DMEM-高糖培養液(含1%青鏈霉素混合液100×)5 ml換液;倒置顯微鏡觀察細胞形態,貼壁情況,細胞培養液顏色、渾濁度等;每2~3 d細胞培養液換液1次,置入孵箱繼續培養,鏡下觀察細胞呈星芒狀生長至覆蓋培養皿底80%~90%,可考慮傳代培養,7~10 d傳代1次,按照1∶2或1∶3傳代培養。
1.3 原代HSC的鑒定
1.3.1 活細胞鑒定:取90 μl細胞懸液,加入0.4%臺盼藍溶液10 μl,混勻后光鏡下未著色者為活細胞。倒置熒光顯微鏡下細胞內脂滴豐富,折光較強,在熒光顯微鏡328 nm波長的紫外光激發下,自發一過性藍綠色熒光。用細胞計數板、計數器計算細胞得率和存活率(未著色細胞/鏡下總細胞數)。
1.3.2 性質鑒定:(1)油紅O染色:用24孔培養板制作細胞爬片48 h;倒置熒光顯微鏡下觀察細胞貼壁良好,用PBS輕緩漂洗3遍;加入4%中性甲醛固定30 min;稀釋油紅儲存液,油紅∶去離子水=3∶2,濾紙過濾,室溫放置10 min;染色10~20 min,加至體積覆蓋住板底即可;用60%異丙醇分化脫色,去除多余的染料;復染,淡蘇木素染色10~15 s(根據核染情況決定時間長短),PBS漂洗;甘油明膠封片;鏡下觀察;ScanScope數字病理掃描儀掃描。(2)Desmin及α-SMA免疫細胞化學染色:用24孔培養板制作細胞爬片48 h;用PBS漂洗2 min×2次;加4%中性甲醛室溫固定30 min;PBS漂洗2 min×3次;0.5% Txitonx-100室溫處理20 min;3% H2O2室溫處理15 min;PBS漂洗2 min×2次;試劑盒中血清封閉液封閉30 min;取出甩干封閉液,加一抗(PBS稀釋為1∶100),陰性對照用PBS代替,4 ℃過夜;PBS漂洗,3 min×3次;二抗孵育,試劑盒中的生物素化,37 ℃,20 min;PBS漂洗,2 min×3次;SABC孵育,濕盒內37 ℃,20 min;PBS漂洗,4 min×3次;加適量的DAB顯色液顯色,鏡下觀察細胞顯色情況;自來水沖洗;蘇木素復染;自來水沖洗;封片劑封片;鏡下觀察;ScanScope數字病理掃描儀掃描。
2 結果
2.1 原代HSC得率和存活率臺盼藍染色后鏡下觀察計數分離的細胞,小鼠原代HSC得率為(2~5)×106/只,存活率在95%以上。
2.2.1 倒置熒光顯微鏡觀察:(1) 鏡下觀察,新分離的HSC呈圓形,具有折光性;培養12 h后大部分細胞貼壁;24 h后多數細胞呈圓形或紡錘形,已貼壁;48 h后貼壁的細胞體積增大開始伸展,數量增多,呈現梭形或星形,少數細胞伸出偽足,但細胞仍處于靜止階段(見圖3A);培養5 d細胞數量增多,呈梭形或星形,伸出偽足(見圖3B),培養7 d細胞數量明顯增多,細胞呈長梭形,伸出細長的偽足(見圖3C),說明細胞已經開始或部分活化。(2)倒置熒光顯微鏡下觀察:新分離的HSC具有豐富的脂滴,在328 nm波長的紫外光激發下自發藍綠色熒光,并在數秒內迅速減退(見圖3D)。
2.2.2 原代HSC油紅O染色:原代HSC培養48 h貼壁后,油紅O染色,可見胞漿中的脂滴呈紅色,細胞核復染后呈藍色(見圖3E~3F)。
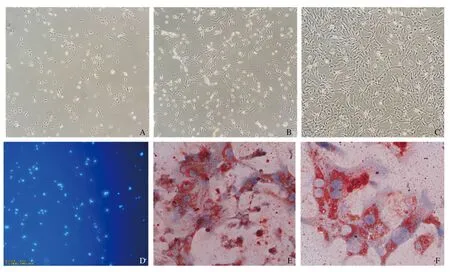
注:A:分離培養48 h的原代HSC(放大200倍);B:培養5 d的原代HSC(放大200倍);C:培養7 d的原代HSC,細胞數量明顯增多,細胞呈長梭形,伸出細長的偽足(放大200倍);D:在328 nm波長的紫外光激發下HSC自發藍綠色熒光(放大100倍);E:培養48 h的原代HSC油紅O染色(放大200倍);F:培養48 h的原代HSC油紅O染色(放大400倍)。
2.2.3 Desmin免疫細胞化學染色:Desmin染色:小鼠原代HSC培養48 h、7 d和傳2代消化后培養48 h的HSC培養皿內貼壁生長后,進行Desmin免疫細胞化學染色。Desmin陽性細胞胞漿染色為棕色顆粒,分離后培養48 h的原代HSC Desmin染色約60%呈陽性,原代HSC培養7 d Desmin陽性染色達100%,傳2代培養的HSC Desmin陽性染色達100%(見圖4A)。
2.2.4 α-SMA免疫細胞化學染色:α-SMA染色:小鼠原代HSC培養48 h、7 d和傳2代消化后培養48 h的HSC培養皿內貼壁生長后, 進行α-SMA免疫細胞化學染色。α-SMA陽性細胞胞漿染色為棕色顆粒,分離后培養48 h的原代HSC α-SMA 染色約5%呈陽性;原代HSC培養7 d α-SMA陽性染色為60%~70%;傳2代培養的HSC α-SMA陽性染色達100%(見圖4B)。
3 討論
肝纖維化是各種慢性肝損傷的病理結果,如無有效治療,多數患者最終會發展為肝硬化、原發性肝癌、肝功能衰竭等,嚴重威脅著肝病患者的生存質量。HSC在肝纖維化發生發展中發揮著關鍵作用[11]。近年來發現HSC作為一種非專職抗原提呈細胞,參與肝臟免疫反應。在肝移植宿主對異體肝臟的免疫排異和免疫耐受中發揮著一定作用。因此,對HSC的研究是目前科學界逆轉肝纖維化和肝移植存活及免疫性肝病免疫耐受的希望所在。
目前分離HSC需要考慮幾方面的因素:(1)小鼠體積小,肝臟重量輕,HSC作為非實質細胞,數量極少;(2)HSC與Kupffer細胞密度相近,影響分離的純度;(3)HSC易與肝細胞吸附,影響分離效果。因此,去除混雜的肝細胞和其他間質細胞得到高純度、高得率的原代HSC是分離培養HSC的難點。目前國際上提取小鼠HSC的方法報道多采用肝臟原位灌注和密度梯度離心法相結合的方法[12-13]。本實驗選用OptiPrep密度梯度分離液,提取到純度高、得率高的HSC,值得總結推廣。
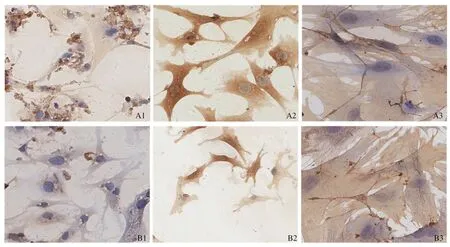
注:原代HSC分離培養48 h(A1)、7 d(A2)、傳2代HSC消化后培養48 h(A3)Desmin免疫細胞化學染色(放大400倍)和原代HSC分離培養48 h(B1)、7 d(B2)、傳2代HSC消化后培養48 h(B3)α-SMA免疫細胞化學染色(放大400倍)。
由于小鼠體積小,臟器脆弱,血管纖細,操作難度大,所以操作時速度要快、穿刺要準。從插管成功到灌注結束,操作過程不超過20 min。本實驗中選擇血管鉗直接夾閉肝上下腔靜脈,充盈肝下下腔靜脈和門靜脈,一方面可以縮短手術操作時間,另一方面血管鉗夾閉操作快,不易穿破胸腔,降低小鼠死亡率,延長存活時間,留出更多時間用于肝臟灌注,利于HSC的有效提取。采用24G套管針穿刺肝下下腔靜脈,而未選擇門靜脈穿刺,是由于下腔靜脈直徑較門靜脈直徑粗,相對易于操作,整個灌注過程中套管針易于固定,不易因灌流壓力高而刺破血管。在灌注的不同階段需要采取不同灌注壓力和速度,開始階段為了快速沖洗出肝臟中的血液、免疫活性細胞、Ca2+以及其他雜質,要求壓力高、速度快,之后灌注含膠原酶的液體時,需要酶液和肝臟的充分接觸,達到更好的消化效果,另外活體灌注,以利于提取出高質量、高得率的HSC,因此,本實驗采用原位灌注結合手工靜脈推注法以滿足以上要求。首先灌注D-Hanks液,D-Hanks液不含鈣鎂離子,以免鈣鎂離子影響肝臟的存活狀態,酶灌注時選擇Hanks液,Hanks液中有鈣離子,這樣利于擴張血管,酶灌注速度相對緩慢,使酶與肝組織接觸更充分。灌注結束時,肝臟變脆,黃白色,壓之凹陷不恢復,肝臟表面肝包膜皺縮,達到理想灌注效果。
肝臟灌注結束后,剪除膽囊、肝上下腔靜脈,小心剝離肝臟周圍韌帶,充分細致剪碎肝組織成勻漿狀,盡可能減少塊狀肝組織殘留,以免影響細胞分散進而影響HSC得率。雖然鏈霉蛋白酶可以選擇性消化肝細胞,但其對HSC也有一定的損傷,為避免此酶對HSC的毒副作用,我們選擇DNase I酶避免了鏈霉蛋白酶的毒副作用,在容易破壞肝細胞步驟中均加入一定量的DNase I酶,清除在消化過程中被破壞的大量肝細胞釋放出DNA,由于DNA帶有粘性,使得包括HSC在內的各種細胞粘成一團,直接影響細胞的得率。
選擇合適的密度梯度介質及建立準確的密度梯度離心體系是分離純化HSC、提高HSC得率的關鍵步驟。密度梯度分離液的選擇要遵循操作簡便、液體易配、密度準確的原則。本研究選用OptiPrep密度梯度分離液,該分離原液為含碘克沙醇(iodixanol)的梯度分離液,原液密度為60%,只需按照操作說明書用HBSS配制成相應密度梯度分離液,與其他密度梯度介質相比,具有操作簡便、密度準確、對細胞的粘附小較易洗脫、使提取時液體分層明顯、可直接觀測等優點。HSC密度為1.047~1.061 g/ml,而Kupffer細胞密度為1.083~1.095 g/ml,15% OptiPrep密度梯度分離液重懸細胞后實際濃度為12%~13%,11.5% OptiPrep密度梯度分離液密度約1.063 g/ml,分離后,HSC位于11.5% OptiPrep密度梯度分離液與HBSS液面層之間的界面層細胞,能保證HSC的純度。
無菌操作觀念要強,任何一個操作步驟均需嚴格掌握無菌操作技術,才能使后續分離到的HSC在培養過程中生長良好。無菌操作技術主要體現在三個大的操作步驟過程中:(1)體外肝臟灌注及摘除肝臟:從開始的液體配制,包括液體的過濾到灌注,手術過程包括手術器械消毒,剖腹、灌注、去除肝薄膜及周圍血管韌帶等,到將灌注好的肝臟移入無菌器皿;(2)密度梯度離心法提取細胞:包括細胞消化分散、密度梯度離心提取細胞,分離到的細胞孵箱培養;(3)孵箱培養細胞的換液、傳代,到細胞爬片、免疫組化檢測等。幾十個步驟均需嚴格無菌操作,才能確保有效分離到原代HSC。
HSC為儲存維生素A的儲脂細胞,剛分離出的原代HSC含大量脂滴,并含維生素A而自發熒光[14]。在倒置熒光顯微鏡下紫外光激發下自發藍綠色熒光。油紅O染色陽性,分離培養48 h的HSC貼壁生長,處于靜止期的HSC富含脂滴,代表靜止期的HSC為儲脂細胞,維生素A含量豐富[15]。具有肌細胞特點,細胞質中含有Desmin,穩定地存在于剛分離出及傳代的HSC中,Desmin免疫細胞化學染色陽性。新鮮分離的HSC Desmin染色陽性率達60%,7 d后達100%,與報道[16]一致。活化HSC是肝纖維化發生發展的關鍵,活化的HSC表達α-SMA,α-SMA染色陽性是其活化的標志,在分離HSC 48 h后,α-SMA幾乎不表達,在體外培養環境中,原代HSC可自發活化,培養7 d的HSC可達到近70%活化,傳2代的HSC全部活化。
總之,整個操作過程中嚴格無菌操作,動作熟練、準確、輕柔,最大程度防止細胞污染和細胞損傷,保證小鼠原代HSC分離、培養成功。本實驗采用的OptiPrep密度梯度分離液結合肝臟原位手工灌注法分離到高得率、高純度的小鼠原代HSC,且操作簡單易行,適于廣泛開展,為進一步研究HSC奠定基礎。

