miRNA-34a靶向Bcl-2對肝癌細胞HepG2的生長和遷移能力的影響*
張游俠 嚴其康 陳玉然 郝佳奇 朱金玲
(佳木斯大學基礎醫學院,黑龍江 佳木斯 154007)
原發性肝細胞癌(Hepatocellular carcinoma,HCC)簡稱肝癌,指發生于肝臟的惡性腫瘤,是臨床上最常見的惡性腫瘤之一。根據最新統計,HCC全球發病率已超過62.6萬/年,居于惡性腫瘤的第5位, 正嚴重威脅人類健康和生命。中國是肝癌的高發國家,2020 年新增與死于HCC的患者均處于世界前列[1]。盡管目前外科手術、消融治療等技術日益發展,但由于腫瘤復發和肝內轉移導致HCC患者的5年生存率仍然很低。因此,探索肝癌生物學的發生發展機制,尋找新的治療靶點以改善目前HCC的治療方式有著重要意義。MicroRNA(miRNA)是近年發現的一種十分重要的非編碼小RNA, miRNA在基因調控中起重要作用,其通過基因轉錄后調控來調節細胞的各種生理過程,其中包括細胞凋亡,炎癥,腫瘤發生等[2], miRNA在肝癌中也發揮著重要功能,主要通過抑制基因以及靶向致癌基因在癌癥的進展及轉移過程中進行有效參與[3]。miRNA-34a是miRNA的一種,活化的miRNA-34a可阻止腫瘤細胞的遷移和浸潤[4]。有多項研究顯示miRNA-34a在肝癌中表達水平顯著低于癌旁組織,miRNA-34a參與肝癌的發生發展,與肝癌惡性程度密切相關[5-6],還有研究報道,在乳腺癌,胃癌,肺癌等多種人類癌癥中miRNA-34a的表達也異常增高[7-8],但其作用機制并不明了,又因Bcl-2在肝癌組織中高表達,抑制細胞凋亡。基于此,本研究通過體外過表達miRNA-34a,探討miRNA-34a與Bcl-2的靶向調節,以及miRNA-34a對肝癌HepG2細胞增殖和遷移能力的影響,為肝癌的治療提供新靶點。
1 材料與方法
1.1 主要材料與試劑 人肝癌細胞系HepG2購于中國科學院生物科學研究所;FBS 和DMEM購于美國Gibco公司;riboFECTTMCP轉染試劑盒、miRNA-34a mimics(miRNA-34a模擬物)和其陰性對照物mimics NC購于中國銳博生物;雙熒光素酶測定試劑盒購于中國易錦生物;Trans-well小室購于美國Corning公司; MiniBEST通用RNA提取試劑盒、Prime Script RT Master Mix試劑盒、TB GreenTMPremix Ex TaqTMII購于中國Takara公司;Western blot細胞裂解緩沖液,ECL曝光液購于中國碧云天生物;Bcl-2 Antibody,Gapdh Antibody購于美國Affinity公司。
1.2 方法
1.2.1 細胞培養與轉染 在含有10%FBS的DMEM中培養HepG2細胞。在37℃,5%CO2和95%濕度的培養條件下進行細胞培養。將肝癌細胞分為2個組:對照組(轉染miRNA-34a陰性對照物mimic NC);miRNA-34a轉染組(轉染miRNA-34a模擬物)。細胞以1.8×105/孔的密度接種于24孔板中。依據試劑說明書使用riboFECTTMCP轉染試劑盒試劑進行轉染。
1.2.2 CCK8檢測miRNA-34a對肝癌細胞活力的影響 細胞以3×103/孔的密度接種于96孔板中培養并轉染。檢測1、2、3、4、5、6和7 d的細胞活力(在450 nm波長下檢測樣品OD值)。最后以吸光度值為縱軸,時間為橫坐標繪制細胞增殖曲線。
1.2.3 miR-34a靶標預測 用TargetScan(http://www.targetscan.org)數據庫預測miR-34a的靶標基因。
1.2.4 熒光素酶報告基因檢測miRNA-34a對Bcl-2靶向調控 把miRNA-34a模擬物和熒光素報告對照載體分別與wild-type of Bcl-2、mutant of Bcl-2和Negative control的pEZX-MT06的熒光素酶報告載體一起共轉染(表1)。轉染后36 h,使用雙熒光素酶測定試劑盒檢測熒光素酶活性。

表1 熒光素酶報告基因檢測分組
1.2.5 Trans-well檢測miRNA-34a對肝癌細胞遷移能力的影響 調整細胞濃度為1×105個/mL, 取200 μL接種于transwell小室上室中,下室加入含有10%FBS的DMEM培養液550 μL。繼續培養12 h后,PBS清洗,再用4%多聚甲醛固定10 min,并在室溫下用吉姆薩染色液染色10 min。最后使用顯微鏡拍照計數遷移的細胞數目(吉姆薩染色細胞數)。
1.2.6 qRT-PCR檢測過表達miRNA-34a對肝癌細胞中Bcl-2的表達量的影響 將培養的細胞按TaKaRa MiniBEST通用RNA提取試劑盒說明書操作提取細胞總RNA,按Prime Script RT Master Mix試劑盒說明書操作進行cDNA合成。使用TB GreenTMPremix Ex TaqTMII試劑盒進行實時定量PCR反應,Gapdh為內參基因,Bcl-2基因的引物序列為F: ATT GTGGCCTTCTTTGAGTTCG,R:CATCCCAGCCT CCGTTATCC;內參Gapdh基因的引物序列為F:CCAAAATCAGATGGGGCAATGCTGG,R:TGAT GGCATGGACTGTGGTCATTCA。相對表達量采用2-ΔΔCt法計算。
1.2.7 Western blot檢測過表達miRNA-34a對肝癌細胞中Bcl-2的表達量的影響 收集培養好的細胞提取總蛋白并測定濃度,SDS-PAGE凝膠電泳,轉膜(用含5%脫脂奶粉的TBS溶解液, 37℃孵育PVDF膜),封閉1 h,然后一抗孵育過夜(Bcl-2,1∶500;Gapdh,1∶5000;4℃)。然后室溫孵育二抗1 h,使用ECL溶液曝光,最后使用Tanon凝膠軟件分析系統分析蛋白質條帶的光密度值,以目的條帶和Gapdh條帶的比值作為蛋白表達水平。
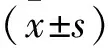
2 結果
2.1 過表達miRNA-34a抑制HepG2細胞的增殖能力 CCK8實驗結果顯示,miR-34a 轉染組的細胞增殖能力和細胞活力明顯低于對照組,差異具有統計學意義(P<0.05)。見表2。
2.2 過表達miRNA-34a抑制HepG2細胞的遷移能力 轉染后的HepG2細胞進行Transwell小室遷移實驗,結果顯示,miRNA-34a轉染組的細胞遷移能力

表2 過表達miRNA-34a抑制肝癌細胞增殖
明顯低于對照組,差異具有統計學意義(P<0.01)。見圖1。

圖1 過表達miRNA-34a抑制HepG2細胞的遷移能力(n=3)
2.3 Bcl-2是miRNA-34a的下游靶標 生物信息學方法預測Bcl-2是miRNA-34a的潛在下游靶標(圖2A)。在HepG2細胞中進行雙熒光素酶實驗證實Bcl-2是miRNA34a的靶點(圖2B),雙熒光素酶報告基因的檢測結果表明,過表達miRNA-34a可顯著下調Bcl-2野生型熒光素酶報告基因的活性(P<0.01),并且對其它組無作用。

圖2 Bcl-2是miRNA-34a的下游靶標(n=3)
2.4 在肝癌細胞中過表達miRNA-34a下調Bcl-2的表達 qRT-PCR和Western blot實驗結果均顯示miRNA-34a組的Bcl-2表達量明顯低于對照組,差異具有統計學意義(P<0.05)。見圖3。

圖3 miRNA-34a在肝癌細胞中下調Bcl-2的表達量(n=3)
3 討論
肝癌對人類的健康和生活產生了巨大的危害,肝癌的發病率在不斷增加。因此研究肝癌的發生發展機制、尋找一種可以用于治療肝癌的新靶點是我們急需解決的問題。近十幾年來,miRNA這種表觀遺傳學調控分子受到了越來越多的關注,有多種miRNA參與肝癌的發生和發展,與肝癌臨床惡性表型及抗藥性密切相關[9-11]。miRNA-34a在多種癌癥中均表達異常[12-14]。此外有研究報道,在肝癌患者中miRNA-34a低表達[5-6],這表明miRNA-34a可能參與肝癌的發展過程。為此本研究將miRNA-34a mimics NC和miRNA-34a mimics分別轉染進入HepG2細胞來研究miRNA-34a對肝癌細胞的增殖和遷移能力的影響,通過CCK8和Transwell實驗發現過表達miRNA-34a能夠明顯的抑制HepG2細胞的活力和遷移能力, 研究結果與郭瑛等[15]的研究結果類似。表明過表達某些miRNA可抑制肝癌細胞的增殖能力,因此推測miRNA-34a可能有助于治療肝癌。在其他類型的人類癌癥中也有類似的發現。為了更加深入的了解miRNA-34a抑制HepG2細胞的活力和遷移能力的原因,本研究推測這與其下游靶標有關,因此應用生物信息學方法Target Scan數據庫預測miRNA-34a的下游靶標,篩選出腫瘤界中備受關注的癌基因Bcl-2。近年來Bcl-2在腫瘤的發生發展過程中被廣泛關注[16],Bcl-2能夠參與細胞凋亡的起始階段,和Bax等促凋亡蛋白結合,阻止線粒體膜透化(MOMP),防止細胞色素C等凋亡因子從線粒體中釋放,最終達到抗細胞凋亡的作用[17-18]。研究發現Bcl-2高表達的細胞增殖能力和遷移能力高,這種現象在其他腫瘤中也得到了證實[19]。另外還有研究報道Bcl-2不僅可以影響肝癌細胞的生長,侵襲等,而且對肝癌的耐藥性也有影響[20]。這些都表明Bcl-2作為癌基因在肝癌中發揮重要作用。為了進一步驗證miRNA-34a是怎樣發生生物作用,本研究用雙熒光素酶報告實驗確定了BcL-2是miRNA-34a的靶基因,并且通過qRT-PCR和Western blot的實驗結果確定了miRNA-34a能夠直接下調Bcl-2的表達。
總之,以上結果表明miRNA-34a對肝癌細胞的增殖和遷移能力具有抑制作用并且這種作用可能是通過miRNA-34a直接靶向并下調Bcl-2而造成的。本研究不僅為肝癌的發生和發展的潛在機制提供了新的見解,而且還為肝癌的治療提供了新的思路。但是miRNA-34a的靶標不僅只有Bcl-2,還有許多其他的靶標。因此miRNA-34a對肝癌的影響可能還有其它的機制。為此,在后續的研究中會進一步探討。
4 結論
miRNA-34a可靶向并負向調控Bcl-2的表達,降低肝癌細胞HepG2的活力和遷移能力,可為肝癌的治療提供新靶點,并為探討肝癌的發病機制提供理論基礎。

