紅球菌Y-1發酵條件優化及其抗菌活性物質初探
何玲敏,吳秋芳,胡高陽,李 悅,杜煜潔,張美玲,蔡 新,李鎖平,郭瑞林
(1.安陽工學院 生物與食品工程學院,河南 安陽 455000;2.河南省太行山林業有害生物野外科學觀測研究站,河南 林州 456550;3.河南大學 生命科學學院,河南 開封 475000)
小麥赤霉病(Fusarium Head Blight,FHB)別名麥穗枯、爛麥頭、紅麥頭,是一種世界范圍內廣泛流行的麥類作物上的真菌病害。禾谷鐮刀菌(Fusarium graminearumSchwabe)是引起小麥赤霉病的主要病原菌[1]。河南省是我國小麥種植面積最大的省份,小麥赤霉病亦是當地小麥生產的主要病害。該病害的發生對小麥的產量和品質均會造成影響,其分泌的真菌毒素可引起人、畜中毒。
隨著人們生活水平的提高和對高品質生活的追求,保護環境、倡導生態和諧和實施可持續發展越來越受到重視,進而提出了“公共植保、綠色植保”的理念。因此,生產上迫切需要一種可持續、環保、高效的防治措施來控制小麥赤霉病的發生和危害。生物防治技術具有對人畜及生態環境影響小、專一性強、對農產品無污染、不易使病蟲害產生耐藥性等優點,符合環境及農業可持續發展的理念,被認為是最有前途的化學農藥替代品,在許多國家已被開發為商業化的生物肥料或生防菌劑[2]。
鑒于目前尚無理想的高抗赤霉病的小麥品種,因此生物防治技術將是一種更有效、更環保的農產品生產方法,是小麥可持續發展的重要保障[3]。用于生物防治的微生物主要是從不同生態系統中的植物、土壤中篩選得到的拮抗菌,包括細菌、真菌和放線菌等[4]。拮抗微生物對病原真菌的作用方式多樣,包括抗生作用、競爭作用、重寄生作用,溶菌作用,誘導抗病性等。國內外許多學者在有益拮抗菌的研究和應用方面做了大量工作并取得積極成果,有效菌株主要有芽孢桿菌(Bacillusspp.)[5]、假單胞菌(Pseudomonasspp.)[6]、木霉菌(Trichodermaspp.)[7]。徐劍宏等[8]從土壤中分離到的枯草芽孢桿菌AF0907能抑制禾谷鐮刀菌菌絲的生長和孢子的萌發,且可有效降低小麥赤霉病的發病率,防治效率可達40%以上。藺國強等[9]從土壤中分離到一株解淀粉芽孢桿菌,其對小麥赤霉病的防治效果達80%以上。Khan等[6]首次報道了假單胞菌可用于防治小麥赤霉病并同時減少DON(脫氧雪腐鐮刀菌烯醇)毒素的分泌量。
拮抗菌株在代謝過程中產生的抗生素、抗菌蛋白或細胞壁降解酶等次級代謝產物可直接對抗病原菌,從而使植物抵抗病原菌的入侵、潛伏和擴散,菌株產生的次級代謝產物越多,其生物防治效果就越強[10]。關于小麥赤霉病生防菌株的生防機制的研究,大多數研究者認為拮抗菌株在小麥穗部等組織產生的一些細胞壁降解酶以及次級代謝產物等抗菌活性物質,在赤霉病的防治中起著關鍵作用[7,11],然而,拮抗菌株發酵液中具體哪些物質發揮了拮抗作用,其具體的生防機制是什么,以及能否將拮抗菌研制成生物制劑運用到小麥赤霉病的生物防治中,這些問題都制約了小麥赤霉病的生物防治進程[5]。
拮抗菌在田間的防治效果與室內平板對峙實驗結果不一致,是植物病害生物防治中存在的普遍問題。當室內篩選的拮抗微生物釋放到田間后,其防治效果往往不盡人意。目前,小麥赤霉病拮抗菌難以完全滿足商品化生產的要求,許多拮抗菌的田間防治效果及其作用機理尚不明確。因此,需要對拮抗菌的活性拮抗物質及其生物活性進行深入研究。
課題組前期從小麥葉片分離到一株紅球菌Y-1菌株,發現該菌株能有效抑制小麥赤霉病病原菌禾谷鐮刀菌(F.graminearum)的分生孢子萌發和菌絲生長。本文將以Y-1菌株為研究對象,采用單因素試驗優化其發酵條件,并初步研究其抗菌活性物質類型,以期為利用Y-1菌株防控小麥赤霉病提供科學依據,并為高效生防菌劑的研制提供材料。
1 材料與方法
1.1 供試材料
拮抗菌:紅球菌Y-1,分離自小麥葉片。
病原菌:禾谷鐮刀菌,由江蘇省林科院提供。
主要試劑和儀器:苯、二甲苯、乙酸乙酯、石油醚30-60、丙酮、培養箱、搖床、離心機、pH計、旋轉蒸發儀、超聲波破碎儀等。
1.2 培養基
LB培養基:胰蛋白胨10 g,酵母浸出粉5 g,氯化鈉10 g,固體培養基則添加15 g-20 g的瓊脂粉,調節pH為7.0,蒸餾水定容至1 L;用于Y-1菌株的活化和培養。
PDA培養基:新鮮土豆200 g,葡萄糖20 g,瓊脂粉15 g-20 g,蒸餾水定容至1 L,自然pH;用于禾谷鐮刀菌的活化和培養。
1.3 Y-1菌株發酵條件的優化
將紅球菌Y-1菌株在LB固體培養基上活化2次,然后接種于50 mL LB液體培養基中,放置于28℃搖床中,200 rpm震蕩培養過夜,作為種子液備用。禾谷鐮刀菌在PDA培養基上活化2次,25℃培養,備用。
從培養基初始pH、發酵溫度、發酵時間、接種量和裝液量5個因素對Y-1菌株的發酵條件進行優化。
①發酵溫度
將Y-1菌株接種于LB液體培養基中,分別在22℃、25℃、28℃、30℃和37℃五個溫度下,200 rpm振蕩培養36 h,檢測無菌濾液對禾谷鐮刀菌的抑菌活性。
②初始pH
分別將LB液體培養基的初始pH調為4.0、5.0、6.0、7.0、8.0,以 1∶ 50的接種量將Y-1菌株接種于不同初始pH的LB液體培養基中,于30℃ 200 rpm振蕩培養36 h后,檢測無菌濾液對禾谷鐮刀菌的抑菌活性。
③裝液量
于500 mL錐形瓶中分別加入50 mL、100 mL、150 mL、200 mL、250 mL的LB液體培養基,接種Y-1菌株后,于30℃ 200 rpm振蕩培養36 h,檢測無菌濾液對禾谷鐮刀菌的抑菌活性。
④發酵時間
將Y-1菌株接種于LB液體培養基中,30℃200 rpm連續振蕩培養,分別取第24 h、36 h、48 h、72 h、96 h和120 h的發酵液,檢測無菌濾液對禾谷鐮刀菌的抑菌活性。
⑤接種量
將Y-1菌株的種子液分別以0.5%、1%、3%、5%、7%、10%的接種量接種到LB液體培養基中,30℃ 200 rpm振蕩培養36 h后,檢測無菌濾液對禾谷鐮刀菌的抑菌活性。
Y-1菌株無菌濾液的制備:取各處理組Y-1菌株發酵液分別倒入50 mL無菌離心管中,4℃,10 000 rpm,離心10 min,上清液用0.22 μm的濾膜抽濾,無菌濾液于4℃冰箱保存備用。
Y-1菌株無菌發酵濾液的抑菌活性測定:取各處理組Y-1無菌濾液5 mL分別與20 mL冷卻至50℃左右的PDA培養基均勻混合,制成帶毒平板。用直徑為5 mm的打孔器打取同質同量的禾谷鐮刀菌菌餅,接種至上述PDA帶毒平板中央,以無菌水代替Y-1無菌濾液作為對照組,每組重復3次。將上述平板放至28℃培養箱中培養約5 d,當對照組的禾谷鐮刀菌菌絲生長至接近培養皿邊緣時,用十字交叉法測量禾谷鐮刀菌菌落直徑,計算各處理組Y-1無菌濾液的抑菌率。
抑菌率計算公式如下:抑菌率=[(對照平板菌落直徑-帶毒平板菌落直徑)/(對照平板菌落直徑-菌餅直徑)]×100%。
1.4 Y-1菌株對禾谷鐮刀菌的拮抗作用
將Y-1菌株在LB固體培養基上活化2次后,接種于50 mL LB液體培養基中,按照上述優化后的最佳發酵條件進行發酵培養。發酵液經4℃,10 000 rpm離心20 min后,上清液用0.22 μm微孔濾膜過濾即得無菌濾液。取無菌濾液5 mL與20 mL冷卻至50℃的PDA培養基混合均勻后倒平板,制成帶毒平板;以無菌水代替無菌濾液為對照。用直徑為5 mm的打孔器打取同質同量的禾谷鐮刀菌菌餅,接種至上述PDA帶毒平板中央。每個處理3個重復,28℃培養約5 d,當對照組的禾谷鐮刀菌菌絲生長至接近培養皿邊緣時,用十字交叉法測量禾谷鐮刀菌菌落直徑,計算Y-1無菌濾液的抑菌率(計算公式同上)。
1.5 Y-1菌株抑菌物質的粗提取及活性測定
①揮發性代謝產物的抑菌作用
將直徑為5 mm的禾谷鐮刀菌菌餅接種于PDA平板中央,在另一個同樣大小的LB平板上涂布接種0.2 mL Y-1菌株發酵液,再將前者反扣于后者之上,兩培養皿接口處用封口膜密封。以LB平板上涂布接種0.2 mL LB液體培養基作為對照組,每個處理3個重復。將上述培養皿置于28℃恒溫培養箱中培養約4 d,觀察并統計Y-1菌株揮發性代謝產物對禾谷鐮刀菌的抑菌率。
②非揮發性代謝產物的抑菌作用
在PDA平板上鋪一張無菌玻璃紙,涂布接種0.2 mL Y-1菌株發酵液,28℃培養2 d后,用無菌鑷子小心揭去玻璃紙,再在平板中央接種一塊禾谷鐮刀菌菌餅,28℃培養。以PDA平板不接種Y-1菌株為對照,每個處理3個重復。待對照組禾谷鐮刀菌菌絲長至接近培養皿邊緣時,觀察并統計Y-1菌株的非揮發性代謝產物對禾谷鐮刀菌的抑菌率。
③非蛋白提取物的抑菌作用
非蛋白提取物的獲得:Y-1菌株發酵液在4℃10 000 rpm下離心20 min,上清液經0.22 μm微孔濾膜過濾后即得無菌濾液。取4支提前滅菌的250 mL錐形瓶,每瓶裝入50 mL的Y-1無菌濾液,分別加入等體積的苯、二甲苯、乙酸乙酯、石油醚30-60封閉并劇烈振蕩,靜置15 min后取有機相,如此反復萃取4-5次。用旋轉蒸儀將有機相制備成干物質,用5 mL相應的有機溶劑將干物質重新溶解,然后經0.22 μm微孔濾膜過濾除菌,即得非蛋白粗提物,-80℃保存備用。
非蛋白提取物的抑菌活性:用同樣的方法制備禾谷鐮刀菌菌餅,將菌餅接種于PDA平板距中心點3.5 cm處的兩側,中心點放置牛津杯,并向牛津杯中加入200 μL的非蛋白粗提物。以牛津杯中加等量相應的有機溶劑作為對照,每個處理3個重復。28℃培養箱中培養,3-4 d后觀察非蛋白粗提物對禾谷鐮刀菌的生長抑制作用。
④蛋白提取物的抑菌作用
粗蛋白提取物的制備:Y-1菌株發酵液在4℃、10 000 rpm下離心20 min,上清液經0.22 μm微孔濾膜過濾后即得無菌濾液。取100 mL無菌濾液,加入硫酸銨使其飽和度為100%,4℃、10 000 rpm下離心30 min,將沉淀溶解于0.1 mol/L、pH 7.0的磷酸緩沖液(PBS)中,并置于透析袋(截留分子量3 500 Ku)中,兩端用透析袋夾夾緊,用去離子水透析24 h,在透析液中加入2倍體積的冷丙酮(-20℃),-20℃靜止2 h后,10 000 rpm,離心30 min,將沉淀冷凍干燥后即得粗蛋白粉。用PBS將粗蛋白粉重新溶解,使其終濃度為原液的20倍,經0.22 μm微孔濾膜過濾除菌,即得Y-1菌株的蛋白粗提液。
蛋白提取物的抑菌活性試驗方法同非蛋白提取物的抑菌活性測定。
⑤細胞破碎物的抑菌作用
Y-1菌株發酵液在4℃、10 000 rpm下離心20 min,棄上清,沉淀用適量PBS溶解,離心,棄上清,此過程重復3次。沉淀用適量PBS溶解,超聲破碎(破碎5 s,間隔5 s)15 min,將細胞破碎液在4℃、10 000 rpm下離心20 min,取上清,經0.22 μm微孔濾膜過濾除菌。
細胞破碎液的抑菌活性試驗方法同非蛋白提取物的抑菌活性測定。
1.6 數據處理與分析
試驗數據采用SPSS 20.0和Microsoft Office Excel 2007軟件進行統計和分析,取平均值繪制柱形圖或條形圖;對各組數據在0.05水平進行單因素方差分析和多重比較分析(Tukey檢驗)。
2 結果與分析
2.1 不同單因素對Y-1無菌發酵液抑菌活性的影響
2.1.1 發酵溫度
如圖1A所示,發酵溫度會顯著影響Y-1無菌發酵液的抑菌活性。隨著溫度的升高,Y-1無菌發酵液對禾谷鐮刀菌的抑菌活性呈現出先升高后降低的趨勢。在22℃時,抑菌率最低,僅為24.8%;當發酵溫度為25℃時,Y-1菌株的抑菌率最高,達56.5%,且顯著高于其他處理組;28℃和30℃時的抑菌率至40%左右,二者之間不存在顯著差異;而溫度升至37℃時,Y-1菌株的抑菌率繼續降至27%。因此,Y-1菌株的最佳發酵溫度定為25℃。
2.1.2 初始 pH
培養基的初始pH對Y-1菌株抑菌能力的影響見圖1B,Y-1菌株的抑菌率隨著pH的增大先升高后降低。當pH為6.0和7.0時,Y-1菌株對禾谷鐮刀菌的抑菌率較高,且二者差異不限制,其中pH為6.0時的抑菌率最高,為53.1%;隨著pH的升高或降低,抑菌率均急劇下降。因此,Y-1菌株的最適發酵pH定為6.0。
2.1.3 裝液量
裝液量對Y-1菌株抑菌能力的影響見圖1C,隨著裝液量的增加,Y-1菌株的抑菌率呈現先升高后降低的趨勢。當500 mL錐形瓶中的裝液量為100 mL時,Y-1菌株對禾谷鐮刀菌的抑菌率達到最高51.8%;隨著裝液量的增加,抑菌率急劇下降,當裝液量為250 mL時抑菌率降至最低9.6%。由此可見,相對空氣量高、氧氣傳質阻力小更有利于Y-1菌株的生長。因此,Y-1菌株的發酵最適裝液量為100 mL/500 mL錐形瓶(即1/5)。
2.1.4 發酵時間
發酵時間對Y-1菌株抑菌能力的影響見圖1D,Y-1菌株的抑菌率隨著發酵時間的延長先升高后降低。當發酵72 h時,Y-1菌株的抑菌率達到最高,為55.6%,且現在高于其它處理組;發酵時間過短或過長,其抑菌率均會顯著降低。發酵初期,Y-1菌株分泌的抑菌物質的量少,導致其抑菌率較低;而到發酵后期,其抑菌率顯著下降,可能是由于此時發酵液中的營養物質基本耗盡,導致Y-1菌株分泌的抑菌物質被分解利用[12]。因此,Y-1菌株的最適發酵時間為72 h。
2.1.5 接種量
如圖1E所示,接種量會顯著影響Y-1無菌發酵液的抑菌活性。隨著接種量的增加,Y-1菌株對禾谷鐮刀菌的抑菌率呈現先升高后降低的趨勢。當接種量為1%時,Y-1菌株的抑菌達到最高,為55.8%,且現在高于其它處理組;接種量過小或過大,其抑菌率均會顯著降低。當接種量為0.5%時,發酵液中的Y-1菌株數量較少,因而分泌的抑菌物質也較少,此時的抑菌率也較低。當接種量為3%、5%、7%、10%時,過高的接種量可能導致發酵液中的營養物質被迅速消耗或次級代謝產物含量較高,影響菌體的生長和繁殖,抑菌率大大降低。
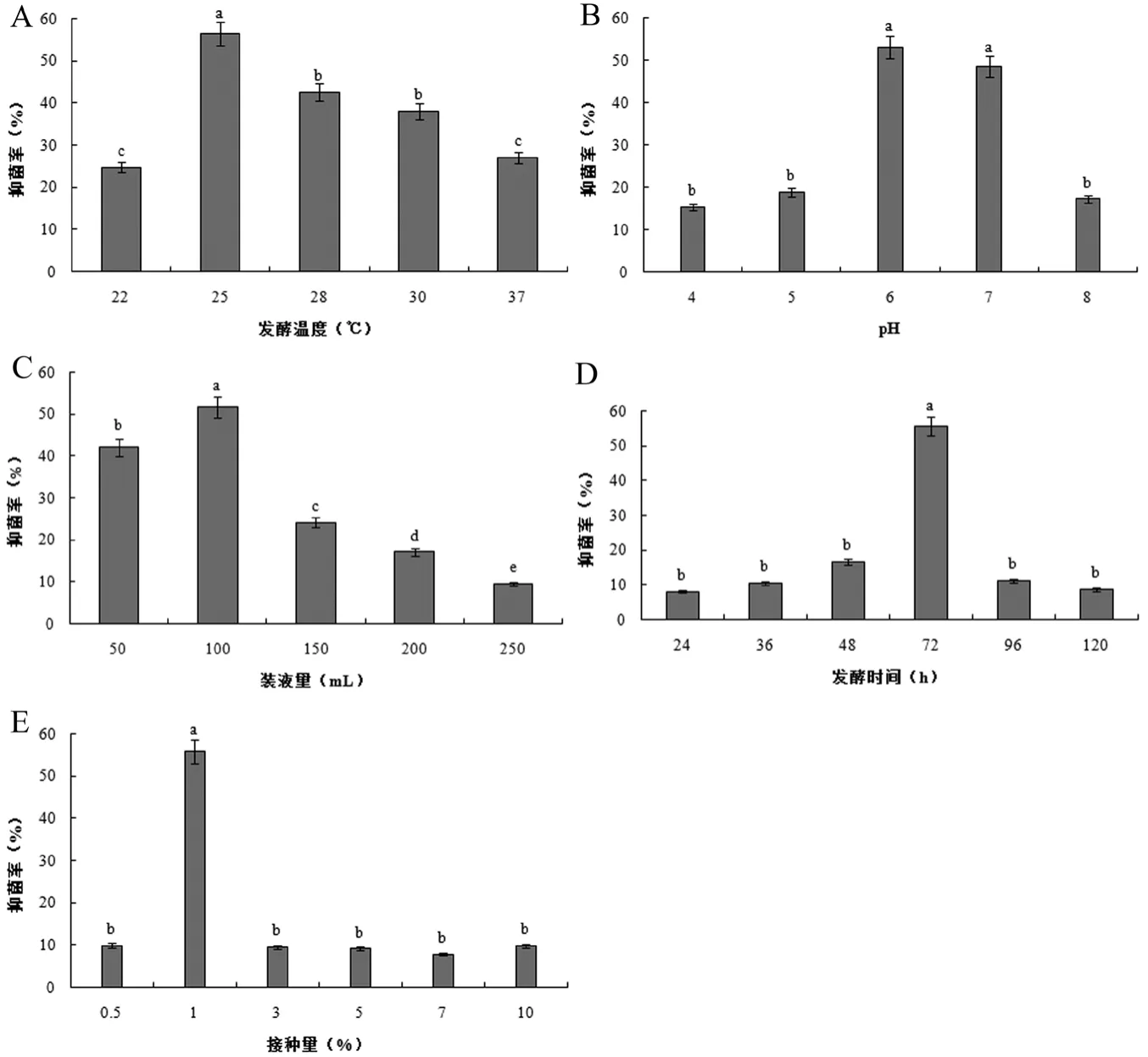
圖1 各單因素試驗中Y-1無菌發酵液對禾谷鐮刀菌的抑菌率
通過單因素試驗得到Y-1菌株的最佳發酵條件為:pH 6.0、發酵溫度25℃、發酵時間72 h、接種量1%、裝液量1/5。初步研究結果表明,中性偏酸性環境有利于紅球菌產生抗菌物質,且該菌株為好氧型菌株。
2.2 Y-1菌株對禾谷鐮刀菌的拮抗作用
按照上述優化后的發酵條件制備Y-1菌株發酵液。通過觀察禾谷鐮刀菌在由Y-1菌株發酵濾液制備的帶毒平板上的生長情況(圖2A),并計算Y-1無菌濾液的抑菌率,發現Y-1發酵濾液可以明顯抑制禾谷鐮刀菌的生長,抑菌率為58.6%。由此可知,在上述優化后的發酵條件下所得的Y-1發酵濾液的抑菌率顯著高于各單因素試驗的抑菌率(圖2B)。
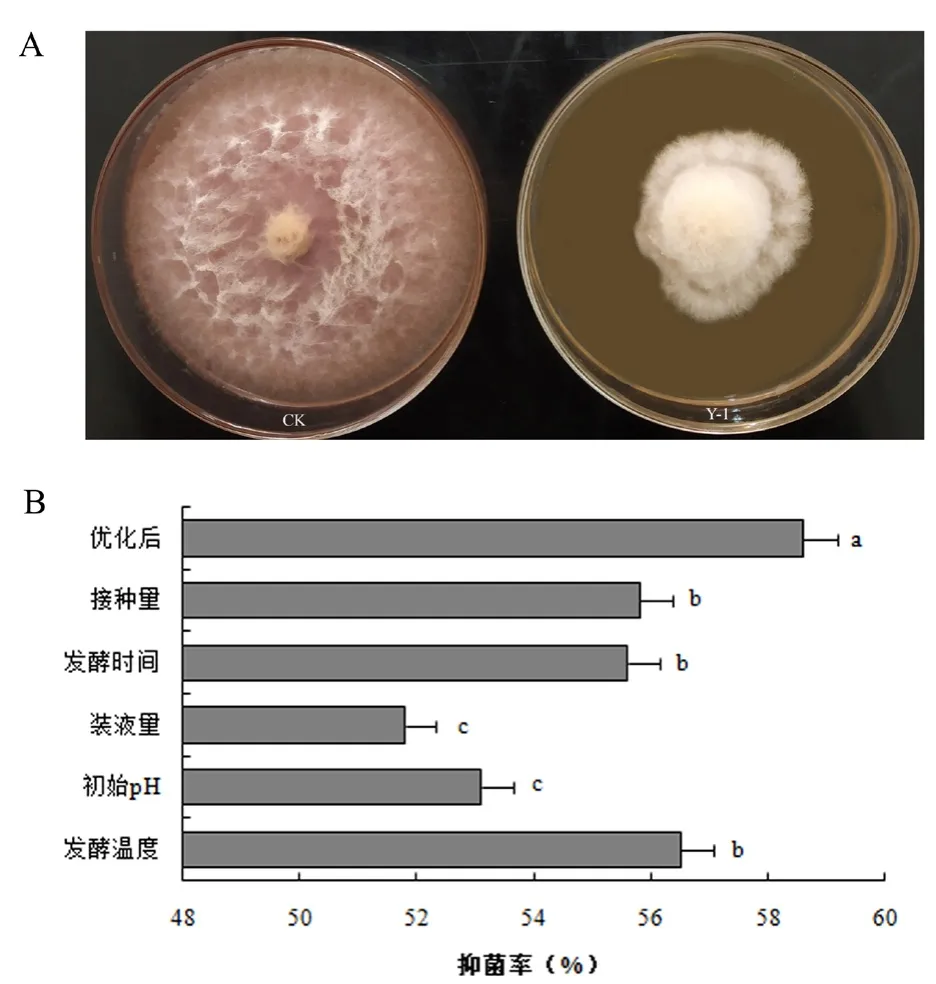
圖2 優化后Y-1菌株對禾谷鐮刀菌生長的影響(A)及各發酵條件下Y-1菌株對禾谷鐮刀菌抑菌率的比較分析(B)
2.3 Y-1菌株的主要抑菌物質類型
Y-1菌株發酵液中的各類粗提物對禾谷鐮刀菌的抑菌活性如圖3所示,結果顯示其發酵液中的非蛋白類物質(提取劑:二甲苯)對禾谷鐮刀菌的抑菌作用最強(圖4B),抑菌率為77.4%;其次是揮發性物質(圖4D),抑菌率為57.5%;而非揮發性物質、蛋白提取物和細胞破碎物對禾谷鐮刀菌的抑菌率相當,且均表現出較弱的抑菌作用。
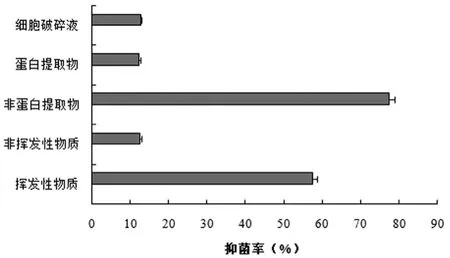
圖3 Y-1菌株發酵液中各類粗提物對禾谷鐮刀菌的抑菌率
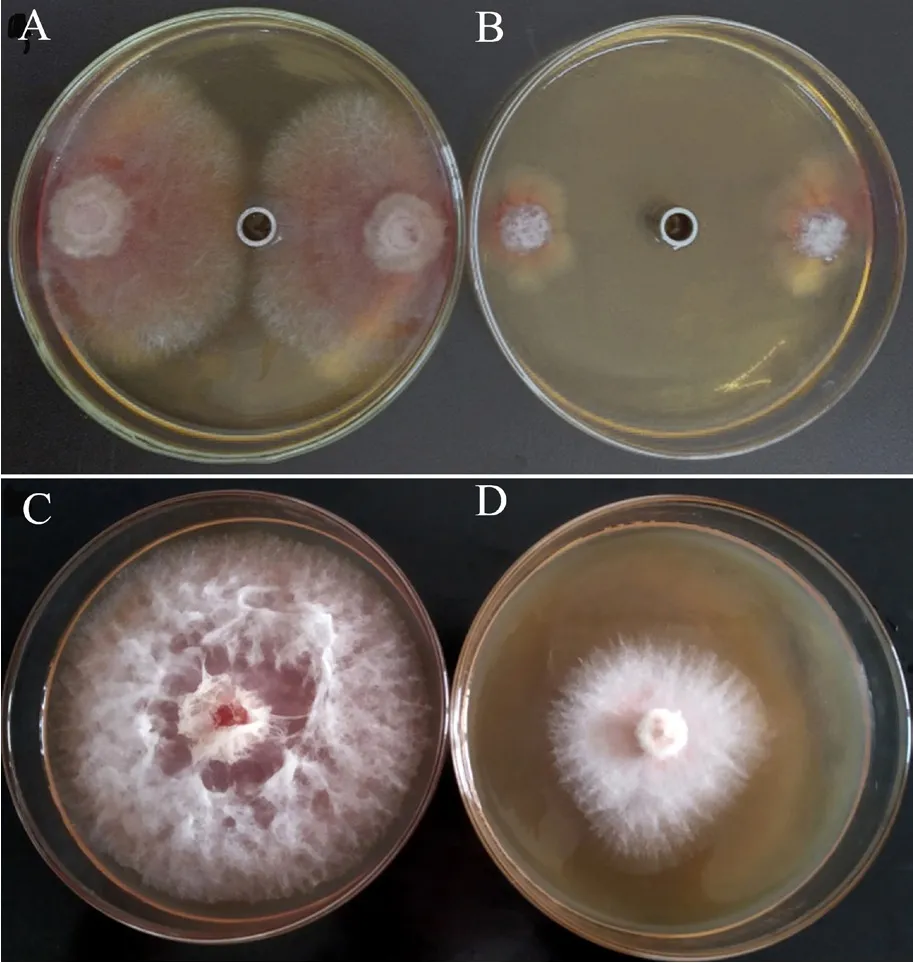
圖4 Y-1菌株的非蛋白提取物(A、B)和揮發性物質(C、D)對禾谷鐮刀菌菌絲生長的抑制作用
初步得知,Y-1菌株發酵液中的揮發性物質和非蛋白類物質在對禾谷鐮刀菌的抑制作用中貢獻較大,是其主要的抑菌活性物質。
3 結論與討論
小麥赤霉病在全球多個國家和地區發生,是禾谷類作物上的一類十分嚴重的病害,對麥類作物的種植和生產帶來巨大影響。其病原菌產生的有毒物質DON等不僅危害人畜健康,而且嚴重降低小麥的產量和質量,進而導致巨大的經濟損失[3]。關于小麥赤霉病的生物防治,國內外一些研究者在有益拮抗菌的研究和應用方面做了大量工作并取得積極成果,已經篩選出小麥赤霉病生防菌有芽孢桿菌、假單胞菌、放線菌以及真菌等[13-15]。生防菌的生防機制主要包括溶菌作用、營養和空間的競爭、產抗生素或其它活性代謝物質、誘導植物的系統抗性等[16]。近幾年,關于小麥赤霉病拮抗菌的篩選及其生物防治機制的研究備受關注。盡管篩選到一些拮抗作用較強的菌株,但目前僅有少數芽孢桿菌被開發為生物農藥并申請專利投入市場[16]。小麥赤霉病的生物防治依然在探索前進中,并處于試驗階段,距離大規模田間應用仍有一段距離[17]。
微生物的生長及其代謝受眾多外界因素的影響,如溫度、pH、接種量等。因此,探究微生物的最佳發酵條件對其高效產生抗菌物質十分必要。拮抗菌株在不同發酵條件下抑菌活性物質的產量具有顯著性差異。江丹霞等[12]以康氏木霉為指示菌,采用單因素試驗結合正交試驗對芽孢桿菌Z21產抑菌活性物質的發酵條件進行優化,優化后其發酵液對康氏木霉菌絲生長的抑制率明顯提高,高達72%。趙月等[18]以蠟樣芽孢桿菌BCCY-22的OD600為指標,采用單因素試驗和響應面法對該菌株的發酵條件進行優化,優化后發酵時間縮短了6 h,生物量增加了36%。何明川等[19]結合單因素試驗及正交試驗對特基拉芽胞桿菌D5-8的發酵培養基和發酵條件進行了優化,優化后其對煙草黑脛病的預防效果和防治效果可達66.89%和53.72%,且均高于優化前。王明環等[20]通過單因素試驗和正交試驗明確了直絲紫鏈霉菌A8的最佳發酵條件,并通過氣相色譜-質譜聯用技術得到26種化合物,其中3-甲基-1,2-環戊二酮、1,2,4,5-四甲基苯和二氫-3-亞甲基-2,5-呋喃二酮對立枯絲核菌的抑菌率達到70%以上。
針對篩選出的具有拮抗活性的紅球菌Y-1的發酵條件進行優化,對其生防菌劑的進一步開發和應用具有重要意義。不同發酵條件下,Y-1菌株抑菌活性物質的產量也具有顯著性差異。本研究采用單因素試驗初步獲得Y-1菌株的最佳發酵條件為:發酵溫度25℃、發酵時間72 h、接種量1%、初始pH 6.0、裝液量為100 mL/500 mL錐形瓶(即1/5)。在該發酵條件下,Y-1發酵液對禾谷鐮刀菌的抑菌率高達58.6%,顯著高于各單因素實驗的抑菌率。由此可知,環境中相對空氣量高、氧氣傳質阻力小更有利于Y-1菌株的生長;且過高的接種量使得發酵液中的營養物質被迅速消耗,影響菌體的生長繁殖,進而影響其抑菌率[20]。
利用拮抗微生物的次級代謝產物是防治植物病害的一條有效途徑。拮抗微生物通過分泌活性抗菌物質,作用于病原菌細胞的細胞壁或細胞膜,干擾病原菌的蛋白合成系統和能量代謝系統的正常功能,進而抑制或殺死病原菌[16]。拮抗微生物產生的次級代謝產物越多,其生物防治效果就越強[10]。有研究表明,微生物代謝產生的揮發性有機化合物(VOCs)在抑制植物病原菌生長、誘導植物產生系統抗性和對非生物脅迫的耐受性有著重要的影響[21-22]。目前,已有很多禾谷鐮刀菌生防菌抗抗菌物質的研究報道,主要傾向于生防菌的次級代謝產物,但其具體的生防機制尚不明確[5,7]。楊洋[23]研究了小麥赤霉病拮抗菌解淀粉芽孢桿菌FZB42的拮抗機制,發現其主要抗菌活性物質為桿菌毒素D和泛革素兩種脂肽類物質,其中桿菌毒素D可以誘導禾谷鐮孢菌細胞內活性氧(ROS)的積累以及誘導細胞死亡。程超等[24]發現產酶溶桿菌OH11產生的一種熱穩定抗真菌物質HSAF對小麥赤霉病菌有較強的抑制作用,不僅抑制禾谷鐮刀菌孢子萌發、菌絲生長以及分生孢子產生,而且導致菌絲形態、幼殖體形態和細胞形態發生畸變,同時使病原菌細胞對環境脅迫更為敏感。鄭小亮等[25]的研究也得到類似的結果,發現枯草芽孢桿菌Z1-2產生的活性蛋白使禾谷鐮刀菌的菌絲形態畸形、底端膨大、抑制孢子萌發,對禾谷鐮刀菌具有較強的抗菌作用。裴韜等[26]對小麥赤霉病拮抗菌枯草芽孢桿菌P72的抑菌活性進行研究,發現經0.5 M NaCl溶液洗脫得到的蛋白物質對小麥赤霉病菌的拮抗能力最強,該蛋白分子量約40 ku,且在酸性條件下穩定。Dunlap等[27]通過對小麥赤霉病拮抗菌解淀粉芽孢桿菌AS43.3的全基因組進行分析,證實了該菌能產生的伊枯草素、表面活性素、泛革素、鐵載體、溶桿菌素、抗生素等抗菌活性物質,并且這些抗菌活性物質的代謝調控與對應的基因簇密切相關。周清等[28]分離得到1株小麥赤霉病高效拮抗菌株奇異變形桿菌DY05,其發酵液和無細胞上清均可顯著抑制禾谷鐮刀菌菌絲體生長(抑制率分別為79.50%和51.25%)和分生孢子萌發(抑制率均為100%)。本文初步明確了小麥赤霉病拮抗菌紅球菌Y-1的主要抗菌活性成分為揮發性、非蛋白類物質,其對禾谷鐮刀菌的抑菌率分別為57.5%和77.4%,但具體是哪一種或哪幾種活性物質發揮抗菌作用尚需進一步研究。
綜上所述,本研究初步明確了紅球菌Y-1菌株的最佳發酵條件和其主要抑菌活性物質類型,證明了該菌株對小麥赤霉病菌具有較好的抑菌作用,為其菌劑開發及對小麥赤霉病的生物防治提供了科學依據。在下一步研究中,應加強Y-1菌株生防機理等方面的探究。

