1-甲基萘加氫飽和反應熱力學平衡分析及實驗研究
張 銳, 葛泮珠, 任 亮, 王麗新, 劉清河, 習遠兵, 聶 紅
(中國石化 石油化工科學研究院,北京 100083)
占到中國柴油池三分之一的催化裂化輕循環油(LCO)是催化裂化生成油中453~643 K的餾分,其硫、氮含量高,特別是其中的芳烴質量分數高達60%以上,并以雙環芳烴為主,占到總芳烴含量的70%以上。LCO既使采用高苛刻條件的加氫精制過程也難以直接滿足日趨嚴格的清潔柴油的標準要求,將LCO中大量的多環芳烴催化轉化為苯、甲苯和二甲苯(BTX),是提升LCO品質的途徑之一,也是壓減柴油產量的途徑之一。近些年,中國化工行業對BTX的需求量激增,市場上呈現供不應求的局面。考慮到LCO中富含芳烴,將其催化轉化生產BTX,可以解決中國柴油產能過剩和BTX短缺的問題,具有非常高的工業應用潛力[1]。目前工業上利用LCO生產BTX的工藝流程主要分為2部分[2-3]:首先是將LCO進行加氫處理去除油品中的硫、氮雜質,并將多環芳烴選擇性加氫飽和為單環芳烴;然后再將油品進行加氫裂化或催化裂化處理,得到C6~C8中富含BTX的高辛烷值汽油組分。
由于催化裂化反應很難將多環芳烴進行開環,因此需要首先將多環芳烴進行部分加氫飽和,再將生成四氫萘類的單環芳烴在分子篩催化劑上進行裂化生成BTX。也就是說,對于雙環芳烴無論是通過加氫裂化的途徑還是催化裂化的途徑[4-5],都不可避免地需要對雙環芳烴中其中之一的芳香環進行加氫飽和生成含有環烷環的四氫萘類單環芳烴,從而實現將環烷環開環并進行斷側鏈的目的。以1-甲基萘(1-MN)為含甲基的雙環芳烴模型化合物來描述上述LCO催化轉化生成BTX的過程,結果見圖1。從圖1可以看出,萘類首先加氫飽和生成四氫萘類單環芳烴,四氫萘類的單環芳烴再經過催化轉化生成BTX類單環芳烴。
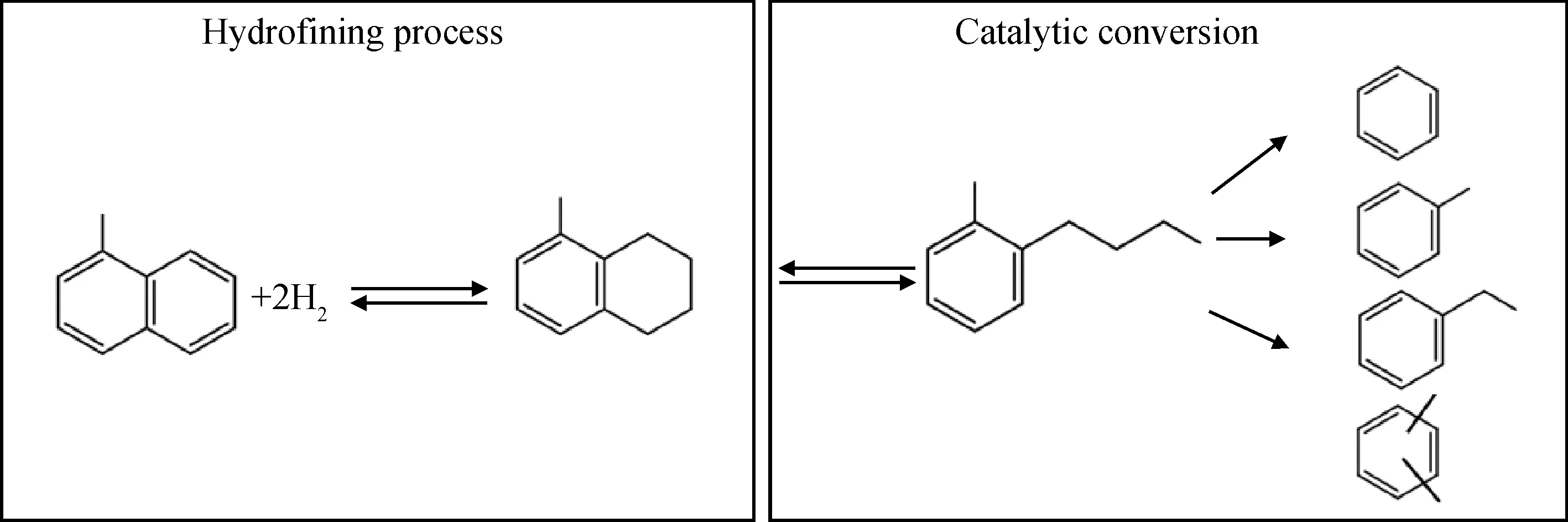
圖1 雙環芳烴催化轉化為BTX的反應網絡示意圖Fig.1 Reaction network diagram for the catalytic conversion of bicyclic aromatic hydrocarbons to BTX
芳烴加氫是可逆、強放熱、體積減小的反應[6],芳烴加氫的反應熱介于63~71 kJ/mol。根據化學平衡原理,對于放熱反應,反應平衡常數隨反應溫度的升高而降低,芳烴的平衡濃度隨反應溫度的升高而升高,因而較低的反應溫度有利于加氫。在選擇芳烴加氫飽和反應溫度時,必須從動力學和熱力學2方面考慮,既能有適當的反應速率,又能使芳烴達到較高的轉化率。對芳烴類加氫反應的研究由來已久,并且在反應熱力學、動力學及微觀機理等方面都取得了一些成果[7]。但由于受實驗條件、模型化合物不易獲取等因素的限制,特別針對于雙環芳烴定向轉化為單環芳烴過程的熱力學研究相對較少[8]。
以1-MN為模型化合物,通過理論計算得到其反應網絡中各步反應的標準平衡常數(K),分析K隨溫度的變化規律,并在此基礎上,通過計算討論氫分壓、反應溫度和氫/烴摩爾比對單步反應體系的平衡轉化率、連續反應體系的平衡濃度分布的影響;同時結合熱力學平衡計算結果,以Ni-Mo/γ-Al2O3為催化劑,采用高壓加氫微型反應實驗裝置,考察了反應溫度、反應壓力對l-MN加氫飽和反應路徑的影響。
1 實驗部分
1.1 原料、試劑和催化劑
原料和試劑:1-甲基萘(1-MN),純度98%,美國Alfa公司產品;環己烷,化學純,國藥集團公司產品。配制1-MN質量分數為10%的環己烷溶液。
催化劑: Ni-Mo/γ-Al2O3加氫精制催化劑,由中國石化石油化工科學研究院提供,其中MoO3質量分數為23.5%,NiO質量分數為4.0%,比表面積為140 m2/g,孔體積為0.28 mL/g。
1.2 1-MN加氫飽和實驗裝置和分析方法
以1-MN作為模型反應物,采用固定床加氫微型反應器進行實驗研究。催化劑裝填量0.5 g,催化劑顆粒40~60目,氫氣流量300 mL/min,溫度523~653 K(250~380 ℃),H2分壓3.0~5.0 MPa。正式反應前,在溫度573 K、H2分壓4.0 MPa下,通入CS2質量分數5%的環己烷溶液,對催化劑進行硫化反應處理4 h,硫化油進料量0.3 mL/min。硫化結束后切換成1-MN進料,進油量0.2 mL/min,連續進料反應3 h,待催化劑活性穩定后取樣分析。
采用美國安捷倫公司生產的7890型氣相色譜儀分析產物的烴類詳細組成。1-MN的平衡轉化率 (y1-MN,%),1-甲基四氫萘(1-MTL)和5-甲基四氫萘(5-MTL)的單環芳烴選擇性(s1-MTL和s5-MTL,%),1-甲基十氫萘(1-MD)的加氫飽和選擇性(s1-MD,%)分別由式(1)~式(4)計算。
(1)
(2)
(3)
(4)
式(1)~式(4)中:xf和xp分別為原料和產物中1-MN的摩爾分數,%;x1-MTL、x5-MTL及x1-MD分別為產物中1-MTL、5-MTL及1-MD的摩爾分數,%。
2 1-甲基萘加氫飽和熱力學分析
從熱力學角度,對1-甲基萘的加氫飽和反應網絡進行系統分析,首先通過理論計算得到其反應網絡中各步反應的標準平衡常數(Ki),分析Ki隨溫度的變化規律,并在此基礎上進一步討論氫分壓、反應溫度和物質結構對單步反應體系的平衡轉化率、連續反應體系的平衡濃度分布及氫含量增加的影響。
2.1 反應網絡建立與分析
LCO中含有40%~60%的雙環芳烴,碳數為10~14,也就是表明雙環芳烴還有1~4個支鏈碳。目前對具有甲基取代基的雙環芳烴的加氫飽和反應網絡研究比較透徹,如圖2所示為1-MN加氫飽和反應網絡[9];但是對帶側鏈多環芳烴的熱力學計算研究較少。因此,計算帶側鏈雙環芳烴加氫的反應熱力學對于指導LCO的加氫飽和具有重要意義。

1-MN—1-Methylnaphthalene; 1-MTL—1-Methyltetralin;5-MTL—5-Methyltetralin; 1-MD—1-Methyldecalin;R1—Hydrogenation of 1-MN to 5-MTL;R2—Hydrogenation of 5-MTL to 1-MD;R3—Hydrogenation of 1-MN to 1-MTL;R4—Hydrogenation of 1-MTL to 1-MD圖2 1-MN加氫飽和反應網絡Fig.2 Network of 1-MN hydrogenation saturation reaction
圖2中涉及的芳烴加氫飽和反應主要有:雙環芳烴加氫成單環芳烴的R1和R3反應路徑,即1-MN加氫生成5-甲基四氫萘(5-MTL)的R1反應路徑、1-MN加氫生成1-甲基四氫萘(1-MTL)的R3反應路徑;單環芳烴加氫飽和生成環烷烴的R2和R4反應路徑,即5-MTL加氫生成1-甲基十氫萘(1-MD)的R2反應路徑和1-MTL加氫生成1-MD的R4反應路徑。
2.2 熱力學計算分析
建立熱力學分析方法中的化學平衡分析基于兩點假設:(1)氣相反應體系;(2)理想氣體混合物。這與實際的氣-液-固三相四氫萘加氫裂化反應體系存在偏差,但是規避了熱力學平衡難以準確描述且編程運算極其復雜的難題。對于一理想氣體化學反應,當體系處于化學平衡狀態時,該反應的標準平衡常數(Ki)可由式(5)來計算,并且標準平衡常數和該反應的吉布斯自由能滿足Gibbs-Helmholtz方程,見式(6)。在一定溫度下,化學反應的標準摩爾反應吉布斯函數(ΔrGθ)等于相同溫度下參與反應的各組分標準摩爾生成吉布斯函數(ΔfGθ)與化學計量數(vB)的乘積之和,見式(7)。
Ki=Πj(pi/pθ)vij=Πj(xiptotal/pθ)vij
(5)
(6)
ΔrGθ(T)=∑BvBΔfGθ(B)
(7)
式(5)~式(7)中:Ki為處于化學平衡體系中i組分的平衡系數;pi為i組分的平衡分壓,MPa;ptotal為系統總壓,MPa;xi為反應體系中i組分的摩爾分數,%;pθ為標準大氣壓(0.101 MPa);ΔrGθ(T)為反應溫度T下的標準反應吉布斯自由能,kJ/mol;R為理想氣體常數,8.314 J/(mol·K);T為反應溫度,K;ΔfGθ為標準摩爾生成吉布斯函數,kJ/mol;vB為化學計量數。
按照式(5)~式(7),則反應平衡常數與反應吉布斯自由能之間存在以下關系式:
ΔrG1=ΔfG5-MTL-ΔfG1-MN-2ΔfGH2=-RTlnK1
(8)
ΔrG2=ΔfG1-MD-ΔfG5-MTL-3ΔfGH2=-RTlnK2
(9)
ΔrG3=ΔfG1-MTL-ΔfG1-MN-2ΔfGH2=-RTlnK3
(10)
ΔrG4=ΔfG1-MD-ΔfG1-MTL-3ΔfGH2=-RTlnK4
(11)
式(8)~式(11)中:ΔrG1、ΔrG2、ΔrG3、ΔrG4分別為R1、R2、R3、R4這4條反應路徑的反應吉布斯自由能,kJ/mol;ΔfG1-MN、ΔfG5-MTL、ΔfG1-MTL、ΔfG1-MD分別為1-MN、5-MTL、1- MTL和1-MD的生成吉布斯自由能,kJ/mol;K1、K2、K3、K4分別為R1、R2、R3、R4這4條反應路徑所對應的平衡常數,K1~K4的計算公式如下:
(12)
(13)
(14)
(15)
式(12)~式(15)中:p1-MN、p1-MTL、p5-MTL、p1-MD、pH2分別為1-MN、1-MTL、5-MTL、1-MD和H2的分壓,MPa;x1-MN、x1-MTL、x5-MTL、x1-MD分別為1-MN、1-MTL、5-MTL、1-MD的摩爾分數,%。
利用Material studio軟件,基于密度泛函的量子力學Dmol3方法來計算上述反應網絡中對應的R1~R4路徑各步反應的自由能。主要計算步驟如下:首先計算溫度為0 K下1-MN、1-MTL、5-MTL 及1-MD 4種分子的活化能量Ei;其次獲得不同溫度下自由能的校正值(Gi)以及對應的f(T)函數,并以此來計算不同溫度下各自分子的吉布斯反應自由能,即Gi(T)=Ei+Gi,f(T);最后計算不同溫度下各個反應的吉布斯反應自由能。將獲得各步反應在不同溫度下的ΔrG繪制于圖3。再根據Gibbs-Helmholtz方程即可獲得各反應的平衡常數Ki,并作Ki隨反應溫度的變化曲線,如圖4所示。

圖3 不同反應溫度(T)下1-MN加氫反應自由能(ΔrG)Fig.3 1-MN hydrogenation reaction free energy (ΔrG)at different reaction temperatures (T)
根據圖3的結果可知,各個反應體系的共同特點是:在300~800 K內,ΔG隨反應溫度升高而近似線性增加;當溫度低于400 K時,ΔG2和ΔG4為負值,表明這些反應在低于400 K(126.9 ℃)時為自發過程,且溫度越低,ΔG越小。另外根據4個反應ΔG隨反應溫度的變化趨勢可知,其中甲基萘加氫生成四氫萘(R1、R3)的ΔG隨溫度的變化率要小于四氫萘加氫生成十氫萘的變化率(R2、R4),說明四氫萘加氫生成十氫萘反應自由能的變化對溫度更為敏感。

圖4 不同反應溫度(T)下各個反應的平衡常數(K)Fig.4 Equilibrium constants (K) of each reactionat different reaction temperatures (T)
從圖4可以看出,隨著反應溫度的升高,平衡常數逐漸降低,表明1-MN的加氫反應為放熱反應。在4個反應中,當反應溫度高于500 K時,1-MN加氫生成5-MTL的平衡常數K1要高于5-MTL加氫生成1-MD平衡常數K2;但當溫度低于500 K時,K1要低于K2;對于1-MN加氫生成1-MTL再加氫飽和生成1-MD,這個轉變的溫度為575 K。通過上述分析可知,在低于500 K的反應溫度下,有利于1-MN全部加氫反應的發生;而在高于575 K的反應溫度下,有利于部分加氫飽和反應。有學者采用Material studio分子模擬軟件[10],對1-MN的反應路徑進行模擬,發現反應溫度在600 K以上,雙環芳烴第一個芳環加氫較容易,由四氫萘類進一步加氫生成十氫萘類的反應自由能較高,加氫飽和較困難,是整個連串反應的控制步驟。
熱力學所計算的反應體系中有1-MN、1-MTL、5-MTL、1-MD以及H2,通過給定反應體系的初始條件,再經過聯立上述的式(12)~式(15),在方程求解過程中運用Fortran語言進行編程,便可得到4種反應物在不同反應條件下的平衡組成。表1為在反應溫度673 K條件下采用此計算方法得到1-MN加氫各基元反應的平衡常數與文獻值的比較。
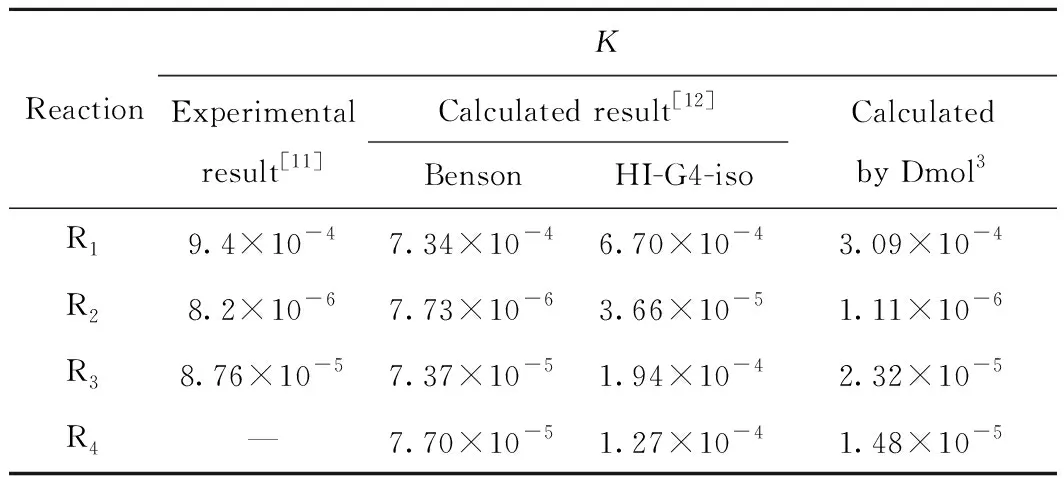
表1 量子力學Dmol3方法的平衡常數(K)計算值與文獻值的比較Table 1 Comparison of calculated values of equilibriumconstants (K) by quantum mechanics Dmol3 methodand reference values in literature
從表1可以看出,文獻[11-12]的計算結果與Dmol3方法的計算結果存在一定的偏差,但還是在同一個數量級水平上,表明此方法的計算結果具有一定的代表性,能夠反映出真實反應的特點。
2.3 反應條件對1-MN加氫反應的影響
對于芳烴加氫飽和的工業裝置來說,其屬于連續加氫過程,即反應體系中存在連續的H2氛圍以實現加氫飽和反應持續進行。因此以連續的加氫反應體系為研究對象,通過熱力學計算出在各個反應條件下達到熱力學平衡時各組分的摩爾分數,從而獲得更多的轉化率以及選擇性數據來指導工業裝置生產。以1-MN為例,假定反應初始時,連續反應體系中只有1-MN和H2,且H2分壓為6.0 MPa,在一定反應溫度下,當反應網絡達到平衡時,其中的每步反應也應平衡,即滿足式(12)~式(15)的關系。在平衡的反應體系中以x1-MN、x5-MTL、x1-MTL、x1-MD分別為平衡體系中1-MN、5-MTL、1-MTL及1-MD的摩爾分數,則有如式(16)所示的關系式:
x1-MN+x5-MTL+x1-MTL+x1-MD=1
(16)
由式(16)以及式(12)~式(15)所得出的在一定溫度下的標準平衡常數Ki,即可計算出該溫度下1-MN連續加氫體系中各物種的摩爾分數,再通過式(1)可以計算得出1-MN的平衡轉化率。
2.3.1 反應溫度對加氫飽和反應的影響
在H2分壓為6.0 MPa、初始氫氣/1-MN摩爾比(n(H2)/n(1-MN))為5的條件下,考察了反應溫度對整個反應體系中產物摩爾分數的影響,計算結果見圖5。

圖5 反應溫度(T)對1-MN及其加氫產物摩爾分數(x)的影響Fig.5 Effect of reaction temperature (T) on the molarfraction (x) of 1-MN and its hydrogenation productsp=6.0 MPa; n(H2)/n(1-MN)=5
根據圖5可知:在反應溫度為600~800 K時,隨著反應溫度的升高,1-MN的摩爾分數先保持不變,后快速升高,再緩慢升高;5-MTL和1-MTL的摩爾分數隨著反應溫度的升高先升高后降低,并且在相同反應溫度下,5-MTL的摩爾分數始終高于1-MTL的摩爾分數,如在700 K時,5-MTL的摩爾分數為42.8%,而1-MTL的摩爾分數為4.4%;1-MD的摩爾分數隨著反應溫度的升高先快速降低后緩慢降低。根據上述分析可知,在反應溫度低于600 K時,平衡體系中即可以獲得較高的全加氫產物1-MD的摩爾分數;而在反應溫度高于700 K時,可以獲得較高的中間加氫飽和產物(5-MTL 及1-MTL)的摩爾分數,并且5-MTL的摩爾分數高于1-MTL的摩爾分數。這可能由于苯環的大π鍵在催化劑表面呈現平躺吸附,帶甲基的芳環在催化劑表明的吸附需要占據一定的空間來容納較大的半徑,甲基對苯環加氫的空間位阻效應較明顯[9],因此在加氫飽和中間產物中5-MTL摩爾分數較高。另外,結合上述的熱力學計算可知,1-MN 生成5-MTL的反應吉布斯自由能變始終低于1-MN生成1-MTL的反應吉布斯自由能變,所以加氫飽和產物中5-MTL的摩爾分數高于1-MTL。
有關不同反應溫度下1-MN的平衡轉化率及其加氫產物選擇性的變化如圖6所示。
從圖6可以看出,1-MN的平衡轉化率在低于600 K的溫度下能夠保持較高的平衡轉化率,當溫度升高至650 K時開始顯著降低,當溫度超過720 K 時降低的幅度變小。對于中間加氫飽和產物5-MTL和1-MTL來說,隨著反應溫度的提高,兩者的選擇性均是逐漸增加,而在反應溫度高于600 K 時,生成5-MTL的選擇性要顯著高于生成1-MTL的選擇性。對于1-MN完全加氫飽和生成產物1-MD過程,在反應溫度低于600 K時具有較高的1-MN平衡轉化率,且在反應溫度低于573 K時1-MN平衡轉化率可達到100%,這與文獻[13]的結論相一致。隨著反應溫度的提高,1-MD的選擇性也呈現先快速降低后緩慢降低的趨勢,在反應溫度高于800 K時1-MD的選擇性趨于0%,也就是表明甲基四氫萘類的單環芳烴在高溫下受到熱力學平衡的限制,很難將最后一個芳環進行加氫飽和得到雙環環烷烴。
2.3.2 反應壓力對加氫飽和反應的影響
在反應溫度為650 K、n(H2)/n(1-MN)為5的條件下,考察了反應壓力對整個反應體系的影響。圖7為不同反應壓力下1-MN及其加氫產物的摩爾分數。
根據圖7可知:隨著反應壓力的升高,1-MN的摩爾分數先快速降低再緩慢降低;5-MTL和1-MTL的摩爾分數隨著反應壓力的升高先升高后降低;1-MD的摩爾分數隨著反應壓力的升高先快速升高后緩慢升高。根據上述分析可知,在反應壓力高于6 MPa時,平衡體系中全加氫產物1-MD的摩爾分數可以達到高于67.6%;而在反應壓力為4 MPa時,中間加氫飽和產物(5-MTL及1-MTL)的摩爾分數之和可以達到最高為42.2%。結果表明,當反應壓力為2~6 MPa時,反應體系中的中間加氫飽和產物含量較高。

圖7 反應壓力(p)對1-MN及其加氫產物摩爾分數(x)的影響Fig.7 Effect of reaction pressure (p) on the molarfraction (x) of 1-MN and its hydrogenation productsT=650 K; n(H2)/n(1-MN)=5
不同反應壓力下1-MN平衡轉化率及其加氫產物選擇性如圖8所示。
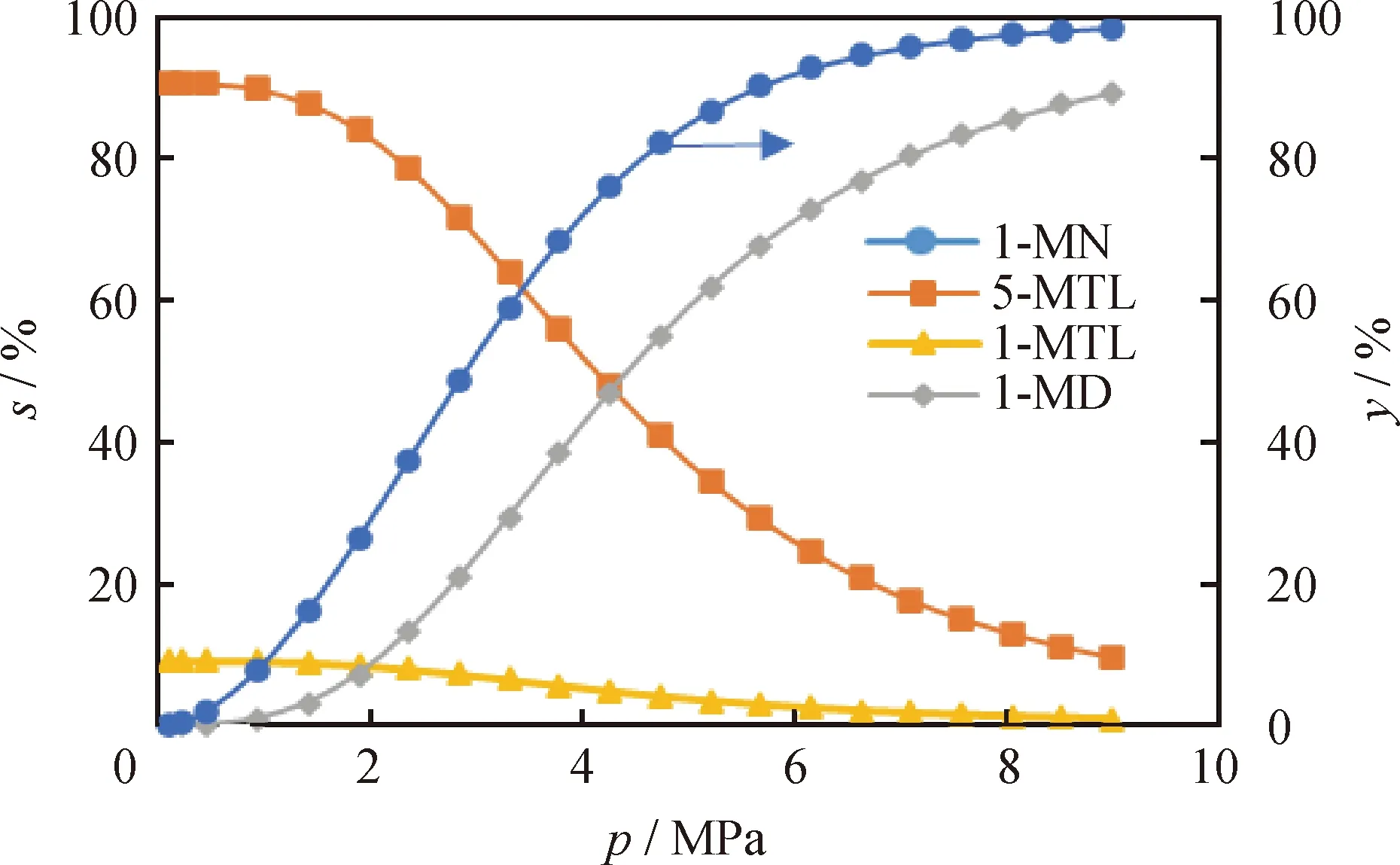
圖8 反應壓力(p)對1-MN平衡轉化率(y)及其加氫產物選擇性(s)的影響Fig.8 Effect of reaction pressure (p) on the equilibriumconversion rate (y) of 1-MN and selectivity (s)of its hydrogenation productsT=650 K; n(H2)/n(1-MN)=5
從圖8可以看出,隨著反應壓力的升高,1-MN的平衡轉化率先快速升高而后緩慢升高,當反應壓力升至6 MPa時即可獲得超過90%的轉化率。對于中間加氫飽和產物5-MTL和1-MTL來說,隨著反應壓力的提高,兩者的選擇性均是逐漸下降的;而在反應壓力低于4.0 MPa時,5-MTL選擇性遠高于1-MTL選擇性。在高于4.0 MPa的反應壓力下,1-MN生成1-MD的選擇性要顯著高于生成中間加氫飽和產物5-MTL和1-MTL的選擇性。根據上述分析可知,為了獲得較高的1-MN平衡轉化率需要較高的反應壓力,而較高的反應壓力會進一步促使1-MN經由中間加氫飽和產物(5-MTL和1-MTL)向1-MD的轉化,從而提高了雙環芳烴加氫飽和生成雙環環烷烴。
2.3.3 氫/烴摩爾比對加氫飽和反應的影響
在反應溫度為650K 、反應壓力為6.0 MPa的條件下,考察了n(H2)/n(1-MN)的變化對整個反應體系的影響。圖9為在不同n(H2)/n(1-MN)對1-MN及其加氫產物摩爾分數的影響。
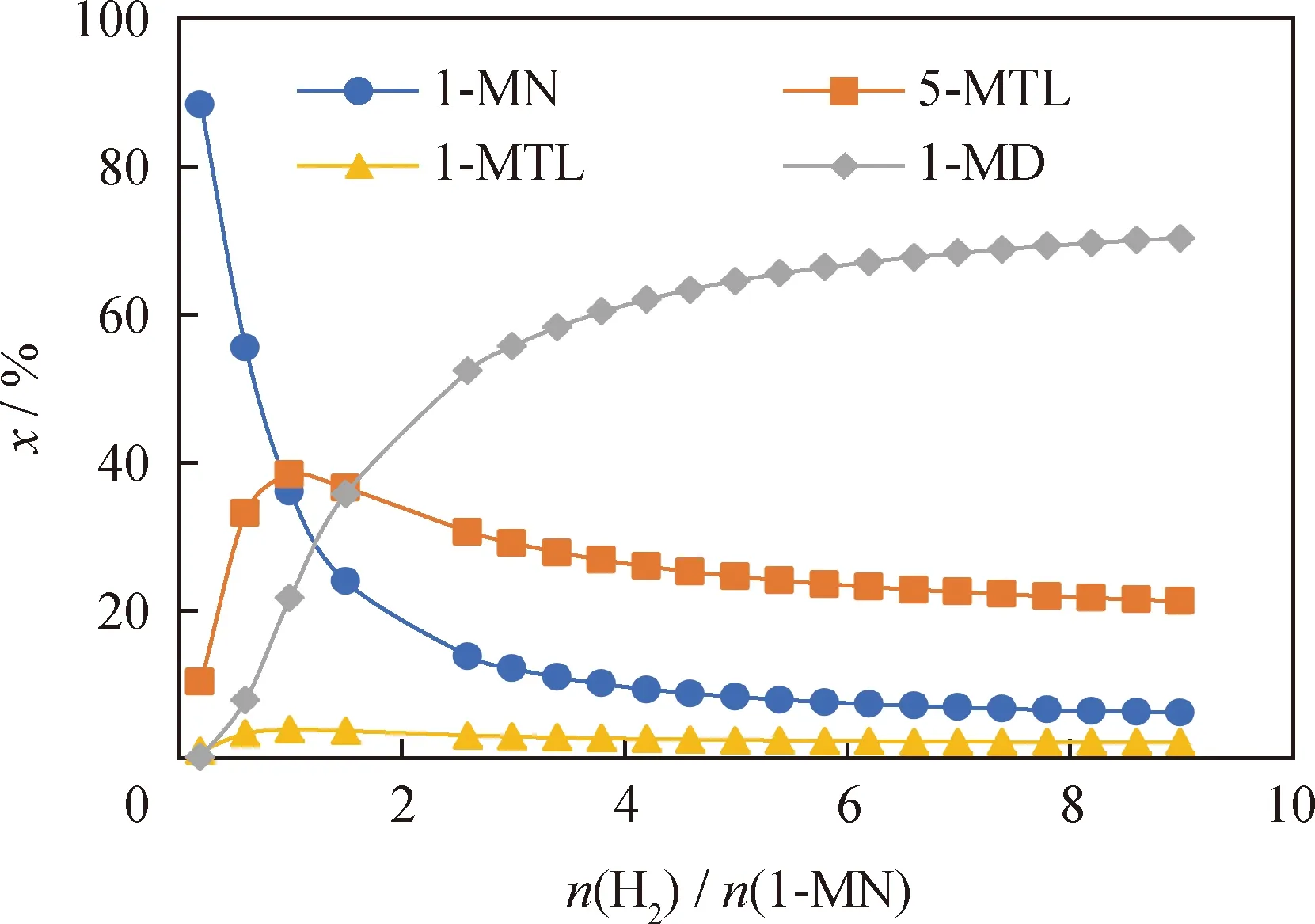
圖9 氫/烴摩爾比(n(H2)/n(1-MN))對1-MN及其加氫產物摩爾分數(x)的影響Fig.9 Effect of hydrogen/hydrocarbon molar ratio(n(H2)/n(1-MN)) on the molar fraction (x) of1-MN and its hydrogenation productsT=650 K; p=6.0 MPa
從圖9可以看出:隨著n(H2)/n(1-MN)增大,1-MN的摩爾分數先快速降低再緩慢降低;5-MTL和1-MTL的摩爾分數隨著n(H2)/n(1-MN)的增大先升高后降低,在n(H2)/n(1-MN)為1時達到極大值;1-MD的摩爾分數隨著n(H2)/n(1-MN)的增大先快速升高而后緩慢升高。根據上述分析可知,在n(H2)/n(1-MN)為1時,平衡體系中的中間加氫產物(5-MTL和1-MTL)摩爾分數之和可以達到最高值42.2%;而在n(H2)/n(1-MN)高于4的條件下,全加氫產物1-MD摩爾分數大于62.0%。
不同n(H2)/n(1-MN)下1-MN的平衡轉化率和及其加氫產物選擇性的變化如圖10所示。
從圖10可以看出:隨著n(H2)/n(1-MN)增大,1-MN的平衡轉化率先快速升高而后緩慢升高,當n(H2)/n(1-MN)高于4時,1-MN的平衡轉化率可達到90%以上;對于中間加氫飽和產物5-MTL和1-MTL來說,隨著n(H2)/n(1-MN)增大,兩者的選擇性均是呈現逐漸下降的趨勢,而在n(H2)/n(1-MN)低于 4時,5-MTL選擇性要遠高于1-MTL選擇性。而當n(H2)/n(1-MN)高于4時,生成1-MD的選擇性要顯著高于生成中間加氫飽和產物5-MTL和1-MTL 的選擇性。表明在較高的1-MN平衡轉化率下會進一步促使經由中間加氫飽和產物(5-MTL和1-MTL)向1-MD的轉化,從而提高了雙環芳烴加氫飽和生成雙環環烷烴。就n(H2)/n(1-MN)而言,當反應壓力恒定時,提高n(H2)/n(1-MN)相當于提高H2分壓,這對于芳烴加氫飽和是有利的。因此,n(H2)/n(1-MN)對1-MN加氫飽和生成中間加氫飽和產物(5-MTL和1-MTL)以及全加氫飽和產物(1-MD)的影響與反應總壓對各反應路徑的影響規律一致。
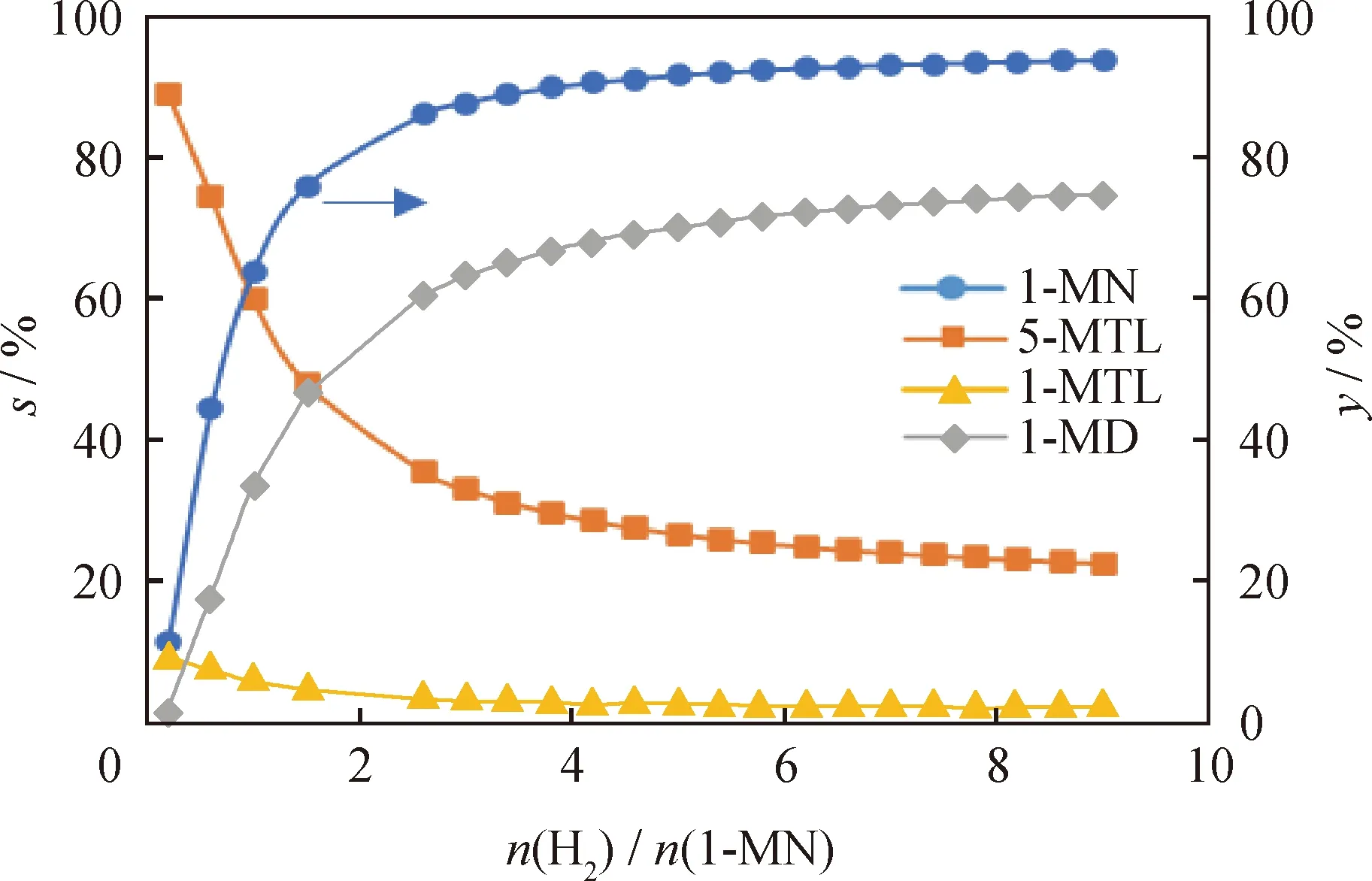
圖10 氫/烴摩爾比(n(H2)/n(1-MN))對1-MN平衡轉化率(y)及其加氫產物選擇性(s)的影響Fig.10 Effect of hydrogen/hydrocarbon molar ratio(n(H2)/n(1-MN)) on the equilibrium conversion rate (y)of 1-MN and selectivity (s) of its hydrogenation productsT=650 K; p=4.0 MPa
2.3.4 熱力學平衡分析模擬結果
根據上述熱力學計算,將1-MN的平衡轉化率和平衡體系中的中間加氫飽和產物四氫萘類含量以及選擇性繪制于圖11。
從圖11可以看出,隨著1-MN平衡轉化率的提高,全部甲基四氫萘類(MTLs,即5-MTL和1-MTL 之總和)的摩爾分數先增加后降低,當1-MN平衡轉化率為65%時,在反應體系中MTLs摩爾分數最高為47.2%;隨著1-MN平衡轉化率的升高,MTLs的選擇性逐漸降低,而完全加氫飽和產物1-MD選擇性逐漸升高。計算結果表明,對于工業裝置運行來說,為了獲得較高的單環芳烴(MTLs)含量,則需要選擇控制雙環芳烴(甲基萘類)轉化率在65%左右。
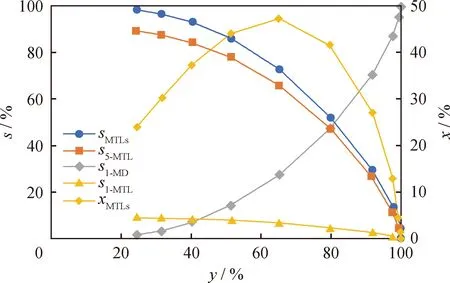
圖11 1-MN平衡轉化率(y)與四氫萘類、十氫萘類選擇性(s)及四氫萘類摩爾分數(x)的關系Fig.11 Relationship between the equilibrium conversionrate (y) of 1-MN and the selectivity (s) oftetrahydronaphthalenes and decahydronaphthalenesand the molar fraction (x) of tetrahydronaphthalenesT=650 K; p=6.0 MPa; n(H2)/n(1-MN)=5
3 1-MN加氫飽和實驗結果
采用微型固定床加氫反應器,考察了反應溫度、H2分壓對1-MN加氫飽和反應規律的影響。在芳烴加氫飽和工業裝置中,反應條件的變化對芳烴加氫飽和過程及產物選擇性產生重要的影響[14-15],在熱力學計算的基礎上通過實驗結果進一步說明反應條件的影響。
3.1 反應溫度對產物分布及MTLs選擇性的影響
1-MN加氫飽和反應隨反應溫度的變化如圖12和圖13所示。
從圖12可以看出:反應溫度由523 K提高至583 K時,1-MN摩爾分數略有降低, MTLs摩爾分數顯著降低;反應溫度由583 K提高至653 K,1-MN摩爾分數逐漸升高,MTLs摩爾分數繼續降低。說明在反應溫度523~583 K范圍內,1-MN加氫飽和尚未達到熱力學平衡,還在反應動力學控制區,提高反應溫度能進一步促進1-MN的轉化;在反應溫度583~653 K范圍內,1-MN加氫飽和達到了熱力學平衡,提高反應溫度導致1-MN摩爾分數升高。同理分析MTLs與1-MD之間的轉化可知,在反應溫度523~623 K范圍內該反應受到動力學的控制,1-MD摩爾分數隨反應溫度的升高而逐漸升高;在反應溫度623~653 K范圍內則受到熱力學的控制,1-MD摩爾分數隨反應溫度的升高而逐漸降低。

圖12 反應溫度(T)對1-MN加氫產物摩爾分數(x)的影響Fig.12 Effect of reaction temperature (T) on the molarfraction (x) of 1-MN hydrogenation productsp=4.0 MPa; n(H2)/n(1-MN)=10; LSHV=2.4 h-1

圖13 反應溫度(T)對1-MN平衡轉化率(y)及其加氫產物選擇性(s)的影響Fig.13 Effect of reaction temperature (T) on the equilibriumconversion rate (y) of 1-MN and selectivity (s)of its hydrogenation productsp=4.0 MPa; n(H2)/n(1-MN)=10; LSHV=2.4 h-1
根據圖13可知:在所考察的反應溫度范圍(523~653 K)內,1-MN的平衡轉化率保持在85.9%以上,當反應溫度由523 K提高至553 K時,1-MN的平衡轉化率略有升高;當反應溫度由553 K提高至653 K時,1-MN的平衡轉化率逐漸降低,從變化趨勢上可以看出1-MN達到熱力學平衡的反應溫度為553 K。當反應溫度由523 K提高至623 K,MTLs選擇性逐漸下降,而1-MD選擇性逐漸上升,說明在反應溫度523~623 K范圍內,1-MN 加氫飽和生成MTLs已經達到熱力學平衡,而MTLs加氫飽和生成1-MD尚未達到熱力學平衡,還在反應動力學控制區,提高反應溫度能進一步促進MTLs轉化為1-MD。當反應溫度超過623 K時,MTLs加氫飽和生成1-MD進入了熱力學控制區,提高反應溫度抑制了MTLs轉化為1-MD,也就導致反應體系中1-MD選擇性降低,不利于1-MD的生成。上述結果表明,在LCO加氫裝置進行工業生產時,為了避免多環芳烴的過度加氫飽和,不易在較低的反應溫度下進行,需要提高反應溫度至623 K以上,以實現多環芳烴轉化為單環芳烴。
3.2 H2分壓對平衡轉化率及MTLs選擇性的影響
1-MN加氫飽和反應隨H2分壓的變化規律如表2 所示。
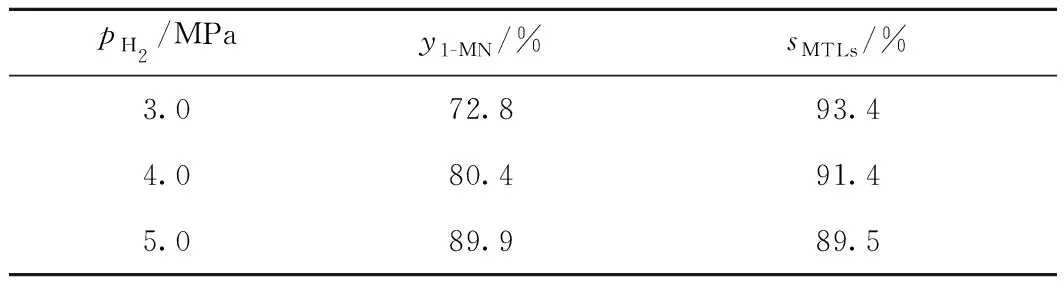
表2 H2分壓對1-MN平衡轉化率及MTLs選擇性的影響Table 2 Effect of H2 partial pressure on the equilibriumconversion rate of 1-MN and selectivity of MTLs
由表2可見,隨著H2分壓的升高, 1-MN的平衡轉化率呈現逐漸升高的趨勢。當H2分壓由3.0 MPa 提高至5.0 MPa時,1-MN平衡轉化率增加了17.1百分點。隨著H2分壓升高,MTLs的選擇性降低。提高H2分壓有利芳烴加氫飽和平衡反應向右移動,即促使1-MN繼續進行加氫飽和。結合表2中結果可知,在反應溫度623 K時1-MN平衡轉化率已經很高,MTLs的選擇性也較高,當進一步提升H2分壓時,反而促使MTLs再進一步加氫飽和生成1-MD類,從而導致了MTLs選擇性的降低。綜合考慮,采用Ni-Mo/γ-Al2O3催化劑時,選擇適宜的H2分壓為4.0 MPa,此時可以在保持較高1-MN平衡轉化率的情況下獲得較高的MTLs選擇性。
4 結 論
(1)1-MN加氫飽和反應網絡中4個反應的平衡常數均隨反應溫度的升高而減小,其中MTLs加氫生成1-MD反應自由能的變化對溫度更為敏感。
(2)1-MN在連續加氫反應體系中各反應物的摩爾分數隨反應條件的變化結果表明,反應溫度、系統總壓力和氫/烴摩爾比對1-MN加氫飽和產物分布具有重要影響,反應溫度高于600 K和反應壓力低于6.0 MPa的反應條件有利于提高反應體系中MTLs摩爾分數,當反應溫度為650 K、反應壓力為6.0 MPa以及氫/烴摩爾比為5時MTLs摩爾分數可以達到47.2%。
(3)采用Ni-Mo/γ-Al2O3催化劑的加氫飽和反應實驗結果驗證了1-MN的加氫飽和反應網絡,反應溫度對生成MTLs的單環芳烴加氫生成飽和烴的反應更為敏感,當反應溫度超過623 K時能夠抑制MTLs進一步加氫飽和生成1-MD;提高H2分壓有利于芳烴加氫飽和平衡反應向右移動,可以提高1-MN 的轉化率,卻使MTLs選擇性降低,綜合考慮1-MN加氫飽和生成MTLs的適宜H2分壓為4.0 MPa。

