納米藥物體外溶出測(cè)定方法研究進(jìn)展
楊子毅,盛利娟,朱霖,林霞
(1.江南大學(xué)生命科學(xué)與健康工程學(xué)院,無(wú)錫 214000;2.江蘇諾和必拓新藥研發(fā)有限公司,無(wú)錫 214028)
隨著醫(yī)藥科學(xué)的快速發(fā)展,納米技術(shù)在臨床被廣泛用于肺部疾病[1]、皮膚病[2]、生殖醫(yī)學(xué)[3]等各領(lǐng)域的診斷和治療,納米藥物研究成為當(dāng)今藥物研究的熱點(diǎn)之一。與傳統(tǒng)藥物遞送系統(tǒng)相比,納米藥物具有眾多優(yōu)勢(shì)[4-5],如改善難溶性藥物生物利用度、提高藥物體內(nèi)外穩(wěn)定性、將藥物靶向遞送至人體病變組織部位、提高藥物療效等。
然而,近年來(lái)納米藥物存在的安全性風(fēng)險(xiǎn)被逐漸關(guān)注。質(zhì)量評(píng)價(jià)對(duì)控制納米藥物安全性和有效性至關(guān)重要。其中體外藥物溶出或釋放是評(píng)價(jià)藥物質(zhì)量、監(jiān)控藥物制劑設(shè)計(jì)和批次間差異的關(guān)鍵質(zhì)量屬性[6],是影響納米藥物生物利用度的基本特征之一,可在一定程度上反映納米藥物安全性、療效和質(zhì)量。此外,可以根據(jù)體外藥物釋放特征模擬納米藥物體內(nèi)分布,如利用數(shù)學(xué)模型建立體內(nèi)外相關(guān)性,預(yù)測(cè)納米藥物體內(nèi)行為,加快納米藥物上市。筆者在本文綜述不同類(lèi)型納米藥物結(jié)構(gòu)特點(diǎn)及現(xiàn)有溶出測(cè)定方法,以期為納米藥物開(kāi)發(fā)提供參考。
1 納米藥物分類(lèi)及釋藥特點(diǎn)
納米藥物主要包括藥物納米晶和載藥納米遞送系統(tǒng)兩類(lèi)。納米晶是將藥物直接制備成具有納米尺度的顆粒,并制備成供臨床使用的適宜制劑;載藥納米遞送系統(tǒng)是將藥物以溶解、分散、吸附或包裹于適宜的載體或高分子材料中所形成的的納米粒。其中載藥納米遞送系統(tǒng)由于載體材料不同,制備工藝不同,其所形成的的納米藥物結(jié)構(gòu)也不同,包括脂質(zhì)體、聚合物膠束、納米管、納米囊/納米球、納米纖維、納米乳、納米凝膠等,結(jié)構(gòu)示意圖見(jiàn)圖1[7]。目前已有幾十種納米藥物應(yīng)用于臨床,部分已上市納米藥品及其結(jié)構(gòu)類(lèi)型見(jiàn)表1。
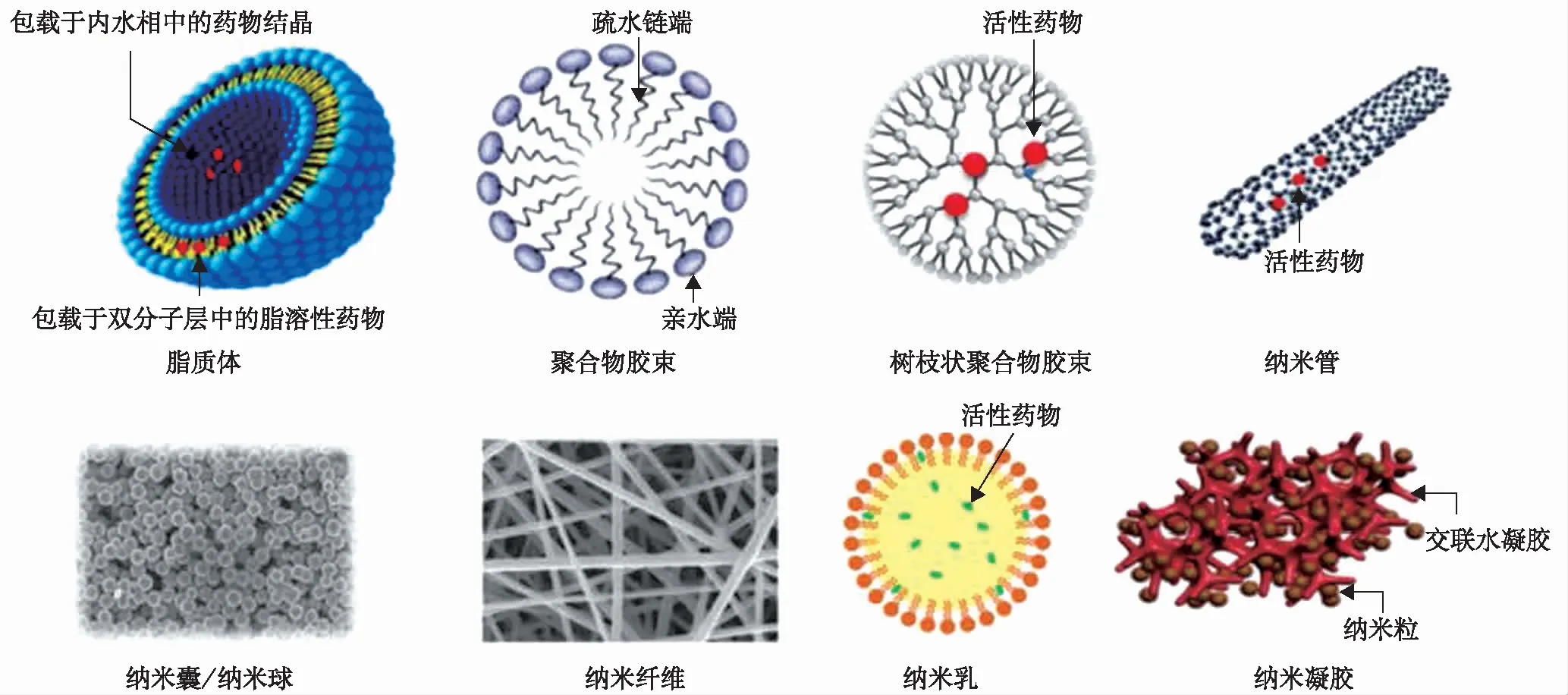
圖1 部分載藥納米遞送系統(tǒng)結(jié)構(gòu)示意圖[7]

表1 部分已上市納米藥品
由于納米藥物尺寸較小、結(jié)構(gòu)復(fù)雜,與其他制劑相比,影響藥物釋放的因素更復(fù)雜。如納米藥物粒度分布、結(jié)構(gòu)特點(diǎn)、載體材料自身降解特點(diǎn)、藥物自身理化性質(zhì)及與載體材料的相互作用、藥物在制劑結(jié)構(gòu)中的微觀分布、納米藥物與體內(nèi)蛋白之間的相互作用、納米載體孔徑大小、外部環(huán)境刺激、內(nèi)部構(gòu)象和滲透性等均可影響藥物釋放。不同納米藥物由于結(jié)構(gòu)不同,影響藥物釋放的因素也有所區(qū)別。
1.1納米晶 納米晶也稱(chēng)為納米混懸,其結(jié)構(gòu)較簡(jiǎn)單,由納米尺度的藥物顆粒與吸附于粒子表面的穩(wěn)定劑層組成。納米晶經(jīng)不同給藥途徑給藥后,藥物釋放特點(diǎn)及影響因素也各不相同[8]。如經(jīng)口服后,藥物釋放主要受藥物理化性質(zhì)、胃腸道分泌液環(huán)境影響。弱酸性藥物在胃中溶解速率較低,進(jìn)入腸道后,由于腸道pH值更高,溶解度顯著增加。而弱堿性藥物在胃中快速溶解,進(jìn)入十二指腸后形成過(guò)飽和溶液體系。中性藥物在胃腸道的溶出則主要依賴(lài)自身溶解速率和胃腸道分泌的增溶劑。此外,影響納米晶釋放的因素還包括物理穩(wěn)定性(如聚結(jié)性和再分散性等)、與溶解和過(guò)飽和度相關(guān)的溶解性質(zhì)、輔料對(duì)維持過(guò)飽和態(tài)的穩(wěn)定作用等[9]。經(jīng)靜脈注射后,納米晶體藥物溶出速率主要與其在血液中的溶解速率相關(guān)。此外,進(jìn)入體循環(huán)后也會(huì)被巨噬細(xì)胞吞噬,富集于肝臟和脾臟。納米晶體經(jīng)肌內(nèi)注射后,可在注射部位誘發(fā)慢性肉芽腫炎癥反應(yīng),給藥24 h后,納米晶體被炎癥反應(yīng)誘發(fā)的上皮樣巨噬細(xì)胞包裹,在巨噬細(xì)胞內(nèi),藥物緩慢溶解,達(dá)到緩釋目的[10]。
1.2載藥納米遞送系統(tǒng)
1.2.1脂質(zhì)體 脂質(zhì)體是內(nèi)部為水相、由類(lèi)脂質(zhì)雙分子層組成的超微囊載體制劑。脂溶性藥物分散于脂質(zhì)雙分子層中,如維替泊芬和紫杉醇;或是與帶有相反電荷的脂質(zhì)形成復(fù)合物分散于脂質(zhì)雙分子層,如兩性霉素B。親水性藥物通常以不同物理狀態(tài)被包載于內(nèi)水相,如順鉑和環(huán)丙沙星以過(guò)飽和溶液形式存在;長(zhǎng)春瑞濱和長(zhǎng)春新堿以無(wú)定型沉淀存在;多柔比星、柔紅霉素和拓?fù)涮婵狄约{米晶形式存在[11]。脂質(zhì)體藥物釋放主要依賴(lài)藥物滲透和擴(kuò)散作用,其影響因素較復(fù)雜,包括脂質(zhì)體本身理化性質(zhì)、被包載藥物的物理狀態(tài)、以及外在因素如釋放介質(zhì)種類(lèi)及是否含有滲透性離子、溫度、pH值和酶等。影響脂質(zhì)體藥物溶出的理化性質(zhì)包括藥物在雙分子層的滲透性、藥物電離常數(shù)、藥物與脂質(zhì)雙分子層的結(jié)合作用、藥物自聚集性和脂質(zhì)體內(nèi)藥物沉淀物的理化性質(zhì)等。藥物分子的尺寸和橫截面積也顯著影響藥物在脂質(zhì)雙分子層的滲透和擴(kuò)散。此外,內(nèi)水相中緩沖鹽濃度及類(lèi)型、藥物/脂質(zhì)比例、內(nèi)水相pH值、體積等對(duì)藥物釋放也有影響。
1.2.2納米乳 納米乳可以顯著提高難溶性藥物溶解度,已被廣泛應(yīng)用于難溶性藥物靜脈用注射劑及口服高效制劑的研究。其中藥物可以溶解或分散于油相,也可以分布于界面膜。其藥物釋放影響因素包括藥物與納米乳界面乳化劑的結(jié)合作用、藥物界面活性、乳滴粒徑、脂質(zhì)組成、界面膜穩(wěn)定性、藥物在納米乳的微觀分布。此外,納米乳在體內(nèi)環(huán)境中自身結(jié)構(gòu)不穩(wěn)定,易被機(jī)體代謝,也會(huì)加速藥物釋放。
1.2.3基于聚合物載體的納米藥物 基于聚合物載體的納米藥物結(jié)構(gòu)類(lèi)型包括聚合物膠束、納米管、納米囊、納米球、納米纖維以及納米凝膠等。該類(lèi)納米藥物的藥物釋放主要受以下因素影響:制劑組成(藥物、聚合物類(lèi)型和其他輔料),各組分間比例,各組分間的相互作用,聚合物降解特性和制備工藝等。藥物釋放機(jī)制主要包括擴(kuò)散、溶劑交換、聚合物降解和環(huán)境響應(yīng)釋放4類(lèi)機(jī)制,具體見(jiàn)圖2[12]。
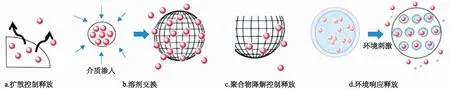
圖2 基于聚合物載體的納米藥物釋藥機(jī)制[12]
藥物擴(kuò)散控制釋放在納米囊和納米球中較常見(jiàn)。納米囊為“核-殼”結(jié)構(gòu),溶解或分散在核心的藥物經(jīng)溶解,并通過(guò)“殼”狀結(jié)構(gòu)擴(kuò)散釋放至體液或介質(zhì)[13]。骨架型納米球中藥物通常分散于聚合物高分子材料基質(zhì),也存在擴(kuò)散控制釋放機(jī)制。
溶劑交換,即在藥物釋放過(guò)程中,溶劑進(jìn)入某些納米藥物結(jié)構(gòu),從而影響納米藥物中藥物釋放,包括滲透壓或溶脹控制釋放。如納米凝膠,其由具有三維網(wǎng)狀結(jié)構(gòu)的交聯(lián)聚合物組成。納米凝膠溶脹后,藥物可經(jīng)體系中溶劑通道溶解-擴(kuò)散,釋放至體液或介質(zhì)。可以通過(guò)調(diào)整制劑中藥物分布或聚合物類(lèi)型,控制藥物釋放速度。如SHEN等[14]設(shè)計(jì)了一種具有氧化還原/超聲波雙重刺激反應(yīng)的新型納米凝膠系統(tǒng),用于精確控制藥物釋放速度。
聚合物降解控制釋放是以生物可降解高分子材料為載體的納米藥物中藥物釋放的重要釋藥機(jī)制之一。如聚乳酸(polylactic acid,PLA)、聚乳酸-羥基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]或聚己內(nèi)酯(polycaprolactone,PCL)隨著聚合物的降解,還會(huì)發(fā)生自催化降解,使骨架結(jié)構(gòu)塌陷,水分進(jìn)入制劑內(nèi)部,藥物釋放。聚酸酐和聚原酸酯等通常發(fā)生溶蝕作用,并導(dǎo)致聚合物逐漸降解,藥物釋放。
環(huán)境響應(yīng)型釋藥機(jī)制多應(yīng)用于具有局部靶向治療作用的納米藥物中,包括pH值、離子強(qiáng)度、超聲、電化學(xué)或磁響應(yīng)。其藥物釋放機(jī)制主要是納米藥物所處環(huán)境發(fā)生變化時(shí),聚合物結(jié)構(gòu)或溶解特性發(fā)生變化,制劑結(jié)構(gòu)塌陷或瓦解,導(dǎo)致藥物釋放。
2 納米藥物的體外溶出測(cè)定方法
藥物體外釋放度是指藥物在規(guī)定條件下從藥物制劑中釋放的速度和程度,是納米藥物的質(zhì)量控制指標(biāo)之一,一定程度上反映了納米藥物的體內(nèi)行為,從而確保了藥物臨床使用有效性和安全性。它可指導(dǎo)制劑開(kāi)發(fā)并可在一定程度上預(yù)測(cè)體內(nèi)吸收特點(diǎn)。
納米藥物體外溶出/釋放的主要測(cè)定方法包括取樣分離法、透析法、流通池法等。在藥物溶出/釋放測(cè)定方法的研究中,無(wú)論是使用已有方法還是修訂及重新建立方法,納米藥物的溶出/體外釋放測(cè)定法均應(yīng)經(jīng)過(guò)充分驗(yàn)證,以確保方法的準(zhǔn)確性和重現(xiàn)性[15]。
2.1取樣分離法 取樣分離法是將納米藥物直接分散于一定體積恒溫釋放介質(zhì),定時(shí)取樣,取樣后及時(shí)補(bǔ)充等量新鮮釋放介質(zhì)以維持相應(yīng)漏槽條件,通過(guò)測(cè)定藥物累積釋放量評(píng)估藥物釋放行為。取出的樣品可以使用過(guò)濾器分離釋放介質(zhì)和納米藥物,也可以采用離心分離法,如超速離心法和離心超濾法。取樣分離法可以使用《中華人民共和國(guó)藥典》標(biāo)準(zhǔn)溶出裝置,包括槳法、籃法、小杯法等,也可以使用搖瓶法。
如ZHANG等[16]采用取樣分離法,使用水浴恒溫振蕩器研究谷胱甘肽響應(yīng)型姜黃素納米膠束的體外釋放,取樣后采用超速離心法分離納米藥物和介質(zhì)。該方法可以區(qū)分含有不同濃度谷胱甘肽濃度的介質(zhì),釋放速率隨谷胱甘肽濃度的增加而增加(圖3)。美國(guó)食品藥品管理局(FDA)溶出度數(shù)據(jù)庫(kù)中,阿立哌唑緩釋注射劑(Abilify Maintena?)以及兩種帕潘立酮棕櫚酸酯緩釋注射液(Invega Sustenna?和Invega Trinza?),均使用《美國(guó)藥典》(United States Pharmacopoeia,USP)第二法槳法取樣分離法測(cè)定體外釋放度。
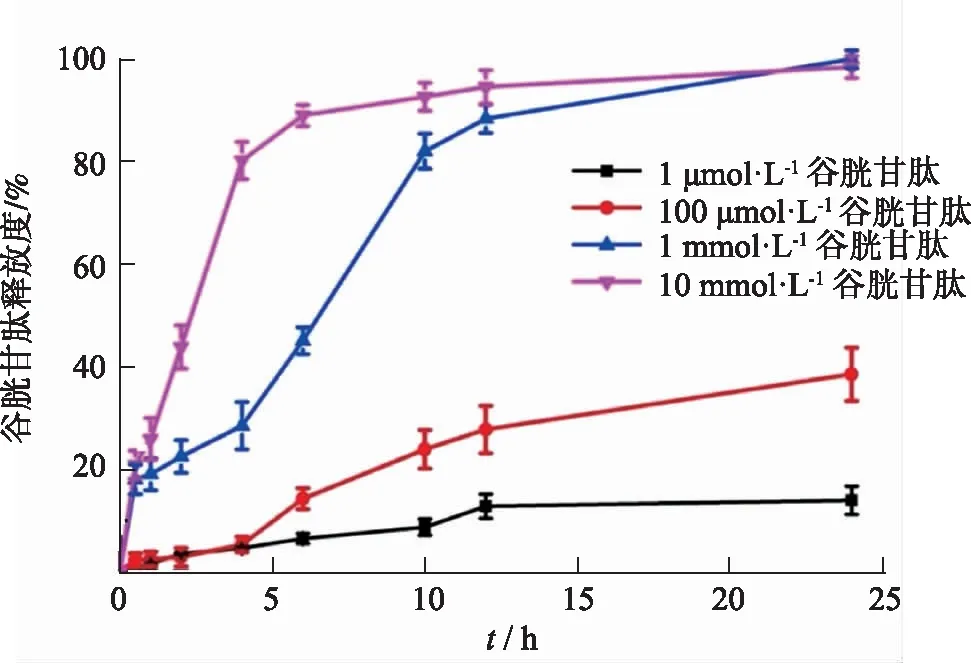
圖3 谷胱甘肽響應(yīng)型納米膠束體外釋放曲線[16]
取樣分離法可以直接檢測(cè)藥物釋放,并可以使用《中華人民共和國(guó)藥典》規(guī)定的標(biāo)準(zhǔn)溶出設(shè)備開(kāi)展,方法較簡(jiǎn)單。但該方法也存在一定局限性,如在釋放過(guò)程中藥物可能發(fā)生聚集;取樣過(guò)程中由于納米藥物粒徑較小,易堵塞或吸附在溶出裝置的過(guò)濾系統(tǒng)中,取樣時(shí)也有部分藥物被取出,造成藥物損失;以上因素均影響測(cè)定結(jié)果準(zhǔn)確性。此外,在將樣品中分散介質(zhì)與納米藥物分離過(guò)程中,藥物還在繼續(xù)溶出,也影響結(jié)果的準(zhǔn)確性。
2.2透析法 透析法是將納米藥物密封于含有釋放介質(zhì)的透析袋或者透析裝置,再置于含有釋放介質(zhì)的容器,利用小分子可以通過(guò)半透膜,而納米顆粒粒徑大不能透過(guò)半透膜的特點(diǎn),使游離藥物擴(kuò)散至釋放介質(zhì)。通過(guò)直接測(cè)定透析裝置外側(cè)釋放介質(zhì)中藥物濃度,評(píng)估藥物釋放速度。也可以將納米藥物使用大體積釋放介質(zhì)稀釋置于容器,將含有空白釋放介質(zhì)的透析袋或透析裝置置于上述容器,測(cè)定透析袋內(nèi)釋放介質(zhì)中藥物濃度。透析法可以使用《中華人民共和國(guó)藥典》標(biāo)準(zhǔn)溶出裝置,包括槳法、籃法、小杯法、流通池法、擴(kuò)散池法等,也可以使用簡(jiǎn)易方法如搖瓶法或燒杯攪拌法。
與取樣分離法相比,透析法可以利用透析膜分離游離藥物與納米藥物,在釋放過(guò)程中可避免反復(fù)取樣導(dǎo)致的藥物損失,以及取樣后繁瑣的游離藥物分離操作。目前,透析法已被廣泛應(yīng)用于納米藥物體外溶出研究中[17-18]。如NAIR等[17]使用透析法研究不同粒徑(<50 nm,50~100 nm和>100 nm)苯妥英鈉脂質(zhì)體體外藥物釋放,隨著粒徑增大,體外釋放速度顯著降低,可以區(qū)分不同粒徑脂質(zhì)體的藥物釋放。
透析法中影響藥物釋放速度的重要因素是透析膜材質(zhì)和截留分子量。透析膜材質(zhì)主要有再生纖維素、纖維素酯和聚偏二氟乙烯[19]。需充分評(píng)估透析膜對(duì)藥物的吸附作用,避免釋放出的游離藥物大量吸附于透析膜表面,進(jìn)而影響游離藥物向釋放介質(zhì)中擴(kuò)散。此外,還需系統(tǒng)優(yōu)化透析膜截留分子量,需在滿(mǎn)足游離藥物擴(kuò)散通過(guò)的同時(shí),避免納米藥物中小粒徑顆粒通過(guò)或堵塞透析膜。
透析法雖然操作簡(jiǎn)單,但在實(shí)際應(yīng)用中仍然存在一定問(wèn)題。如納米藥物在透析袋或透析裝置中聚集或沉降,透析袋或透析裝置形狀不固定導(dǎo)致釋藥表面積存在差異,在溶出裝置中位置無(wú)法固定,難溶性藥物易吸附于透析膜中,透析袋內(nèi)可容納的介質(zhì)體積有限、往往難以達(dá)到漏槽條件等,這均導(dǎo)致無(wú)法測(cè)得納米藥物真實(shí)溶出速率。
透析膜對(duì)絕大多數(shù)藥物擴(kuò)散均產(chǎn)生一定屏障作用,從而減慢藥物釋放速度。因此,采用透析法測(cè)定的是表觀藥物釋放動(dòng)力學(xué),是由真實(shí)藥物釋放動(dòng)力學(xué)和藥物在半透膜中的滲透動(dòng)力學(xué)兩者共同組成。JANAS等[20]設(shè)計(jì)了一種基于透析法的分散釋放器(dispersion releaser)(圖4)。該裝置由樣品供給室和外側(cè)透析膜組成,供給室內(nèi)裝有攪拌槳。該裝置可裝載于USP第二法溶出裝置(槳法)上,利用溶出儀攪拌動(dòng)力,在供給室內(nèi)對(duì)納米藥物進(jìn)行攪拌,避免藥物在透析裝置內(nèi)沉降聚結(jié),促進(jìn)藥物擴(kuò)散通過(guò)半透膜;并以氟比洛芬為模型藥物,計(jì)算膜滲透常數(shù),應(yīng)用數(shù)學(xué)模型獲得標(biāo)準(zhǔn)化藥物釋放曲線。

圖4 分散釋放裝置圖[20]
2.3流通池法 流通池法是指將釋放介質(zhì)以適宜的恒定流速流經(jīng)樣品適配器,與適配器內(nèi)樣品接觸,釋放介質(zhì)經(jīng)適配器上方過(guò)濾流出,在不同時(shí)間測(cè)定釋放介質(zhì)中藥物濃度,計(jì)算釋放度的方法。根據(jù)釋放介質(zhì)是否循環(huán)流經(jīng)適配器,還分為開(kāi)放式和循環(huán)式流通池法。該方法優(yōu)勢(shì)是,溶出裝置為《中華人民共和國(guó)藥典》標(biāo)準(zhǔn)溶出裝置,樣品位置以及樣品與釋放介質(zhì)接觸面積固定,釋放過(guò)程中釋放介質(zhì)不斷流經(jīng)樣品,可以維持適宜的漏槽條件,避免局部濃度差較低[21]。
YUAN等[22-23]使用流通池法結(jié)合透析裝置,建立了多柔比星脂質(zhì)體體外釋放方法,通過(guò)優(yōu)化介質(zhì)中羥丙基-環(huán)糊精濃度、溫度和待測(cè)樣品濃度等參數(shù),可以區(qū)分不同組成、不同理化性質(zhì)和不同制備工藝所制備的多柔比星脂質(zhì)體。TANG等[24]和LIU等[25]聯(lián)合FDA相關(guān)研究人員建立了流通池法測(cè)定兩性霉素B脂質(zhì)體體外溶出,可以區(qū)分已上市兩性霉素B脂質(zhì)體原研產(chǎn)品(AmBisome?)及其仿制藥,對(duì)產(chǎn)品質(zhì)量控制以及仿制藥開(kāi)發(fā)具有重要指導(dǎo)意義。
2.4其他方法 MENEZES等[26]開(kāi)發(fā)了一種傳統(tǒng)槳法和超濾離心組合新方法,并與傳統(tǒng)取樣分離法、透析法進(jìn)行比較,該組合方法更適合研究納米顆粒制劑藥物釋放動(dòng)力學(xué)。納米藥物的體外溶出測(cè)定方法還有電化學(xué)方法,該法是一種快速原位測(cè)量方法,可以實(shí)時(shí)監(jiān)測(cè)藥物釋放,同時(shí)可以避免釋放介質(zhì)中未溶解藥物引起的干擾[27]。但該技術(shù)僅適用于具有電化學(xué)活性的藥物,其敏感性和響應(yīng)性差異很大。除電化學(xué)方法外,非電化學(xué)法,如量熱法[28]也可用于納米藥物體外溶出研究。CHI等[29]使用自制便攜式分析儀測(cè)定3種非甾體抗炎藥電紡絲的藥物溶出。該方法可在線同步監(jiān)測(cè)多種藥物釋放,且線性檢測(cè)范圍很寬,檢測(cè)限(limit of detection,LOD)低至 μg·mL-1水平,為快速準(zhǔn)確檢測(cè)納米纖維類(lèi)制劑的溶出度提供了一種有前景的方法。
3 數(shù)學(xué)模型的建立及體內(nèi)外相關(guān)性
藥物釋放機(jī)制和動(dòng)力學(xué)是描述藥物溶出的兩個(gè)重要特征。藥物在溶出介質(zhì)中的溶解過(guò)程涉及不同物理現(xiàn)象,包括顆粒表面的潤(rùn)濕、固態(tài)作用力破壞、溶劑化、液體間擴(kuò)散及周?chē)后w對(duì)流現(xiàn)象等。利用數(shù)學(xué)模型可以更好地理解特定劑型的藥物釋放機(jī)制,利用計(jì)算機(jī)模擬技術(shù)獲得的藥物釋放動(dòng)力學(xué)可用于優(yōu)化藥物處方設(shè)計(jì)并減少藥物制劑開(kāi)發(fā)時(shí)間和成本。ROOS等[30]開(kāi)發(fā)了一種新型納米藥物溶出數(shù)學(xué)模型,以預(yù)測(cè)藥物在體內(nèi)吸收機(jī)制。PONTRELLI等[31]通過(guò)數(shù)學(xué)模型參數(shù)反映pH敏感型載藥納米載體的釋放,可用于表征藥物動(dòng)力學(xué),從而優(yōu)化納米藥物處方工藝。臨床研究中,DOGRA等[32]利用數(shù)學(xué)模型研究納米顆粒、腫瘤和個(gè)體相關(guān)參數(shù)確定納米材料在腫瘤遞送中的作用。JAFARI等[33]研究新型預(yù)合成磁性納米復(fù)合聚氨酯基質(zhì)的藥物釋放機(jī)制,并開(kāi)發(fā)了一種合適的數(shù)學(xué)模型來(lái)預(yù)測(cè)體外乳腺癌治療的定量靶向藥物遞送。
目前常用的數(shù)學(xué)模型包括零階模型、一階模型、Hixson-Crowell 模型立方根方程、Korsmeyer-Peppas 動(dòng)力學(xué)方程和 Higuchi 模型等,通常使用多種數(shù)學(xué)模型組合提高預(yù)測(cè)準(zhǔn)確性[33]。FAZLI-ABUKHEYLI等[34]在研究納米多孔陽(yáng)極氧化鋁植入物改善局部藥物遞送的過(guò)程中提出了一種新的兩階段釋藥模型:第一階段采用零級(jí)動(dòng)力學(xué)模型,第二段采用一級(jí)動(dòng)力學(xué)模型。將實(shí)驗(yàn)數(shù)據(jù)擬合到新模型中,實(shí)驗(yàn)數(shù)據(jù)與該模型預(yù)測(cè)數(shù)據(jù)相關(guān)性較好。
除體外溶出測(cè)定方法優(yōu)化外,數(shù)學(xué)模型還可應(yīng)用于納米藥物溶出的體內(nèi)外相關(guān)性?xún)?yōu)化。體內(nèi)外相關(guān)性(invitro-invivocorrelation,IVIVC)是指藥物制劑的生物學(xué)性質(zhì)與其物理化學(xué)性質(zhì)(如體外釋放度)之間建立的定量關(guān)系。通常將納米藥物體外溶出數(shù)據(jù)和血漿藥物濃度時(shí)間曲線進(jìn)行數(shù)學(xué)處理以建立相關(guān)性。IVIVC研究有助于加快藥物處方篩選,為溶出測(cè)定方法的建立及生物等效性研究提供參考。然而建立具有良好IVIVC的納米藥物體外溶出測(cè)定方法仍具有較大挑戰(zhàn),藥物的理化性質(zhì)、制劑結(jié)構(gòu)特點(diǎn)及生理環(huán)境均會(huì)對(duì)其產(chǎn)生影響[35]。SINGH等[36]使用混合計(jì)算機(jī)模擬模型預(yù)測(cè)替莫泊芬脂質(zhì)體在人體中的藥動(dòng)學(xué),建立了A級(jí)IVIVC。SARANGI等[37]在洛伐他汀固體脂質(zhì)納米粒的IVIVC研究中,通過(guò)優(yōu)化數(shù)學(xué)模型,獲得了良好的A級(jí)相關(guān)性,回歸系數(shù)值為0.902。對(duì)已有數(shù)學(xué)模型進(jìn)行分析和系統(tǒng)性?xún)?yōu)化,可以有效提高IVIVC的準(zhǔn)確性。
4 總結(jié)與展望
體外溶出評(píng)價(jià)是控制納米藥物質(zhì)量的重要手段,也是納米藥物處方工藝研究階段的重要指標(biāo)。納米藥物體外溶出測(cè)定往往存在許多挑戰(zhàn),如納米藥物粒徑分布不均勻且結(jié)構(gòu)復(fù)雜,體外溶出實(shí)驗(yàn)時(shí)取樣分離不準(zhǔn)確,過(guò)濾破壞納米藥物結(jié)構(gòu)等。此外,納米藥物體內(nèi)釋放易受各種生理因素影響,例如體液量、血流速度、體內(nèi)酶和蛋白、細(xì)胞作用等。因此建立具有良好體內(nèi)體外相關(guān)性的體外溶出測(cè)定方法仍存在很大挑戰(zhàn)。但隨著納米藥物體外溶出測(cè)定方法研究的深入,包括溶出裝置的改善、溶出介質(zhì)的復(fù)雜性提升、數(shù)學(xué)模型及計(jì)算機(jī)輔助的介入,納米藥物的體外溶出測(cè)定方法開(kāi)發(fā)日趨成熟。越來(lái)越多的方法顯著改善了對(duì)納米藥物關(guān)鍵質(zhì)量屬性的區(qū)分力,為基于納米藥物的仿制藥研發(fā)、創(chuàng)新制劑設(shè)計(jì)、納米藥物質(zhì)量監(jiān)管提供了有效幫助。
- 醫(yī)藥導(dǎo)報(bào)的其它文章
- 2023年《醫(yī)藥導(dǎo)報(bào)》各期藥物專(zhuān)欄要目
- 《醫(yī)藥導(dǎo)報(bào)》雜志關(guān)于作者署名的原則
- 歡迎訂閱2023年《醫(yī)藥導(dǎo)報(bào)》雜志
- 《醫(yī)藥導(dǎo)報(bào)》在《2022年中國(guó)學(xué)術(shù)期刊影響因子年報(bào)》中評(píng)價(jià)指標(biāo)再創(chuàng)新高
- 《醫(yī)藥導(dǎo)報(bào)》對(duì)學(xué)術(shù)不端論文的認(rèn)定標(biāo)準(zhǔn)和處理辦法
- 關(guān)于假冒《醫(yī)藥導(dǎo)報(bào)》工作人員與作者聯(lián)系的聲明

