納米疫苗的發展與應用*
呂蔚林,陳朝霞,雍土瑩,甘璐,楊祥良
(1.華中科技大學生命科學與技術學院,武漢 430074;2.國家納米藥物工程技術研究中心,武漢 430074)
自1796年第一劑牛痘疫苗發明以來,針對不同疾病的疫苗被逐步研發并應用于臨床。按照發展歷程,疫苗可大致分為三代:第一代為滅活疫苗或減毒活疫苗,第二代為基因工程疫苗,第三代為核酸疫苗。為進一步減少不良反應,提高疫苗順應性,增強疫苗效價,誘導持久的免疫反應,人類需要一種高效的遞送系統,既能把抗原遞送到靶點激活持久的免疫反應,又能減少毒副作用。
近年來,納米載體技術快速發展,在改善藥動學、提高藥物生物利用度等方面效果顯著。納米載體技術可實現佐劑和抗原有效封裝與遞送,提高抗原穩定性,增加抗原裝載量,為多種途徑接種疫苗(如口服給藥、吸入給藥等)提供了可能。同時,納米技術可將納米疫苗加工為免疫反應的靶點,一旦納米疫苗被抗原呈遞細胞(antigen-presenting cells,APCs)內化,納米顆粒可誘導炎癥體復合物形成,促進炎性細胞因子分泌、免疫細胞招募等。此外,調控納米疫苗的形狀、粒徑、電荷或進行表面修飾等可增強疫苗組織靶向性,提高攝取效率,減少細胞毒性等。
目前常見的納米疫苗包括脂質納米顆粒疫苗、有機高分子聚合物納米疫苗、無機納米顆粒疫苗、病毒載體疫苗、生物膜納米粒疫苗等幾大類。利用不同的載體制備納米疫苗可以有針對性地實現繞開生理屏障、靶向遞送、溶酶體逃逸、免疫激活等目標。筆者在本文概述納米疫苗在傳染病預防和腫瘤免疫治療中的應用進展。
1 脂質納米顆粒疫苗
脂質納米顆粒主要包括膠束、乳劑、固體脂質納米粒(solid lipid nanoparticles,SLN)、納米結構脂質載體(nanostructed lipid carriers,NLC)、脂質體(liposomes)等。脂質納米顆粒主要由脂質或類脂質分子組成,可通過吸附、包載等方式攜帶抗原,具有結構穩定、生物相容性好、可以攜帶抗原佐劑實現體內長循環、增強細胞對抗原的識別攝取及增強組織靶向等優點。但為了在體內更好發揮作用,脂質納米顆粒仍需要解決抗原或mRNA等物質容易降解[1]、腎臟對納米粒的截留[1]、納米粒難以靶向特定組織、納米粒難以實現核內體逃逸[2]、佐劑造成的炎癥或毒性等一系列問題。
為增強納米粒的穩定性和血液滯留時間,有文獻報道采用聚乙二醇(polyethylene glycol,PEG)對脂質納米顆粒進行修飾(圖1A,圖1B),可以通過減少顆粒聚集從而增強脂質納米粒穩定性[3],并通過增加脂質納米粒的親水性減少單核吞噬細胞系統(mononuclear phagocyte system,MPS)對脂質納米顆粒的清除,延長血液循環時間[4]。PEG的分子量可以在350~3000,脂質錨的長度可以在10~18碳[5],一般較大的分子量和較長的長度可以減少MPS的清除作用,增加納米粒在血液中的滯留。此外,PEG修飾可增加親水性從而使納米粒更容易穿透黏膜屏障[6],有利于噴霧劑型疫苗的發展。
納米顆粒可以通過表面修飾實現組織或器官靶向并促進細胞攝取。KEDMI等[7]利用一種膜錨定脂蛋白(anchored secondary scFv enabling targeting,ASSET)開發了一種細胞特異性小干擾RNA(small interfering RNA,siRNA)遞送平臺(圖1C),其一端整合到脂質納米顆粒上,一端與抗體的Fc片段相連,實現在脂質納米顆粒表面非共價包被靶向抗體。ZOHRA等[8]在N-[1-(2,3-二油氧基)丙基]-N,N,N-三甲基氯化銨的陽離子脂質體中加入無機碳酸鹽磷灰石,形成陽離子脂質體-磷灰石復合物,大大提高了轉染效率。MOON等[9]構建了一種雙層間交聯的多層膜囊泡(interbilayer-crosslinked multilamellar vesicles,ICMVs),通過短的共價交聯鍵穩定多層囊泡形成,這些短鏈將脂質頭基連接在囊泡壁內相鄰緊密堆疊的雙層的相對面上(圖1D)。與相同脂質組成的簡單脂質體或多層囊泡(multilamellar vesicles,MLVs )相比,ICMVs封裝并保留了更多抗原蛋白,并在暴露于血清(超過30 d)時緩慢釋放蛋白(圖1E),在胞內脂肪酶作用下實現快速降解。通過對小鼠免疫發現,ICMVs引起的強效抗體滴度比簡單脂質體提高約1000倍,比相同脂質成分的MLVs提高約10倍。
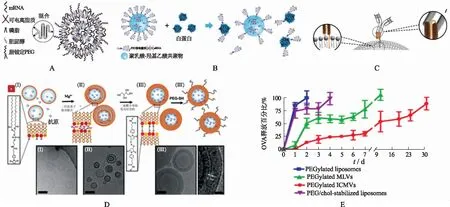
A.PEG修飾的載mRNA脂質納米顆粒結構示意圖[3];B.在血清白蛋白存在的情況下,納米粒結構和脂質-PEG分離的示意圖[14];C.膜錨定脂蛋白鏈接抗體至脂質納米顆粒表面示意圖[8];D.ICMVs合成示意圖及電鏡圖;E.ICMVs與其他結構脂質體抗原釋放速率對比[9]。
由于大部分脂質納米粒進入細胞后主要聚集于核內體,因此,增強脂質納米粒的核內體逃逸至關重要。篩選合適的陽離子脂質,改變可電離脂質的比例、pKa或脂質尾部的性質等可以促進溶酶體逃逸發生。ELIA等[10]利用熒光素酶mRNA的體內表達來篩選利于核內體逃逸的可電離脂質。JAYARAMAN等[11]利用6-對甲苯胺基萘磺酸與帶正電的膜結合時發生熒光而在自由溶液中不發光的特性,檢測不同PKa下陽離子脂質釋放情況。HAJJ等[12]發現具有相同分子量及相同碳數尾鏈的兩個脂質分子,由于一個的尾部呈直線,另一尾部有一單碳分支,導致支鏈尾脂質分子構建的載體療效增強10倍,并將這種現象歸因于其在pH值為5.0的晚期核內體的強表面電離作用。
脂質納米載體也可以通過增強免疫激活效果、減少佐劑用量來削弱疫苗佐劑的不良反應。PANDIT等[13]證明,與普通Toll樣受體4(Toll-like receptors 4,TLR4)激動劑結合疫苗相比,TLR4激動劑結合的多層“錨定”脂囊泡疫苗佐劑的使用劑量可降至10%但卻誘導更強的體液免疫反應。此外,部分納米顆粒本身就具備佐劑的性質,即使沒有TLR配體或其他佐劑也可以引起B細胞激活、補體激活等。
脂質體納米疫苗具有良好的生物安全性,產業化技術成熟,大規模生產方便,目前已有Epaxal?、Inflexal?V、Stimuvax?等多款產品上市。然而,目前脂質體納米疫苗的臨床應用仍面臨著免疫載體佐劑功能差、大分子藥物裝載困難、不易被細胞攝入、長期儲存過程中易發生粒徑增大、絮凝等問題。通過調控脂質體的脂質成分、理化性質、對脂質體表面修飾等,有望推動脂質體納米疫苗臨床應用。
2 聚合物納米疫苗
聚合物納米顆粒有生物可降解性、良好的生物相容性、安全性和緩釋性,部分聚合物還可作為佐劑,增強疫苗的免疫激活效率。常用于納米疫苗載體的聚合物包括天然聚合物納米載體、合成聚合物納米載體。天然聚合物包括殼聚糖、海藻酸鹽、透明質酸、支鏈淀粉、菊粉、葡聚糖等。這些生物來源聚合物分子大部分存在于細菌、酵母等微生物中,可被人體APCs識別并激活免疫反應。
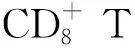
殼聚糖是由 α(1-4) 2-氨基2-脫氧-β-D葡聚糖-氨基葡萄糖和n-乙酰氨基葡萄糖的共聚物組成的天然線性多聚氨基糖。殼聚糖帶正電荷,可以與帶負電的mRNA強結合作為核酸遞送載體。研究表明,殼聚糖具備明顯的生物粘附性,可以延長抗原在黏膜上的滯留時間[17],打開上皮細胞緊密連接進而增強免疫應答。殼聚糖可誘導產生強大的免疫激活反應。PANDIT等研究發現,聚乳酸[poly(lactic acid),PLA]-明礬和PLA-殼聚糖微球誘導乙型肝炎病毒表面抗原(hepatitis B surface antigen,HBsAg)血清特異性抗體反應,顯著優于PLA微球和游離抗原[18]。殼聚糖不僅能使微粒表面帶正電荷,而且可以通過化學修飾改善其溶解度、親水性、親脂性、靶向性,改變納米粒子的粒徑和Zeta電位。然而,殼聚糖在生理條件下易沉淀[19],生產過程中的雜質難以去除,可能導致嚴重的免疫反應,極大地限制了其進一步臨床應用。
合成聚合物主要包括聚乳酸-羥基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]、聚己內脂、聚酸酐、樹狀大分子、聚乳酸[poly(lactic acid)]等。聚羥基乙酸[poly(glycolic acid),PGA]是一種高度結晶的材料。與PGA相比,PLA結構中附加的甲基增加了疏水性和抗水解穩定性,通常用于較長時間內的抗原可控或脈沖釋放[20]。KANCHAN等[21]發現用明礬和PLA聚合物顆粒(直徑2~8 μm)包埋抗原后進行體內免疫后可產生長效抗體,且當機體再次暴露于極少量的可溶性抗原后會產生非常高水平的記憶抗體滴度,是一類極具潛力的納米疫苗載體。目前已有大量工作具體研究PLA在納米疫苗方面的應用。
PLGA是由PLA和PGA無規聚合而成的共聚物[22]。PLGA具有樹突狀細胞(dendritic cells,DCs)靶向、穩定性高、易加工、緩釋等諸多優點[23](圖2A,B),作為疫苗遞送平臺廣泛用于瘧疾、利什曼病、乙型肝炎和埃博拉等疾病[24]。基于PLGA/PLA的納米顆粒能夠以可控和持續的方式將包被的抗原遞送到APCs(圖2C)[25]。通過控制單體比例、化學修飾等有望改善PLGA疏水性與藥物釋放特性,產生持久的免疫反應與免疫記憶(圖2D)[22]。
樹狀大分子是一種納米大小、徑向對稱的分子,具有明確的、均勻的、單分散的結構(圖2E)。研究發現低代數的樹狀大分子與高代數的樹狀大分子相比,生物相容性更好,免疫原性更強[26-27]。大分子電荷、代數均可控,有非常多的可供表面修飾的位點,可以根據不同的需求設計相應的大分子,有望成為一種重要的新型納米疫苗載體。
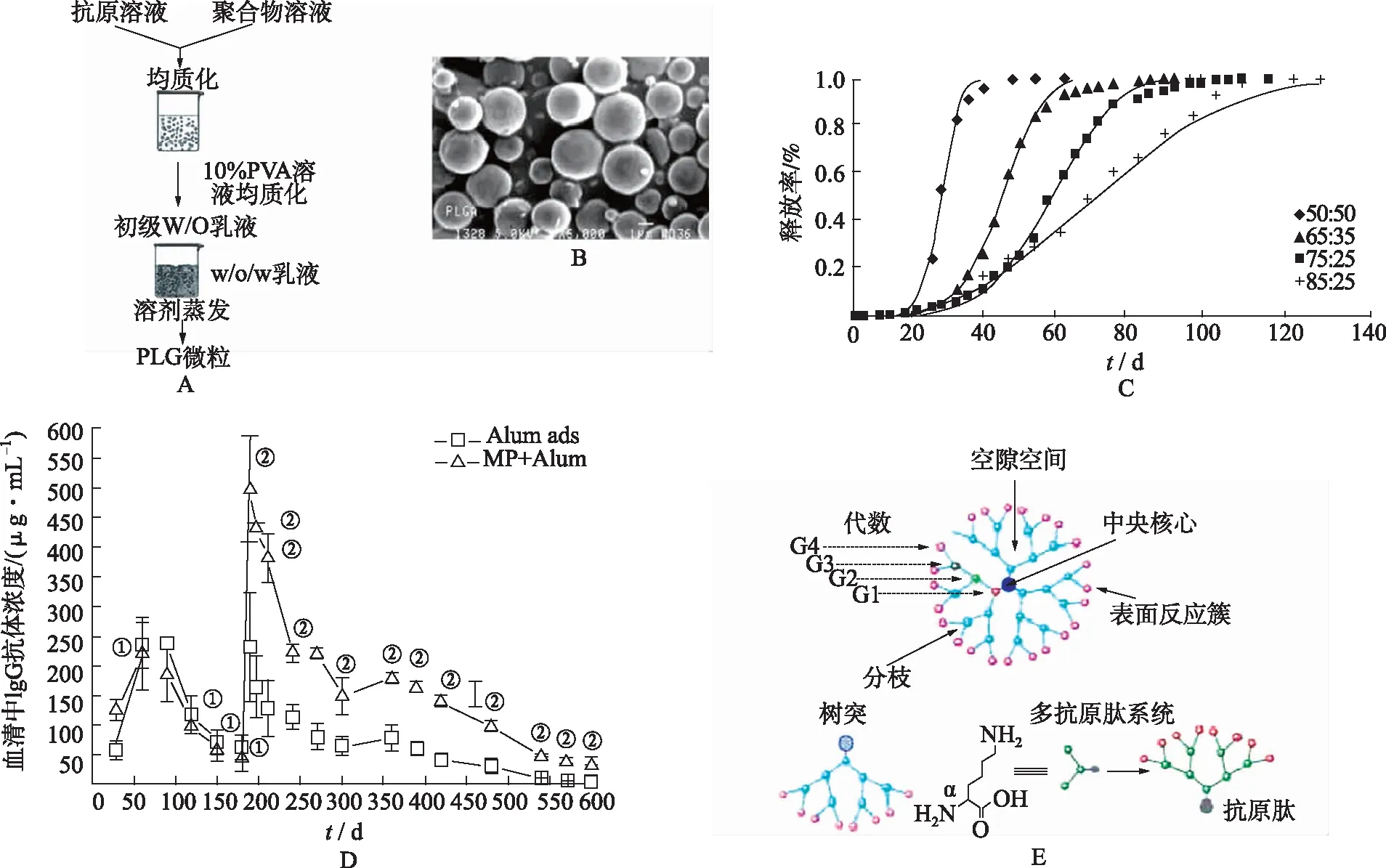
A.溶劑蒸發法制備包埋抗原的PLGA微球示意圖[19];B.PLGA微球包覆重組HBsAg的掃描電鏡照[23];C.通過改變聚乳酸與羥基乙酸比例可以調控抗原釋放速率[25];D.PLA載體疫苗產生了更強的免疫記憶[22];E.樹突大分子、樹突和多重抗原肽系統的結構示意圖[27](①與鋁佐劑對照組相比,P>0.05;②與鋁佐劑對照組相比,P<0.001)。
3 無機納米顆粒疫苗
無機材料生物降解性低,結構穩定。作為納米疫苗載體,無機納米材料需要進行修飾,改變理化特性,以提高其生物相容性。一些無機材料,例如金、硅納米粒子,由于其固有的佐劑樣功能而被用于增強抗原免疫原性。
金納米粒具有良好的生物相容性、低免疫原性和高抗原負載能力,且具有強大的免疫刺激能力,可誘導炎性細胞因子的產生(圖3A)[28]。ALMEIDA等[29]報道與金納米粒偶聯模式抗原OVA(AuNP-OVA)可防止抗原肽降解并將抗原靶向遞送至APCs。皮下給藥AuNP-OVA后,DCs釋放大量的細胞因子,誘導小鼠產生強烈的抗原特異性反應(圖3B)。DRAZ等[30]報道了一種基于體內電刺激金納米粒子進行DNA疫苗接種的方法。等離子體納米粒子的電激發可以破壞附近細胞膜,結合金納米粒在細胞表面的聚焦和放大電場的能力,顯著誘導細胞穿孔并促進DNA疫苗的吸收。與對照組(沒有納米顆粒)相比,使用此疫苗免疫的小鼠體內基因表達水平高100倍,且針對丙型肝炎病毒的抗體和細胞免疫反應水平顯著提高。
LI等[31]報道了一種基于多孔硅、金納米復合材料作為顆粒核來制備仿生納米疫苗用于實體瘤免疫治療的策略。據報道,這些外源性的納米顆粒核心可以有效地將腫瘤細胞膜遞送到樹突狀細胞中,以激活抗原遞呈細胞和下游的抗腫瘤免疫。此外,這種納米疫苗可作為一種光熱治療劑,與其他免疫療法協同作用,通過啟動體內抗腫瘤免疫反應、減弱免疫抑制微環境,顯著抑制腫瘤的生長和轉移。
不同形態及孔徑的硅顆粒具有可變的孔隙率(圖3C,圖3D),可增加不同抗原和佐劑的負載率,增強納米疫苗的靶向遞送和攝取[32-33](圖3E)。LI等[34]發展了一種介孔二氧化硅微棒,可通過靜電相互作用依次吸附聚乙烯亞胺(polyethylene endomine,PEI)和腫瘤新抗原,3 h內快速制造腫瘤疫苗。研究發現,PEI與介孔二氧化硅微棒可協同激活APCs并誘導炎性細胞因子的分泌,顯示出強大的抗腫瘤療效。碳納米管(carbon nano tube,CNTs)是一種用于遞送抗原和佐劑的另一個前瞻性平臺。CNTs可負載腫瘤睪丸抗原NY-ESO-1和佐劑 CpG,構建具備明顯抑瘤效果的腫瘤疫苗[35]。金屬有機框架(metal-organic frame,MOF)通過將金屬離子或簇連接到有機配體構建而成,基于MOF的平臺也可用于制備腫瘤疫苗[36]。
無機納米顆粒主要通過靜電吸附等方式攜帶抗原,易導致抗原不穩定,疫苗難以長期保存。因此,迫切需要發展能夠穩定攜帶抗原的新策略以增強無機納米顆粒疫苗的進一步臨床應用。
4 病毒載體納米疫苗
病毒樣顆粒(virus-like particles,VLPs)是由某種病毒的一個或多個結構蛋白自組裝而成的、高度結構化的復合物。VLPs主要通過病原體相關分子模式(pathogen-associated molecular patterns,PAMPs)激活免疫反應。PAMPs被模式識別受體識別為外來物質后導致細胞因子的級聯反應和APCs激活,有效激活體液免疫和細胞免疫[37]。基于上述特點,VLPs是一種非常理想的疫苗開發平臺(圖4A)。目前,已有多款基于VLP的疫苗成功上市,包括針對人乳頭瘤病毒的Cervarix?和Gardasil?,以及針對肝炎病毒的Sci-B-VacTM疫苗。基于VLPs的新冠疫苗富含S、M、E和(或)N抗原表位,具有高度免疫原性,可直接結合B細胞受體以激活B細胞,在小鼠中產生高濃度的中和抗體[38]。在臨床前研究中,也有報道通過使用Matrix-M1 佐劑以及裝載SARS-CoV和MERS-CoV的全長S蛋白的VLPs,可極大提高冠狀病毒中和抗體水平[39-40]。
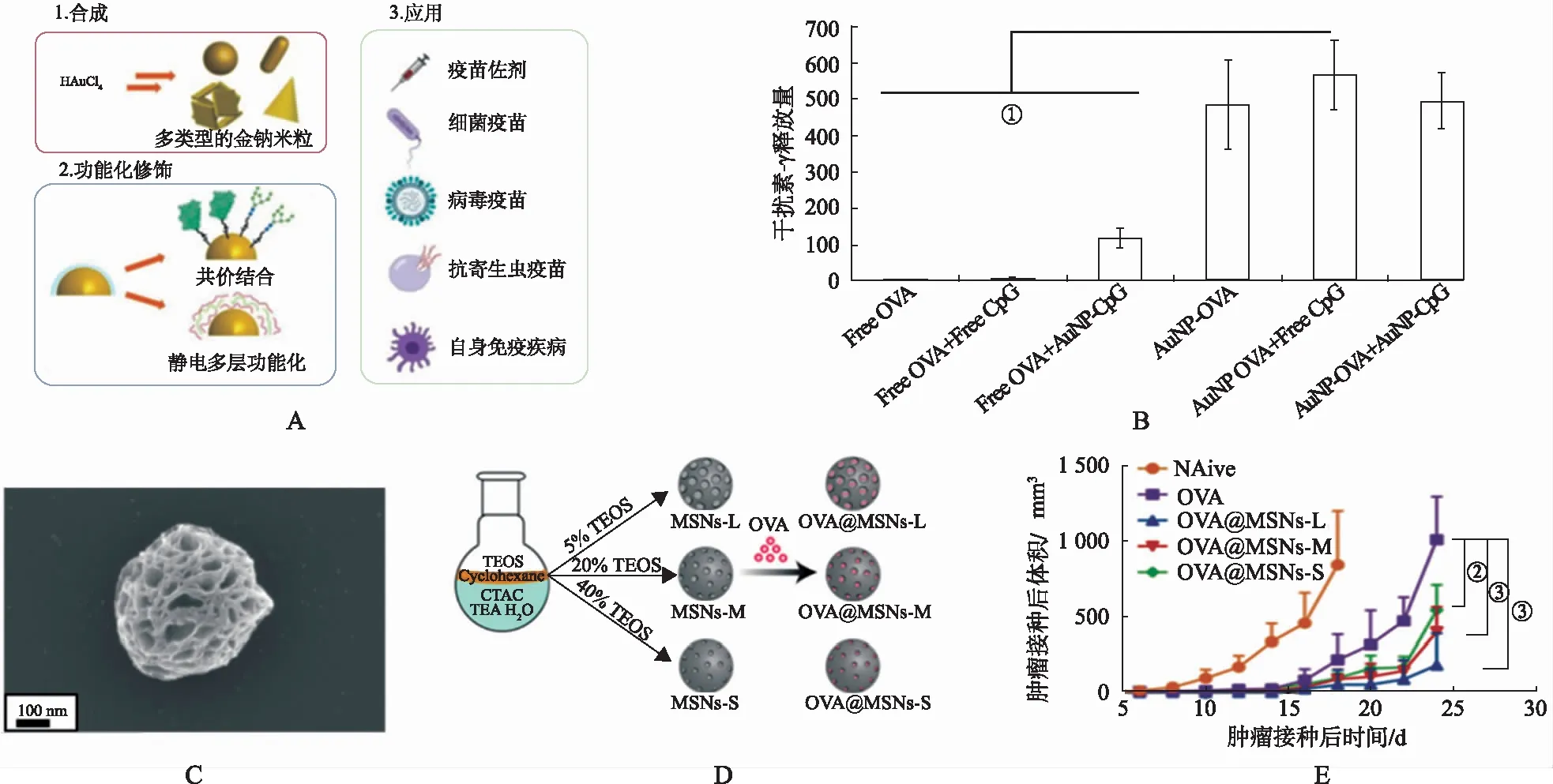
A.金納米疫苗的合成、功能化修飾與應用[28];B.金納米疫苗促進脾細胞釋放IFN-γ[28];C.多孔硅微球的掃描電鏡圖片[32];D.調節正硅酸四乙酯在環己烷中的濃度合成不同孔徑的單分散二氧化硅微球[32];E.負載抗原的二氧化硅微球腫瘤疫苗顯著抑制腫瘤生長[33](①P<0.05;②P<0.01;③P<0.001)。
抗腫瘤研究中使用最多的是二十面體植物病毒的豇豆花葉病毒(cowpea mosaic virus,CPMV),其衣殼大小約為28 nm。CPMV可在體外與APCs結合并被內化[41]。腹腔注射后,CPMV蓄積于淋巴結并被APCs攝取,誘導APCs激活[42](圖4B,C,D,E)。接種CPMV疫苗后小鼠各器官未見明顯的損傷或炎癥跡象,表明CPMV具備良好的生物安全性[43]。VLP疫苗接種也可與放射療法、化學療法或免疫療法聯合使用來發揮抑瘤作用[44-46]。
A.擬病毒納米顆粒疫苗制備示意圖[48];B.CPMV促進骨髓來源DC細胞體外細胞因子的釋放[43];C,D,E.CPMV有效抑制B16-F10黑色素瘤肺轉移[43](①P<0.001;②P<0.01)。
病毒載體疫苗可被APCs攝取并協同PAMPs激活強大的免疫反應,其自身無復制感染能力且具有大規模生產基礎,已經作為一種理想的納米疫苗載體開發上市。現階段病毒載體疫苗的研發需要考慮如何克服“預存免疫”難題,即患者如果曾經感染過該種病毒,其體內可能存在病毒相關抗體,導致疫苗有效性顯著降低。同時,應警惕病毒自身可能產生的強烈炎癥、組織壞死等不良后果。
5 生物膜仿生納米疫苗
作為疫苗材料,仿生納米材料功能多樣,可以高效遞送抗原至目標部位,同時具有高生物相容性、長時間體內循環、獨特的抗原特性、良好的柔韌性等優點。
目前,大量研究利用仿生納米材料制備疫苗。例如,WANGA等[47-48]利用聚多巴胺將帶有病毒抗原和Toll樣受體激動劑的仿生納米顆粒修飾在紅細胞表面,顯著增強體內抗病毒免疫反應(圖5A)。由于紅細胞可歸巢靶向脾臟并與APCs相互作用,錨定仿生病毒納米顆粒的紅細胞可將病毒抗原高效遞送到DCs。與對照組相比,仿生納米顆粒修飾的紅細胞在小鼠體內成功刺激DCs成熟和活化、S1 特異性免疫球蛋白G(immunoglobulins G,IgG) 抗體的產生和T細胞免疫應答(圖5B)。由于聚多巴胺在結合不同分子結構方面具有易操作性和普適性,可裝載其他多種抗原,可作為通用平臺開發針對多種疾病的疫苗。
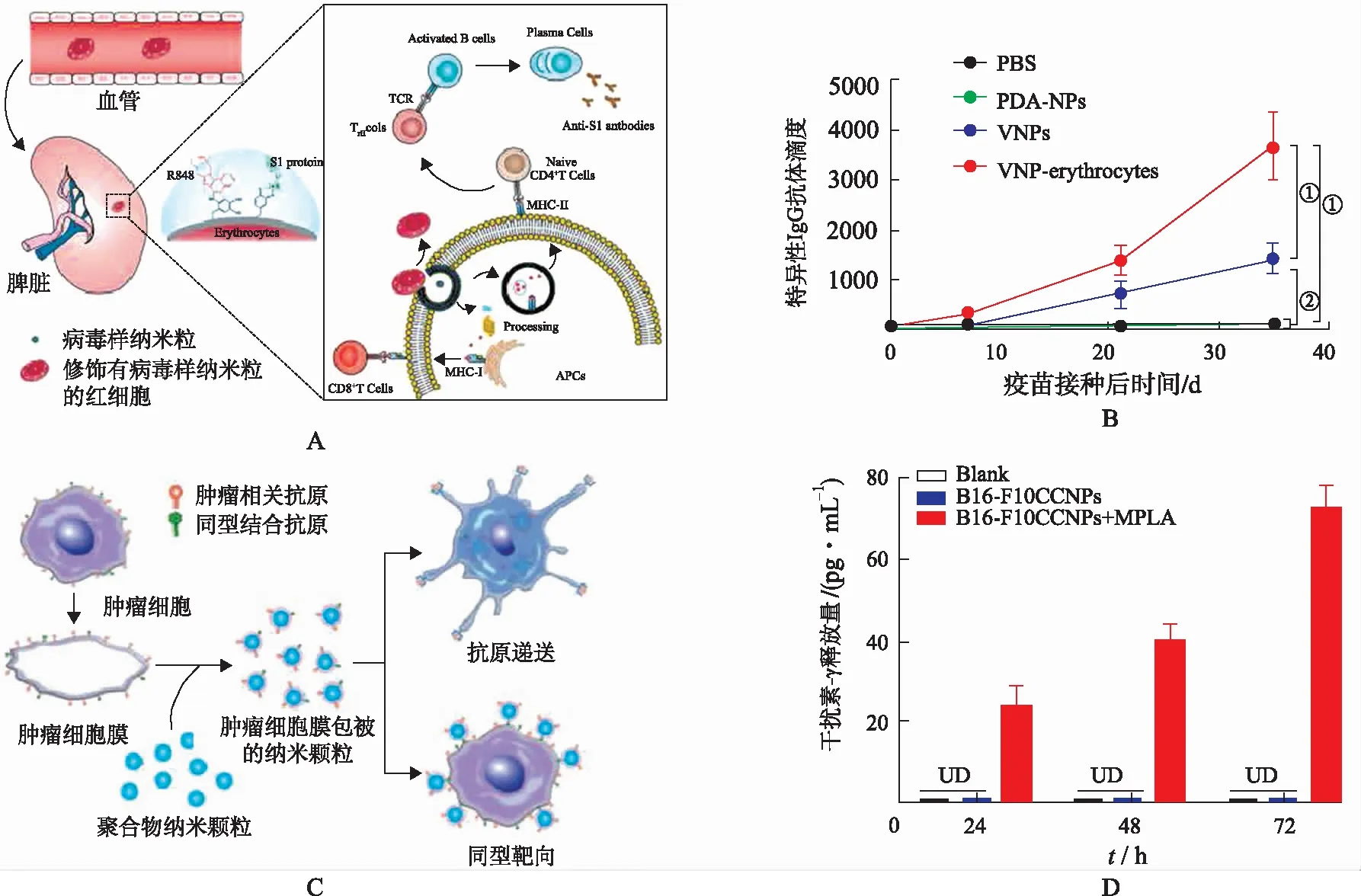
A.表面錨定負載病毒抗原與Toll樣受體激動劑的仿生納米顆粒的紅細胞疫苗[47];B.經過修飾的紅細胞疫苗誘導抗體產生[47];C.腫瘤細胞膜包被聚合物顆粒作為腫瘤疫苗示意圖[49];D.腫瘤細胞膜包被的腫瘤疫苗促進IFN-γ分泌[50](①P<0.001;②P<0.01)。
FANG等[49-50]發展了腫瘤細胞膜包裹的納米顆粒(cancer cell membrane-coated nanoparticles,CCNPs),可作為腫瘤疫苗用于腫瘤高效治療(圖5C)。這些納米顆粒通過多種機制發揮抗腫瘤作用:① CCNPs 攜帶完整的腫瘤相關抗原,與佐劑共同遞送顯著增強抗原遞呈細胞活化和抗原呈遞水平;②腫瘤細胞膜來源于自體腫瘤組織,固有的同源結合能力增強CCNPs腫瘤靶向作用。JIANG等[51]對其進一步優化,設計了一種表達共刺激信號分子的腫瘤細胞膜仿生納米顆粒平臺,此體系可無需APCs直接刺激T細胞活化(圖5D)。CNNPs納米疫苗平臺包含存在于膜表面的天然抗原表位,并且通過與T細胞受體和CD28的結合直接刺激腫瘤抗原特異性T細胞激活,通過殺死表達相關抗原的腫瘤細胞而達到抑瘤目的。
細菌外膜囊泡(outer membrane vesicles,OMVs)由革蘭陰性菌外膜形成,內含傳遞細菌信號的生化物質,包括DNA、RNA、蛋白質、內毒素和相關的毒力分子等。OMVs直徑50~250 nm,具有很好的淋巴結歸巢和APCs靶向遞送能力。細菌來源OMVs中免疫刺激“危險信號”使OMV成為極具吸引力的免疫佐劑。大量研究報道OMVs作為抗菌疫苗和抗癌疫苗[52-54]。例如,類鼻疽伯克霍爾德菌OMVs免疫的小鼠表現出T細胞記憶反應和對類鼻疽伯克霍爾德菌和鼻疽假單胞菌的交叉保護[55]。在鋁佐劑協同作用下,銅綠假單胞菌OMVs作為抗原能夠刺激小鼠產生免疫反應,顯著降低銅綠假單胞菌感染的致死率[56]。作為免疫佐劑,OMVs也可應用于腫瘤治療領域,例如OMVs可誘導干擾素-γ依賴的抗腫瘤反應并促進抗腫瘤相關細胞因子產生[57]。最新的研究表明,改造后的OMVs可靶向腫瘤組織。研究者將磷酸鈣殼覆蓋OMVs表面用于腫瘤治療,可有效重塑腫瘤微環境,且無明顯毒副作用。同時,pH敏感的磷酸鈣殼可中和腫瘤酸性環境,誘導巨噬細胞從促進腫瘤生長的M2型向抑制腫瘤生長的M1型轉變,顯著提高抗腫瘤療效[58]。
生物膜仿生納米疫苗有望成為新一代納米疫苗的主力軍,但是制備工藝普遍復雜、難以大規模生產、產品成分復雜、生產成本高等限制了其進一步臨床應用。
6 納米疫苗臨床研究進展
目前納米疫苗已逐步用于防治傳染病或治療腫瘤,并表現出良好的治療效果。2021年4月22日公布的輝瑞公司新型冠狀病毒mRNA疫苗BNT162b1在中國的I期臨床試驗數據顯示,BNT162b1在年輕和年長的中國成年人中均誘導了對包括RBD在內的多肽庫的強大干擾素-T細胞應答[59]。一種稱為DermaVir的PEI納米顆粒疫苗已經完成了II期(NCT00711230)臨床試驗,目前正在向III期臨床試驗發展。DermaVir通過靶向輸送人類免疫缺陷病毒(human immunodeficiency virus, HIV)核酸物質至表皮樹突狀細胞前體、朗氏細胞,誘導其表達大量病毒結構基因和調節基因,刺激特異性T細胞免疫應答。臨床試驗證明,DermaVir可降低約70%的HIV-RNA表達。納米疫苗在臨床治療中展現出令人驚喜的效果,但隨著臨床研究的深入,也面臨著一些挑戰,例如載體體內降解困難導致蓄積并產生不良反應;抗體、佐劑包封率不高且遞送過程不穩定;合成步驟復雜、生產成本高、質量把控困難、產品均一性差等。選取生物相容性好的納米載體、構建自組裝納米疫苗體系、設計個性化治療疫苗等是未來納米疫苗潛在的發展方向。
7 結束語
傳統疫苗存在穩定性差、免疫原性低、難以靶向遞送、且大劑量的佐劑易產生不良反應等不足,已難以滿足社會需求。納米疫苗是基于納米技術的新一代疫苗,可以通過載體設計、表面配體修飾等方式誘導長期、有效的免疫反應,具有很好的臨床應用前景。然而,納米疫苗也存在一些問題,例如載藥效率低、不易長期儲存、成本較高難以大規模生產等困難,但隨著納米技術的發展與生產工藝的優化,未來會有越來越多的納米疫苗逐步臨床轉化,為傳染病預防與腫瘤治療帶來新的希望。

