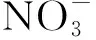氟喹諾酮類藥物氯化的選擇性氧化反應及紫外/氯強化處理工藝
沈 蕓,趙世榮,商偉偉,錢雅潔
(東華大學環境科學與工程學院,上海 201620)
氟喹諾酮類(fluoroquinolones,FQs)藥物是喹諾酮類藥物的哌嗪基衍生物,由于其廣譜性和療效好,在臨床中廣泛應用[1]。但是FQs在人體內無法完全代謝,在使用后進一步排放至自然環境中,導致該類物質在水環境中頻繁檢出[2]。據報道,我國七大流域中,海河、遼河和珠江的FQs檢出的質量濃度達100 ng/L[3];典型的半封閉內海渤海灣,在廢水和城市污水的大量排放下,其FQs檢出的質量濃度高達726 ng/L[4]。FQs在水環境中不斷累積,通過食物鏈富集到生物體內,從而危害人體健康[5]。
我國現有污水處理工藝是基于物化預處理耦合活性污泥法的生化處理工藝,該類處理工藝對FQs等新興污染物去除效率較低[6]。氯化是城市污水和飲用水凈化過程中被普遍采用的技術,因此,研究氯化過程對掌握FQs在水環境中的歸宿至關重要[4]。幾乎所有FQs藥物都含有芳香胺的結構,Najjar等[7]研究了左氧氟沙星(levofloxacin,LVF)的氯化行為,發現其結構上的叔胺會最先受到氯的攻擊,在氯化過程中,藥物可能會發生氧化/取代反應;Wang等[8]的產物分析結果表明,大部分產物中都存在完整的喹諾酮類化合物;Dodd等[9]的研究表明喹諾酮類部分對游離活性氯(FAC)不反應。然而,FQs不同哌嗪結構與氯化反應的活性關系鮮有研究,比較仲胺和叔胺基FQs一類的氯化行為,研究氯化對FQs藥物的選擇性反應,對掌握氯化消毒過程中污染物的轉化具有重要意義。
本文選擇LVF、恩諾沙星(enrofloxacin,ENR)和環丙沙星(ciprofloxacin,CIP)3種典型FQs,研究其單獨氯化的降解行為,比較了不同FQs氯反應濃度的變化,并探究FQs不同結構與氯化反應的相關關系;同時通過紫外強化手段,研究了FAC在紫外活化作用下CIP的降解反應過程和不同水基質對CIP的降解影響。
1 材料與方法
1.1 試驗材料與儀器
1.1.1 試驗材料
LVF、ENR、CIP的標準化學品均購自Sigma Aldrich上海有限公司,為分析純級別,物質結構如表1所示。磷酸二氫鈉、磷酸氫二鈉、L-抗壞血酸、氯化鈉、碳酸氫鈉、腐植酸、氫氧化鈉、磷酸、三乙胺均為Aladdin分析純級別。液相使用的甲醇、乙腈均為Sigma Aldrich色譜純級別。
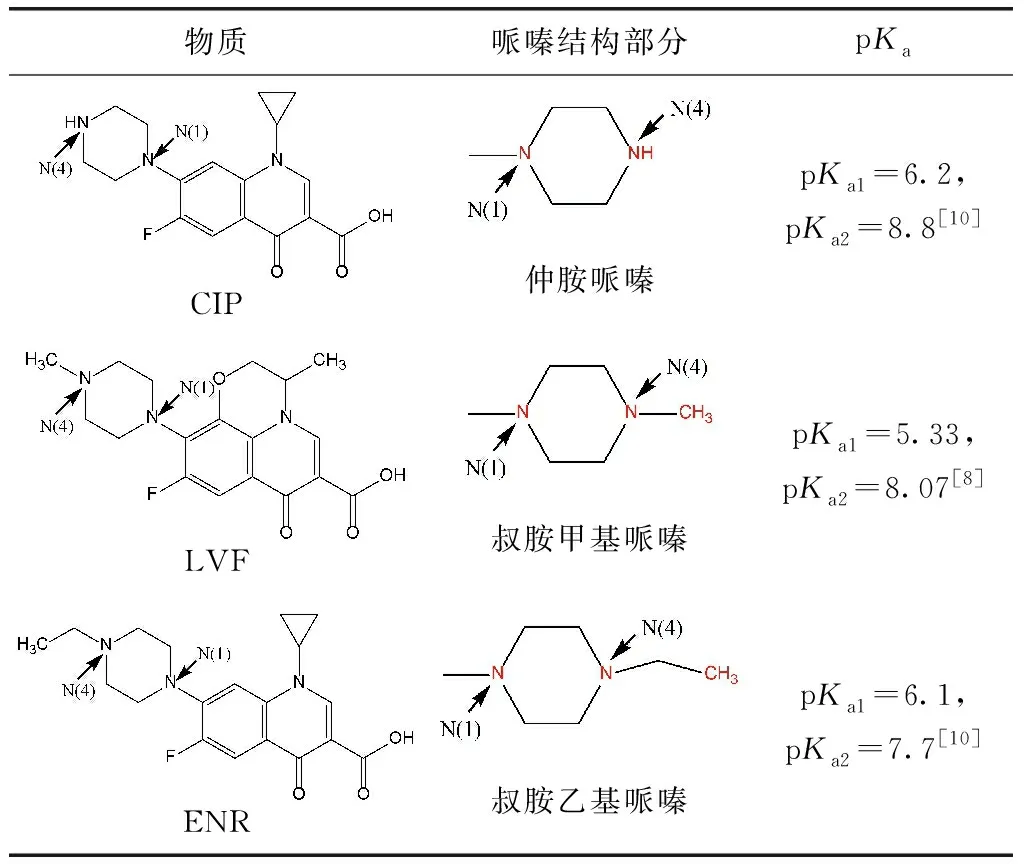
表1 FQs不同結構示意圖Tab.1 Schematic Diagram of Different Structures of FQs
1.1.2 試驗儀器
試驗儀器:高效液相色譜儀(Agilent 1260,美國)、Poroshell 120 EC-C18色譜柱(4.6 mm×250 mm×2.7 μm)、紫外分光光度計(UV-1600PC,上海美譜達)、pH值計(FE28K,Mettler Toledo)、磁力攪拌器(84-1A上海司樂儀器有限公司)、電子天平(AW120, 島津)。試驗裝置如圖1所示。
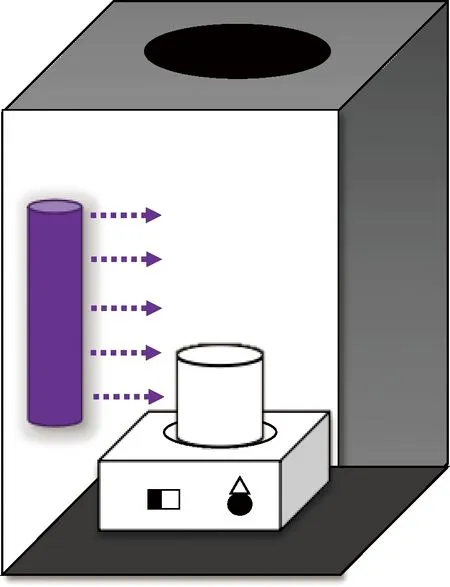
圖1 反應裝置示意圖Fig.1 Schematic Diagram of Reaction Apparatus
1.2 試驗方法
所有試驗操作均在室溫為(25±2)℃下,在裝有254 nm紫外燈管的黑箱中進行,并于試驗前30 min打開紫外燈準備。將40 μmol/L等目標污染物溶解于石英杯中,用10 mmol/L磷酸鹽(PB)緩沖液調節反應pH,加入相應濃度的NaClO溶液,在恒溫磁力攪拌器上充分攪拌,于一定的時間點取樣1 mL并經過0.45 μmol/L濾膜過濾于液相棕色進樣瓶,并立即用0.5 mL摩爾濃度為100 mmol/L的L-抗壞血酸對余氯進行猝滅,取樣結束后于48 h內將樣品放于高效液相色譜(HPLC)進行定量分析以測定FQs濃度。試驗還分別研究了NaClO投加量、pH、共存離子等對反應降解效果的影響和降解動力學。所有的試驗重復3次。
1.3 分析方法
經過紫外、單獨氯化和紫外/次氯酸鈉系統處理后的樣品溶液采用HPLC進行檢測。檢測器為光電二極管陣列檢測器,流速為0.8 mL/min,進樣量為20 μL,柱溫為30 ℃,流動相A相(0.3%的磷酸緩沖液,使用三乙胺調節pH值為2.4)和C相(乙腈)的比例為80∶20,樣品檢測時間為12 min。反應過程中氯濃度的變化采用國標法DPD分析方法進行測定。
1.4 反應動力學分析
FAC降解FQs的動力學方程如式(1)。
(1)
其中:kapp——二級速率常數,L/(mol·s);
t——時間,s;
[FQs]、[FAC]——FQs、FAC的平衡摩爾濃度,μmol/L。
當反應體系中[FAC]∶[FQs]≥10∶1,可近似認為式(1)中的[FAC]為常數,符合一級反應的驗證,可簡化為式(2)。
(2)
其中:kobs——偽一級反應速率常數,s-1。
2 結果與討論
2.1 單獨氯化過程氧化FQs
2.1.1 氯投加量對不同結構FQs的降解影響
如圖2所示,LVF和ENR降解反應呈現較高的一致性,即隨著氯濃度的增加,其降解率逐漸增大,而CIP降解率變化較小。結果表明,在pH值為7、氯投加量為75 μmol/L時,LVF和ENR在2 min時降解率分別為96.4%和91.5%,而CIP降解率僅為5.2%。當氯投加量增加到400 μmol/L時,LVF和ENR在2 min內完全降解,CIP降解率為12.4%,僅增加7.2%,由此可見,相較于LVF和ENR,CIP在單獨氯化作用下的降解效率較慢,這是FQs不同哌嗪結構所致。
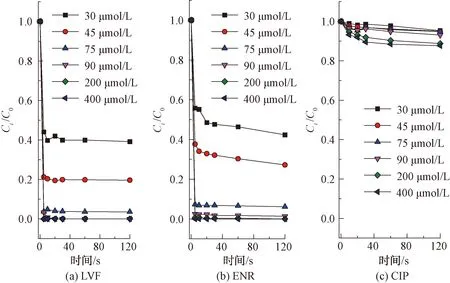
注:[FQs]=40 μmol/L,[PB]=10 mmol/L,pH值=7圖2 氯投加量對不同結構FQs的降解影響Fig.2 Influence of Chlorine Dosage on Degradation of FQs with Different Structures
已有研究表明,FQs喹諾酮類部分不易與游離氯反應,每個哌嗪環的酸性N(4)原子(pKa=0.7)對親電因子的反應性應比N(1)原子小得多[9],因此,FQs主要以哌嗪結構中的N(4)原子為反應位點[9-10]。同時,N(4)原子反應速率的快慢也可間接通過氯消耗速率的快慢來體現。當反應開始,體系中的氯首先會攻擊哌嗪結構上的N(4)原子生成自由基,接著通過來自N(1)的電子供體協同裂解導致C-C裂解并生成亞胺中間體,隨后發生脫烷基化反應[11]。試驗數據表明,相同條件下LVF和ENR降解效率較CIP更快,說明LVF和ENR與氯的反應性高于CIP與氯的反應性,即具有叔胺哌嗪結構的FQs比仲胺哌嗪結構的FQs和氯反應更活潑。
2.1.2 不同FQs結構下對應氯濃度的消耗
為進一步研究FQs結構對氯反應的相關性,試驗做了不同FQs結構下對應氯濃度的消耗曲線圖。由圖3可知,不同FQs對應氯的消耗呈現顯著差異性。在相同氯量條件下,FQs對應氯的消耗結果為:LVF>ENR>CIP。比較明顯地,當氯摩爾濃度為75 μmol/L時,LVF氯的消耗率為87.07%,ENR為58.57%,而CIP僅為23.33%。試驗數據表明,在相同條件下,含有叔胺甲基哌嗪的LVF反應所消耗氯的量最多,含有叔胺乙基哌嗪的ENR反應所消耗的氯量次之,含有仲胺哌嗪結構的CIP反應所消耗的氯量最少。
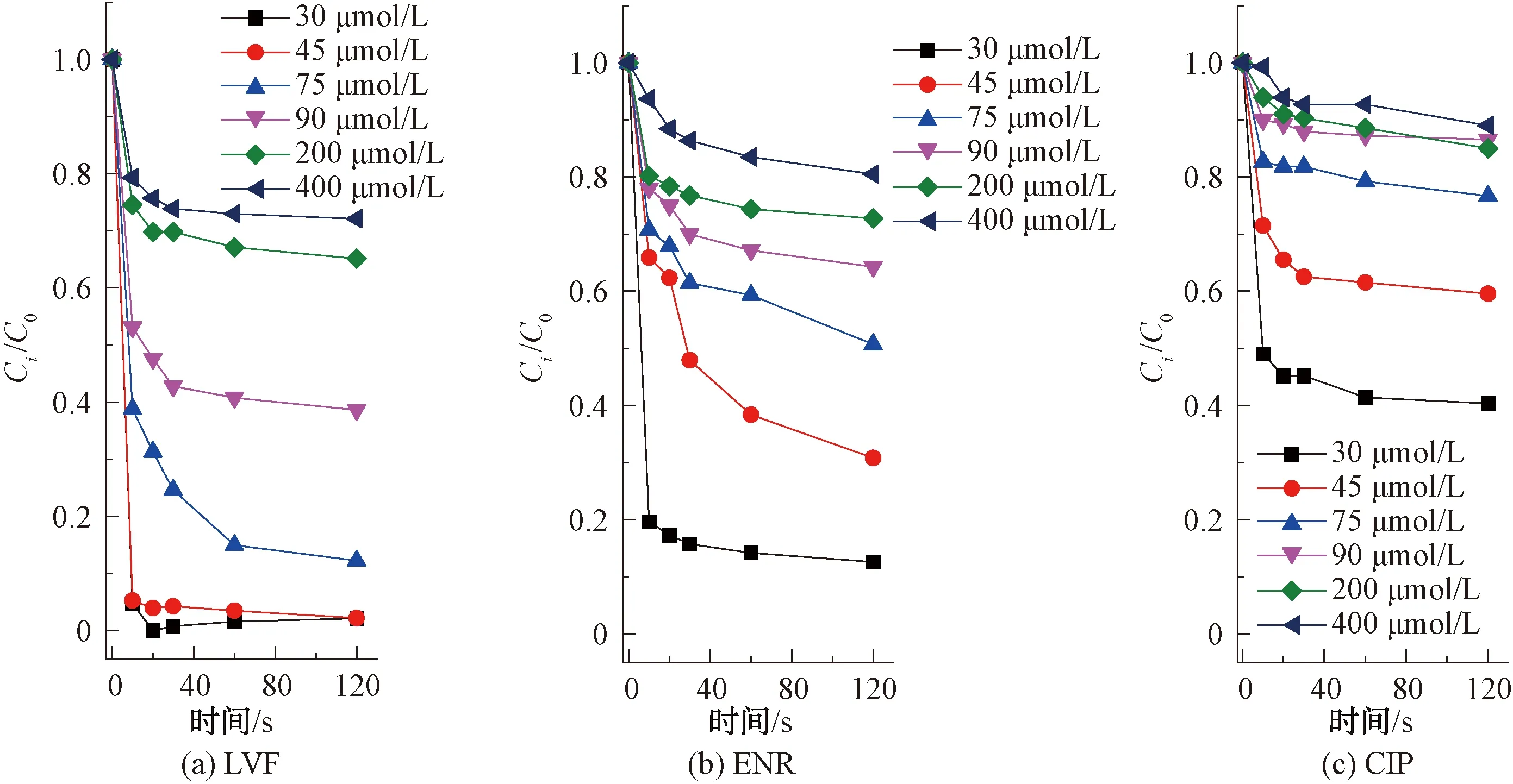
圖3 不同FQs結構下對應氯濃度的消耗Fig.3 Consumption of Relevant Chlorine Concentration under Different FQs Structures
已有研究比較了FQ陰離子的速率常數(FQs陽離子對整體的降解貢獻不顯著[10]),發現在其哌嗪部分含有叔N(4)胺的氧氟沙星(OFL)和ENR與ClO2的反應速率快于含有仲N(4)胺的CIP、諾氟沙星(NOR)、洛美沙星(LOM)和哌啶酸(PIP),其動力學模擬結果為OLF>ENR>CIP~LOM~NOR>>PIP[11]。本試驗數據表明,CIP降解所消耗的氯量最少。從結構上來看,LVF和ENR分別為含有叔胺甲基哌嗪和叔胺乙基哌嗪的FQs,而哌嗪結構上甲基的氧化態高于乙基,從而導致LVF消耗更多的氯量。因此,3種不同FQs與氯反應的活潑性為LVF>ENR>CIP,即叔胺甲基哌嗪結構>叔胺乙基哌嗪結構>仲胺哌嗪結構。
2.1.3 pH對不同FQs結構的降解影響
pH是FQs氯化過程中重要的影響因素[12]。如圖4所示,LVF、ENR和CIP在不同pH下呈現相同的降解規律,pH值從3~7和7~9降解率分別呈先增加后減少的趨勢,即在堿性條件下(pH值=9),FQs的降解率最低,在中性條件下(pH值=7),FQs的降解率最高。查閱文獻,抗生素的降解歸因于FAC形態(HOCl和OCl-)和抗生素解離狀態的綜合效應[13]。
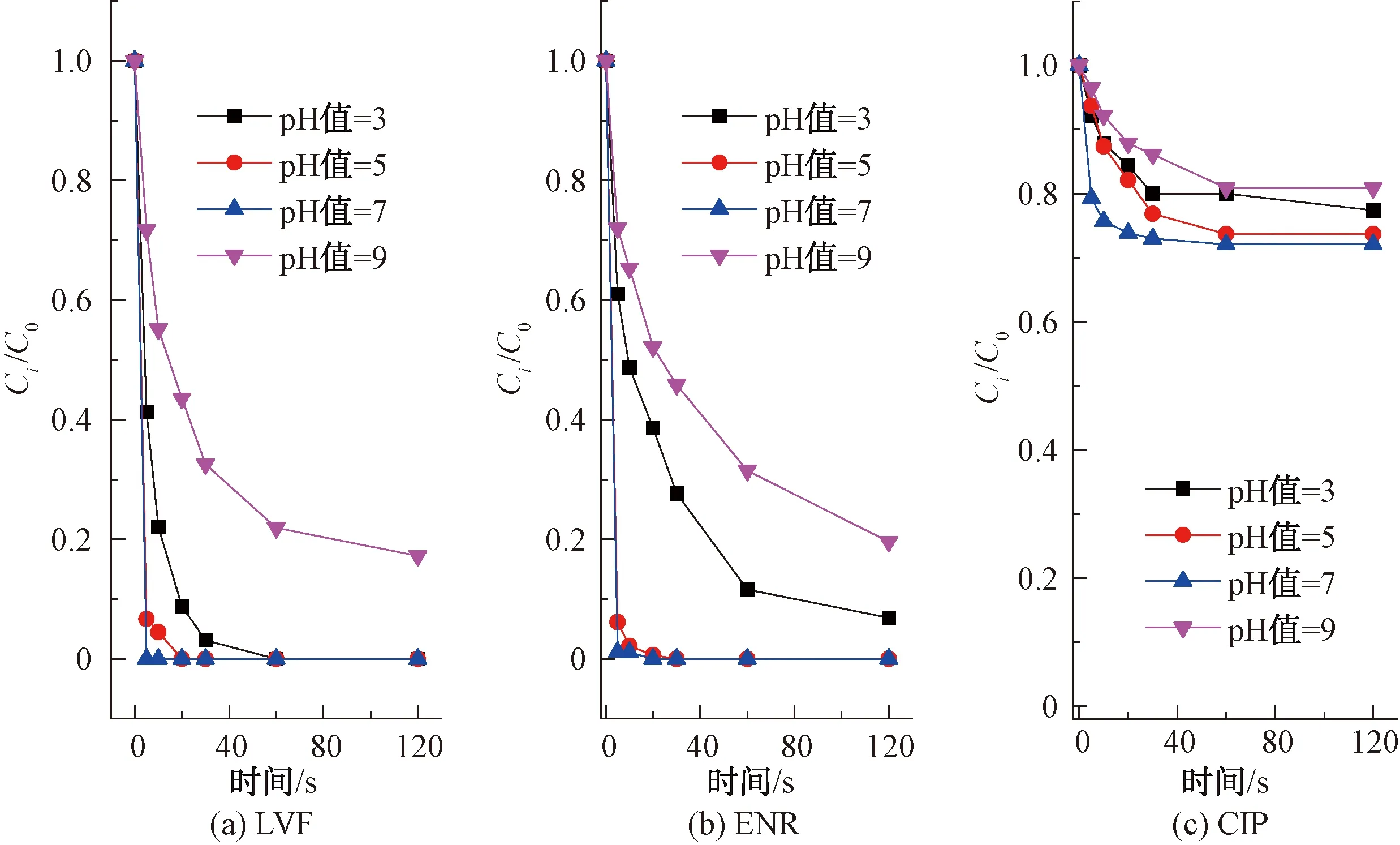
圖4 pH值對不同FQs結構的降解影響Fig.4 Influence of pH Value on Degradation of FQs with Different Structures
已知HOCl是一種不穩定弱酸,在水中會發生電離反應[10],如式(3)。

(3)
不同pH下HOCl和OCl-的形態分布如圖5所示,pH升高,促使反應正向進行,而后者的氧化能力明顯弱于前者,導致pH增大而降解速率降低,即FQs的降解率在堿性條件下低于中性和酸性條件。然而在中性和酸性條件下,FQs的降解率并不總是隨著pH的降低而增加。這是因為去質子化的FQs與FAC反應時比質子化的FQs更具活性[14](FQs的pKa如表1所示),同時,HOCl的氧化能力比OCl-更強,因此,當pH值為7時,FQs的降解率最大。
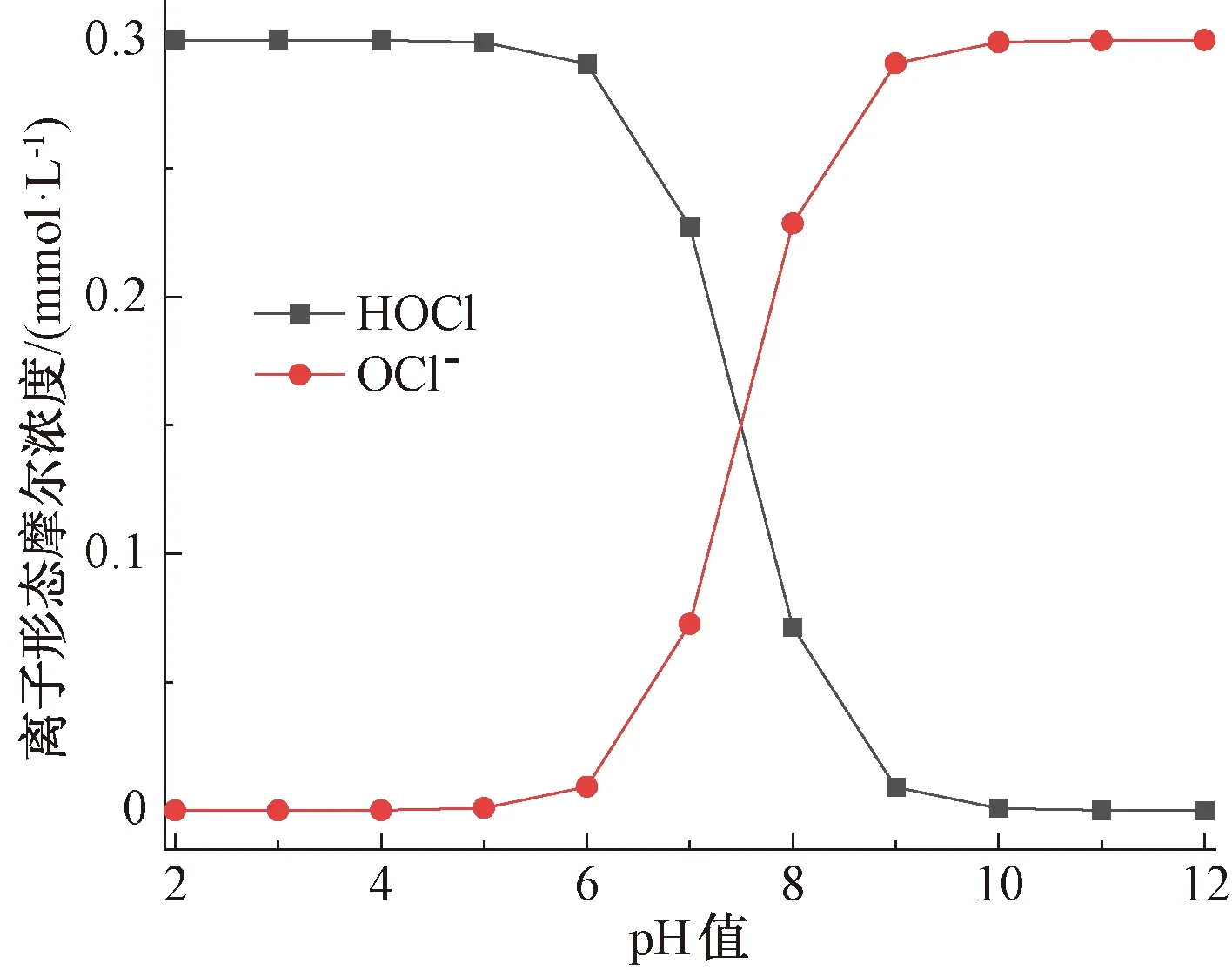
圖5 不同pH值下HOCl的形態分布Fig.5 Form Distribution of HOCl under Different pH Values
2.2 紫外活化氯化降解CIP
2.2.1 CIP降解動力學
由于CIP在單獨氯化的作用下降解速率慢,因此,本試驗通過耦合紫外的方式對其進行強化處理。如圖6所示,即隨著氯投加量的增加,CIP的降解效率隨之變高。在2 min內,紫外/氯作用下的CIP降解率均超過80%,當氯摩爾濃度為400 μmol/L,其降解率高達96.29%,而相同條件下,單獨氯作用對CIP的降解效果僅為12.4%,從試驗數值上看,紫外/氯條件明顯優于單獨氯條件對CIP的降解效果。
對CIP在紫外/氯條件下的降解進行動力學分析,ln([CIP]/[CIP]0)與反應時間的反應關系如圖6所示,在不同氯投加量下均呈現良好的線性關系(R2>0.91),故可推出:紫外/氯條件對CIP的降解滿足準一級反應動力學規律。當氧化劑濃度為0時,由于缺乏足夠的活性自由基,CIP降解受到抑制,而隨著氯投加量的不斷增加,體系中HOCl和OCl-通過UV光解產生HO·和Cl·,促進了CIP的分解[15]。
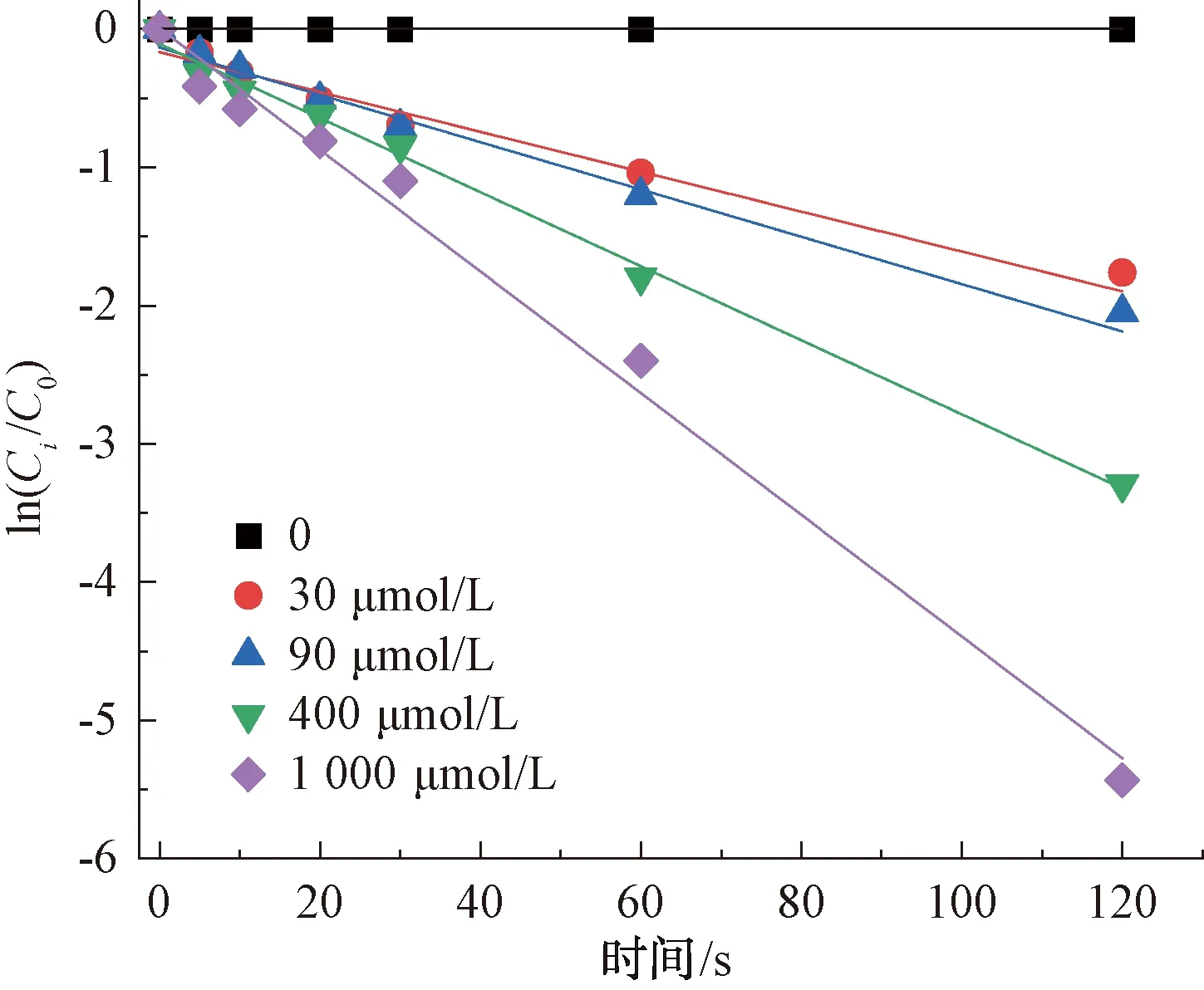
圖6 紫外/氯工藝下氯投加量對CIP的降解影響Fig.6 Influence of Chlorine Dosage on Degradation of CIP in UV/Chlorine Process
2.2.2 pH對CIP降解的影響
如圖7所示,紫外/氯工藝在不同pH條件下對CIP的降解均符合準一級反應動力學特性,其相關系數R2>0.93。pH在紫外條件下對CIP的降解效果影響較大,其降解率隨著pH的增加而增加,在pH值為9時,CIP的降解率最高,達96.61%;pH值為3時降解率最低,僅為76.74%。與單獨氯對CIP的降解結果不同,紫外/氯對CIP的降解結果在中性和堿性條件下優于酸性條件。這可能是不同pH條件下活性物質的相對貢獻所致[16],這一結果和Deng等[17]報道一致。
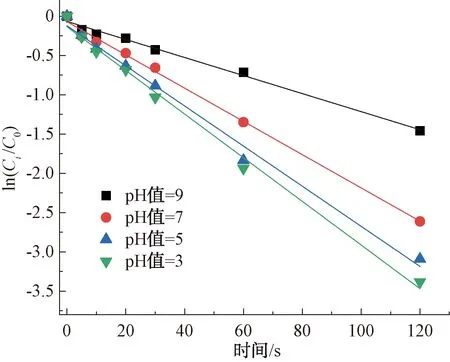
圖7 紫外/氯工藝下pH值對CIP的降解影響Fig.7 Influence of pH Value on Degradation of CIP in UV/Chlorine Process
2.2.3 水基質對CIP降解的影響
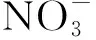
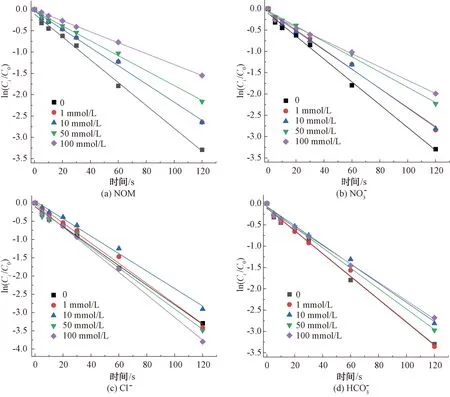
圖8 紫外/氯工藝下不同水基質對CIP的降解影響Fig.8 Influence of Water Matrix on Degradation of CIP in UV/Chlorine Process
3 結論
(1)根據3種不同FQs在氯化過程的降解情況及氯投加量的消耗情況,3種不同FQs與氯反應的活潑性:LVF>ENR>CIP,即叔胺甲基哌嗪結構>叔胺乙基哌嗪結構>仲胺哌嗪結構。
(2)pH可以通過改變物質形態(HOCl、OCl-和FQs離子形態)、自由基的產生來影響FQs的降解情況,在單獨氯化條件下,對FQs降解影響為pH值為7>pH值為5>pH值為3>pH值為9;而在紫外/氯工藝下對仲胺哌嗪FQs降解影響為在堿性條件下,即pH值為9降解效果最好。