藤茶總黃酮通過TGF-β/Smad通路對肝纖維化小鼠的作用機制研究*
王利兵,李 雯,李木松
(1.唐山市工人醫(yī)院,河北 唐山 063000;2.保定市人民醫(yī)院,河北 保定 071000)
肝纖維化是由各種致病因素導致肝臟中大量細胞外基質沉積,纖維性瘢痕組織形成的一個病理過程,其長期惡化會發(fā)展成肝硬化、肝癌等。肝纖維化早期是一個可逆的過程,因此早期治療對于預防肝硬化和肝癌至關重要。研究發(fā)現,藤茶總黃酮(Tengcha flavonoids,TF)具有多種藥理學作用,可通過激活細胞凋亡信號通路,達到抗肝癌作用[1],而且TF能干預糖尿病大鼠糖脂代謝及氧化應激損傷,改善胰腺和肝臟的病理學變化[2]。此外,TF可改善四氯化碳(carbon tetrachloride,CCl4)造成的肝損傷[3]。已有多項研究表明,轉化生長因子β(transforming growth factor beta,TGF-β)/Smad信號通路在調節(jié)組織纖維化中具有重要作用[4-5],本研究旨在探討TF是否能通過調節(jié)TGF-β/Smad信號通路減輕CCl4誘導的肝纖維化。
1 材 料
1.1 實驗動物健康8周齡SPF級雄性昆明小鼠50只,體質量(35±3)g,購自北京維通利華實驗動物技術有限公司,動物生產許可證號:SCXK(京)2016-0011,飼養(yǎng)溫度20~25℃,相對濕度45~55℃,光照12 h明暗交替,自由飲食飲水,適應性飼養(yǎng)3 d用于實驗。該實驗經唐山市工人醫(yī)院實驗動物倫理委員會批準,倫理審批號:TSGRYY20190421。
1.2 藥物與試劑藤茶總黃酮(寶雞晨光生物科技有限公司,批號:20190503);轉化生長因子β1(transforming growth factorβ1,TGF-β1)(批號:ab215715)、p-Smad2(批號:ab188334)、Smad7(批號:ab216428)、膠原Ⅰ(CollagenⅠ,ColⅠ)(批號:ab34710)均購自美國Abcam公司;天門冬氨酸氨基轉移酶(aspartate aminotransferase,AST)試劑盒(批號:010-2-1)、丙氨酸氨基轉移酶(alanine aminotransferase,ALT)試劑盒(批號:C009-2-1)均購自南京建成生物工程研究所。
1.3 主要儀器CKX53型倒置顯微鏡(日本OLYMPUS公司);SpectraMax M5型多功能酶標儀(美國MD公司);164-5052型電泳儀(美國Bio-Rad公司);ASP200S型脫水機和EG1150型自動包埋機(德國Leica公司)。
1.4 分組與造模50只小鼠按照隨機數字表法分為對照組、模型組、藤茶總黃酮組、激動劑組和藤茶總黃酮+激動劑組,每組10只。除對照組外,其余各組小鼠背部皮下注射25%四氯化碳(CCl4)花生油溶液,2 mL/kg,每3 d注射1次,連續(xù)10周,制備小鼠肝纖維化模型[6]。對照組小鼠背部皮下注射等量100%花生油溶液,每3 d注射1次,連續(xù)10周。小鼠若出現精神萎靡、反應遲鈍,毛色干燥粗糙,血清AST和ALT水平明顯升高,病理結果顯示肝組織損傷,炎癥細胞浸潤并有大量膠原沉積則說明模型制備成功[7]。
1.5 實驗給藥造模同時給藥,藤茶總黃酮組和藤茶總黃酮+激動劑組小鼠灌胃藤茶總黃酮溶液,100 mg/kg,1次/d,連續(xù)10周[8];對照組、模型組和激動劑組小鼠灌胃等體積蒸餾水;激動劑組和藤茶總黃酮+激動劑組小鼠同時腹腔注射rhTGF-β1,1 μg/kg,1次/d,連續(xù)10周;對照組、模型組和藤茶總黃酮組小鼠同時腹腔注射等量生理鹽水。
1.6 觀察指標
1.6.1 血清ALT、AST活性測定 第10周末,給藥結束后2 h,稱取各組小鼠體質量。戊巴比妥鈉麻醉小鼠,收集腹主動脈血液于EP管中,室溫靜置30 min后,3 000 r/min離心15 min,離心半徑8 cm,收集上清液,全自動生化分析儀檢測血清中ALT和AST活性。
1.6.2 肝指數測定 腹主動脈采血完成后,頸椎脫臼法處死小鼠,打開腹腔,剝離肝臟,置于冰PBS中清洗,吸水紙吸干多余水分,稱取肝臟質量,計算肝指數。肝指數=肝臟質量(mg)/體質量(g)×100%。
1.6.3 HE染色觀察肝臟病理學變化 取部分肝臟,置于10%甲醛溶液中固定24 h,脫水、透明、石蠟包埋切片,切片厚度為4 μm,經二甲苯透明,梯度乙醇脫水后,進行蘇木精和伊紅染色,中性樹膠封片,光學顯微鏡下觀察肝組織病理改變。
1.6.4 Masson染色觀察肝臟纖維化 取“1.6.3”項下病理切片,二甲苯透明、梯度乙醇脫水、蘇木精染色5 min,酸性乙醇分化,品紅染液染色5 min,磷鉬酸溶液孵育15 min,苯胺藍染液染色10 min,酸性乙醇分化。常規(guī)脫水、透明,中性樹膠封片。光學顯微鏡下觀察肝臟纖維化情況。每張切片隨機選取5個視野,并計算每個視野藍染面積。膠原面積百分比(%)=藍染面積/肝臟組織總面積×100%。
1.6.5 蛋白印跡法檢測肝臟組織中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白表達 取部分肝臟組織,液氮研磨,加入RIPA裂解液室溫靜置30 min,4℃12 000 r/min離心10 min,離心半徑10 cm,收集上清液于EP管中,參照BCA試劑盒說明書測定蛋白濃度,制備蛋白樣品。配制凝膠,每孔20 μL蛋白樣品,恒壓120 V電泳1.5 h,停止電泳。恒流0.3 A濕轉2 h,室溫封閉1 h,4℃ColⅠ、α-SMA、TGF-β1、p-Smad2、Smad7一抗(1∶1 000)孵育過夜,二抗(1∶5 000)孵育2 h,ECL法顯色。Image J軟件計算蛋白條帶灰度值,目的蛋白條帶灰度值與GAPDH條帶灰度值的比值為目的蛋白相對表達量。
1.7 統計學方法采用SPSS 21.0統計學軟件進行分析,計量資料以“均數±標準差”(±s)表示,經正態(tài)性檢驗和方差齊性檢驗,多組比較用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。P〈0.05為差異有統計學意義。
2 結 果
2.1 各組小鼠血清ALT、AST活性比較模型組小鼠血清ALT、AST活性均明顯高于對照組(P〈0.05);藤茶總黃酮組小鼠血清ALT、AST活性均明顯低于模型組(P〈0.05),而激動劑組小鼠血清ALT、AST活性均明顯高于模型組(P〈0.05);藤茶總黃酮+激動劑組小鼠血清ALT、AST活性均明顯高于藤茶總黃酮組,而低于激動劑組(P〈0.05)。(見表1)
表1 各組小鼠血清ALT、AST活性比較(±s)
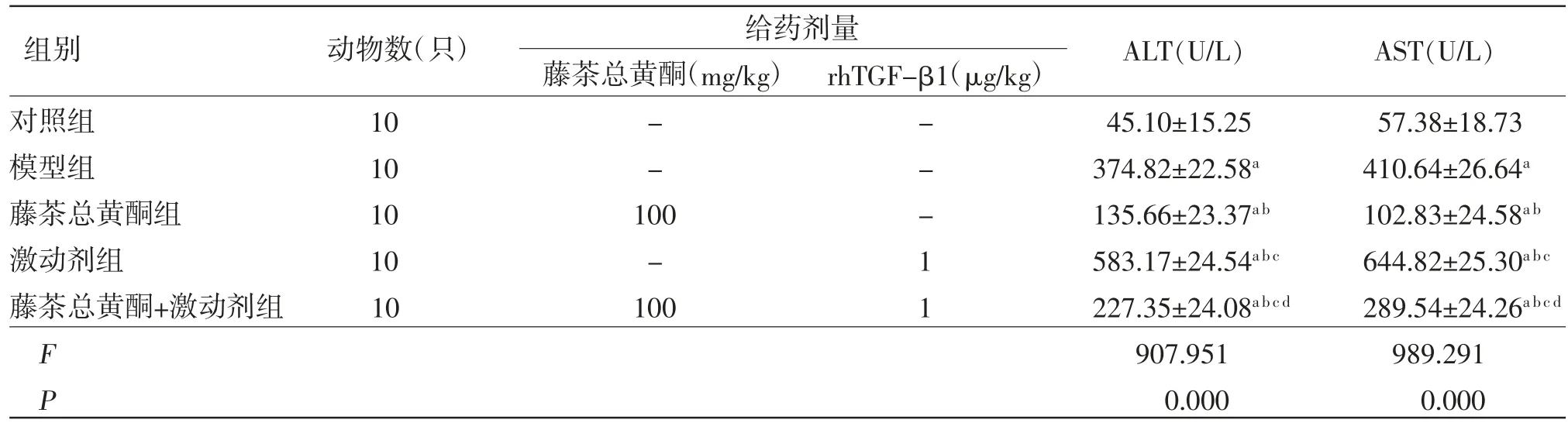
表1 各組小鼠血清ALT、AST活性比較(±s)
注:與對照組比較,aP〈0.05;與模型組比較,bP〈0.05;與藤茶總黃酮組比較,cP〈0.05;與激動劑組比較,dP〈0.05
給藥劑量藤茶總黃酮(mg/kg)rhTGF-β1(μg/kg)對照組 10 - - 45.10±15.25 57.38±18.73模型組 10 - - 374.82±22.58a 410.64±26.64a藤茶總黃酮組 10 100 - 135.66±23.37a b 102.83±24.58a b激動劑組 10 - 1 583.17±24.54a b c 644.82±25.30a b c藤茶總黃酮+激動劑組 10 100 1 227.35±24.08a b c d 289.54±24.26a b c d F 907.951 989.291 P 0.000 0.000組別 動物數(只) ALT(U/L) AST(U/L)
2.2 各組小鼠肝指數比較模型組小鼠肝指數明顯高于對照組(P〈0.05);藤茶總黃酮組小鼠肝指數明顯低于模型組(P〈0.05),而激動劑組小鼠肝指數明顯高于模型組(P〈0.05);藤茶總黃酮+激動劑組小鼠肝指數明顯高于藤茶總黃酮組,而低于激動劑組(P〈0.05)。(見表2)
表2 各組小鼠肝指數比較(±s)
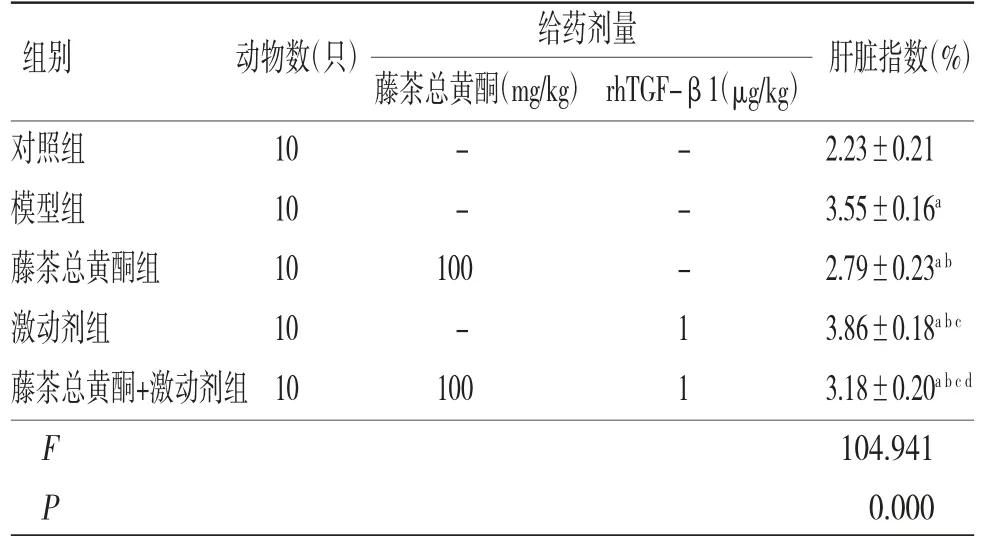
表2 各組小鼠肝指數比較(±s)
注:與對照組比較,aP〈0.05;與模型組比較,bP〈0.05;與藤茶總黃酮組比較,cP〈0.05;與激動劑組比較,dP〈0.05
給藥劑量藤茶總黃酮(mg/kg)rhTGF-β1(μg/kg)對照組 10 - - 2.23±0.21模型組 10 - - 3.55±0.16a藤茶總黃酮組 10 100 - 2.79±0.23a b激動劑組 10 - 1 3.86±0.18a b c藤茶總黃酮+激動劑組10 100 1 3.18±0.20a b c d F 104.941 P 0.000組別 動物數(只)肝臟指數(%)
2.3 各組小鼠肝組織病理學變化對照組小鼠肝小葉結構清晰可見,肝索排列整齊,肝細胞大小均勻,未見變性壞死;模型組小鼠肝小葉結構受損,模糊不清,肝細胞發(fā)生脂肪變性水腫,部分細胞出現壞死,肝索結構紊亂,炎癥細胞浸潤;藤茶總黃酮組小鼠肝細胞脂肪變性和壞死減少,炎癥細胞浸潤減輕;激動劑組小鼠肝細胞發(fā)生脂肪變性,可見肝細胞壞死和炎癥細胞浸潤;藤茶總黃酮+激動劑組小鼠肝組織結構稍正常,炎癥細胞浸潤減輕。(見圖1)
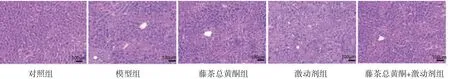
圖1 各組小鼠肝組織病理學變化情況(HE,×200)
2.4 各組小鼠肝臟組織膠原面積百分比比較對照組小鼠肝小葉結構正常,肝索排列整齊,僅有少量膠原沉積;模型組小鼠肝臟組織膠原纖維增生,成條索狀,導致肝小葉正常結構被破壞;藤茶總黃酮組小鼠肝細胞排列稍整齊,膠原沉積減輕;激動劑組小鼠肝臟組織膠原沉積增多,形成纖維間隔,肝小葉遭到破壞;藤茶總黃酮+激動劑組小鼠肝臟組織膠原沉積減少,病理損傷減輕。(見圖2)
模型組小鼠肝臟組織膠原面積百分比明顯高于對照組(P〈0.05);藤茶總黃酮組小鼠肝臟組織膠原面積百分比明顯低于模型組(P〈0.05),激動劑組小鼠肝臟組織膠原面積百分比明顯高于模型組(P〈0.05);藤茶總黃酮+激動劑組小鼠肝臟組織膠原面積百分比明顯高于藤茶總黃酮組,而低于激動劑組(P〈0.05)。(見表3、圖2)。
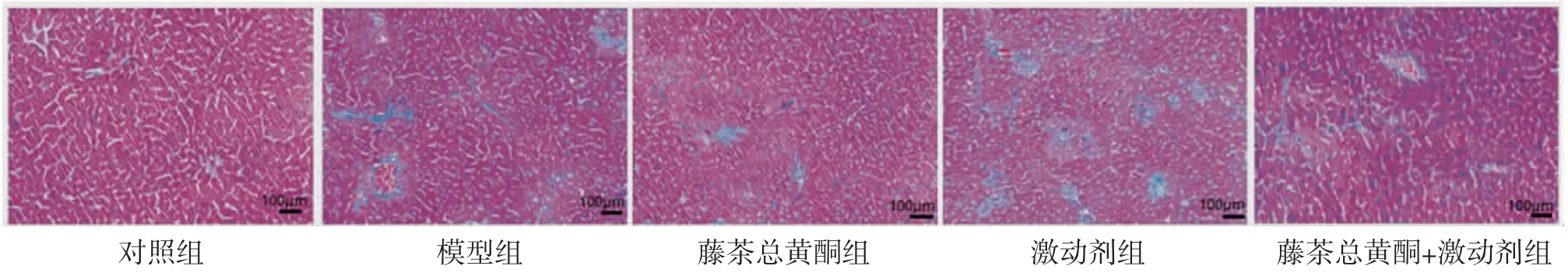
圖2 各組小鼠肝臟組織Masson染色圖(×200)
表3 各組小鼠肝臟組織膠原面積百分比比較(±s)
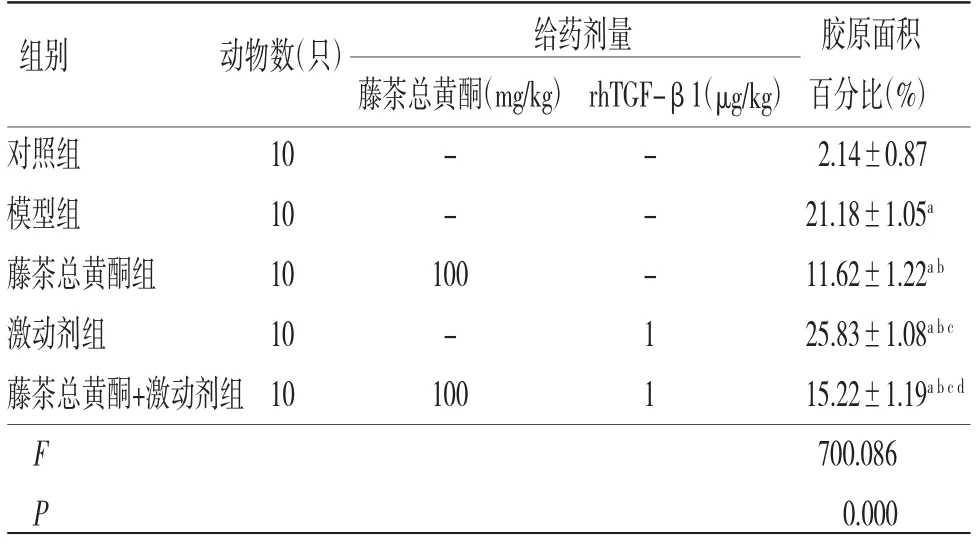
表3 各組小鼠肝臟組織膠原面積百分比比較(±s)
注:與對照組比較,aP〈0.05;與模型組比較,bP〈0.05;與藤茶總黃酮組比較,cP〈0.05;與激動劑組比較,dP〈0.05
給藥劑量 膠原面積藤茶總黃酮(mg/kg)rhTGF-β1(μg/kg)百分比(%)對照組 10 - - 2.14±0.87模型組 10 - - 21.18±1.05a藤茶總黃酮組 10 100 - 11.62±1.22a b激動劑組 10 - 1 25.83±1.08a b c藤茶總黃酮+激動劑組10 100 1 15.22±1.19a b c d F 700.086 P 0.000組別 動物數(只)
2.5 各組小鼠肝臟組織中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白相對表達量比較模型組小鼠肝臟組織中ColⅠ、TGF-β1和p-Smad2蛋白相對表達量均明顯高于對照組(P〈0.05),Smad7蛋白相對表達量明顯低于對照組(P〈0.05);藤茶總黃酮組小鼠肝臟組織中ColⅠ、TGF-β1和p-Smad2蛋白相對表達量均明顯低于模型組(P〈0.05),Smad7蛋白相對表達量明顯高于模型組(P〈0.05);激動劑組小鼠肝臟組織中ColⅠ、TGF-β1和p-Smad2蛋白相對表達量均明顯高于模型組(P〈0.05),Smad7蛋白相對表達量明顯低于模型組(P〈0.05);藤茶總黃酮+激動劑組小鼠肝臟組織中ColⅠ、TGF-β1和p-Smad2蛋白相對表達量明顯高于藤茶總黃酮組(P〈0.05),而低于激動劑組(P〈0.05),藤茶總黃酮+激動劑組Smad7蛋白相對表達量明顯低于藤茶總黃酮組(P〈0.05),而高于激動劑組(P〈0.05)。(見表4、圖3)
表4 各組小鼠肝臟組織中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白相對表達量比較(±s)
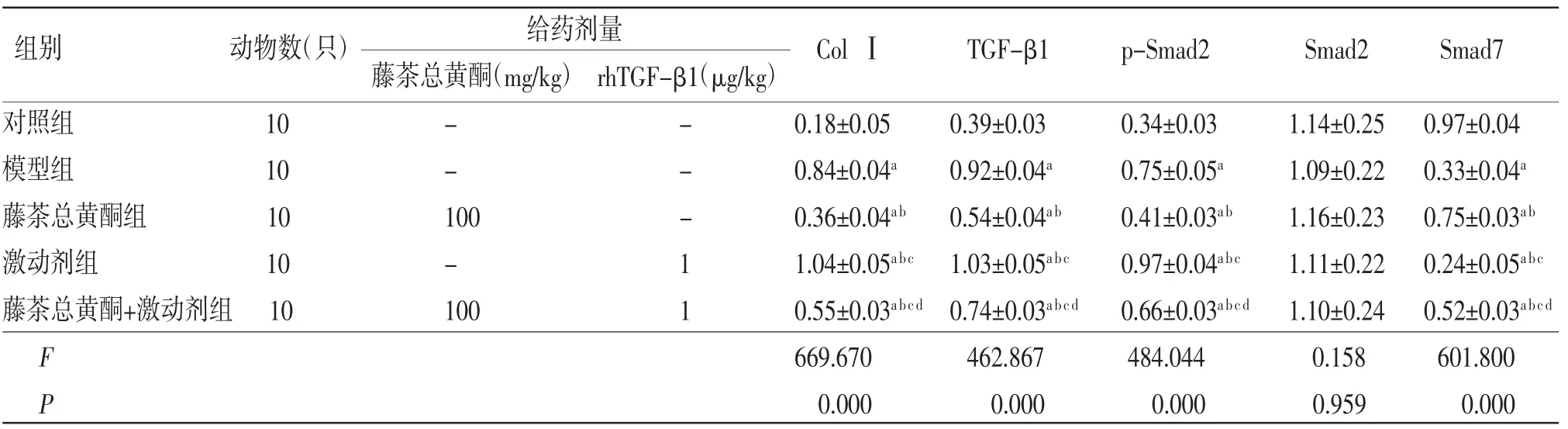
表4 各組小鼠肝臟組織中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白相對表達量比較(±s)
注:與對照組比較,aP〈0.05;與模型組比較,bP〈0.05;與藤茶總黃酮組比較,cP〈0.05;與激動劑組比較,dP〈0.05
給藥劑量藤茶總黃酮(mg/kg)rhTGF-β1(μg/kg)對照組 10 - - 0.18±0.05 0.39±0.03 0.34±0.03 1.14±0.25 0.97±0.04模型組 10 - - 0.84±0.04a 0.92±0.04a 0.75±0.05a 1.09±0.22 0.33±0.04a藤茶總黃酮組 10 100 - 0.36±0.04ab 0.54±0.04ab 0.41±0.03ab 1.16±0.23 0.75±0.03ab激動劑組 10 - 1 1.04±0.05abc 1.03±0.05abc 0.97±0.04abc 1.11±0.22 0.24±0.05abc藤茶總黃酮+激動劑組10 100 1 0.55±0.03abcd 0.74±0.03abcd 0.66±0.03abcd 1.10±0.24 0.52±0.03abcd F 669.670 462.867 484.044 0.158 601.800 P 0.000 0.000 0.000 0.959 0.000組別 動物數(只)ColⅠ TGF-β1 p-Smad2 Smad2 Smad7

圖3 各組小鼠肝臟組織中ColⅠ、TGF-β1、p-Smad2、Smad7蛋白表達Western blotting圖
3 討 論
肝纖維化是由各種慢性肝臟疾病導致的肝損傷病理修復過程,主要病理學變化為細胞外基質過度沉積。肝纖維化時,炎癥細胞浸潤、過度增生等病理改變可導致肝功能紊亂。藤茶總黃酮的主要活性成分二氫楊梅素已被報道具有多種藥理學活性。如二氫楊梅素能抑制高糖誘導的人視網膜上皮色素細胞氧化應激和凋亡,降低氧化應激損傷改善糖尿病小鼠內皮細胞功能障礙,抑制膽管癌細胞增殖、遷移和侵襲,促進凋亡[9-11]。藤茶總黃酮提取物可通過抗炎、調節(jié)糖脂代謝及腸道菌群等方式,干預糖尿病的發(fā)生發(fā)展[12]。但是,藤茶總黃酮是否能夠改善肝纖維化須進一步探討。
本研究通過皮下注射CCl4建立肝纖維化小鼠模型,探討藤茶總黃酮對肝纖維化的影響。二氫楊梅素能夠促進細胞自噬、減輕腎臟纖維化,從而有效改善糖尿病腎病的發(fā)生發(fā)展[13];二氫楊梅素還能改善非酒精性脂肪性肝炎的脂肪變性、炎癥和纖維化[14];此外,二氫楊梅素能通過改變脂質代謝、促進乙醇代謝發(fā)揮肝臟保護作用[15]。本實驗HE和Masson染色結果顯示,藤茶總黃酮可改善肝纖維化小鼠肝臟病理學變化,減輕纖維化程度,rhTGF-β1能加重肝臟病理學變化和纖維化程度;肝臟指數結果表明,藤茶總黃酮可降低肝纖維化小鼠肝指數,而rhTGF-β1可增加肝指數。ALT和AST是臨床上用于評估肝臟損傷的常用指標[16]。本研究結果顯示,模型組小鼠血清ALT、AST活性均明顯高于對照組,藤茶總黃酮治療后ALT、AST活性均明顯降低,rhTGF-β1激活TGF-β/Smad信號通路后,ALT、AST活性高于模型組,藤茶總黃酮+激動劑組小鼠血清ALT、AST活性均低于激動劑組,提示藤茶總黃酮具有改善肝纖維化小鼠肝臟病理學變化、減輕纖維化程度、改善肝損傷的作用。
TGF-β1是一種重要的促纖維化因子,是TGF-β家族中的一員,廣泛存在于肝臟組織。研究發(fā)現,二甲雙胍可抑制TGF-β1信號通路減輕腺嘌呤誘導的腎臟纖維化,TGF-β1可上調血管生成素樣蛋白2,加重退行性髓核細胞的炎癥和纖維化[17-18]。當細胞處于某種外界刺激時,TGF-β1被激活,具有活性的TGF-β1與Ⅰ型和Ⅱ型TGF-β1受體結合,從而激活TGF-β/Smad信號通路。Smad2和Smad3作為該信號通路的下游受體蛋白被激活而發(fā)生磷酸化,磷酸化后的Smad2和Smad3蛋白與Smad4蛋白結合形成復合物。該復合物轉移入細胞核,與特異性DNA連接蛋白結合,從而啟動靶基因轉錄。Smad7是一種纖維化抑制因子,可通過結合活化的TGF-β1阻斷TGF-β1與其受體結合,從而阻斷該過程的信號轉導[19]。研究表明,褪黑素可通過抑制TGF-β/Smad3信號通路減輕糖尿病小鼠腎臟纖維化[20]。酸漿苷D可通過阻斷TGF-β/Smad信號通路降低肝星狀細胞激活和肝纖維化[21]。本研究為了進一步探討藤茶總黃酮發(fā)揮肝臟保護作用是否是通過調控TGF-β/Smad信號通路,采用rhTGF-β1激活TGF-β/Smad信號通路,并采用Western blotting法檢測ColⅠ、TGF-β1、p-Smad2、Smad7蛋白表達。結果顯示TGF-β/Smad信號通路被激活后,ColⅠ、TGF-β1、p-Smad2蛋白相對表達量明顯升高,而Smad7蛋白相對表達量明顯降低;TGF-β治療后,ColⅠ、TGF-β1、p-Smad2蛋白相對表達量明顯降低,而Smad7蛋白相對表達量明顯升高,表明藤茶總黃酮能抑制TGF-β/Smad信號通路。
綜上所述,藤茶總黃酮能減輕肝纖維化小鼠肝臟損傷、改善肝功能,可能作用機制為抑制TGF-β/Smad信號通路。本研究結果為臨床藤茶總黃酮相關藥物的研發(fā)及應用于肝纖維化早期治療提供了實驗依據。

