人體內可以抑制HIV復制的天然免疫因子有哪些
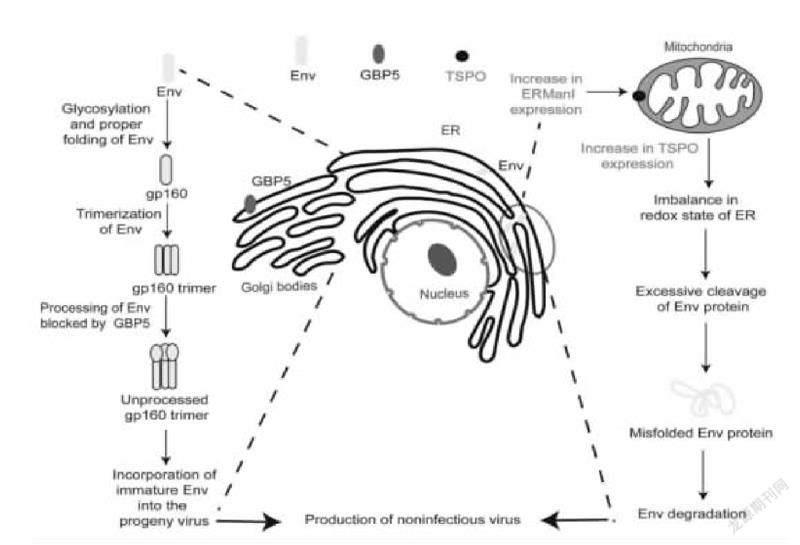
圖1 TSPO、ERMAN Ⅰ和GBP5在HIV-1復制過程中可能抑制作用機制示意圖
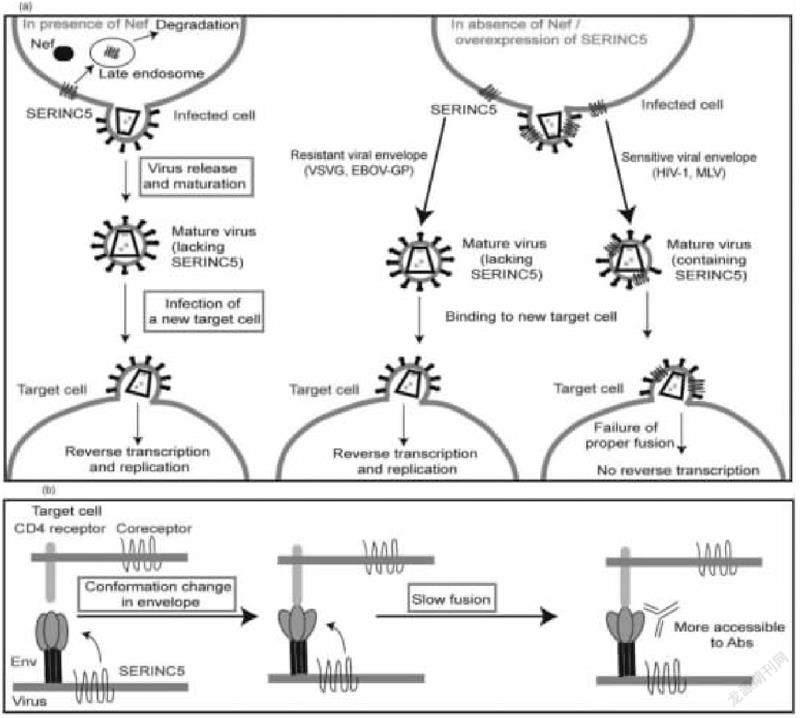
圖2 SERINC5在HIV-1復制過程中可能抑制作用機制示意圖
人類獲得性免疫缺陷病毒Ⅰ型(HIV-1)感染人體后,一些宿主細胞蛋白在HIV-1生命周期的不同階段對其產生抑制作用,鑒別新型宿主限制因子并闡明其作用機制可為今后艾滋病的治療和疫苗研發提供思路。常見的宿主限制因子有如下幾種。
1.APOBEC3G (A3G)
A3G可以被打包進病毒顆粒,在病毒的逆轉錄過程中發揮抗病毒作用。其能夠使新牛DNA負鏈上的腺嘌呤或胞嘧啶脫氨基變為黃嘌呤或尿嘧啶,產生對病毒致死的C→A高突變,而APOBEC3G能被HIV-1的Vif蛋白拮抗。
2.SAMHD1
在樹突狀和髓系細胞中表達,通過影響磷酸水解酶活性降低dNTP水平,干擾HIV復制。并具有核酸酶活性,降解病毒RNA。SAMHD1能被Vpx和Vpr所拮抗。
3.Tetherin
是一種被干擾素α誘導產生的宿主限制性因子,可以將新生HIV病毒顆粒束縛在細胞表面,阻止病毒釋放。Vpu拮抗Tetherin的功能,是HIV-1完成跨種傳播的重要毒力因子。
4.轉運蛋白(translocator protein,TSPO)
位于線粒體膜上的TSPO可與線粒體相關ER膜上的VDAC相互作用改變膜電位,阻斷活性氧物質的釋放來降低內質網內的氧化狀態,導致Env錯誤折疊并經由ERAD途徑識別降解,最終使新生HIV-1病毒缺乏Env且傳染性降低。
5.內質網甘露糖苷酶Ⅰ(endoplas-mic reticulumal,2-mannosidase Ⅰ,ER-MAN Ⅰ)
ERMan Ⅰ在內質網中的高表達增加線粒體TSPO的表達,破壞了Env在內質例中正確折疊所必需的最佳氧化狀態,使Env錯誤折疊,最終導致其降解。
6.鳥苷酸結合蛋白5(guanylate-binding protein 5,GBP5)
CBP5是干擾素誘導的鳥苷三磷酸酶(CTPascs)超家族成員之一,研究表明,CBP5可通過干擾高爾基體內包膜糖蛋白的N-連接寡糖糖基化修飾來影響HIV-1包膜糖蛋白的加丁,增加了子代病毒包膜上未成熟gp160,降低了HIV-1的感染性。
7.絲氨酸結合蛋白(serine incor-porator,SERINC3/5)
在HIV-1缺乏負調節因子Nef或SERINC5自身過表達的情況下,SERINC5能和對它有高親和力的子代病毒包膜結合,以此抑制HIV-1和宿主細胞之間小融合孔的形成,從而限制了HIV-1與宿主細胞的融合,最終降低了HIV-1的感染力。SERINC蛋白還可能與HIV-1的Env蛋白相瓦作用,引起Env蛋白的構象變化,減緩HIV-1與宿主細胞的融合過程,并使HIV-1暴露出能與各種中和抗體結合的表位,從而對HIV-1復制起到一定抑制作用。
8.鋅指抗病毒蛋白(zinc-fin-ger antiviral protein, ZAP)
ZAP過表達可通過阻止HIV-1mRNA翻譯來抑制HIV-1的復制。其機制可能是:(1)ZAP與宿主細胞eIF4G結合,使病毒mRNA不能成功進行翻譯;(2)ZAP可通過與病毒mRNA結合、與ZAP結合反應元件(ZRE)結合或間接影響RNA解旋酶p72/DDX17來募集具有mRNA降解酶活性的物質,從而降解病毒mRNA。
9.TRAB結構域包含蛋白2A(TRAB domain-containing protein2A,TRABD2A)
該蛋白家族成員主要包括TRABD2A和TRABD2B。TRABD2A主要表達于靜息CD4+T細胞表面,TRABD2A在HIV-1感染中能夠發揮抗病毒功能,通過降解CD4+T細胞膜上的病毒結構蛋白Gag以限制HIV-1在靜息CD4+T細胞中的子代組裝,進而抑制HIV-1復制。
宿主限制性因子的鑒定仍是研究抗HIV天然免疫的熱點,科學家不斷發現的抗HIV天然限制因子,為理解HIV發生跨種傳播的機制,開發抗HIV/AIDS的新療法提供了一個潛在的策略。
(中國疾病預防控制中心性病艾滋病預防控制中心)

