四丁基溴化銨-二氧化碳體系中不同結構水合物生成條件測量與模型預測研究
*丁宇 榮少杰 劉青松
(中油(新疆)石油工程有限公司設計分公司 新疆 834099)
水合物技術是一種高效、環保捕集、封存二氧化碳(CO2)的一體化技術[1-2]。在一定低溫和高壓條件下,CO2吸附于由水分子在氫鍵作用下形成的籠型結構中,實現CO2的捕集與封存[3]。當前水合物生成壓力較高限制了水合物的應用與發展,但低毒性、不揮發的陰離子表面活性劑-四丁基溴化銨(TBAB)的開發有效解決了這一問題[4]。
有效生成水合物是水合物法CO2捕集與封存一體化技術的實施前提,必須掌握不同條件下TBAB-CO2水合物臨界生成條件,這是制定捕集、封存工藝的基礎[5]。通過實驗明確TBAB-CO2生成條件,并建立合適的預測模型是實現這一技術工業化的前提。但由于TBAB-CO2有A型(TBAB·26H2O)和B型(TBAB·38H2O)兩種結構,兩種結構水合物生成熱力學條件明顯不同,且兩種結構水合物生成的相對難易程度會隨條件變化而逆轉,這使得TBAB-CO2的臨界生成壓力預測十分困難,難以采用現有技術將多種結構水合物模糊處理成一種結構水合物的方式來解決[6-7]。
本文針對水合物法CO2捕集過程中的強化問題,通過實驗研究了含TBAB體系CO2水合物的生成條件,明確TBAB對CO2水合物的強化及促進作用。在試驗結果的基礎上,將A型和B型兩種結構水合物分開計算,根據對A型和B型水合物的計算結果,選取既定條件下更容易生成的結構型的生成條件為體系生成條件,從而將模型進一步貼合于實際,實現了預測準確性的提升。經過本文的研究掌握了TBAB-CO2體系水合物生成條件,定性分析了不同條件下A、B雙構型轉換和分布規律,為實現水合物法CO2捕集與封存一體化工業應用打下了基礎。
1.試驗與模型
(1)試驗試劑
二氧化碳(CO2),x(CO2)=99.9%,北京永圣氣體科技有限公司;四丁基溴化銨(TBAB),ω(TBAB)=99.0%,天津光復精細化工研究所;去離子水,15×106Ω·cm,實驗室自制。
(2)試驗儀器
活塞式高壓反應釜(耐壓25MPa,不銹鋼,磁力攪拌)海安拓新科研儀器有限公司;手搖泵(調節反應釜內氣體壓力,刻度范圍0~230ml)、空氣浴(調節反應釜內溫度,控溫范圍-20℃~50℃,控溫精度±0.1℃),海安拓新科研儀器有限公司;溫度傳感器(Pt100,測溫精度±0.1℃),上海實驗儀器廠有限公司;壓力傳感器(0~20MPa,測量精度±0.01MPa),上海實驗儀器廠有限公司;電子天平(LQA5003),上海瑤新電子科技有限公司。
(3)熱力學實驗方法
本實驗采用“恒溫壓力搜索法”測量水合物生成條件,該方法為水合物熱力學測量的通用方法。將100ml按照配方量配制所需濃度的實驗溶液加入清洗干凈的反應釜中。使用CO2氣體吹掃反應釜和管線充分置換空氣后,向反應釜內通入一定壓力的CO2氣體。啟動空氣浴,控制反應溫度至指定實驗溫度,待溫度恒定時,啟動磁力攪拌并維持實驗過程中攪拌速度恒定。通過手搖泵調節反應釜內壓力,使反應釜內生成痕量水合物顆粒,并維持4h穩定。則此時的壓力即為當前溫度條件下的水合物生成壓力。改變實驗溫度、溶液等條件,測定不同實驗條件下的水合物生成條件。
(4)熱力學模型
本文基于Chen-Guo水合物模型[8-9],結合TBAB水合物構型轉換現象,以化學位判據建立了TBAB-CO2水合物生成預測改進模型。根據Chen-Guo水合物模型的描述,首先生成基礎水合物,基礎水合物不斷生長形成聯結孔,然后發生氣體分子CO2的吸附過程,CO2分子填充于聯結孔中,降低水合物化學位能,提高結構穩定性。以化學位能差△μ為判據,<0表示可生成水合物,>0表示不能生成水合物且水合物出現解離,△μ計算式如方程式(1)所示[10-11]。
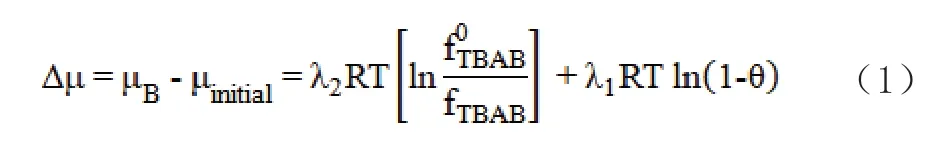
式中,μinitial、μB分別為體系生成水合物前后的化學位能;λ1、λ2分別為聯結孔數、氣體分子數與水分子數比;R、T分別為通用氣體常數、實驗溫度;fTBAB0、fTBAB分別為TBAB在基礎水合物、實驗條件下的逸度。fTBAB0由方程式(2)計算:
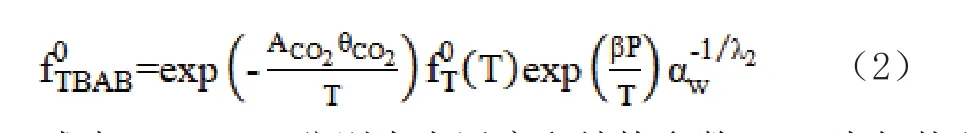
式中,αw、β分別為水活度和結構參數;ACO2為氣體分子吸附過程中聯結孔CO2分子間相互作用參數。本模型考慮TBAB水合物A、B結構構型轉換問題,對ACO2與TBAB濃度進行關聯,其中ωTBAB為TBAB質量分數。
TBAB A型水合物關聯式如方程式(3)所示:
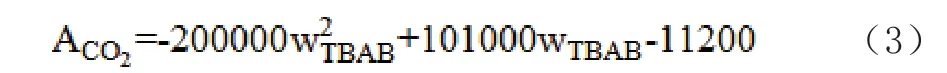
TBAB B型水合物關聯式如方程式(4)所示:

2.結果與討論
(1)TBAB-CO2水合物生成條件。實驗測定了7~11℃范圍內,不同濃度TBAB溶液(ω(TBAB)=5%,10%,15%,20%,25%)中CO2水合物的生成條件,結果如圖1所示,整體趨勢為水合物生成壓力與溫度呈正相關。相比于純水體系,在相同溫度下TBAB溶液中CO2水合物的生成壓力明顯降低。根據文獻[12-13]報道,TBAB在常壓下就可生成水合物,陰離子取代一個水分子在氫鍵作用下與其他水分子形成籠型結構,陽離子占據水合物晶體的大孔穴,氣體分子則填充于小孔穴[12-13]。因此TBAB的熱力學促進作用已被證實。TBAB的存在可有效促進CO2水合物的生成,降低CO2水合物的生成條件。10℃時,ω(TBAB)=5%溶液中CO2水合物生成壓力降低2.74MPa,降幅達63.7%;ω(TBAB)=20%溶液中,生成壓力降低4.12MPa,接近常壓,降幅達95.8%,這為實現水合物法CO2捕集與封存技術的工業化應用提供了可能。水合物生成壓力降低幅度與TBAB濃度呈正相關,濃度越高,促進作用越強。
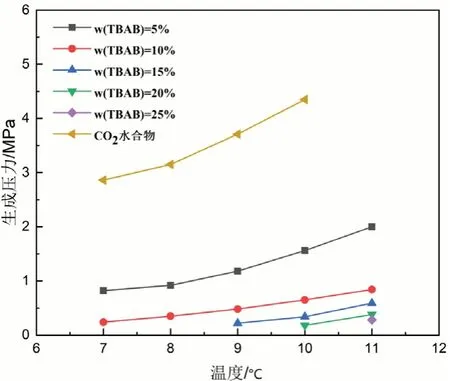
圖1 TBAB-CO2體系水合物生成條件
(2)TBAB-CO2水合物熱力學模型。表1為采用TBAB A型水合物模型計算所得不同TBAB濃度及不同溫度條件下的CO2水合物生成壓力。將計算值與實驗值對比,可以發現在濃度為ω(TBAB)=5%、10%的溶液中,CO2水合物的生成壓力模型預測值經過迭代計算均超過10MPa,遠遠大于實驗值,同時ω(TBAB)=15%的溶液中,CO2水合物的生成壓力預測值也遠大于實驗值。這表明ω(TBAB)=5%、10%、15%的溶液體系中無A型水合物的生成,在ω(TBAB)=20%、25%的溶液中,CO2水合物的模型預測值與實驗值基本一致,絕對偏差在0.001MPa,由此表明該體系生成的為A型水合物。
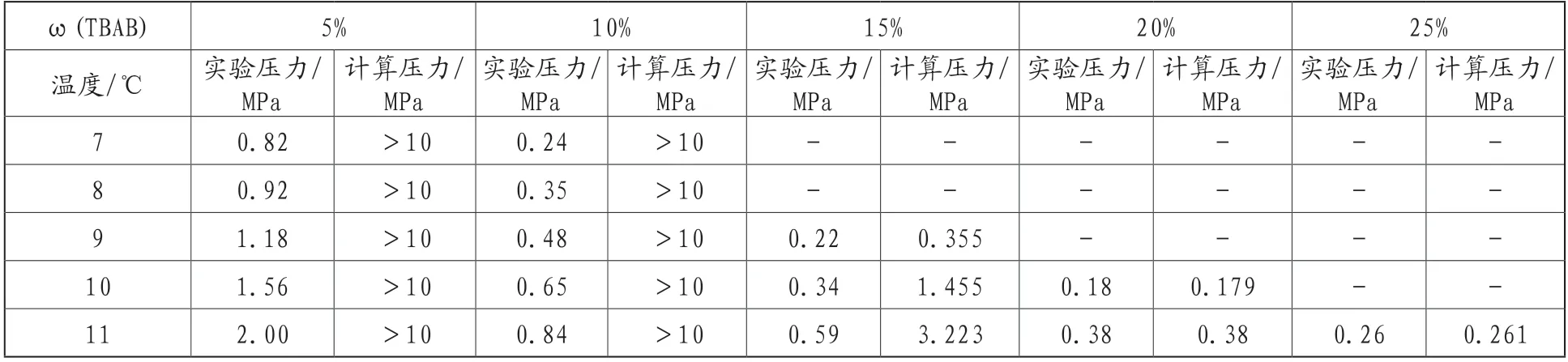
表1 A型水合物生成壓力實驗值與計算結果
表2為采用TBAB B型水合物模型計算所得不同TBAB濃度及不同溫度條件下的CO2水合物生成壓力。同樣對比計算值及實驗值可以發現,ω(TBAB)=5%、10%、15%的溶液中,相同溫度下,CO2水合物生成壓力預測值與實驗值基本一致。這表明在此條件下生成的水合物為B型。同時從表中可知,針對ω(TBAB)=20%、25%的溶液體系,模型預測值與實驗值也基本吻合,這表明在該濃度下同樣可以生成B型號水合物,但在此兩種濃度條件下,以B型水合物模型計算的預測值精度要低于以A型水合物模型計算的預測值。
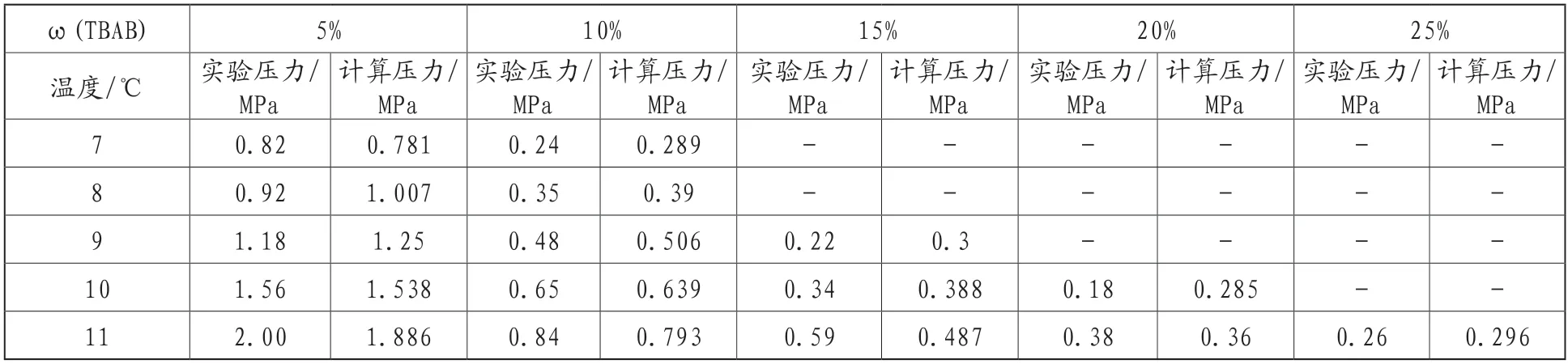
表2 B型水合物生成壓力實驗值與計算結果
依據模型預測值與實驗值接近原則,ω(TBAB)=5%、10%、15%的溶液體系CO2水合物的生成壓力預測值選擇以B型水合物模型的計算結果,同時ω(TBAB)=20%、25%的溶液體系CO2水合物的生成壓力預測值選擇以A型水合物模型的計算結果。通過分析可以明確不同濃度的TBAB溶液體系A型和B型水合物構型轉變和分布情況,在低濃度時B型水合物是體系中的主要構型,當濃度較高時A型水合物將會出現,A型和B型水合物共生共存。從表3數據可知,模型具有較高的精度,預測值與實驗值的絕對誤差在0.1MPa以內。
3.結論
水合物CO2捕集與封存一體化技術具有高效、環保的特點,針對該技術中熱力學促進劑TBAB的應用及存在A、B構型轉變、TBAB-CO2體系模型預測困難的問題,本文通過研究得以有效解決以上問題,并得出以下結論:
(1)本研究實驗測定了TBAB-CO2水合物體系的相平衡數據,TBAB可有效降低CO2水合物的生成條件,促進CO2水合物的生成,并且促進作用隨著TBAB濃度的增加而增強。
(2)建立了考慮TBAB構型轉換的熱力學模型,通過定性分析模型計算數據,在ω(TBAB)=5%、10%、15%的溶液體系中,優先生成B型水合物,無A型水合物的存在。而ω(TBAB)=20%、25%的溶液體系中,A型和B型水合物將共同存在。模型預測值與實驗值的絕對誤差在0.1MPa以內,模型具有較高的精度。為水合物CO2捕集與封存一體化技術奠定基礎。

