酶解大豆蛋白抗氧化肽的分離純化與鑒定
劉 輝,張會生,童火艷,江曉楠,陳曉婷
(1.廣東海天創新技術有限公司,廣東 佛山 528000;2.佛山市國創生物發酵食品技術創新中心,廣東 佛山 528000)
大豆作為傳統發酵調味品中主要原料之一,其蛋白質是大豆生物活性肽的主要來源,是開發功能性調味品的理想原料。大豆蛋白屬于一類球蛋白,其主要由2 種球蛋白組成:-伴大豆球蛋白和大豆球蛋白,約占大豆蛋白的65%~80%。在此基礎上,細分球蛋白種類主要為2S、7S、11S、15S球蛋白,11S和7S球蛋白是大豆蛋白中的主要蛋白,約占60%。酶解大豆蛋白產物,是大豆生物活性肽主要來源之一,因其廣泛的生物學功能受到科學研究者的密切關注。在大豆蛋白肽的多種活性功能中,抗氧化活性是最主要的功能之一。大豆抗氧化肽能有效清除機體內殘存的氧自由基,保持機體內氧自由基的穩定,從而發揮機體抗衰老、抗疲勞、提高免疫力、調節受損皮膚等功效。在自然發酵食品中,以酸性或弱酸性條件為主,在此條件下更有利于酸性蛋白酶和中性蛋白酶的發揮,而堿性蛋白酶由于pH值的不適,很難發揮其主要作用。堿性蛋白酶是一種專一性廣泛的內切蛋白酶,尤其傾向于催化裂解蛋白質中不帶電荷側鏈大的氨基酸(芳香族和脂肪族氨基酸,如異亮氨酸(Ile)、亮氨酸(Leu)、纈氨酸(Val)、甲硫氨酸(Met)、苯丙氨酸(Phe)、酪氨酸(Tyr)、色氨酸(Trp))C端肽鍵,而且當N端為疏水性氨基酸時裂解更快,從而形成以疏水性氨基酸為末端的肽。Hu Fei等采用堿性蛋白酶水解核桃蛋白獲得新型抗氧化肽(氨基酸序列為LAYQYTDFETR)。在抗氧化肽中N端和C端氨基酸對其抗氧化活性有很大影響。例如,N端的疏水氨基酸能夠增加肽的抗氧化活性,而C端氨基酸常為Trp、谷氨酸(Glu)、Leu、Ile、Met、Val和Tyr可增強肽的抗氧化活性。Han Ruixian等對比堿性蛋白酶和中性蛋白酶對不同蛋白水解后的功能,發現大豆蛋白是提供生物活性最好的原料。
課題組前期優化了堿性蛋白酶的酶解條件,從大豆蛋白中獲得具有最大抗氧化活性的肽。本實驗對最優酶解條件下的大豆蛋白抗氧化肽進行研究,采用高效強陰離子交換柱、快速弱陰離子交換柱和制備液相方法,分離純化抗氧化肽,并使用液相色譜-串聯質譜(liquid chromatography-tandem mass spectrometry,LC-MS/MS)、氨基酸分析儀對抗氧化肽進行鑒定分析。
1 材料與方法
1.1 材料與試劑
Tris(分析級) 美國西格瑪奧德里奇(上海)貿易有限公司;三氟乙酸(色譜級)、乙腈(色譜級)、蛋白測定試劑盒 美國賽默飛世爾科技公司;氯化鈉(分析級) 天津市耀華化學試劑有限責任公司;抗氧化測定試劑盒 北京索萊寶生物技術有限公司。
1.2 儀器與設備
AKTA pure 25M1蛋白質層析純化系統 美國通用電氣公司;1100 Series高效液相色譜儀、Millspectrum分析軟件 安捷倫科技(中國)有限公司;2545制備型液相色譜儀 美國沃特世公司;G6545B LC-MS/MS美國安捷倫科技有限公司;LA8080 氨基酸分析儀日立(中國)有限公司。
1.3 方法
1.3.1 酶解大豆蛋白抗氧化肽的分離
1.3.1.1 強陰離子交換柱分離抗氧化肽
將超濾(截留分子質量5 kDa)后的酶解大豆蛋白抗氧化肽樣品(優化酶解工藝得到抗氧化活性最強的樣品),凍干濃縮,溶于用1 mol/L NaOH溶液調至pH 9.0的水溶液中用于初步分離。
采用HiTrap Q HP強陰離子交換柱(25 mm×50 mm)分離抗氧化肽,柱平衡緩沖液為50 mmol/L pH 9.0 Tris-HCl緩沖液。平衡2 個柱體積后上樣,上樣量為1 mL。未結合的物質用2 個柱體積的Tris-HCl緩沖液沖洗去除。用含0~1.0 mol/L NaCl的50 mmol/L pH 9.0 Tris-HCl緩沖液進行線性洗脫,洗脫體積為10 個柱體積,洗脫流速為3 mL/min,每管收集2 mL洗脫液。洗脫后用5 個柱體積含1.0 mol/L NaCl的Tris-HCl緩沖液清洗柱子。在214 nm波長下,測定各管洗脫液的響應信號。將出峰物質收集后凍干濃縮,用于后續測定。
1.3.1.2 弱陰離子交換柱分離抗氧化肽
用1 mol/L NaOH溶液將酶解大豆蛋白抗氧化肽樣品調至pH 8.0用于初步分離。
采用HiTrap DEAE -FF 陰離子交換柱(25 mm×150 mm)分離抗氧化肽,柱平衡緩沖液為50 mmol/L pH 8.0 Tris-HCl緩沖液。平衡2 個柱體積后上樣,上樣量為1 mL。未結合上的物質用2 個柱體積的Tris-HCl緩沖液沖洗去除。用含0~1.0 mol/L NaCl的50 mmol/L pH 8.0 Tris-HCl緩沖液進行線性洗脫,洗脫體積為10 個柱體積,洗脫流速為3 mL/min,每管收集2 mL洗脫液。洗脫后用5 個柱體積含1.0 mol/L NaCl的Tris-HCl緩沖液清洗柱子。在214 nm波長下,測定各管洗脫液的響應信號。將出峰物質收集后凍干濃縮,用于后續測定。
1.3.1.3 制備液相分離純化抗氧化肽
采用Zorbax SB-C色譜柱(21.2 mm×250 mm,7 μm);平衡2 個柱體積后上樣,上樣量為1 mL;流動相A:超純水+0.1%三氟乙酸;流動相B:乙腈+0.1%三氟乙酸;洗脫程序:38% A+62% B,洗脫38 min,流速10 mL/min。在214 nm波長下,測定吸光度。將出峰物質收集后凍干濃縮,用于后續測定。
1.3.2 高效液相色譜測定抗氧化肽的純度
選用Poroshell 120 SB-C色譜柱(4.6 mm×150 mm,2.7 μm)。流動相A:超純水+0.1%三氟乙酸;流動相B:乙腈+0.1%三氟乙酸。洗脫程序:35% A+65% B,流速1.0 mL/min,洗脫時間20 min。在214 nm波長下,測定吸光度。
1.3.3 LC-MS/MS測定抗氧化肽分子質量
將純化后的抗氧肽溶于水中使其質量濃度為0.5 mg/mL。
色譜條件:上樣量1 μL;InfinityLab Poroshell 120 SB-C色譜柱(2.1 mm×150 mm,2.7 μm);流動相A:超純水+0.1%三氟乙酸;流動相B:乙腈+0.1%三氟乙酸;等度洗脫:90%~10% A、10%~90% B,洗脫時間10 min,流速0.5 mL/min。
質譜條件:離子源:電噴霧離子源;正離子模式;噴射電壓3.0 kV;錐形電壓80 V;離子源溫度80 ℃;分解溫度200 ℃;錐形氣體流量10 L/h;氣體去溶劑化流速600 L/h;碰撞能量10~50 eV;一級質譜掃描范圍/100~3 000;二級質譜掃描范圍/100~3 000。
1.3.4 氨基酸分析儀測定抗氧化肽氨基酸組成和數量
用6 mol/L HCl溶液在110 ℃下水解抗氧化肽12 h。水解后,加入NaOH溶液進行中和。取20 μL中和后溶液上樣,采用Pico-Tag C色譜柱。通過與氨基酸標準品的對比,確定抗氧化肽氨基酸組成和數量。
1.3.5 LC-MS/MS測定抗氧化肽序列
將抗氧肽溶于水中使其質量濃度為0.5 mg/mL。色譜和質譜條件與1.3.3節一致。
1.3.6 抗氧化肽數據庫比對
將抗氧化肽的質譜數據輸入到Millspectrum軟件中,在Uniprot數據庫,搜索類別為Taxonomy,輸入大豆種屬為Glycine max,選擇Reviewed數據庫中共409 個大豆數據,下載并將數據庫加載入Millspectrum軟件中,根據實驗條件選擇分析模式,確定抗氧化肽的來源和序列。
2 結果與分析
2.1 HiTrap Q HP強陰離子交換柱分離抗氧化肽分析
由于酶解大豆是在堿性條件下,大豆蛋白在酶解過程結束后,其中的酸性肽或中性肽普遍帶有負電荷,HiTrap Q HP強陰離子交換柱能有效吸附帶有負電荷的大豆抗氧化肽。
如圖1所示,在洗脫體積0~15 mL范圍內,NaCl濃度并未發生變化,主要目的是洗脫上樣后未結合在色譜柱上的物質,提高樣品的純度。將出峰物質收集后通過抗氧化活性檢測,結果表明抗氧化肽主要在洗脫體積30~60 mL之間,在此范圍內出現多個相互重疊的物質峰,說明HiTrap Q HP強陰離子交換柱不僅對目標物質有較強的吸附能力而且對于非目標物也存在較強的吸附,主要是色譜柱性質和pH值兩個方面作用的結果。Jin Duxin等采用堿性蛋白酶水解玉米蛋白后,在pH 8.5條件下使用Q-sepharose陰離子交換柱進行分離抗氧化肽時,出現大范圍的重疊物質峰。此外,在分離魚類蛋白被水解產生的抗氧化肽和分離果汁蛋白被水解產生的抗氧化肽的研究中,都在初分離時用到陰離子交換柱,并且其目標區都出現大范圍重疊區。因此陰離子交換層析分離抗氧化肽只是分離純化過程中的第一步,得到高純度的抗氧化肽依然需要借助其他色譜柱同共完成。
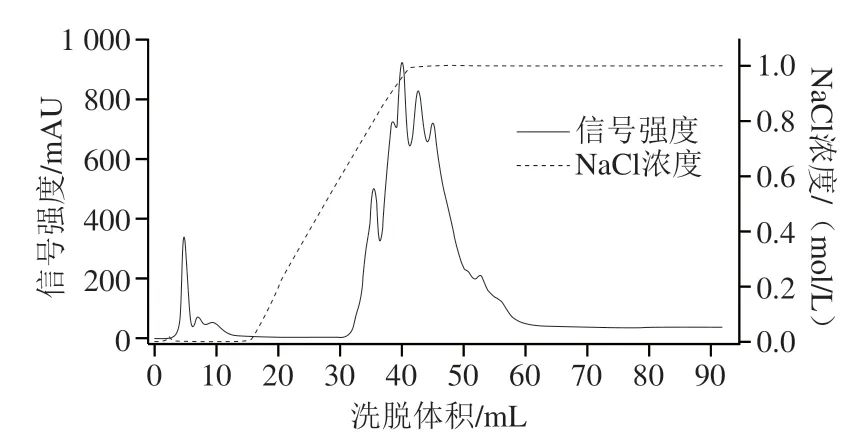
圖1 HiTrap Q HP強陰離子交換柱分離抗氧化肽Fig.1 Separation of soybean protein hydrolysate on HiTrap Q HP strong anion exchange column
2.2 HiTrap DEAE-FF弱陰離子交換柱分離抗氧化肽分析
由圖2可知,與強陰離子交換柱的結果相似,在洗脫體積0~150 mL范圍內,NaCl濃度并未發生變化,主要目的是洗脫上樣后未結合在色譜柱上的物質,提高樣品的純度。將主要出峰范圍收集液通過抗氧化活性檢測,結果表明抗氧化肽范圍在洗脫體積300~350 mL之間出峰。表明HiTrap DEAE-FF弱陰離子交換柱能有效分離抗氧化肽,而且抗氧化肽出峰的位置在陰離子柱的后端,說明此類抗氧化肽較其他肽類吸附能力更強,能有效將抗氧化肽與其他肽類雜質分離開。Ren Jian等使用DEAE弱陰離子交換柱分離葵花籽蛋白水解抗氧化肽;Sampath Kumar等使用DEAE弱陰離子交換柱分離魚類水解抗氧化肽。此外,DEAE弱陰離子交換柱還可以用于蝦醬、雞肉水解蛋白、大米水解蛋白等抗氧化肽的分離。因此,在抗氧化肽的分離過程中DEAE弱陰離子交換柱比Q HP強陰離子交換柱在分離抗氧肽方面更為普遍,但是分析相關文獻的整體純化過程,發現DEAE弱陰離子交換柱更多應用于抗氧化肽的初步分離和二次分離,并非最終分離的色譜柱,其主要原因是相同性質的肽類會重疊。如圖1所示,抗氧化肽的出峰位置明顯存在其他物質,說明其中還存在其他肽類或蛋白物質,需要進一步分離。

圖2 HiTrap DEAE-FF弱陰離子交換柱分離抗氧化肽Fig.2 Purification of antioxidant peptides on HiTrap DEAE-FF weak anion exchange column
2.3 制備型液相分離抗氧化肽分析
制備型液相是通過反相色譜柱,根據物質的極性強弱分離物質的一種有效方法,其主要特點是通過高壓能有效提高分離的精密度,其次通過不同反相色譜柱接合性質不同,能有效將比較難分離的物質分開,包括一些旋光異構體。
由圖3可知,制備型液相分離出了單一的抗氧化肽。通過對出峰位置抗氧化活性的檢測,結果表明在3 個出峰物質濃度相同時,具有抗氧化活性的肽出峰時間為3.27 min,將其命名為SHP-1。收集制備液相分離的抗氧化肽物質通過高效液相色譜測定純度,高純度的抗氧化肽有利于分子質量和結構的測定。Zhang Miao等通過制備液相最終從堿性蛋白水解甜土豆蛋白中分離出5 種抗氧化肽,并分析出它們的結構和組成。Harnedy等通過制備液相從海藻酶解蛋白中分離出一種新型抗氧化肽(氨基酸序列為SDITRPGGQM)。大部分抗氧化肽的分子質量都不大于1 000 kDa,分子篩在分離純化過程中的作用不明顯。抗氧化肽一般都為單鏈和二級結構,結構比較穩定,不易受到有機試劑對活性的影響。因此,在分離純化抗氧化肽過程中,制備液相是必備的方法。

圖3 制備液相分離抗氧化肽Fig.3 Separation of SHP-1 by preparative liquid chromatography
2.4 抗氧化肽純度分析
分析型高效液相色譜較制備型高效液相,最主要的不同是分析型液相色譜柱的粒徑、孔徑可以更小,柱效更好,可以有效檢測分離樣品的純度。
由圖4可知,在保留時間2~4 min出現了兩個峰。第1個峰為儀器上樣峰,這是由于設備上樣時會出現極短時間的流動相切換,導致電導率出現波動,所以出峰形狀出現正負峰;第2個峰為樣品溶劑峰,主要是由于樣品在進入色譜柱后,被流動相稀釋,導致部分流動相與樣品溶劑混合后打破原有的平衡體系而出現。由圖4還可知,在保留時間9.952 min處有明顯出峰,說明抗氧化肽SHP-1有較高的純度,根據峰面積計算出SHP-1的純度為96.27%,達到了可用于分析SHP-1分子質量、成分組成、排列順序的純度;其抗氧化比活力為30 U/μg。保留時間10.447 min處為隱藏峰,經檢測為制備液相中與SHP-1相鄰物質峰(相關的數據并未列出)。在肽類物質的分離純化中,制備液相與分析型液相的應用十分普遍,可防止相似性質物質的干擾。Kim等在研究紫蘇種子中蛋白質酶解后產生的抗氧化肽時,制備液相分離純化的兩種抗氧化肽出峰位置與在分析型液相中十分相似。這說明在肽類物質的分離純化中,制備型液相與分析型液相是相輔相承,通過不同類型的色譜柱,可以有效避免出現相似物質重疊的現象。
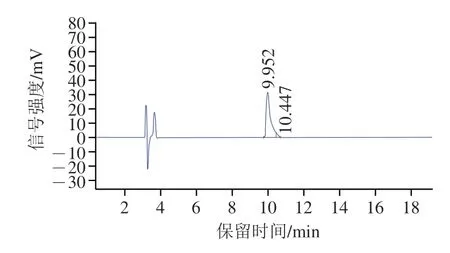
圖4 抗氧化肽SHP-1的高效液相圖譜Fig.4 HPLC profile of SHP-1
2.5 抗氧化肽分子質量分析
抗氧化肽分子質量可用于初步判斷抗氧肽是否為新型抗氧化肽。通過分析抗氧化肽的分子質量還可初步了解抗氧化肽的氨基酸組成數目,為其結構和成分分析提供理論幫助。
由圖5 可知,抗氧化肽SHP-1 的分子質量為741.41 Da。Tang Xueyan等研究表明抗氧化肽的抗氧化活性與其分子質量和疏水性存在十分重要的關聯。當抗氧化肽分子質量小于1 kDa時,更能表現出強抗氧化性,低分子質量抗氧化活性強的特性僅限于某些蛋白水解肽。Lin Songyi等研究水解蛋清蛋白發現分子質量小于1 kDa的抗氧化肽的活性明顯高于其他分子質量組。Cai Luyun等將小分子肽的酶解抗氧化活性與其他282 種肽類的抗氧化活性進行對比,結果表明分子質量與抗氧化活性有著密切的關聯。此外,根據氨基酸平均分子質量為128 Da,初步確定抗氧化肽SHP-1含有5~7 個氨基酸。
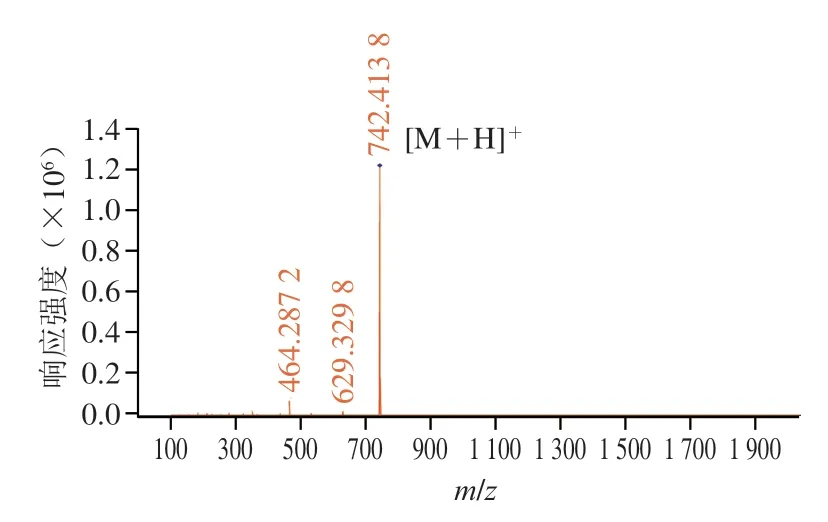
圖5 抗氧化肽SHP-1的MS/MS譜圖Fig.5 MS/MS spectrum of SHP-1
2.6 抗氧化肽氨基酸組成分析
氨基酸組成是抗氧化肽體現自身抗氧化性質的重要方面。由于氨基酸的抗氧化性能,才使得肽類物質具有抗氧化性,而不同的氨基酸抗氧化性能完全不同。
由表1可知,抗氧化肽SHP-1主要由5 種氨基酸組成,分別為Ile、脯氨酸(Pro)、甘氨酸(Gly)、Val、Tyr。對于有環狀結構的氨基酸(組氨酸(His)、Trp、Tyr和Pro)能夠通過環狀結構中的羥基供體提供氫供體,因此可以作為羥自由基清除劑。大部分抗氧化肽都含有疏水氨基酸His、Trp、Phe、Pro、Gly、賴氨酸(Lys)、Ile和Val,這些疏水氨基酸能有效幫助酶解后肽分子形成疏水微環境提高肽的抗氧化性。根據SHP-1各氨基酸濃度可知氨基酸的數量:Gly 1 個、Val 1 個、Ile 1 個、Tyr 1 個、Pro 3 個。各氨基酸組成肽鏈后分子質量為741 Da,與質譜分子質量相同,由此證明SHP-1是由5 種氨基酸組成。
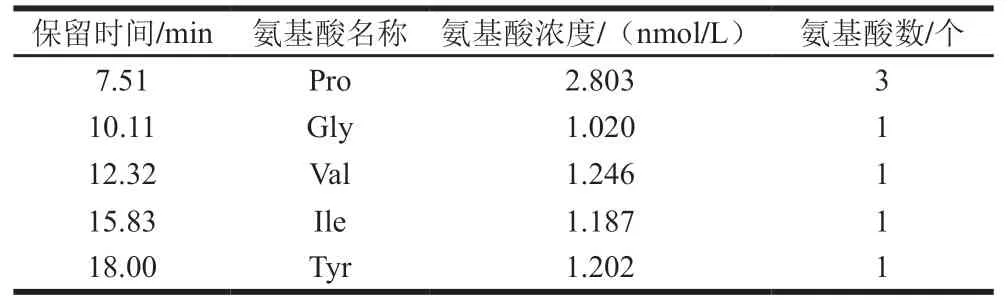
表1 SHP-1氨基酸組成和數量Table 1 Amino acid composition of SHP-1
2.7 抗氧化肽氨基酸序列分析
抗氧化肽的抗氧化活性與氨基酸序列關系密切,通過氨基酸有效組合不僅可以提高抗氧化肽的抗氧化活性,還可以提高其穩定性。因此了解氨基酸序列是研究抗氧化肽的最重要內容。
由圖6可知,抗氧化肽SHP-1的序列存在兩段譜圖,一段解析質譜序列為Ile-Pro-(Pro+Gly)-Val;另一段解析質譜序列為Pro-Gly-Val-Pro-Try。根據分子質量推測SHP-1的序列可能為Ile-Pro-Pro-Gly-Val-Try。抗氧化活性與其氨基酸序列有著明顯關聯,Bamdad和Samaranayaka等認為在C端含有Tyr和Trp都能表現出強自由基清除能力。Chen Huaming等研究28 種合成肽,表明抗氧化肽在C端去除一個His能明顯影響抗氧化肽的活性,而在N端將Leu去除對于抗氧化肽的活性并無顯著影響。Pro是抗氧化肽中重要的一類氨基酸,Pro傾向于干擾和改變肽類分子的二級結構,從而增加肽類物質的抗氧化性。絲氨酸(Ser)和Ile這類氨基酸無論是在N端還是在C端都可以表現出高自由基清除能力。Zou Tangbin等指出抗氧化肽的抗氧化活性在于C端和N端的氨基酸殘基的帶電性質、氫鍵性質和空間位置,其中C端的疏水性和抗氧化肽的帶電性質是最重要的。應用各類酶水解特定蛋白,通過各種分離純化手段尋找功能肽是非常耗時、耗力的方法。由于各類蛋白質的研究,已經清楚了從基因到蛋白的氨基酸序列,通過各類酶解模擬作用氨基酸的位點分析酶解蛋白產生的肽序列,對比生物活性肽庫的數據,可以快速分析得到系列的生物活性肽及其蛋白亞基與位置。選擇適宜的酶和條件,利用LC-MS/MS精準分析,不僅高效而且還能大幅降低研發成本。
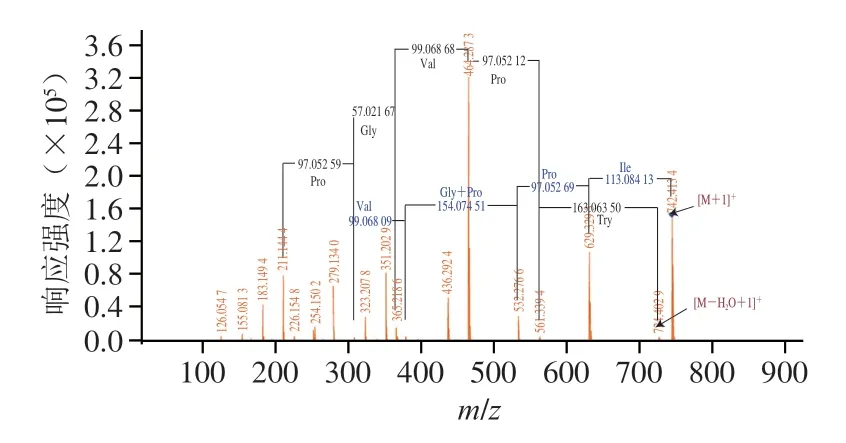
圖6 抗氧化肽SHP-1氨基酸序列分析MS/MS譜圖Fig.6 MS/MS spectrum showing amino acid sequence of SHP-1
2.8 抗氧化肽數據庫比對分析
利用蛋白數據庫比對,是研究蛋白或肽類物質最快捷、有效的方法,可以為研究人員提供復雜的代謝路徑,又可以單一確定某一種類和某一個蛋白。根據質譜結果表明,在N端的數據是由兩個氨基酸總和得出。因此,無法判斷兩個氨基酸的排序,將質譜數據輸入Millspectrum數據庫中進行對比。
由表2可知,SHP-1屬于大豆球蛋白G4,同屬于大豆蛋白11S系列。序列比對結果表明SHP-1的序列為IPPGVPY,比對后的分子質量和偏差分子質量與實際測定SHP-1的分子質量吻合。因此,可以將對比后的序列認定為SHP-1的序列。生物活性肽數據庫可以幫助研究人員快速確定物質屬性,目前開放性的生物數據庫有BIOPEP(http://www.uwm.edu.pl/biochemia/index.php/pl/biopep)、PEPBANK(http://pepbank.mgh.Harv ard.edu/)、FeptidDB(http://www4g.biotec.or.th/FeptideDB/)和Brainpeps(http://brainpeps.Ugent.be/)。Girgih等研究水解大麻籽蛋白,通過數據庫比對最終獲得兩種抗氧化肽(氨基酸序列分別為WVYY和PSLPA)。Lassoued等采用肽類組學研究水解魚膠蛋白,確定20 種抗氧化肽,分子質量為417~1 809 Da,氨基酸數量為5~21 個。頡宇等利用BIOPEP數據庫模擬不同蛋白酶的酶解工藝,實驗確定最佳條件后,獲得新型抗氧化肽(氨基酸序列為LDEPDPL)。由此看出,未來肽類的研究離不開肽類物質數據庫,特別是二肽、三肽等小分子肽的研究中,數據庫可以幫助研究人員更快發展新物質和整合物質特性。

表2 SHP-1蛋白數據庫比對結果Table 2 Results of comparison of SHP-1 to protein database
3 結論
在前期堿性蛋白酶酶解大豆蛋白的最佳條件下,依次采用HiTrap Q HP強陰離子交換柱,HiTrap DEAE-FF弱陰離子交換柱以及制備液相方法將獲得的抗氧化活性肽分離純化,最終獲得高純度的抗氧化肽SHP-1。通過LC-MS/MS測定抗氧化肽SHP-1分子質量為741.41 Da。氨基酸分析儀對SHP-1抗氧化肽的組成進行分析,抗氧化肽SHP-1是由5 種氨基酸組成。LC-MS/MS對抗氧化肽SHP-1二級質譜圖解譜以及大豆蛋白數據庫比對,抗氧化肽SHP-1氨基酸序列為IPPGVPY。SHP-1來自于大豆球蛋白G4亞基。

