蝦青素DHA單酯對脂多糖誘導炎癥反應的保護作用
伍露露,王曉旭,羅京義,李藝洋,王志高,徐 杰,薛長湖
(中國海洋大學食品科學與工程學院,山東 青島 266003)
炎癥反應是人類免疫系統的重要生理反應過程,可保護身體免受刺激并恢復受損的組織結構和功能。然而,過度和不受控制的炎癥反應會誘發各種慢性病和機體紊亂,包括糖尿病、癌癥、心血管疾病、關節炎、自身免疫性疾病和炎癥性腸病等。近年來,炎癥是生物醫學研究人員關注的主要研究領域之一。
脂多糖(lipopolysaccharide,LPS)是革蘭陰性菌細胞壁中特有的成分,適量的LPS能夠激發機體的免疫反應,濃度過高則會引起強烈的炎性反應,促使炎性因子大量分泌,使其成為多種炎癥模型構建的首選誘導劑。蝦青素(3,3’-二羥基-,’胡蘿卜素-4,4’-二酮基)是類胡蘿卜素中唯一一種能夠穿透血-腦屏障和血-視網膜屏障的活性物質。研究表明,蝦青素具有抗炎、抗癌、抗衰老、增強機體免疫力和降低氧化損傷等生理功能。自然界中的蝦青素以游離態、單酯或雙酯的混合形式存在。二十二碳六烯酸(docosahexaenoic acid,DHA)是-3多不飽和脂肪酸,對胎兒大腦及視力的發育和成人神經系統的正常運作十分重要。游離DHA可以通過結合并激活質膜受體和胞質受體來調節炎癥。本課題組前期采用體外和體內消化模型研究了14 種不同分子結構蝦青素酯的穩定性和生物利用度,結果表明具有長鏈和飽和脂肪酸的蝦青素酯比其他類型的蝦青素酯更穩定,蝦青素單酯的生物利用度高于游離蝦青素(free astaxanthin,F-Asta),蝦青素DHA單酯(astaxanthin DHA monomer,AST-DHA)在14 種蝦青素酯中具有最高的生物利用度,這種新型活性物質可能在機體內發揮蝦青素和DHA的協同作用。
小膠質細胞(BV2細胞)被證明是中樞神經系統的固有免疫細胞,響應中樞神經系統疾病,特別是神經炎癥相關疾病的病理刺激。近年來,斑馬魚疾病模型廣泛應用于生命科學的各個領域,如免疫學、腫瘤學、神經科學等。斑馬魚因其生命周期短、繁殖率高、易于飼養,且胚胎的光學透明性可以對體內炎癥進行無創動態成像,被公認是有效的體內抗炎實驗模型。本實驗主要利用以上兩種模型探究AST-DHA抗炎活性。
1 材料與方法
1.1 材料與試劑
BV2細胞 中國科學院上海生化與細胞研究所;合成蝦青素(純度10%) 浙江巴仕曼生物科技有限公司;DHA(純度80%) 中國海洋大學食品科學與人類健康實驗室制備;野生型斑馬魚(AB品系)國家斑馬魚資源中心;LPS、2’,7’-二氯二氫熒光素二乙酸酯(2’,7’-dichloro-dihydrofluorescein diacetate,DCFHDA)、3-乙氧酰基苯胺甲磺酸鹽(ethyl 3-aminobenzoate methanesulfonate,MS222) 上海阿拉丁生化科技公司;活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)測定試劑盒 南京建成生物工程研究所;總RNA提取試劑盒 美國Bio Tek公司;EvaGreen qPCR Master Mix試劑盒 加拿大ABM公司;胎牛血清-培養基 美國Gibco公司;Griess試劑 北京索萊寶科技有限公司。
1.2 儀器與設備
斑馬魚養殖設備 上海海圣生物實驗設備有限公司;HF90/HF240 CO培養箱 上海力新儀器有限公司;LRH-70恒溫恒濕培養箱 上海一恒儀器有限公司;PZMIII體視顯微鏡、PV830斑馬魚顯微注射系統 美國WPI公司;Ti2-E熒光顯微鏡 日本Nikon公司;iCycler iQ5系統實時熒光定量聚合酶鏈式反應擴增儀、680型酶標儀 美國Bio-Rad公司;超微量分光光度計 美國Thermo Scientific公司。
1.3 方法
1.3.1 F-Asta和AST-DHA的制備
參考楊魯等方法,以DHA與蝦青素作為反應底物合成AST-DHA,具體反應條件為蝦青素250 mg、DHA 282 mg、無水丙酮5 mL、4-二甲氨基吡啶100 mg、1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽100 mg,充氮后避光并進行磁力攪拌,在25 ℃反應3 h。合成的產物通過硅膠柱純化后,用C色譜柱進行梯度洗脫,流動相為甲醇和甲基叔丁基醚,采用高效液相色譜-質譜法對純化后樣品進行分析,鑒定得到純化后F-Asta純度為(96.2±0.5)%,AST-DHA純度為(94.0±0.6)%。
1.3.2 細胞培養及形態觀察
BV2細胞培養于含有質量分數1%青霉素及鏈霉素的10%(質量分數,下同)胎牛血清-培養基中。細胞在37 ℃、5% CO下無菌培養。細胞以1∶4隔天傳代,以1×10個/mL孔接種于12 孔細胞培養板中,每孔接種0.5 mL,待細胞貼壁后,加入含質量濃度0、100、200、400 μg/mL LPS的2%胎牛血清-培養基培養24 h和48 h,顯微鏡下觀察細胞形態變化。
1.3.3 四甲基偶氮唑藍法檢測細胞存活率
BV2細胞以5×10個/mL接種于96 孔板中,每孔接種100 μL。待細胞貼壁后,加入含質量濃度0、100、200、400 μg/mL LPS的2%胎牛血清-培養基。持續孵育24 h或48 h后,棄去培養基,每孔加200 μL 3-(4,5-二甲基噻唑)-2,5-二苯基四氮唑溴鹽(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2--tetrazolium bromide,MTT)溶液(用質量濃度0.5 mg/mL、pH 7.4磷酸鹽緩沖溶液配制),繼續孵育4 h,終止培養,吸取并丟棄孔內培養上清液,每孔加100 μL酸化異丙醇(HCl濃度為1 mol/L,(鹽酸)∶(異丙醇)=1∶8),振蕩10 min,使結晶物充分溶解。在570 nm波長處測定吸光度。細胞存活率計算如公式(1)所示。

1.3.4 Griess法檢測細胞內NO產生量
采用Griess方法,取1.3.3節加入不同質量濃度LPS孵育24 h或48 h的細胞培養基上清液與Griess試劑等體積混合,反應5 min后,于550 nm波長處測定吸光度。以NaNO濃度為橫軸、吸光度為縱軸繪制標準曲線,根據NaNO標準曲線計算培養基上清液中NO產生量。標準曲線方程為=0.072+0.048(=0.997),線性關系良好,以NaNO濃度表征NO產生量。
1.3.5 LPS誘導的炎癥細胞模型及實驗分組
炎癥細胞模型蝦青素干預實驗分成4 組:空白對照組、模型組、F-Asta組和AST-DHA組。用質量濃度400 μg/mL LPS處理BV2細胞48 h構建炎癥細胞模型;模型組、F-Asta組和AST-DHA組均用LPS處理,同時F-Asta組和AST-DHA組分別添加終質量濃度200 ng/mL的F-Asta和AST-DHA。
1.3.6 斑馬魚胚胎的獲得及實驗分組
斑馬魚成魚養殖于循環水系統中,溫度控制在(28±1)℃,pH值控制在7.0±0.5,每天明/暗時間為14 h/10 h。
選擇成年斑馬魚,雌魚與雄魚數量按照1∶1的比例置于配魚盒內,中間放置隔板,次日清晨抽去隔板,30 min后將魚卵收集于培養皿中,加入胚胎培養液,置于28 ℃恒溫培養箱中培養。
1.3.7 LPS誘導的斑馬魚炎癥及實驗分組
炎癥造模:將LPS粉末用斑馬魚胚胎培養液配制成質量濃度1 mg/mL的母液備用,實驗時將母液用培養液稀釋為質量濃度10、15、20 μg/mL的工作液。在斑馬魚胚胎發育至2 d(day post fertilization,dpf)自然破膜后,挑選發育正常的斑馬魚胚胎移入6 孔板中,每孔30 條,每個質量濃度組設3 個重復孔。模型組中預先加入5 mL不同質量濃度LPS溶液,空白對照組加入5 mL培養液。將給藥后的6 孔板放入28 ℃恒溫培養箱中,待其發育至3 dpf檢測胚胎體內ROS水平。
蝦青素干預實驗分組:分成4 組,空白對照組、模型組、F-Asta組和AST-DHA組。空白對照組在24 孔板中加入2 mL胚胎培養液;模型組、F-Asta組和AST-DHA組加入2 mL質量濃度15 μg/mL的LPS溶液。每組設置3 個重復孔,每孔30 條胚胎(2 dpf)。將給藥后的胚胎放入28 ℃恒溫培養箱中培養。
F-Asta和AST-DHA通過顯微注射的方式注射入受精后2 h(hour post fertilization,hpf)斑馬魚胚胎中,分別吸取10 μL質量濃度200 ng/mL的F-Asta和AST-DHA溶液于玻璃注射針中,注射液滴大小為2 nL。將2 hpf左右的斑馬魚胚胎排列擺放至瓊脂板上,在體視顯微鏡下進行注射。每個實驗組需注射約200 個胚胎。待胚胎發育至2 dpf,挑選健康的胚胎進行下一步實驗。
1.3.8 體視顯微鏡觀察胚胎發育情況
在各組胚胎發育至72 hpf時,體視顯微鏡下觀察胚胎畸形情況,按式(2)計算畸形率。

1.3.9 免疫熒光分析ROS水平
將3 dpf斑馬魚胚胎轉移至24 孔板中,每孔5 條胚胎,用2 mL熒光探針染料DCFH-DA溶液(質量濃度5 μg/mL)處理,在28.5 ℃避光孵育1 h。將胚胎用胚胎培養液沖洗3 次,并在觀察前用體積分數0.016% MS222將斑馬魚胚胎麻醉。在熒光顯微鏡下觀察并拍照,使用Image J圖像處理軟件分析熒光成像圖片并計算平均熒光強度,ROS水平以平均熒光強度表示。
1.3.10 MDA含量測定
待胚胎發育至4 dpf時,從每組中取10 個斑馬魚胚胎,用磷酸鹽緩沖溶液洗滌3 次,按照試劑盒說明書要求測定胚胎MDA含量,結果以蛋白計,重復3 個平行。
1.3.11 實時熒光定量聚合酶鏈式反應測定促炎因子的表達
按照試劑盒說明書提取BV2細胞和斑馬魚的總RNA,用超微量分光光度計測定不同實驗組RNA濃度;參照反轉錄試劑盒說明書步驟反轉錄為cDNA;以cDNA為模板,加入相關引物進行實時熒光定量聚合酶鏈式反應(quantitative polymerase chain reaction,qPCR),擴增各目的基因。擴增結束后,分別以和為內參基因,用2相對定量法計算各基因的相對表達量。引物序列如表1所示。

表1 qPCR的基因引物Table 1 Gene-specific primers for qPCR
1.4 數據處理與分析
所有實驗至少重復3 次,結果以平均值±標準差表示。用GraphPad Prism 8.0軟件作圖并進行統計學分析,多組數據之間統計學差異分析采用單因素方差分析,<0.05被認為有顯著性差異。
2 結果與分析
2.1 AST-DHA對BV2細胞炎癥的作用
2.1.1 LPS對細胞形態、細胞存活率及NO產生量的影響
用質量濃度0、100、200、400 μg/mL的LPS處理BV2細胞24 h和48 h,觀察BV2細胞形態,細胞活力及NO產生量的變化,由此確定構建BV2細胞炎癥模型的LPS質量濃度。由圖1A可知,加入不同質量濃度LPS培養48 h,空白對照組和質量濃度100 μg/mL LPS組細胞形態正常,多為小的圓形或具有長的突觸。而LPS質量濃度達到200 μg/mL時,細胞胞體明顯變大,突觸變短。LPS質量濃度400 μg/mL時細胞狀態改變更加明顯。由圖1B可知,100 μg/mL以上LPS誘導BV2細胞48 h可以極顯著降低細胞存活率(<0.01),與空白對照組相比,細胞存活率下降了約50%。而各質量濃度LPS誘導24 h后細胞存活率均與空白對照組無顯著差異(>0.05)。NO是炎癥進程中的重要信使,與免疫調節作用密切相關。由圖1C可知,在質量濃度100、200、400 μg/mL LPS誘導BV2細胞48 h,其NO產生量與空白對照組相比極顯著升高(<0.01)。質量濃度100 μg/mL和200 μg/mL LPS處理24 h時,細胞NO產生量與空白對照組相比變化不顯著(>0.05)。綜合上述結果,后續實驗用質量濃度400 μg/mL LPS處理BV2細胞48 h構建炎癥細胞模型。


圖1 LPS誘導BV2細胞炎癥模型的建立Fig. 1 Establishment of BV2 cell model of LPS-induced inflammation
2.1.2 AST-DHA對BV2細胞炎癥因子表達水平的影響
細胞中促炎因子表達水平的上升會加速細胞炎癥的進展。常見的促炎因子有TNF-α和IL-1β。由圖2可知,模型組中和表達水平均高度顯著高于空白對照組(<0.000 1、<0.001),分別約為對照組的1.5 倍和1.4 倍,而AST-DHA組和mRNA相對表達量接近于空白對照組,說明AST-DHA顯著降低了LPS誘導的BV2細胞中炎癥因子的表達水平(<0.001、<0.01),F-Asta對細胞中的表達作用效果不顯著(>0.05)。結果表明,AST-DHA能夠下調炎癥細胞中炎癥因子的表達水平,對LPS誘導的細胞炎癥具有改善作用。

圖2 AST-DHA降低BV2細胞中炎癥因子mRNA表達水平Fig. 2 Astaxanthin DHA monoester decreased the mRNA expression of inflammatory factors in BV2 cells
2.2 AST-DHA對LPS誘導的斑馬魚炎癥的保護作用
2.2.1 LPS誘導斑馬魚炎癥模型的建立
ROS通常是壽命短活性高的小分子,包括氧衍生的自由基,如超氧陰離子自由基和羥自由基等。體內高水平的ROS可以誘導氧化應激反應,導致各種細胞或組織損傷。將斑馬魚胚胎暴露在質量濃度0、10、15、20 μg/mL的LPS中,染色后,熒光顯微鏡下檢測ROS水平。圖3結果顯示,用LPS處理斑馬魚胚胎后,當質量濃度達到15 μg/mL時綠色熒光強度最強,與空白對照組相比染色效果最明顯,后續實驗采取該質量濃度LPS處理斑馬魚胚胎建立炎癥模型。

圖3 不同質量濃度LPS誘導的炎癥斑馬魚胚胎體內ROS熒光圖(4×)Fig. 3 Fluorescence images of ROS in zebrafish embryos with inflammation induced by different concentrations of LPS (4 ×)
2.2.2 AST-DHA對炎癥斑馬魚胚胎發育畸形的調節作用
斑馬魚具有胎身透明的特點,因此其發育過程在顯微鏡下清晰可見。在體視顯微鏡下觀察到正常發育至48 hpf的斑馬魚胚胎(圖4A)和經LPS誘導各組典型的發育陰滯胚胎(圖4A)。發育陰滯的情況有卵黃囊水腫、尾部發育不全、眼部發育不全和脊索畸形等。如圖4B所示,模型組畸形率是空白對照組的2 倍多,F-Asta組和AST-DHA組斑馬魚胚胎畸形率與模型組相比高度顯著下降(<0.001、<0.000 1),尤其是AST-DHA組,其畸形率接近于空白對照組。以上結果表明,AST-DHA對炎癥斑馬魚胚胎的發育具有保護作用。

圖4 AST-DHA對炎癥斑馬魚胚胎畸形率的影響Fig. 4 Effect of astaxanthin DHA monoester on the rate of embryo malformation in zebrafish with inflammation
2.2.3 AST-DHA對斑馬魚體內ROS水平的影響
如圖5A所示,注射AST-DHA的斑馬魚熒光強度明顯低于模型組。進一步采用Image J軟件分析熒光成像圖像并計算平均熒光強度。如圖5B所示,與模型組相比,F-Asta和AST-DHA均能有效抑制炎癥斑馬魚體內ROS的產生(<0.001、<0.000 1)。AST-DHA組斑馬魚的ROS水平較F-Asta組極顯著降低(<0.01),其ROS水平接近于空白對照組。以上結果表明AST-DHA較F-Asta具有更好的降低炎癥斑馬魚體內ROS產生量的效果。

圖5 AST-DHA對炎癥斑馬魚胚胎體內ROS水平的影響Fig. 5 Effect of astaxanthin DHA monoester on ROS levels in zebrafish embryos with inflammation
2.2.4 AST-DHA對斑馬魚胚胎體內MDA含量的影響
體內MDA水平常用來反映過氧化程度,反映機體清除氧自由基的能力。由圖6可知,模型組與空白對照組相比,斑馬魚胚胎體內MDA含量高度顯著上升(<0.000 1),約為對照組的2.5 倍。與模型組相比,AST-DHA和F-Asta均能高度顯著減少炎癥斑馬魚胚胎體內MDA含量(<0.000 1),且AST-DHA組MDA含量的下降較F-Asta組更明顯(<0.01)。結果表明,LPS的暴露會導致斑馬魚胚胎體內過氧化物MDA含量增加,AST-DHA可以緩解這種應激狀態。

圖6 AST-DHA對炎癥斑馬魚胚胎體內MDA含量的影響Fig. 6 Effect of astaxanthin DHA monoester on MDA content in zebrafish embryos with inflammation
2.2.5 AST-DHA對斑馬魚體內炎癥因子的調節作用
由圖7可知,LPS處理后斑馬魚胚胎體內促炎因子和水平較空白對照組極顯著升高(<0.01)。F-Asta對mRNA表達水平無顯著作用(>0.05),但能顯著降低mRNA表達(<0.05);AST-DHA能顯著降低和的表達水平(<0.01、<0.05)。結果表明,蝦青素對LPS誘導的斑馬魚胚胎炎癥反應有改善作用,并且AST-DHA較F-Asta下調炎癥因子的效果更好。
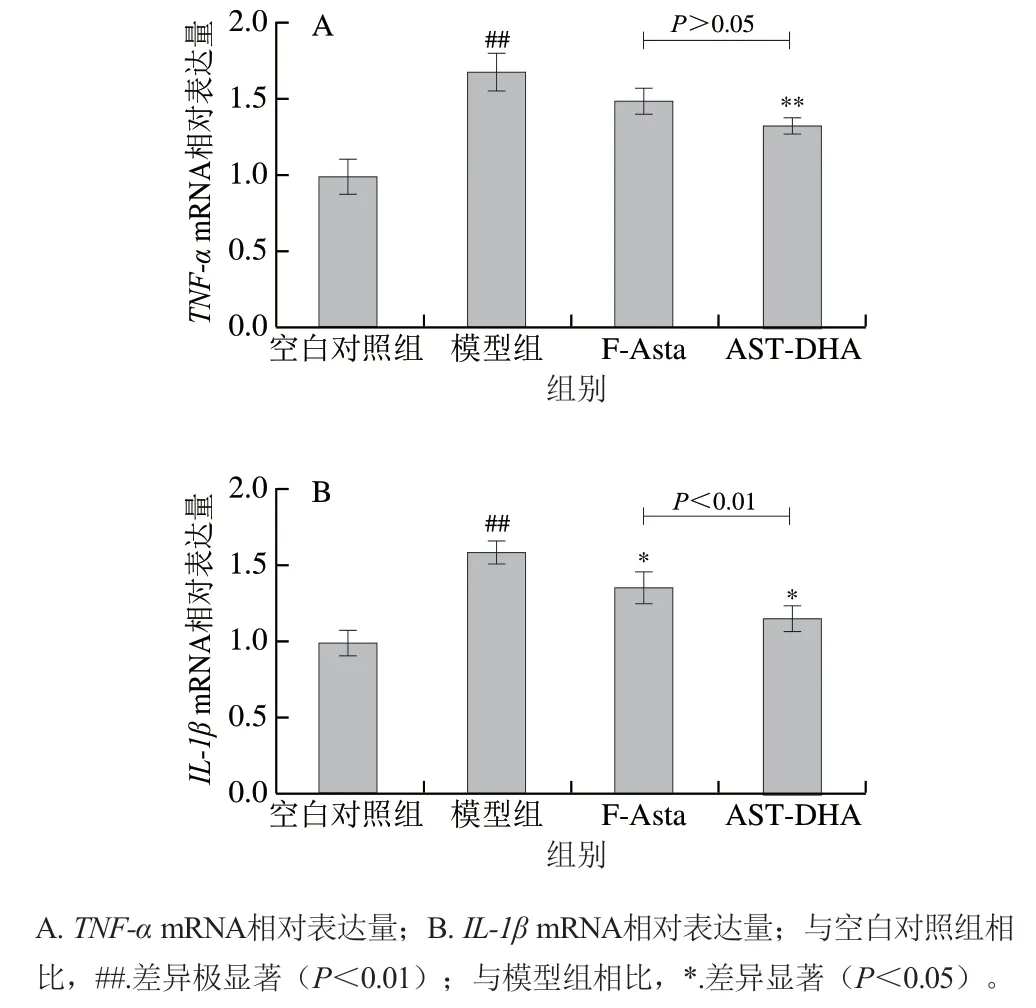
圖7 AST-DHA對炎癥斑馬魚胚胎體內炎癥因子表達水平的影響Fig. 7 Effect of astaxanthin DHA monoester on the expression of inflammatory factors in zebrafish embryos with inflammation
3 討 論
蝦青素是一種具有抗氧化特性的類胡蘿卜素,可作為食品補充劑使用,它是一種親脂化合物,生物利用度低,與其他類胡蘿卜素類似。F-Asta和蝦青素酯均具有很強的生物學活性。Rao等發現,相比于F-Asta,蝦青素酯的抗癌活性更強,認為蝦青素酯在生物體內具有更優的生物利用度。Kamath等對蝦青素單/雙酯、F-Asta的單線態氧猝滅能力進行了比較,表明相對于其他實驗組蝦青素酯具有更好猝滅能力。本課題組前期考察了脂質基質效應對蝦青素酯生物利用度的影響,發現長鏈脂肪酸含量的增加有利于蝦青素酯生物利用度的提高,在此基礎上合成了AST-DHA并優化了反應條件。
斑馬魚具有與人類相似的形態和生理功能,被廣泛應用于藥理學研究。目前研究表明,斑馬魚的免疫系統與人類有著很高的相似度,幾乎所有的人類免疫系統細胞在斑馬魚中均存在。本實驗中利用斑馬魚胚胎身體透明的特點,觀察斑馬魚胚胎發育過程并通過活體染色來監測體內ROS水平變化。巨噬細胞、中性粒細胞和嗜酸性粒細胞通過產生ROS以破壞入侵的細菌和病毒顆粒,因此ROS可被認為是炎癥反應強度的指標。體內產生過量的ROS可能導致細胞和組織損傷。抑制ROS過度產生可以有效陰止炎癥反應的進展,這種抑制可以被視為潛在的抗炎藥物開發目標。本實驗結果說明LPS可引起斑馬魚的炎癥反應并促進ROS生成,而F-Asta和AST-DHA可減少斑馬魚體內ROS產生量,表現出良好的抗炎活性,AST-DHA降低ROS水平的效果更優于F-Asta。
炎癥反應是體內常見的生物反應過程,可促進激活巨噬細胞等炎癥細胞釋放腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和白細胞介素(interleukin,IL)-1β等促炎癥因子。TNF-α是體內重要的早期炎癥反應生物標志物,可提高對中性粒細胞的吞噬作用,促進IL-1β等促炎因子的產生,刺激局部炎癥反應。過量的TNF-α可誘導生成線粒體ROS,導致分枝桿菌和受感染的巨噬細胞程序性壞死。IL-1β是一種強效促炎性細胞因子,可誘導合成前列腺素,活化免疫細胞,促進成纖維細胞的增殖。研究表明,體外和體內毒物會增加斑馬魚體內TNF-α和IL-1β的表達水平。本研究發現,細胞和斑馬魚模型中AST-DHA組的炎癥應激反應較模型組顯著降低,效果優于F-Asta組。
4 結 論
本研究利用不同質量濃度LPS處理BV2細胞和斑馬魚,通過對體內外模型生化指標的檢測、染色結果的觀察以及qPCR檢測,確定了AST-DHA對LPS誘導的炎癥的保護作用,且AST-DHA較F-Asta表現出更好的抗炎活性,這可能得益于蝦青素與DHA的協同作用,為AST-DHA生物活性的研究和相關功能性食品的開發提供理論依據。

