CRISPR專利爭奪的啟示
朱雅姝
安礫
2020年的諾貝爾化學獎授予了CRISPR基因編輯技術及其發明者,也由此將長達10年之久的CRISPR專利爭奪戰推到了大眾視野之中。CRISPR基因編輯技術是一項典型的源自科研院校基礎研究的成果,在其科技成果轉化過程中出現的專利紛爭,揭示了美國院校及發明人的專利運營策略。通過盡可能詳盡的資料調研,可以了解到其中涉及的專利申請、全球布局、競爭保護等直接影響成果轉化成敗的因素,從而為我國優化基礎科研成果轉化路徑帶來重要的啟示和借鑒意義。
前言
基于CRISPR系統的基因編輯技術無疑是目前生物技術領域最具革命性的突破。這個被稱為“基因魔剪”的技術,在被發明還不到10年之后就獲得了2020年諾貝爾化學獎。
但是,在CRISPR領域迅猛發展的同時,CRISPR技術發明人之間的專利糾紛也鏖戰多年。一方是哈佛大學和麻省理工學院博德研究所(Broad Institute)的張鋒團隊(以下簡稱張鋒團隊),另一方是加州大學伯克利分校、維也納大學和埃馬紐埃爾·卡彭蒂耶(Emmanuelle Charpentier)的團隊(以下簡稱CVC團隊),CVC團隊中的核心成員Jennifer Doudna和Emmanuelle Charpentier正是諾獎獲得者。雙方自2013年起均基于該技術創立了多家公司,并對全球其他不同應用領域的公司有多方授權,所創公司多數已上市,專利戰也由此開始。雙方專利戰的最終結果不僅直接影響所創企業的市值,而且會影響已經獲得部分授權的公司是否構成侵權,或者其他公司需要向誰支付專利許可費用等商業利益。
這場事關百億美元市場的糾紛已經持續了10年之久。在歐洲,CVC團隊暫時處于上風,張鋒團隊屢屢受挫;但在北美張鋒團隊獲勝,2022年2月28日美國專利和商標局(USPTO)裁定張鋒團隊擁有在真核細胞中使用CRISPR基因編輯技術的專利。這也意味著CVC團隊失去了該技術在最重要的應用領域的專利優先權,即無法應用于醫療、育種等真核生物領域。而且,從CVC團隊獲得專利許可的公司有可能要重新考慮向張鋒團隊申請授權。
CRISPR的專利之爭是一場非常典型的涉及學院派科技成果轉化過程的專利紛爭,其中包含了專利競爭策略、專利布局戰略、專利申請模式和專利運營模式的信息。其發明人所創立的成果轉化公司經歷融資、上市甚至并購,成果轉化模式也清晰明確。在此,本文會對CRISPR技術研發和全球專利現狀進行簡要的全景概覽,重點對兩大團隊的專利糾紛過程進行分析對比,解析其專利運營模式和競爭策略,提煉關鍵因素或借鑒方案,以期為基礎研究領域新技術成果的轉化應用帶來有價值的啟發。
CRISPR技術的背景概述
科學技術相關發明專利的申請離不開科學原理的發展,通過對研究歷程的路徑梳理,可以更清晰地看到科技成果的專利化運營思路。值得注意的是,通過對全球專利態勢的研究,可以看到我國在專利運營和布局策略上的不足,也從而為進一步增強我國科技成果轉化實力指引努力的方向。
基因編輯的概念及CRISPR技術的意義
科學家們探索生命運行機制時,需要修改細胞中的基因進行分析研究,被稱之為基因編輯(Gene Editing),即對生物體基因組特定目標基因進行修飾的基因工程技術或過程,可以實現對目標基因的敲除、插入和突變校正。早期的基因編輯技術包括:同源重組、鋅指核酸酶(ZFNs)、轉錄激活樣效應因子核酸酶(TALEN)等;但由于這些技術精準度不夠,操作復雜、效率低,而限制了其廣泛的商業化應用。
2012年基因編輯出現革命性突破——CRISPR/Cas9系統技術被證明在試管中能夠精確切割DNA,成功編輯基因組,使得科學家們能在幾周內精準改變生命密碼。正如諾貝爾化學委員會主席克拉斯·古斯塔夫森所說:“這種基因工具擁有強大的力量,影響我們所有人。它不僅使基礎科學發生了革命性的變化,而且制造出了新奇的作物,并將催生開創性的新療法來治愈很多疾病。”因此,自2012年被發明以來,CRISPR系統技術備受資本市場矚目,相關專利權的歸屬爭奪決定著資本各方的直接利益。
CRISPR專利全球態勢概況
第一,專利保護具有嚴格的地域性特點。地域性是專利保護最重要的特質之一,即各國主管機關依照其本國法律授予的知識產權,只能在其本國領域內受法律保護。如果專利權人希望在其他國家享有專利保護權,就必須依照其他國家的相關法律另行提出專利申請。所以兩大團隊在美國提出專利申請的同時也在歐洲提交申請。專利糾紛也分屬兩個地域,并須依據當地法規進行裁定。
第二,近年全球CRISPR/Cas9相關專利數量突飛猛進。隨著近10年的研發,以CRISPR技術體系申請的相關專利數量飛速增加。2006年最早開始出現CRISPR/Cas9的專利申請,但直至2012年底之前,有關專利均不涉及基因編輯領域的應用。2012年開始,CVC團隊和張鋒團隊相繼在歐美申請了CRISPR系統用于基因編輯領域的專利,自此,全球CRISPR/Cas9基因編輯技術專利數量呈現爆發性的增長,并且在之后幾年里持續走高(見圖1)。2013—2016年間全球相關專利申請數量達到年均增長率89%,2019年達到頂峰。基于incoPac數據,截至2022年3月,全球共計申請數量6936件。
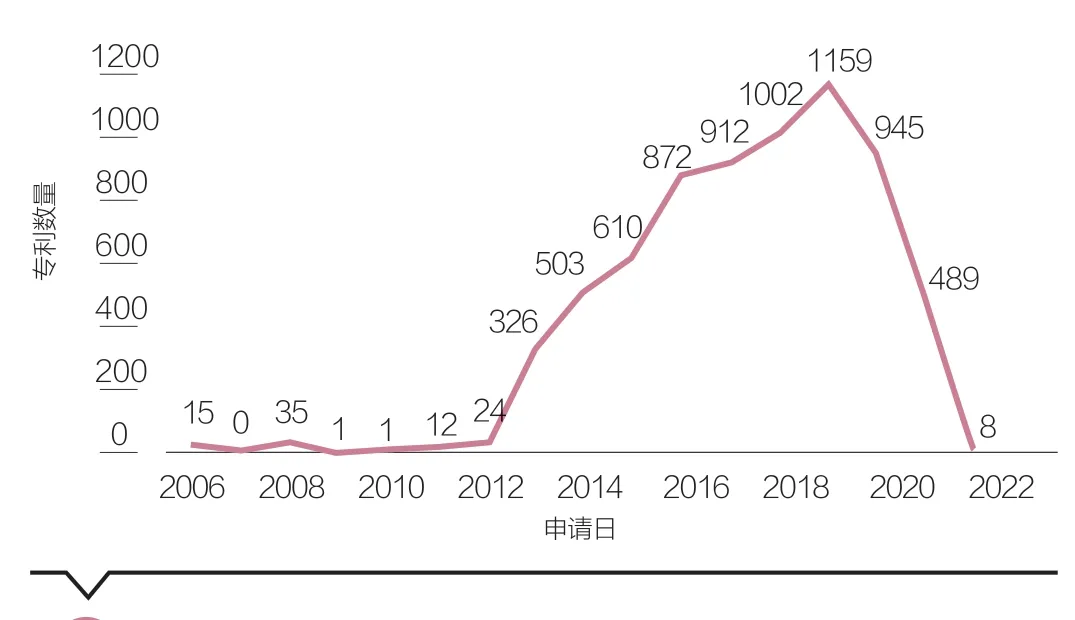
圖1 2003—2022年CRISPR/Cas9相關專利申請數量變化趨勢
兩大團隊在該領域占據主導地位并且競爭激烈。通過分析申請人可見,美國為主要申請人所在地區,全球申請數量位列前三名的分別是博德研究所、麻省理工學院、哈佛大學,均屬于張鋒團隊,并多為共同申請,三者合作緊密度極高。第4位的Editas Medicine公司由張鋒-George Church創立。第13、14位的Caribou Biosciences、CRISPR Therapeutics公司由CVC團隊的Jennifer Doudna和Emmanuelle Charpentier分別創立(見圖2)。
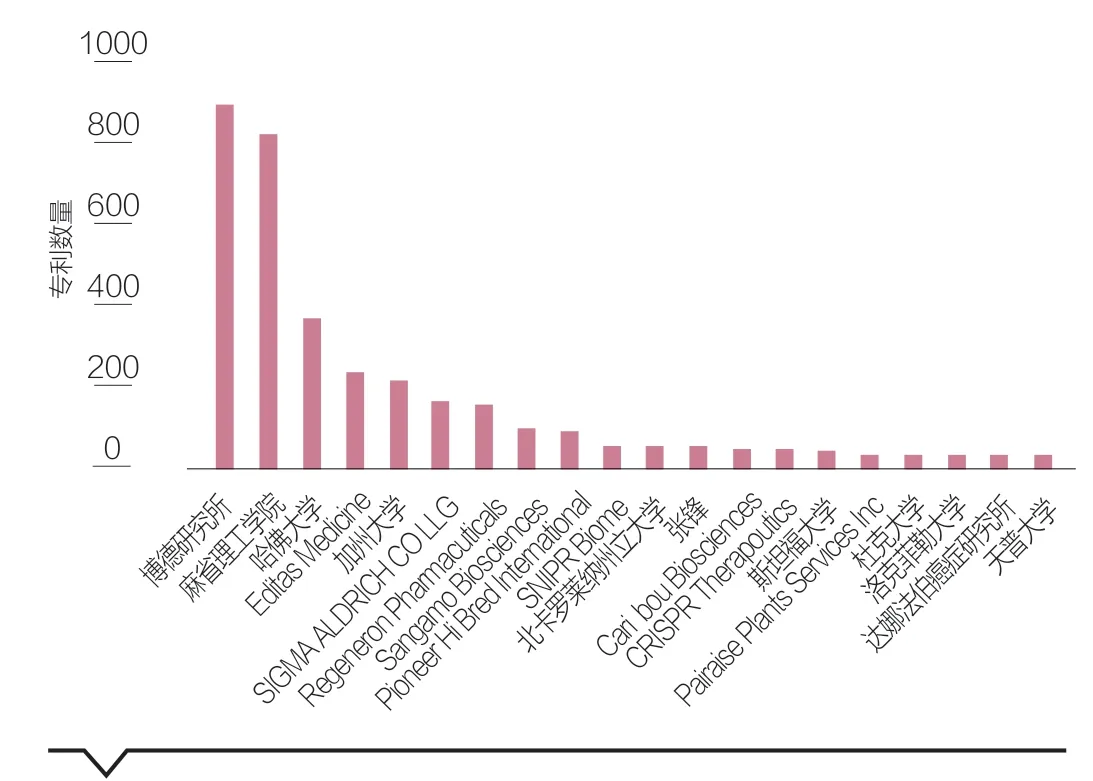
圖2 全球CRISPR/Cas相關專利申請數量TOP20
國際大型企業對新技術領域的專利布局極為重視。圖2中除了兩大專利競爭團隊成員(院校、個人及其創業公司)之外,最典型的就是幾家國際大型企業了。如位于前十的申請人就有:Sigma-Aldrich(著名的全球化學及農業領域的美國企業)、再生元制藥(Regeneron Pharmacuticals,是一家美國的全球性生物制藥公司)和Pioneer Hi Bred(源自美國陶氏杜邦的一家全球種業公司),它們的2021財年全球銷售額都在百億美元以上。而這三家企業所覆蓋的商業領域,正是CRISPR基因編輯技術的典型應用場景——農業、合成化學、醫療。可見作為全球性的大型企業,在新興科技領域的技術跟蹤、專利布局上都有著極其敏銳的嗅覺和極快的執行速度。
我國在全球該領域專利申請數量中的占比越來越大。隨著我國在基因編輯領域的科研實力與知識產權保護意識不斷增強,國內專利申請數量緊追而上。基于PatSnap數據,截至2022年3月全球申請人中,我國排名前十的申請人主要包括:中國科學院遺傳與發育生物學研究所為首,以小麥農業安全生產等遺傳育種研究為主;其次為中國農業大學、北京大學、博雅輯因(北京)生物科技有限公司、山東舜豐生物科技有限公司、華中農業大學、上海科技大學、江南大學、百奧賽圖(北京)醫藥科技股份有限公司、中國農業科學院作物科學研究所等。我國專利在技術上著重于其產業化領域的應用,其中農業育種領域的應用占有較大比重;專利權人之間的研發合作較少;專利出海布局的更少。
美國是全球該領域關注度最高的技術爭奪市場,我國是最重要的專利布局國家之一。截至2022年5月的incoPat全球專利優先權國別分析:美國以2904件位居第一;中國受理量排位第二,達到了613件;歐洲專利局以215件位列第三。由于我國在醫療、農業、工業等應用領域擁有著巨大的市場,外國申請人從一開始就注重全球化布局,占據我國專利池優勢。2013年我國在CRISPR/Cas9基因編輯領域的35件專利申請中,就有23件來自國外機構與企業。其中,美國是最重視全球專利布局的國家,截至2019年國外在中國申請CRISPR相關專利最多的是美國,專利申請量為591項,占國外在我國申請專利總數的73%。
綜上,CRISPR/Cas9編輯技術比較活躍的國家包括中國、美國、歐盟、日本等相關國家和地區,其中美國在該技術領域具有絕對的優勢和影響力,也可見美國基礎科學的創新能力之強大。CRISPR相關專利技術應用領域主要集中于醫學、農業和工業領域;其中,醫學是最大的應用領域,其專利產出量約為工業和農業領域專利數量的總和。
從技術角度可以看到中國專利申請上的關鍵差距:其一,部分專利來源于其他國家在該領域的技術布局,而非我國自身的科技創新成果;其二,部分專利雖是我國科研成果,但側重于生物育種、醫療中的應用,而非基礎研究的開創成果,這部分可能涉及來自底層核心技術的基礎專利的許可。也意味著在未來商業化中,可能要依賴國外專利權人的專利進行實施,從而產生相關技術許可與轉讓費用。
兩大發明團隊之間的專利爭奪
CVC團隊在論文發表及專利申請的時間上均早于張鋒團隊,但專利授權時間晚于張鋒團隊,授權的技術內容有所不同。兩大團隊展開了長達十多年之久的專利爭奪戰,其重點在有關真核生物的應用方向上。
兩大競爭團隊的科學發現及核心專利申請狀況
CRISPR/Cas9系統被證明作為新一代的基因編輯工具而發表在國際頂級學術期刊的時間是2012—2013年。同期有三個科研團隊分別獨立發布了研究成果,相關核心技術的專利申請都是提前進行。
CVC團隊方面,成員包括:Emmanuelle Charpentier和加州大學伯克利分校的Jennifer A.Doudna。發表論文包括:2012年8月兩人合作在Science發表論文,首次闡述清楚了CRISPR/Cas9系統的基本原理(這是獲得諾獎級別的奠基性工作),并解析了crRNA:tracrRNA復合體與Cas9蛋白的基因編輯功能,證明了CRISPR/Cas9能夠作為新一代的基因編輯工具,只是其研究均是在細菌等原核生物上進行的。申請專利方面,最先在歐美申請,但美國授權時間晚于張鋒團隊,授權內容不同。
1)歐洲:2012年加州大學伯克利分校(CVC團隊)率先在歐洲專利局提交了將CRISPR/Cas9基因編輯技術用于無細胞(Cell-free)系統中的專利申請。歐洲專利局分別于2017年5月13日和2018年2月28日準許了不同保護范圍的授權。
2)美國:(申請號:13/842859)專利優先權日為2012年5月25日(在美國專利局最初的臨時申請日),申請日是2013年3月15日。同族專利在美國的專利授權時間更晚,為2018年6月19日,并且僅授權了基因編輯的方法,而涉及的RNA序列及復合物、實驗試劑盒的權利要求尚在審查中。
張鋒團隊方面,成員包括:哈佛大學-麻省理工學院博德研究所的張鋒、叢樂(張鋒學生)以及劉如謙(David R.Liu,化學生物學和治療科學項目主任)。發表論文方面,2013年1月3日,張鋒作為通訊作者,張鋒的學生叢樂作為第一作者在Science發表論文,介紹了如何將CRISPR基因編輯技術應用于小鼠與人類的細胞之中(這是首次證明真核細胞中可以應用CRISPR系統),并且證明了可以一次性利用幾段不同向導sgRNA來實現對基因組的多點精確操作,效率非常高。申請專利方面,在美國通過加速審查獲得優先授權,但在歐洲的申請被撤銷。
1)美國:博德研究所(張鋒團隊)在美國先提交了CRISPR/Cas9基因編輯技術在體外用于真核細胞的專利申請(申請號:No.8697359),其專利優先權日是2012年12月12日,申請日2013年12月12日。值得注意的是,張鋒的律師提出快速處理這項應用專利申請的要求,利用了“適用專利加速審查程序”,于2014年4月15日先被授予一項專利權(US201314054414A)。之后一年,相繼又批準了十多項專利申請。
2)歐洲:在歐洲提交的專利申請并不順利。2018年3月23日,歐洲專利局(EPO)的反對部門(OD)認為優先權要求無效,并因缺乏新穎性而撤銷了其專利。
George Church團隊方面,成員包括:哈佛大學醫學院的George Church(張鋒的博士后導師)和楊璐菡(George Church的學生,當年秋季畢業)。發表論文方面,2013年1月3日,George Church作為通訊作者,楊璐菡作為第一作者在Science雜志上發表論文,證明CRISPR系統可用于人類細胞基因組編輯(與張鋒同期,首次證明真核細胞中可以應用CRISPR系統)。申請專利方面,該團隊與張鋒團隊在之后的成果轉化中保持密切合作,既有共同申請專利也有共創公司,因而在之后的專利競爭中處于同一戰隊中。
兩大團隊專利權爭奪的焦點
自2015年起,兩大團隊為CRISPR/Cas9系統(包括真核細胞在內的)的基因編輯技術專利權歸屬展開激烈爭奪。由于專利法規有典型的地域性特點,在此對美國和歐洲的專利訴訟分別進行解析。僅基于已有的公開資料,通過技術和法理的梳理,可以揭示專利保護及布局策略的關鍵信息。
第一,美國地域的專利訴訟相對更為激烈和復雜。張鋒團隊在美國2014年起優先獲得授權。2015年起,CVC團隊在美國地域內提出專利訴訟,屢次敗訴。
專利爭議所涉及的法律依據包括:一是發明人先申請制。《美國專利法》中關于先完成人和先申請人的發明授予規定為“先申請制”,以專利申請日作為標準確定專利申請的順序,最先提出專利申請的人優先取得專利。如果兩人各自獨立完成了相同的發明并申請專利權,原則上應授權給申請日在先的發明人。
為確保公平,對于披露,設置了寬限期1年的時間規定,即發明人在其專利申請日的前1年之內所作出的披露不會使其喪失此項發明的專利;或者在其專利申請日的前1年之內發明人與他人均披露了此項發明,但發明人的披露行為早于他人的,同樣不影響發明人取得專利權。這一項特殊規定,使得公開披露發明內容不會影響到“新穎性”這一必要專利審查條件。在科研界,科學家通常都會發表學術論文以公開其學術發現。當兩位科學家各自獨立完成了相同的發明之后,都發表論文公開了各自的發明,而且都在公開一年之內申請專利,此時先公開者才可能被授予專利權。據此,美國實際執行的是發明人先申請制。
只看時間點的話:兩大團隊均是在發表論文前先申請專利,CVC團隊無論是論文發表時間還是專利申請日(優先權日)均早于張鋒團隊。
二是被授予專利還須滿足的實質性條件:非顯而易見性。《美國專利法》第103條規定了判斷具有非顯而易見性的條件,即要求保護的發明與現有技術之間存在差異,在申請日之前(《美國專利法》修改前為發明日前),該差異對于本領域內普通技術人員來講不是顯而易見的。這個差異是指技術層面上已經實現的差異。對非顯而易見性的判斷較為靈活,專利審查人員需要充分的專業知識,擁有一定的自由裁量空間。
對于張鋒團隊所申請專利的技術是否為其他普通技術人員無法顯而易見地掌握的,是否為無法顯而易見地從CVC團隊申請的專利中獲得,這就決定了能否認定張鋒團隊是一項新的發明。
爭議焦點方面:一是是否為同一發明。CVC團隊的專利是在細菌(原核生物)和體外Cell-free環境中應用CRISPR/Cas9技術系統進行基因編輯。張鋒團隊的專利是在小鼠和人類細胞(真核生物)中應用CRISPR/Cas9技術系統進行基因編輯。那么,從專業領域進行判斷和認定,CVC團隊的應用范圍是否包括了張鋒團隊的應用就至關重要了。為此,張鋒團隊提交了上千頁的材料(包括實驗記錄、對方公開場合的演講等)以舉證這是一項完全新的發明。
二是誰是發明的先完成人、先申請人。這一點的判斷是從屬于第一條認定為同一發明的,如果不是同一個發明也就不存在先后之爭了。但如果CVC團隊能證明張鋒的發明是本質上相同的,那么以先完成人和先申請人的優勢即可奪得專利權。
因此,CVC團隊在2015年首次訴訟時,認為兩者專利本質上屬于同一發明,而要求美國美國專利與商標局(USPTO)啟動沖突審查程序,以確定與CRISPR/Cas9系統相關的美國專利的所有權。所以,張鋒團隊如何舉證是至關重要的。
最新裁決:張鋒團隊是一項新發明的先申請人。2022年2月28日美國專利和商標局最終裁定:張鋒團隊擁有在真核細胞中使用CRISPR基因編輯技術的專利。裁定要點是,CVC團隊沒有證明他們是第一個在動物細胞中使用CRISPR的人,其最初論文只是描述了它在細菌中的用途。因此,張鋒團隊是這項發明(在真核細胞中使用CRISPR基因編輯技術)的先完成人和先申請人,并且這是一項有別于CVC團隊專利申請的新發明。
第二,歐洲地域的專利訴訟涉及國際專利的申請模式。CVC團隊在歐洲專利局2012年率先提交申請,并于2017年起獲得授權。2019年張鋒團隊提起上訴,但專利申請被撤銷。專利爭議所涉及的法律依據方面,涉及專利的海外布局策略,即選擇最適合的海外專利申請的方法和途徑,從而既高效又安全地獲得全球不同國家的專利授權。依據國際專利組織的公約,申請海外不同國家的專利有三種途徑:
直接申請途徑:直接向目標國家的專利主管機關遞交申請文件。由于準備材料煩瑣,流程緩慢,會出現被別人搶先申請的風險。因此國際上常用的是以下兩種方法。
《巴黎公約》途徑:通過《巴黎公約》向所須申請的國家遞交申請文件。
PCT途徑:通過PCT(Patent Cooperation Treaty,專利合作條約)途徑遞交申請文件。
不同途徑之間較為關鍵的是對優先權日的相關規定。但最終是否授予專利,依然由所進入的目標國國家專利法規及審查來決定。因此,在國際申請時,既要明確選擇申請途徑的策略,又要嚴謹準備以滿足國際申請條件和目標國法規規定。
爭議焦點方面,一是優先權是否有效,二是是否符合目標國專利法規。此處爭議焦點均取決于申請人在申請時是否嚴格遵循了所選國際申請途徑的法規,手續是否合規。張鋒團隊在歐洲的申請是通過PCT途徑進入的,其要求遵從美國臨時申請的優先權,以占據專利先申請制的優勢,并以此在2019年提出上訴。但是在2020年1月歐洲專利局的裁定中敗訴。因為,根據歐洲專利公約要求,通過PCT途徑的申請,在進入歐洲專利局審查階段時,要求必須前后兩個申請的申請人是一致的。但美國的一項申請中存在PCT申請中沒有提到的申請人。因此被歐洲專利局撤銷其專利申請。所以,未符合目標國專利法規的要求,成為敗訴的關鍵。
專利訴訟歷史關鍵事件方面,自2015年起,兩大團隊分別在歐洲和美國的專利局提出申訴。為便于比較和理解,關鍵信息列于表1。
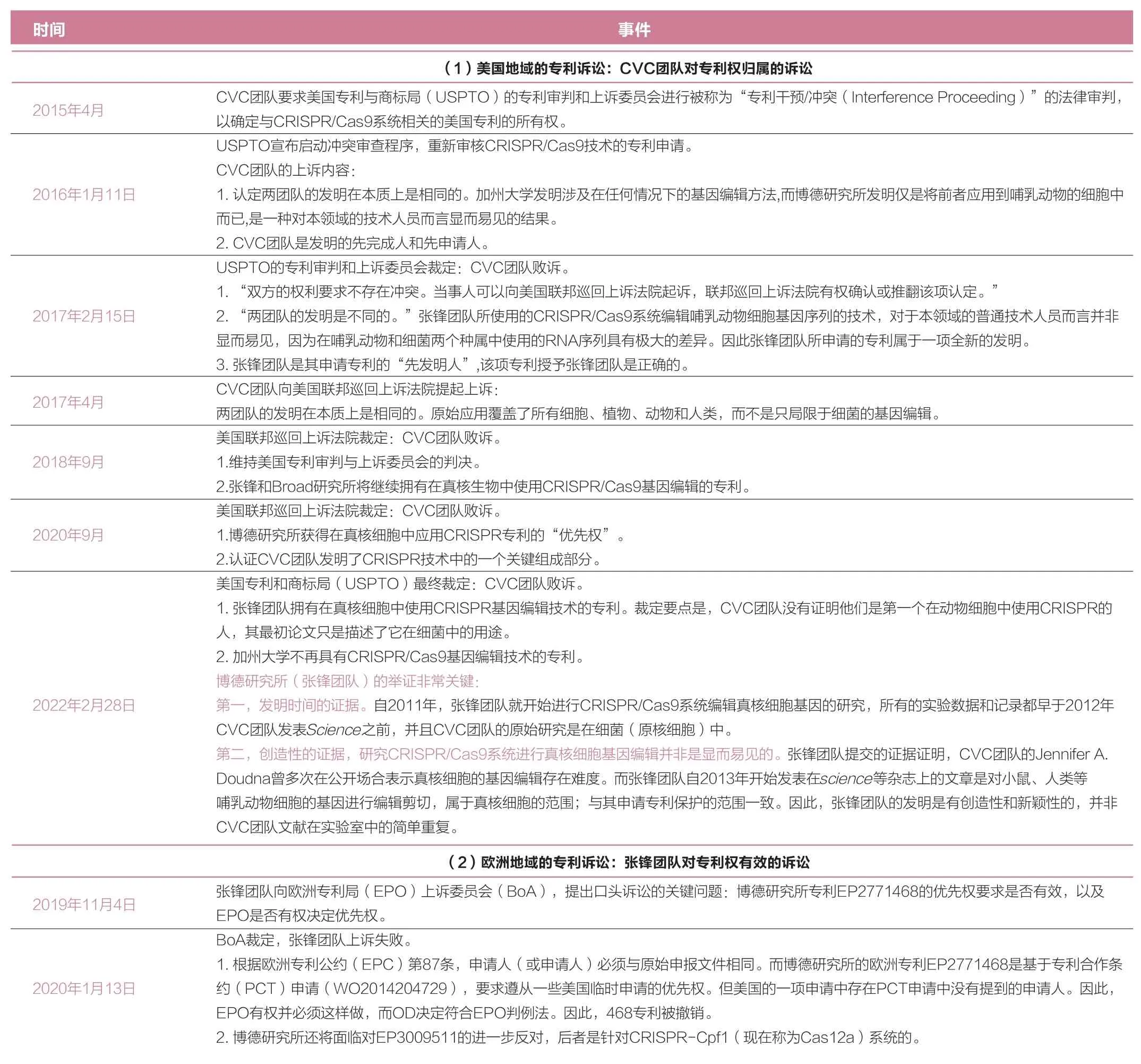
表1 專利訴訟歷史關鍵事件
可見,雙方團隊在CRISPR專利權持有領域中,各有勝負。張鋒團隊雖然獲得了美國地域的專利權,擁有了在真核細胞中使用CRISPR基因編輯技術的專利,但是在歐洲地域的專利申請未獲得任何有效進展。另一方CVC團隊在歐洲地域被授予了專利權,但在美國地域的專利訴訟中失敗,不再具有CRISPR/Cas9基因編輯技術在真核細胞中的專利。
專利訴訟結果對商業賽道的影響巨大
2022年2月28日的這一最新裁決對于國際基因編輯商業賽道的影響是巨大的。股市動蕩是最快速的效應之一,直接影響到由發明人創立的衍生公司。在此消息公布的隨后納斯達克周一盤后交易中,Editas Medicine公司(張鋒團隊創立)股價上漲了8.2%,而Intellia Therapeutics公司、Caribou Biosciences公司(CVC團隊創立)股價分別下跌了9.75%和8.8%。
更深遠的影響則是對已從CVC團隊獲得專利許可授權的在美運營的第三方公司,例如生物技術公司SAGE LABS、醫藥公司NOVARTIS以及CVC團隊自己創立的IntelliaTherapeutics、CRISPR Therapeutics等。他們將面臨無法在美國繼續應用該技術開發人類疾病治療、農業育種等方面的商業市場,并可能承擔巨大的已支付等專利許可費用的損失。為此,他們還必須與張鋒團隊再進行商談以確認是否可以再獲得相關領域的授權。
然而,CRISPR的專利糾紛并沒有終結,至今也沒有完勝的贏家。因為CRISPR基因編輯是一種平臺技術,在醫療上有廣泛的用途,這場糾紛很可能未來會以法律和解、交叉許可協議甚至專利池的形式結束。由于雙方仍有許多索賠和反訴懸而未決,這一問題可能需要數年時間才能完全解決。張鋒團隊在一份聲明中表示,他們愿意達成和解,并表示“所有機構應該共同努力,確保技術獲取的廣泛性、開放性,并繼續探索如何最好地實現這一點”。
專利糾紛的勝訴因素啟示
專利申請策略遵循時間優先原則
在科學論文發表和專利申請的時間點上都是盡早申請原則。但這二者之間的先后順序,需要考慮各地域專利法規對新穎性的評判標準(披露規則)。現實中,多以最嚴格的標準來執行,即申請專利在先,盡量不公開披露任何發明信息。由于美國2013年3月16日專利法的變更,使得這個時間點很容易成為一個關鍵性爭議節點。而由于CRISPR的文獻發表和專利申請恰巧跨越2012—2013年,因此在審查及后續訴訟爭議時會涉及兩種法規依據。很明顯,兩大團隊對其專利保護的策略均采取了國際上通行的從嚴標準——先申請,并盡早披露。可見,這樣的策略可為其后續對抗爭議建立一些可依據的法理基礎。
同時,需要熟悉專利法規的細則和操作方案,能夠在多團隊拼速的情況下,運用一些特殊規定申請加速專利審查流程,最早獲得授權。
專利布局策略須具有前瞻性對全球考量
專利保護涉及全球范圍,如何制定全球專利布局策略,規避未來的競爭風險,都是需要在專業人士的支持下盡早考慮的。本案例中,雙方團隊都利用了自己的地域優勢,分別優先在歐洲、美國申請;同時也都開展了全球申請策略,包括PCT申請。
在申請時就需要采取一些策略以便獲得布局優勢。常用的一個策略是,使其知識產權組合多樣化,從而優先獲得先前專利申請的后續翻新。例如張鋒團隊發現并申請了Cpf1的專利保護,這是Cas9蛋白的一個強有力的替代品。
專利保護需要大量充分、有說服力和可信度的證據材料
在早期開展科學研究的時候即具有專利認知,能夠保留所有詳實、有效的實驗記錄和數據,以備未來有可能遇到專利訴訟時作為證據維權。同時需要具有在整個專利生命期內的留存證據意識。
專利運營必須有專業的專利代理人或律師支持
毋庸置疑,專利代理人或律師的專業度是決定勝負的關鍵。熟悉全球專利法案、規則;能夠基于現實情況做出有利的方案選擇和判斷,識別優勢證據,清楚準確的主張訴求等,每一個細節都不可或缺。
例如,張鋒團隊在2017年第一次的“專利干預”重審時就強調,雙方的專利權主張是完全不同的兩個內容,而不是基于對方先申請人的主張上對峙:張鋒團隊是將CRISPR/Cas9系統限定于真核細胞使用,而CVC團隊只是在描述CRISPR/Cas9系統,并未限定于任何應用環境之下,因而是完全不同的發明。同時,向USPTO提供了證據,證明真核細胞中的使用并不是顯而易見的;使用CVC團隊專利中的CRISPR/Cas9常規實驗操作是無法在真核細胞中成功編輯基因的。可見,專利律師在其中必然發揮了關鍵作用。
專利轉化的前景取決于科學家的研究洞察力
科學家具有敏銳的科研洞察力,能夠清楚判斷所研發成果的應用價值領域,以及其對未來商業化的準確認識,是至關重要的。這才是決定研究方向、技術成果的應用領域,以及專利申請的主張范疇的基石。CVC團隊最大的失誤就是沒有將真核細胞納入其專利申請范疇。然而該技術最大的潛在經濟價值幾乎都在真核生物領域——人類醫療、植物育種改良等。張鋒團隊則從一開始的基礎研究就專注于真核生物,或許他們很早就意識到了該技術未來能發揮最大價值的領域。
專利轉化離不開科學家所在院校的鼎力支持
以上所有的關鍵因素,都是基于科學家所在院校的大力支持。本案例中,雙方團隊背后所依靠的院校才是最關鍵的支撐。科學家并不具備專業的專利系統知識,也沒有足夠的精力去應對冗長繁雜的國際訴訟。無論是在早期的科研環境支持上,還是后期成果轉化、專利申請、專利布局和專利訴訟中,都可以看到所在院校的支持力量。加州大學和麻省理工學院都有非常成熟的科技成果轉化支持體系,比如麻省理工學院設有技術授權辦公室(Technology Licensing Office,簡稱TLO),負責校內從發明披露、技術評估、專利保護到最終商業價值轉化的典型大學技術轉移流程,不僅流程清晰高效,工作人員也極為專業。

