納武利尤單抗聯合常規化療對老年中晚期非小細胞肺癌T細胞、NK細胞的影響及安全性
張 莉 (南通市通州區人民醫院腫瘤科,江蘇 南通 226300)
非小細胞肺癌(NSCLC)多發于老年人群,隱匿性強,早期缺乏特異性表現,75%左右的患者確診時已處于Ⅲ~Ⅳ期,手術療效差,術后復發率達25%~50%[1]。藥物化療是治療中晚期NSCLC重要手段,但實踐證實化療會引發一系列不良反應,影響老年患者化療完成率,且遠期效果欠佳[2]。隨著腫瘤研究不斷深入,發現程序性死亡受體-1(PD-1)與程序性死亡受體配體-1(PD-L1)結合引發的免疫逃避作用是治療腫瘤有效靶點,為NSCLCD治療提供新思路[3]。納武利尤單抗屬PD-1抑制劑,近年來作為自身免疫抗癌新型藥物逐漸在臨床得到應用。本研究選取96例老年中晚期NSCLC患者為研究對象,探討納武利尤單抗聯合常規化療的療效。
1 資料與方法
1.1一般資料:選取2019年7月~2021年7月在我院接受治療的96例老年中晚期NSCLC患者為研究對象,按隨機抽簽法分為單一組和聯合組各48例。單一組男女比例為19:29;年齡60~74歲,平均(66.46±3.13)歲;TNM分期:12例Ⅲa期,20例Ⅲb期,16例Ⅳ期;病理類型:30例腺癌,12例鱗癌,6例腺鱗癌;體重指數(BMI)18.57~27.38 kg/m2,平均(22.41±1.82)kg/m2。聯合組男女比例為17∶31;年齡60~75歲,平均(67.55±3.62)歲;TNM分期:9例Ⅲa期,21例Ⅲb期,18例Ⅳ期;病理類型:33例腺癌,10例鱗癌,5例腺鱗癌;BMI18.21~27.09 kg/m2,平均(22.88±2.03)kg/m2。兩組一般資料(病理類型、年齡、男女比例、TNM分期、BMI)比較,差異無統計學意義(P>0.05),有可比性。本研究由本院醫學倫理委員會審核通過。
1.2納入和排除標準:納入標準:①均對本研究知情、同意;②符合《非小細胞肺癌分子病理檢測臨床實踐指南(2021版)》[4]中NSCLC診斷標準,經病理組織活檢證實;③TNM分期為Ⅲa~Ⅳ期;④卡氏評分≥60分;⑤對化療耐受;⑥首次接受治療;⑦病歷資料完整。排除標準:①預期壽命<6個月;②伴有免疫系統疾病、心腦血管疾病、血液系統疾病、代謝系統疾病、傳染性疾病、肝腎功能不全;③癌細胞向遠處轉移或合并其他部位良惡性腫瘤;④伴有精神疾病;⑤過敏體質;⑥年齡<60歲;⑦依從性差,不配合治療。
1.3方法:①單一組:予以常規化療,靜脈滴注培美曲塞(國藥一心制藥有限公司,國藥準字:H20080169,規格:0.5 g),500 mg/m2,每3 w 1次,3 w為1個周期,治療4個周期。②聯合組:在單一組基礎上靜脈滴注納武利尤單抗(Bristol-Myers Squibb Holdings,批準文號:S20180015,規格:10 ml∶0.1 g/瓶),3 mg/kg,滴注時間為1 h,每2 w 1次,2 w為1個周期,治療4個周期。
1.4觀察指標
1.4.1治療總有效率:治療4個周期后評估效果,評估標準為:病灶完全消失,并維持4 w及以上為完全緩解;病灶直徑總和減少>30%,并維持4 w及以上為部分緩解;病灶直徑總和增加>20%或有新病灶出現為疾病進展;處于疾病進展與部分緩解之間的為疾病穩定[5]。(完全緩解+部分緩解)/總例數×100%=總有效率。
1.4.2免疫功能、腫瘤標志物水平:比較兩組治療前與治療4個周期后免疫功能[T細胞(CD3+、CD4+、CD8+)、NK細胞]、腫瘤標志物[癌胚抗原(CEA)、糖類抗原125(CA125)、細胞角蛋白19片段(CY211)]水平,抽取患者5 ml晨起空腹靜脈血,離心(3 000 r/min,10 min,15 cm)分離血清,使用流式細胞儀[艾森生物(杭州)有限公司,NovoCyte D1041]以間接免疫熒光法測定CD3+、CD4+、CD8+、NK細胞水平,使用全自動生化分析儀(希森美康公司,JCA-BM6010/C)以化學發光法測定CEA、CA125、CY211水平。
1.4.3沉默信息調節因子1(SIRT1)陽性率、微小核糖核酸-21(miR-21)表達量:比較兩組治療前與治療4個周期后SIRT1陽性率、miR-21表達量,取患者腫瘤組織保存于液氮中,取適量組織制作成組織勻漿,以實時熒光定量PCR法測定miR-21表達量,對剩余組織進行免疫組化,借助高倍鏡觀察,選10個視野,共1 000個細胞,SIRT1陽性率即為染為棕黃色顆粒細胞占1 000個細胞的比例。
1.4.4不良反應:不良反應包括骨髓抑制、惡心嘔吐、肝腎功能受損、血小板減少、白細胞減少、貧血等。
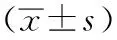
2 結果
2.1兩組患者治療總有效率比較:聯合組治療總有效率54.17%,高于單一組的31.25%,差異均有統計學意義(P<0.05)。見表1。
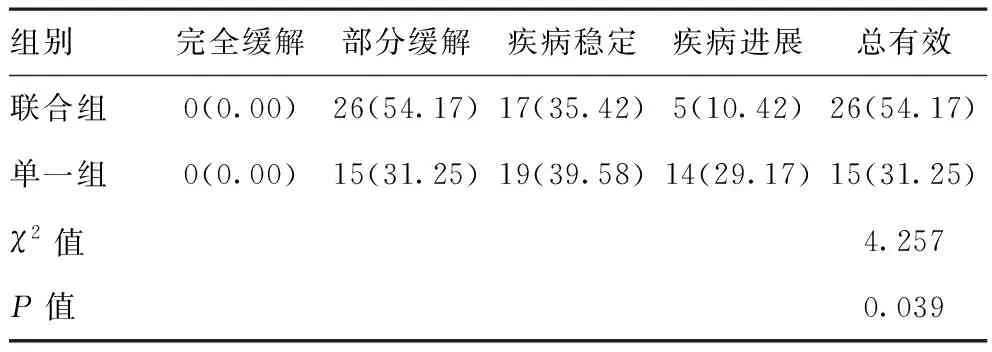
表1 兩組患者治療總有效率比較[n(%),n=48]
2.2兩組患者治療前后免疫功能:兩組治療前CD3+、CD4+、CD8+、NK細胞水平比較,差異無統計學意義(P>0.05);治療4個周期后,聯合組CD3+、CD4+、NK細胞水平均比治療前升高,CD8+水平比治療前下降;單一組CD3+、CD4+、NK細胞水平均比治療前下降,CD8+水平比治療前升高;聯合組CD3+、CD4+、NK細胞水平較單一組高,CD8+水平較單一組低,差異均有統計學意義(P<0.05)。見表2。
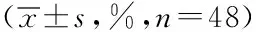
表2 兩組患者治療前后免疫功能比較
2.3兩組患者治療前后腫瘤標志物水平比較:兩組治療前CEA、CA125、CY211水平比較,差異無統計學意義(P>0.05);兩組治療4個周期后CEA、CA125、CY211水平均比治療前下降,且聯合組低于單一組,差異有統計學意義(P<0.05)。見表3。
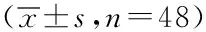
表3 兩組患者治療前后腫瘤標志物水平比較
2.4兩組患者治療前后SIRT1陽性率、miR-21表達量比較,兩組治療前SIRT1陽性率、miR-21表達量比較,差異無統計學意義(P>0.05);治療4個周期后兩組SIRT1陽性率、miR-21表達量均比治療前下降,且聯合組低于單一組,差異有統計學意義(P<0.05)。見表4。
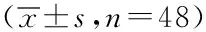
表4 兩組患者治療前、后SIRT1陽性率、miR-21表達量比較
2.5兩組患者不良反應比較:兩組骨髓抑制、惡心嘔吐、肝腎功能受損、血小板減少、白細胞減少、貧血等發生率比較差異均無統計學意義(P>0.05)。見表5。
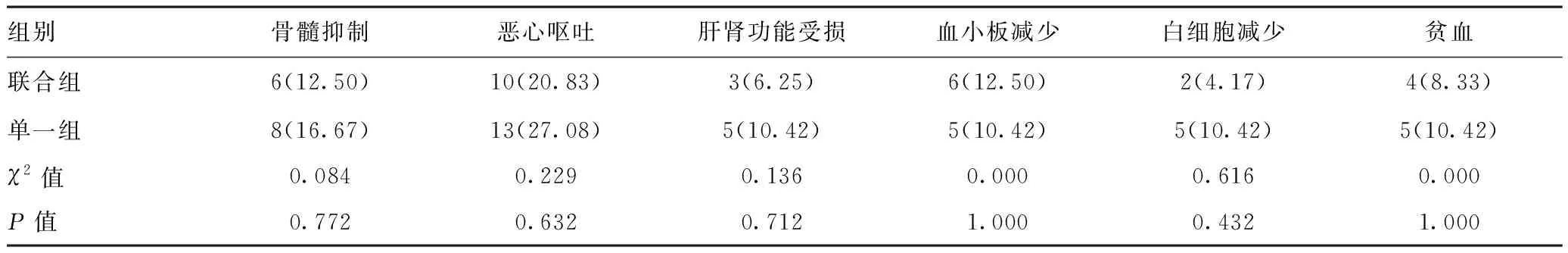
表5 兩組患者不良反應比較[n(%),n=48]
3 討論
培美曲塞是一種多靶點化療藥物,可阻礙DNA原料合成,抑制癌細胞生長,從而促進癌細胞凋亡,發揮抗癌作用[6]。但化療會帶來一定不良反應,影響機體各項功能,降低免疫力,部分患者會因難以耐受化療不良反應中斷治療。納武利尤單抗作為細胞免疫療法常用藥物,通過增強機體免疫功能,達到治療腫瘤目的,安全有效[7]。呂厚寬等[8]學者指出,對于NSCLC患者采用化療藥物與納武利尤單抗聯合治療,療效明顯高于單一使用化療藥物。本研究發現,聯合組總有效率較單一組高(P<0.05),與上述研究結果相符。這是由于納武利尤單抗能穩定腫瘤局部微環境,增強免疫細胞增殖能力,更好殺傷癌細胞,抑制癌細胞生長,從而取得滿意療效。
免疫功能方面,細胞免疫發揮重要作用,T淋巴細胞在免疫內環境調節與維持中意義重大,NSCLC患者免疫功能受損嚴重,加之化療藥物在殺滅癌細胞的同時,也會減弱免疫功能,導致CD3+、CD4+明顯減少,CD8+明顯增加,NK細胞是介導免疫應答主要細胞,在癌細胞發生免疫逃逸過程中其功能明顯下降,數量明顯減少[9-10]。本研究數據說明,相較于單一使用化療藥物,納武利尤單抗與化療聯用能改善老年中晚期NSCLC患者免疫功能。分析原因可能為納武利尤單抗既能減輕化療藥物帶來的免疫抑制作用,增強機體耐受性,又能提高NK細胞的活性,從而改善機體免疫功能。
腫瘤標志物方面,CEA、CA125、CY211在NSCLC診斷、療效與預后判斷中敏感度與特異度較高,相關文獻報道,NSCLC患者CEA、CA125、CY211水平明顯較健康人群高,且與臨床分期成正比[11-13]。本研究還對SIRT1陽性率、miR-21表達量進行探討,SIRT1屬SIRTUIN家族,正常情況下發揮細胞保護作用,還參與腫瘤發生與發展,在癌組織中呈高表達,并與淋巴結轉移與分期等情況相關;miR-21是miRNA家族成員,參與細胞分化、增殖等機體重要生理過程,相關研究證實,其在肺癌患者腫瘤組織中表達異常,其表達水平與淋巴結分期呈正相關[14-15]。本研究使用納武利尤單抗聯合化療藥物培美曲塞治療NSCLC,結果顯示聯合組CEA、CA125、CY211水平與SIRT1陽性率、miR-21表達量均低于單一組(P<0.05),提示該治療方案能降低腫瘤標志物水平,抑制SIRT1與miR-21表達,可能在于納武利尤單抗能抑制腫瘤血管內皮細胞增殖與遷移,減少新生血管生成,達到抑制腫瘤發生與發展的目的。本研究還發現,兩組骨髓抑制、惡心嘔吐、肝腎功能受損、血小板減少、白細胞減少、貧血等發生率比較差異均無統計學意義(P>0.05),說明納武利尤單抗的應用不增加不良反應,患者耐受程度高,更易于患者接受。
綜上所述,常規化療聯合納武利尤單抗方案應用于老年中晚期NSCLC治療中效果顯著,能改善患者免疫功能,降低腫瘤標志物水平,抑制SIRT1與miR-21表達,且安全性高。但本研究也有一定不足之處,如納武利尤單抗在我國上市時間較短,費用高昂,臨床應用較少,后續需擴大樣本量深入研究本治療方案。

