雙側腎上腺高功能皮質腺瘤致ACTH非依賴性庫欣綜合征3例臨床診療探索
蒲虹宇 陳濤 張婷婷 張丹 莫丹 田浩明 任艷
(1.四川大學華西醫院內分泌代謝科,四川 成都 610041;2.四川大學華西醫院健康管理中心,四川 成都 610041;3.西藏自治區人民政府駐成都辦事處醫院內分泌代謝科,四川 成都 610041;4.西藏自治區人民政府駐成都辦事處醫院內科,四川 成都 610041)
庫欣綜合征(Cushing's syndrome,CS)是一組因各種病因導致腎上腺皮質分泌過多糖皮質激素的臨床綜合征,主要分為促腎上腺皮質激素(ACTH)依賴性和非依賴性兩大類。ACTH非依賴性庫欣絕大多數由單側腎上腺高功能腺瘤所致,其他病因還包括皮質腺癌(ACC)、原發性色素沉著結節性腎上腺皮質病(PPNAD)、原發性腎上腺大結節樣增生(PBMAH),而雙側高功能腺瘤非常罕見[1]。本文將我科收治的3例雙側腎上腺高功能皮質腺瘤所致CS的臨床資料及診治結果報道如下,并進行分析,旨在提高該疾病的認識和臨床診治水平。
1 對象與方法
1.1 研究對象 收集2016~2021年四川大學華西醫院內分泌代謝科收治的3例雙側腎上腺功能性皮質腺瘤致ACTH非依賴性庫欣綜合征患者的臨床資料行回顧性分析,3例患者均為女性,臨床癥狀及生化特征,見表1、表2。

表1 3例患者臨床資料
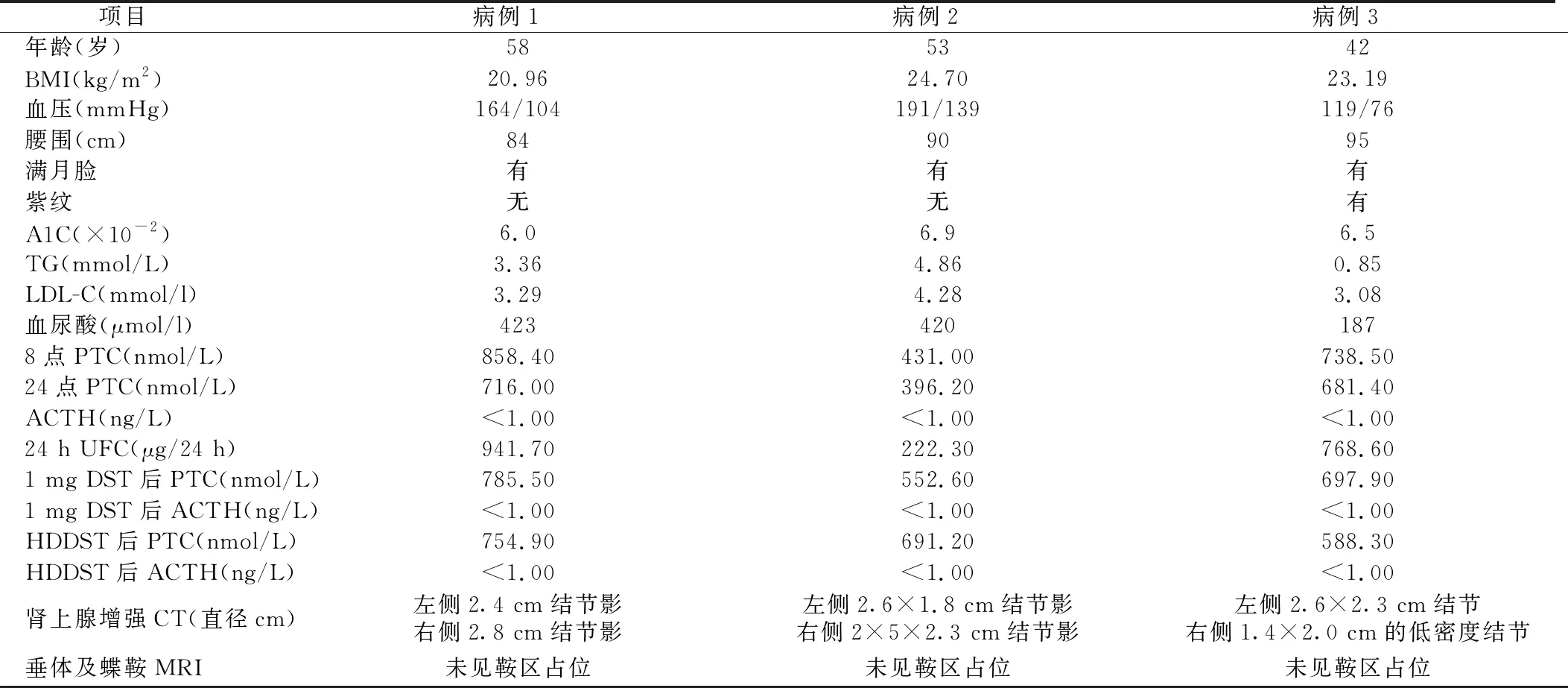
表2 3例患者臨床癥狀及生化特征

圖1 病例1腎上腺增強CT
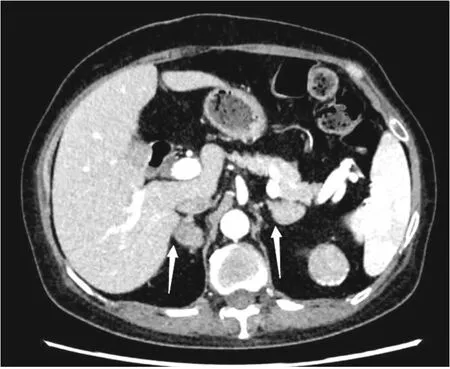
圖2 病例2腎上腺增強CT

圖3 病例3腎上腺增強CT
1.2 方法
1.2.1 腎上腺靜脈取血(Adrenal vein sampling, AVS)檢查 3位患者中有2位行AVS檢查進一步明確雙側腎上腺皮質醇分泌狀況,采用腎上腺靜脈醛固酮濃度/下腔靜脈醛固酮濃度>2作為成功的依據,腎上腺靜脈與外周皮質醇濃度比值大于 6.5 提示皮質醇分泌腺瘤,兩側腎上腺皮質醇的比值≥2.3,作為判斷優勢側的依據[2]。
1.2.2 手術方式 雙側腺瘤切除是該病的主要治療手段,目前多在腹腔鏡下進行。臨床中是先切除一側腺瘤,擇期再切除另一側腺瘤,抑或是同時切除雙側腺瘤應根據患者個體情況而定。
1.2.3 觀察指標 觀察3例患者手術前后臨床癥狀及相關內分泌激素的變化情況,以及3例患者轉規及預后。患者典型的庫欣綜合征表現消失、血尿皮質醇、ACTH 等相關激素水平恢復正常,皮質醇節律恢復則視為治愈。
2 結果
2.1 3例患者AVS結果 患者中2位行AVS檢查,均插管成功。病例1的AVS偏側指數為1.23(左/右),且雙側腎上腺靜脈游離皮質醇濃度均明顯高于外周靜脈(其中左側為13.89倍,右側為13.57倍)。病例3偏側指數為1.16(左/右),雙側腎上腺靜脈游離皮質醇濃度均明顯高于外周靜脈(其中左側為22.30倍,右側為20.28倍),2例患者AVS結果都提示雙側腎上腺皮質醇均呈高分泌且無優勢側(見表3),雙側腎上腺腺瘤均系功能性腺瘤,病例2拒絕AVS檢查。

表3 病例1及病例3 AVS結果
2.2 患者手術情況 3例患者均行腹腔鏡下腎上腺腫物切除術,病例1及病例2因合并嚴重心功能不全等相關危險因素,考慮一次性行雙側腎上腺腺瘤切除后容易出現皮質醇功能不足甚至皮質醇危象等,誘發心臟驟停等,故先行單側腹腔鏡下腎上腺腫瘤切除術,擇期行另一層腎上腺腫物切除術。病例3行腹腔鏡下雙側腎上腺腫瘤切除術(見表4)。3例患者病理結果均提示腎上腺腺瘤,見圖4。
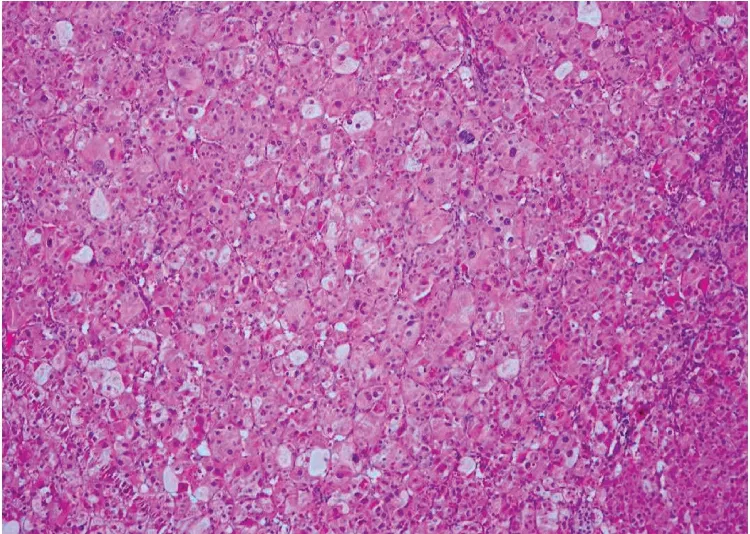
圖4 病例1病理HE染色提示腎上腺腺瘤
2.3 術后情況 術后最長隨訪時間為2年半,病例1、病例2單次手術后血高皮質醇血癥未得到很好緩解,再次手術后血皮質醇激素均恢復正常(見表4)。3例患者術后均給予激素替代治療,病例1、病例2術后血壓控制可,體力可,無乏力、食欲欠佳等不適,病例3手術1年后出現食欲及體力下降,行ACTH興奮實驗:0分鐘PTC 54.35 nmol/L,30分鐘PTC 81.40 nmol/L,60分鐘PTC 57.52 nmol/L.,調整氫化可的松用量后患者體力逐漸恢復。

表4 腫瘤特點、手術方式及術后激素情況
3 討論
雙側高功能皮質腺瘤所致的ACTH非依賴性庫欣綜合征十分罕見,近幾年陸續有少數報道。與單側高功能皮質腺瘤所致的庫欣相比,該病臨床診斷較為困難,后續治療和隨訪也與前者顯著不同,應引起臨床重視。
文獻報道該病患者多為中年女性,男性少見;臨床可表現為典型的庫欣體貌或亞臨床庫欣,大劑量地塞米松抑制試驗不能被抑制[3]。本文3例患者與文獻描述一致,均為女性,伴典型的庫欣體貌,激素檢測及大劑量地塞米松抑制試驗不能被抑制,但腎上腺增強CT顯示雙側均有腺瘤。因此,對于嚴重高皮質醇狀態,生化符合ACTH非依賴性庫欣,且影像提示雙側腎上腺單發腺瘤的患者,應考慮本病的可能。
庫欣綜合征患者常出現繼發性高血壓、糖尿病、高脂血癥、骨質疏松、電解質紊亂、感染易感性增加等[4-5],病程較長者心血管疾病風險增大,死亡率較正常人高出4倍,大多數死因為心腦血管事件或者嚴重的感染[6]。本文3例患者均伴有明顯的高血壓、糖代謝異常,特別突出的是3例均出現心臟結構改變及心功能下降,2例心功能不全較為嚴重,其中1例表現為嚴重的肥厚性梗阻性心肌病改變;2例發生嚴重的骨質疏松及病理性骨折。以上說明雙側高功能腺瘤導致的庫欣心血管及代謝并發癥常較為嚴重,應積極進行合并癥的篩查,尤其應關注心臟的改變,以有利于作出更適合和完善的治療方案。
CT是腎上腺病變最為常見的影像檢查手段。單側腺瘤導致的庫欣多表現為單發的腎上腺占位,直徑多<4厘米,邊界光滑,邊緣輪廓清晰[7];而雙側高功能腺瘤影像學特征報道少,目前已報道的多為邊界清楚的孤立性占位,腫瘤大小多<4 cm[3-4],多數腎上腺腺瘤 CT 平掃密度較均勻,部分腺瘤可能由于血管變異或者出血、囊變等導致其密度不均勻。本文3例患者CT均表現為雙側腎上腺單發的腺瘤,直徑在1~3 cm,腫瘤邊界光滑,輪廓清晰,輕度強化或明顯強化,剩余腎上腺組織未見異常,或肢體較細,顯示出腫瘤外組織的受抑。因此,臨床上如遇典型的ACTH非依賴性庫欣綜合征,且腎上腺CT有上述特征者,應懷疑為雙側高功能腺瘤。有時雙側腎上腺皮質腺瘤和PBMAH容易相混淆,PBMAH常雙側腎上腺顯著增大,有單個或者多個大小不一的結節,或雙側腎上腺彌漫性增大,單側腎上腺大結節等,結節未被包裹,臨近區域肥大,有時包含小的結節[8]。而其他雙側病變所致的ACTH非依賴庫欣綜合征,如ACC、PPNAD等,腎上腺影像學有其相應的特征,常較易區分[9-10]。
明確雙側腫瘤的功能狀態對于后期治療決策非常重要,然而影像學無法明確。目前有研究通過131I-6β碘代甲基-19-去甲膽固醇 (NP-59) 顯像或AVS來判定雙側功能狀態[11-12]。AVS對雙側腎上腺皮質腺瘤功能定位也有重要價值[2,13]。然而,AVS是一項有創檢查,存在取血失敗、輻射等風險,且對操作者的技術能力有較高要求,成功率只有70~90%[14-15]。因此,對于沒有條件行AVS的單位,也可以采取病例2的方式,通過先切除一側腺瘤,隨訪皮質醇、ACTH水平及功能試驗判斷另一側腺瘤的功能狀況。
該病腫瘤組織典型的病理改變為致密細胞組成,顯示強烈的細胞色素P450染色,以及3β-羥基類固醇脫氫酶(3βHSD)染色的中度活性[16]。而ACC 病理腫瘤細胞核多形性,高有絲分裂,IGF2和p53過度表達[17]。PPNAD免疫組化提示主要由致密細胞組成,具有分散的小結節,強烈表達所有類固醇合成酶。PBMAH組織學特征顯示結節由透明細胞和致密細胞組成, 主要表達3β-羥基類固醇脫氫酶、17-α 羥化酶[18]。因此,術后病理及免疫組化可進一步明確診斷。
雙側腺瘤切除是該病的主要治療手段。術前應對患者病情進行充分評估,并和患者充分溝通,根據患者實際情況個體化的選擇手術方式。如病例1和2因合并心功能不全,一次性雙側切除容易誘發腎上腺危象和心臟事件,危及生命,因此分期進行手術,以最大程度降低患者風險[19]。術前均需要常規行垂體核磁共振掃描和血漿ACTH測定,以確定是否存在垂體ACTH腺瘤[1],避免Nelson綜合征的出現。術中及術后均應給予激素替代治療,首選氫化可的松(100~200 mg/d),術后逐漸過渡到口服的氫化可的松或者潑尼松[20],避免過度用藥,幫助患者腎上腺功能最大程度恢復。
術后是否能保留正常腎上腺功能是該病治療中值得關注的問題。雙側腎上腺切除能夠快速控制高皮質醇血癥[21],減少手術創傷。但缺點是術前術后皮質醇水平變化巨大,可能造成皮質功能減退危象,術后永久性腎上腺皮質功能減退的幾率也較高[20-22]。目前多主張手術時盡量保留剩余腎上腺組織,以免術后需長期激素替代治療,但可能出現病變部位切除不完全,遺漏微小的病灶,術后疾病容易復發等風險[23-24]。術后均需要長期隨訪,定期復查血漿皮質醇及ACTH水平。本文中3例患者術后均出現了永久性皮質功能不全,均長期激素替代治療,提示該病患者較單側皮質醇瘤的患者出現永久性皮質功能不全的幾率高很多,需要引起足夠重視,術后需加強隨訪,密切觀有無惡心嘔吐、嗜睡乏力、體位性低血壓等皮質醇功能低下表現。
4 結論與啟示
雙側腎上腺高功能皮質腺瘤致ACTH非依賴性庫欣綜合征是一種非常罕見的庫欣綜合征類型。本文通過對3例該病患者的臨床診療分析,提示對該類患者明確診斷并判斷雙側功能定位非常重要,CT為常見的影像檢查手段,但無法判斷雙側的功能性,AVS可以有助于雙側的功能定位。臨床診療中還需要積極篩查心臟及代謝并發癥。后續手術方式的選擇應根據患者的病情及并發癥情況,個體化的選擇最適合患者的手術方式。對3例患者的長期隨訪發現此病患者出現永久性皮質功能減退的風險很高,應嚴密隨訪,及時給予并調整皮質激素替代治療,并終身隨訪。

