基于網絡藥理學和分子對接預測黃芪-莪術治療胃癌的分子機制
黃越,方崇鍇,聶多銳,藍清霞,李躍軍,黃學武
(1.廣州中醫藥大學 第一臨床醫學院,廣東 廣州 510405;2.湖南中醫藥大學 研究生院,湖南 長沙 410000;3.湖南中醫藥高等專科學校第一附屬醫院,湖南 株洲 412000;4.廣州中醫藥大學第一附屬醫院,廣東 廣州 510405)
胃惡性腫瘤(gastric cancer,GC)是世界上最常見的惡性腫瘤之一,其5年生存率極低,僅為29%[1]。胃癌患者一經發現,很多已到晚期,失去了最佳手術時機。胃癌患者在化療的過程中,生活質量降低,而且長期使用化療藥會讓腫瘤患者產生很多不良反應,比如有一些會出現骨髓抑制的現象,多次化療可能會產生耐藥性,最后療效無法提升甚至療效不佳[2]。中醫藥治療講究整體觀念和辨證論治,中藥可增強機體免疫功能,能緩解藥物的諸多不良反應,達到減毒增效的目的,有助于化療的順利進行,在防治腫瘤過程中具有不可替代的作用。
黃芪含皂苷、黃芪多糖、黃酮類等主要成分,在藥理學上具有治療應激氧化及惡性腫瘤、免疫調節保護等多種作用[3]。莪術具有破血消積、行氣止痛的作用,現代藥理研究發現其主要成分有揮發油、姜黃素類、多糖類等,能夠抗腫瘤、抗血小板聚集、調節胃腸平滑肌等[4]。補氣健脾,活血化瘀是中醫常用的抗腫瘤治療法則。黃芪配莪術是國醫大師朱良春教授治療胃病最為常用的藥物組合[5],黃芪能補五臟之虛,莪術善于行氣、破瘀、消積。莪術與黃芪同用,可奏益氣化瘀之功。兩藥相伍,行中有補,補中有行,相得益彰。黃芪和莪術配伍,也是臨床常用的抗腫瘤組合[6]。研究發現,黃芪能夠通過增強胃黏膜防御因子而起到保護胃黏膜、預防胃癌前病變的重要作用[7]。莪術通過影響細胞周期、抑制某些通路和多種蛋白質的差異表達,從而抑制胃癌細胞的增殖[8]。黃芪和莪術均有抗癌的作用,但兩者配伍治療胃癌的具體作用機制未見明確闡述。
中藥治療疾病的過程中具有作用靶點多、成分多、途徑多等特點,現代藥理學等研究表明,黃芪和莪術的有效成分可通過多靶點、多途徑治療相關疾病[3-4,9]。而網絡藥理學是在系統生物學理論的基礎上,形成復雜的生物網絡模型,體現藥物、活性成分、靶點、通路、疾病間相互作用的整體性與系統性,從而對藥物治療疾病的藥理學機制進行預測[10-11]。本文運用網絡藥理學和分子對接的方法,篩選黃芪和莪術的主要活性成分,研究其治療胃惡性腫瘤的作用機制,為后續的相關研究提供思路。
1 方法
1.1 活性成分的前期準備
本研究在中藥系統藥理學數據庫與分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://tcmspw.com/tcmsp.php)檢索,檢索內容為“黃芪”“莪術”。 藥物口服生物利用度(oral bioavailability,OB)和類藥性(drug-likeness,DL)是代表藥代動力學的重要參數。本研究設定OB≥30%,DL≥0.18來篩選活性成分。
1.2 黃芪-莪術藥對活性成分治療胃癌作用靶點的獲取與收集
通過TCMSP平臺查詢黃芪-莪術有效成分的靶點信息,把靶點分別輸入Uniprot數據庫(https://www.uniprot.org/),定義種源為人,檢索目標蛋白的基因名稱。與胃癌有關的靶點的獲得,通過GeneCards數據庫(https://www.genecards.org/)檢索“gastric cancer”。將“藥物-活性成分” “活性成分-靶點”相互關系整理成Microsoft Excel文件導入Cytoscape3.7.0,繪制藥物-活性成分-靶點網絡圖,從中分析參數,選出兩者的核心作用成分。取兩藥共同靶點和疾病靶點的交叉部分,描繪黃芪-莪術和胃癌靶點的交集圖。
1.3 繪制蛋白質-蛋白質相互作用圖
把黃芪-莪術治療胃癌的預測作用靶點在STRING數據庫(https://string-db.org/)Version 10.5中進行蛋白質-蛋白質相互作用(protein-protein interaction,PPI)分析,并使用 Cytoscape 3.7.0軟件繪制PPI圖。
1.4 分子對接的準備過程
首先在PPI圖中選擇度值(degree)前5的靶點作為核心受體蛋白。目標蛋白選自RCSB蛋白數據庫(https://www.rcsb.org/),使用Pymol軟件對受體蛋白進行去水和去原配體,運行AutoDock Vina軟件對受體蛋白加極性氫。從ZINC數據庫(http://zinc.docking.org/)查詢黃芪-莪術藥對關鍵成分的結構,并保存為mol格式。將活性成分和靶蛋白均轉換成pdbqt格式文件。目標蛋白與配體對接結果以最低結合能為依據,使用Pymol軟件進行觀察和作圖。結合相關文獻,具體原理是對接大分子(蛋白質)和小分子(配體),兩者結合程度的大小通過能量的高低來表現,通常認為能量越低,蛋白質與小分子化合物結合的構象越穩定[12]。
1.5 基因本體生物過程及京都基因與基因組百科全書通路富集分析
將預測的靶基因上傳至Omicshare平臺(http://www.omicshare.com),限定物種為“human”,基因本體(gene ontology,GO)分析從生物過程方向進行,通路分析選擇京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes, KEGG),并將其可視化,繪制多靶點、多通路、多作用網絡圖。
2 結果
2.1 黃芪-莪術藥對活性成分的篩選
以OB≥30%,DL≥0.18為條件進行篩選,最終在TCMSP數據庫搜集到20個黃芪活性成分,4個莪術活性成分,根據相關文獻[3-4,9],將莪術醇、β-欖香烯、黃芪多糖等已研究出具有抗癌功效的活性成分納入,共26個活性成分,詳見OSID附表1,表1為最有代表性的10種活性成分。

表1 黃芪-莪術藥對的活性成分
2.2 藥物-活性成分-靶點網絡的繪制
通過TCMSP平臺搜索得出黃芪的活性成分莎醇-2′,5′-二-O-葡萄糖苷、二氫異黃酮和莪術的活性成分溫金素、雙去甲氧基姜黃素無對應靶點信息,故予剔除。整理從Uniprot數據庫中搜集的預測靶點信息,共有601個活性成分靶點,其中黃芪554個,莪術47個,去除重疊部分,得到291個靶點。運用Cytoscape 3.7.0軟件,將數據導入,繪制黃芪-莪術藥物-活性成分-靶點網絡圖(圖1)。根據參數度值的高低及相關文獻檢索莪術醇、β-欖香烯的抗腫瘤機制[8],得出作用于胃癌靶點的核心活性成分有槲皮素、山奈酚、7,2′-二羥基-3′,4′-二甲氧基異黃烷、莪術醇、β-欖香烯。

圖1 黃芪-莪術藥物-活性成分-靶點網絡Fig.1 Drug-active-ingredient target network of Astragali Radix-Curcumae Rhizoma
2.3 黃芪-莪術治療胃癌的靶點預測
運用GeneCards數據庫,得到499個與胃癌相關的靶點,取黃芪-莪術共同作用靶點和胃癌靶點的交集,得到黃芪-莪術治療胃癌的潛在靶點,共74個(詳見OSID附表2)。構建藥對與疾病的靶點維恩圖見圖2。整理基因對應的主要的Uniprot ID,見表2。
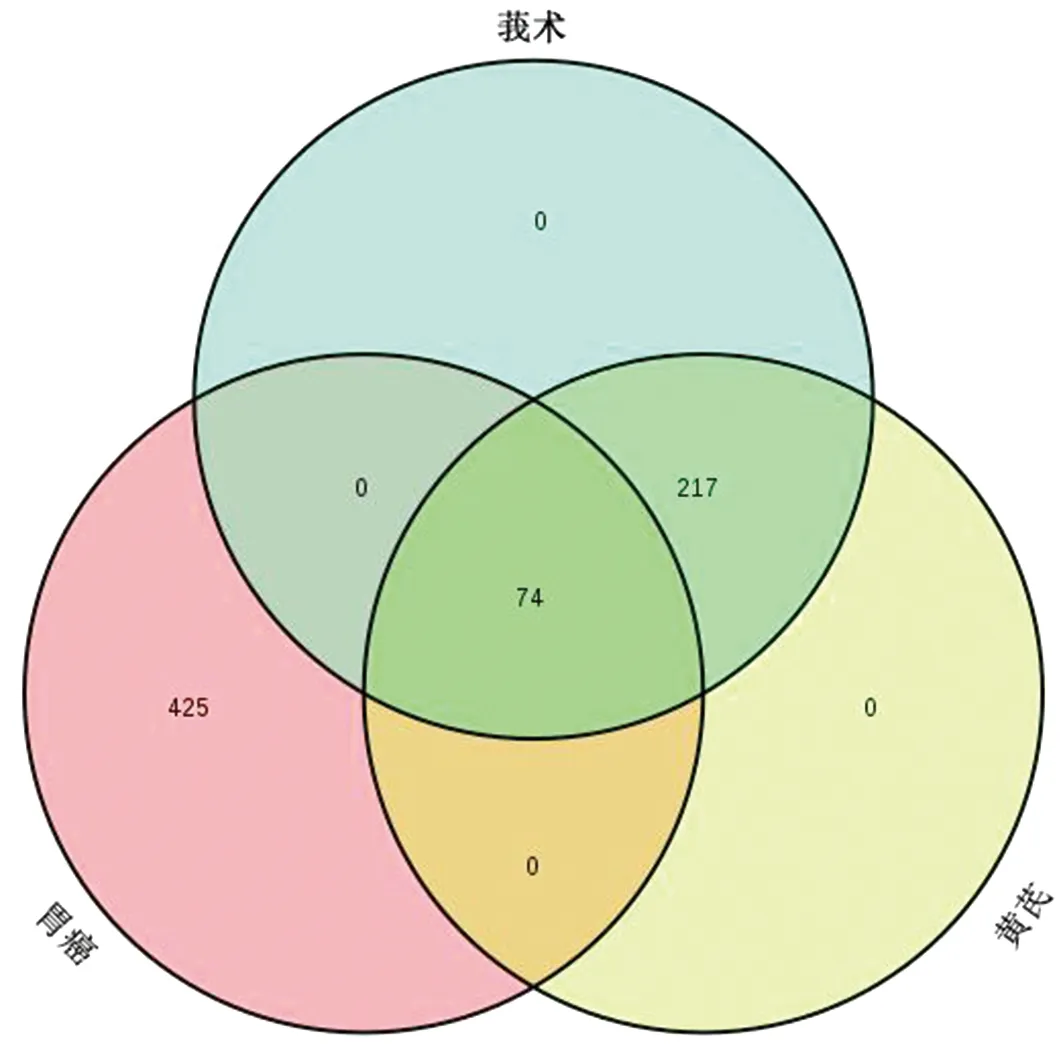
圖2 黃芪-莪術和胃癌靶點的維恩圖Fig.2 Venn diagram of the targets of gastric cancer and Astragali Radix-Curcumae Rhizoma
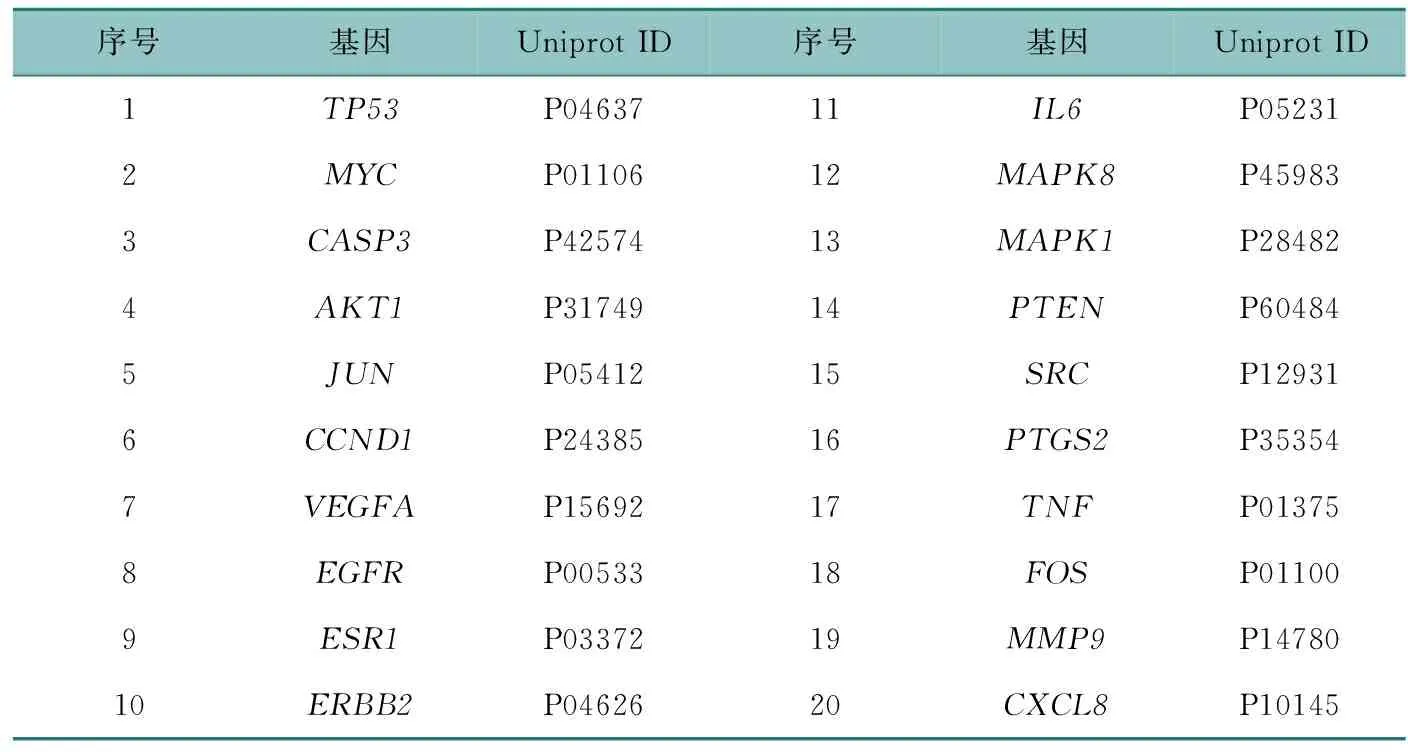
表2 靶點信息表
2.4 PPI圖的分析結果
通過1.3方法得到PPI圖(圖3)。如圖3所示,根據度值的大小,排名前五的分別是TP53、MYC、CASP3、AKT1、JUN這5個靶點蛋白,為黃芪-莪術治療胃癌的主要作用靶點。
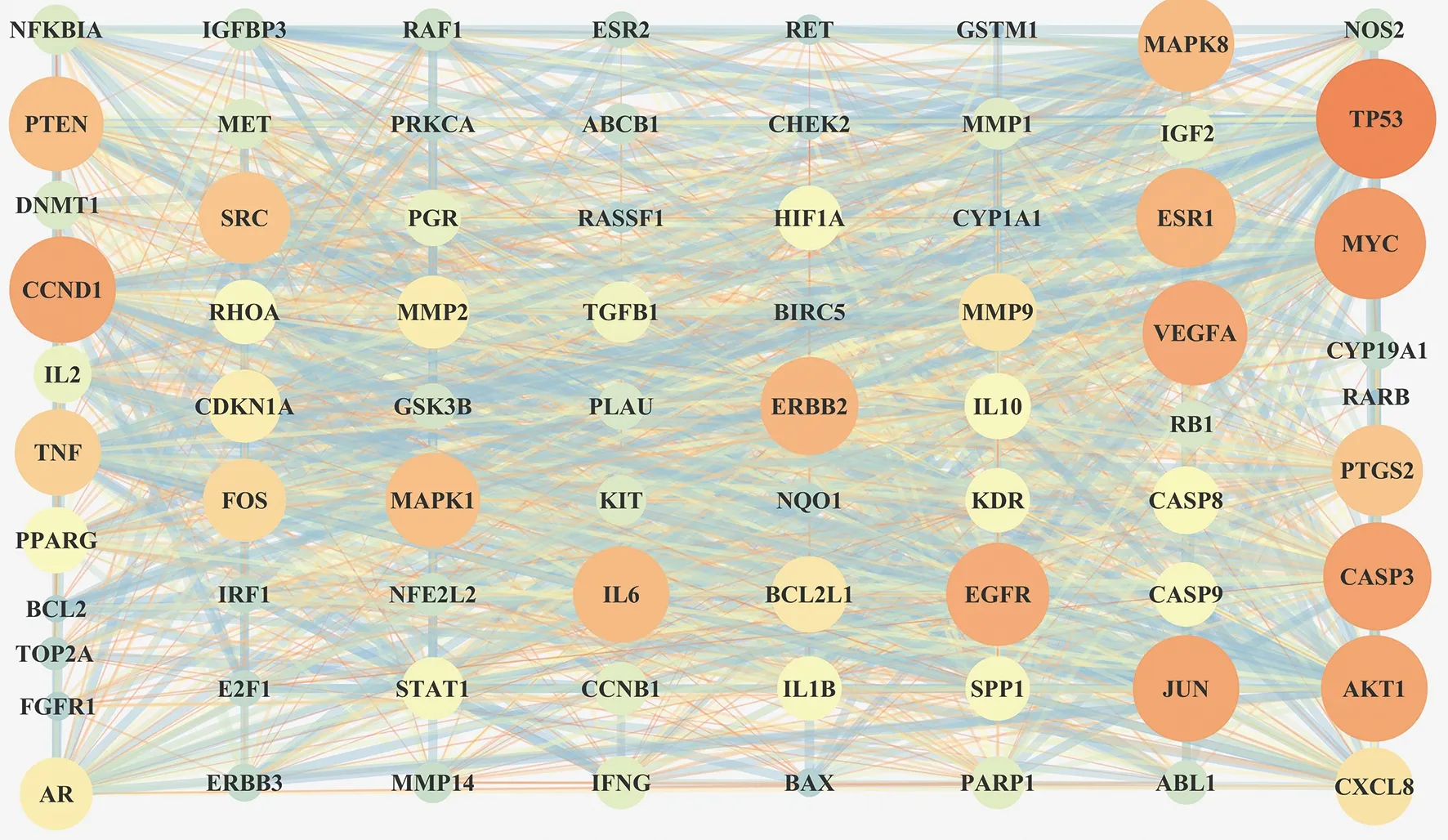
圖3 黃芪-莪術藥對潛在靶點的PPI網絡Fig.3 Protein-protein interaction network of Astragali Radix-Curcumae Rhizoma
2.5 分子對接分析
通過1.4方法進行分子對接,得到活性化合物與靶蛋白對接的結合自由能結果,主要結果見表3(詳細數據見OSID附表3)。活性化合物與靶蛋白的結合能如果是負值,表示兩者具有結合能力。結合活性度越高,負值的絕對值就越高,即結合能力越好。根據表3的結果,得出圖4(a)~(f),即TP53與槲皮素的對接、MYC與槲皮素的對接、CASP3與槲皮素和莪術醇的對接、AKT1與槲皮素的對接、JUN與山奈酚的對接為靶蛋白與活性化合物結合最好的組合,這說明黃芪-莪術藥對的活性成分對主要核心靶點蛋白有調控作用。
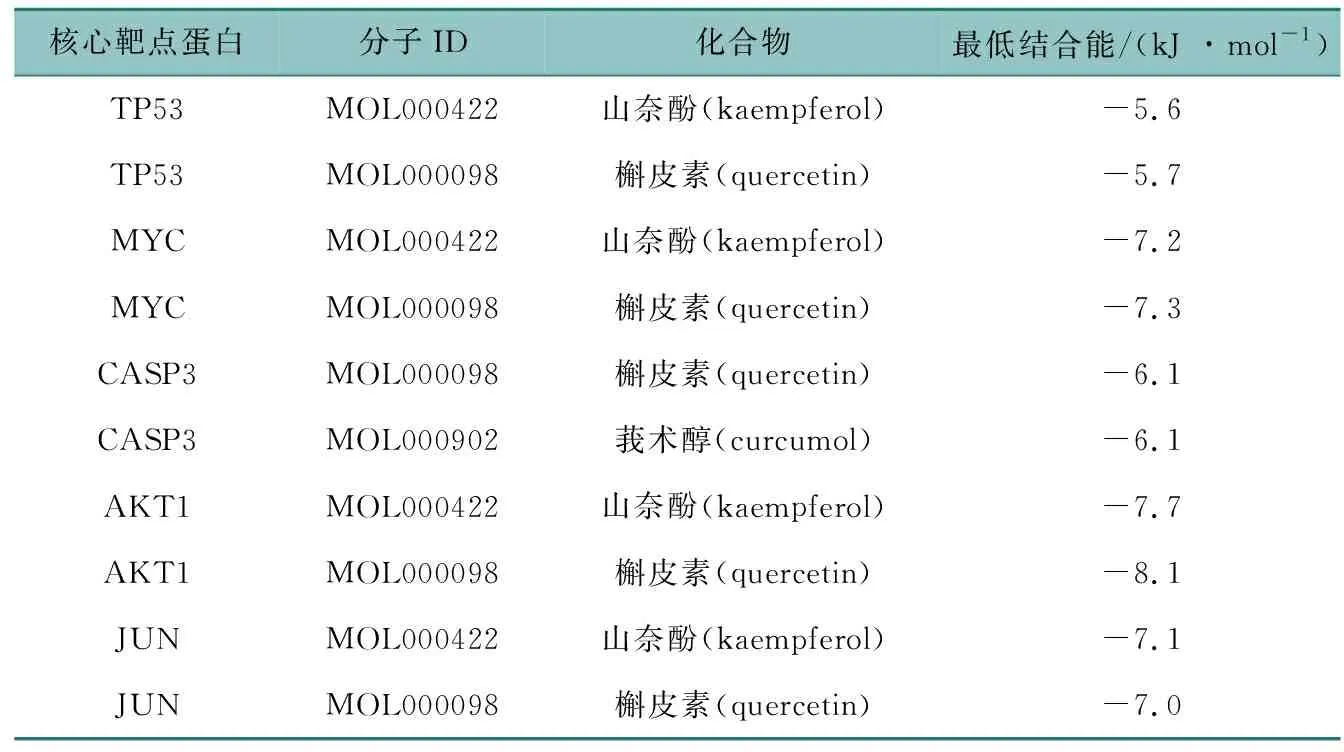
表3 核心靶點蛋白與活性化合物的對接結果
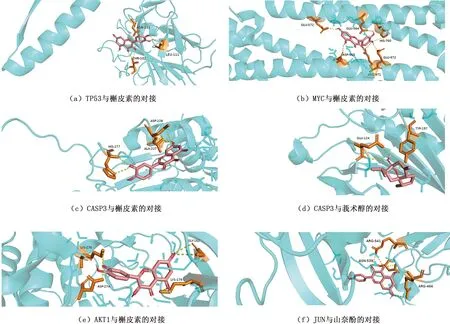
圖4 核心靶點蛋白與活性化合物的最佳對接結果 Fig.4 Docking results of target proteins with active compounds showing the best binding
2.6 GO生物過程及KEGG通路富集分析結果
通過1.5方法進行GO及KEGG通路富集分析,結果如圖5~6所示。GO生物功能富集分析(圖5)結果顯示,關鍵靶點對凋亡信號通路、酶結合、蛋白結合、信號受體結合、RNA聚合酶II轉錄調控復合物等起作用。從KEGG通路富集分析中,結合相關文獻檢索,發現靶點主要富集在癌癥, 癌癥中的蛋白聚糖、PI3K-Akt、MAPK、Rap1、TNF、FoxO等信號通路上[13],進一步獲得如圖6所示的KEGG通路富集分析。
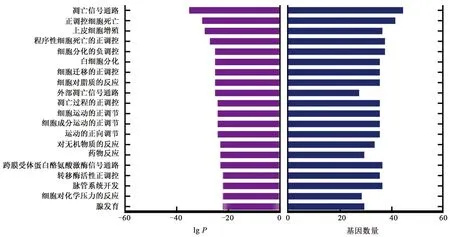
圖5 GO生物功能富集分析Fig.5 Gene ontology pathway enrichment analysis
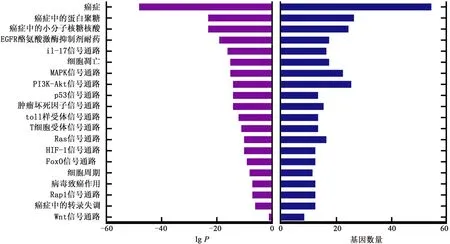
圖6 KEGG通路富集分析Fig.6 Kyoto encyclopedia of genes and genomes pathway enrichment analysis
2.7 疾病-藥物-活性成分-靶點-通路網絡圖的構建與分析
為了使黃芪-莪術治療胃惡性腫瘤的機制更加直觀可視化,通過Cytoscape 3.7.0軟件,把以上得到的治療胃惡性腫瘤的關鍵活性成分、靶點和相關的信號通路進行整理,構建多靶點、多通路、多作用網絡圖(圖7)。圖中共有節點102個,邊線516條。綠色三角形代表胃癌,藍色圓形代表黃芪、莪術,橙色V形代表藥物活性成分,黃色正方形節點代表潛在靶點,淡橙色菱形節點代表黃芪-莪術治療胃癌可能參與的主要信號通路。這一網絡圖充分體現了中藥治療疾病具有多成分、多靶點、多通路的特點。
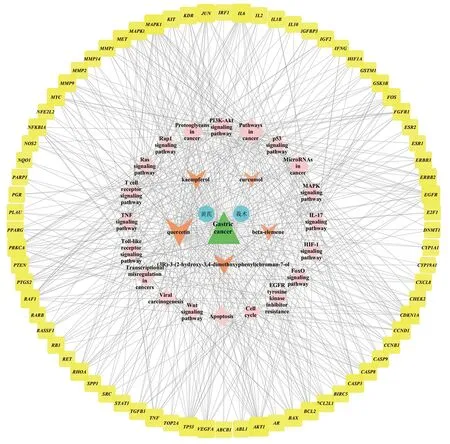
注:綠色三角形代表胃癌,藍色圓形代表黃芪、莪術,橙色V形代表藥物活性成分,黃色正方形節點代表潛在靶點,淡橙色菱形節點代表黃芪-莪術治療胃癌可能參與的主要信號通路。圖7 黃芪-莪術藥對多靶點、多通路、多作用網絡Fig.7 Multitarget, multichannel, and multifunction network of Astragali Radix-Curcumae Rhizoma
3 討論
中醫認為腫瘤的形成與氣滯、痰濕、瘀血、毒邪等有關,常用中醫治療法則有扶正培本、清熱解毒、活血化瘀、除痰散結等,黃芪健脾補氣,而莪術活血化瘀,所以兩者常配伍使用以益氣活血,是臨床常用抗腫瘤組合[6]。槲皮素、山奈酚、7,2′-二羥基-3′,4′-二甲氧基異黃烷屬于黃芪中的黃酮類活性成分,研究發現,槲皮素能抑制胃癌細胞的增殖和侵襲,在聯合槲皮素化療的研究中,發現通過抑制c-Jun的表達可增強5-氟尿嘧啶對胃癌細胞的凋亡[14]。Zhang等[15]研究得出,山柰酚對人胃癌細胞的增殖起抑制作用并且能提高胃癌細胞的自噬能力,其促進人胃癌SNU-216細胞中的miR-181a水平高表達,導致MAPK/ERK和PI3K通路的表達受阻。7,2′-二羥基-3′,4′-二甲氧基異黃烷文獻研究較少,但本文發現其是治療胃癌的核心活性成分之一,值得后續深入研究。黃芪多糖是黃芪中的主要活性成分,研究發現其能夠促進Bax高表達,使Bcl-2低表達,從而抑制胃癌細胞的增殖及直接殺傷人胃癌細胞中的MKN45細胞,還能通過影響端粒酶活性而抑制腫瘤增長[16]。莪術醇通過阻礙信號通路和抑制細胞周期而發揮抗腫瘤作用,其阻礙JAK2/STAT3、NF-κB及JAK3/STAT5等信號通路的表達,促進p38 MAPK信號通路高表達,影響胃癌細胞增殖的速度,促進腫瘤細胞更多的凋亡[8]。研究發現β-欖香烯能引起人胃癌細胞多種蛋白質差異表達而發揮抗癌機制,又通過促進Bcl-2家族的促細胞凋亡成員類BCL-2蛋白12 和人胃癌細胞BCL-2相關轉錄因子(BTF)的高表達,加速腫瘤細胞凋亡速度[8]。
本文通過對PPI網絡圖的分析,得出TP53、MYC、CASP3、AKT1、JUN為黃芪-莪術治療胃癌的主要作用靶點。其中TP53與槲皮素、MYC與槲皮素、CASP3與槲皮素和莪術醇、AKT1與槲皮素、JUN與山奈酚的對接為靶蛋白與活性化合物對接最好的組合,說明黃芪-莪術藥對的活性成分能對主要作用靶點發揮調控作用,但后續仍需進一步的生物實驗驗證。Jiang等[17]證明了TP53突變本身可以導致胃癌和其他癌癥類型的免疫活性下降。MYC是較早發現的一組癌基因,包括C-myc、N-myc及L-myc,胃癌淋巴結轉移和漿膜浸潤的速度和程度,在某種程度上與C-myc蛋白的表達有很大關系[18]。有研究表明,CASP3通過影響胃黏膜和胃腫瘤細胞的凋亡程序而對胃癌的預后判斷起相關作用[19]。AKT1在胃癌組織中出現高表達狀態,相關研究發現其參與胃癌的發生、發展及浸潤的過程,因此,對于AKT1的進一步研究有利于找到胃癌治療的靶點[20]。JUN能影響細胞分化及其凋亡過程,c-JUN通過磷酸化水平的調節,干擾耐藥細胞周期的凋亡及分化,進而對抗化療藥的多重耐藥,這就為胃癌化療藥耐藥機制方面的研究提供了有效借鑒[21]。
對KEGG通路進行分析,發現PI3K-AKT、MAPK、P53等信號通路在黃芪-莪術治療胃惡性腫瘤中發揮抗腫瘤作用,其通過多種信號表達,進而影響腫瘤細胞的凋亡、增殖等。如MAPK在人體細胞中擔任傳遞信號的重要角色,其使核轉錄因子磷酸化,從而發揮抑制細胞凋亡、增殖、分化的作用,發揮抗炎、抗應激、加強免疫調節的作用[22]。作為PI3K信號通路中的核心分子,PI3Ks發揮調控人體細胞分化、增殖的作用。PI3Ks正常以非激活狀態在人體中,如果發生突變,PI3Ks大量被激活,進而使PI3K-AKT信號通路高表達,最終會造成人體細胞新陳代謝發生異常,久之引發惡性腫瘤病變[23]。研究發現,Hp感染是胃惡性腫瘤發生的高危因素,而攜帶TNF-β基因+252位點A等位基因與Hp感染有相關聯系,因此須提高患非賁門型胃癌的警惕性[24]。
4 結論
中醫藥抗癌注重整體觀念,順應了腫瘤綜合治療的發展趨勢。本研究應用網絡藥理學及分子對接的方法,探討黃芪-莪術藥對治療胃癌的分子作用機制,黃芪-莪術藥對治療胃癌的機制體現了中藥治療多靶點、多通路、多作用的特點,為治療胃癌的臨床研究提供了更多思路和方法。

