晚期乳腺癌患者經TP方案治療后TNF-α、IL-6和IL-2水平變化及對預后的預測價值
柯瑤 張琪 王娜★
乳腺癌是威脅女性健康的常見疾病,死亡率較高,給社會、家庭造成嚴重影響[1]。晚期乳腺癌病死率較高,化療是臨床治療晚期乳腺癌的常用方法,通過化療治療可延緩病情進展,但化療治療會損傷患者免疫系統(tǒng),導致其免疫功能下降,誘發(fā)一系列毒副反應,影響患者預后[2-3]。相關報道指出,異常表達的腫瘤細胞壞死因子-α(Tumor cell necrosis factor-α,TNF-α)、白介素-6(Interleukin-6,IL-6)、白介素-2(Interleukin-2,IL-2)等細胞因子不僅可導致患者免疫功能受損,亦可引起化療耐藥,故認為通過檢測上述細胞因子水平可用于評估患者化療治療療效[4-5]。本研究通過檢測晚期乳腺癌患者治療前后TNF-α、IL-6、IL-2 水平,觀察上述因子的變化情況,并探討其對預后的預測價值。
1 資料與方法
1.1 一般資料
收集2017年10月至2020年8月武漢大學中南醫(yī)院收治的86 例晚期乳腺癌患者作為研究組。納入標準:①均符合乳腺癌診斷標準[6];②臨床各方面資料完整;③無乳腺炎;④可耐受化療治療者。排除標準:①合并其他惡性疾病者;②心、腦、肝等功能異常者;③孕婦、精神病等特殊人群;④溝通、意識障礙者。86 例患者均為女性,平均年齡(35.24±6.05)歲;臨床分期:Ⅲ期46 例,Ⅵ期40 例。另選取同期55 名行健康體檢者作為對照組,均為女性,平均年齡(34.31±5.49)歲。兩組一般資料比較差異無統(tǒng)計學意義(P>0.05)。本研究經院醫(yī)學倫理委員會批準通過,受試者或家屬已簽署知情同意書。
1.2 方法
1.2.1 治療方法
研究組化療治療采用TP 方案(紫杉醇+順鉑):第1 d 靜脈滴注135 mg/m2紫杉醇,第1~3 d給予30 mg/m2順鉑,21 d 為一個療程,連續(xù)治療2 個療程。
1.2.2 細胞因子檢測
清晨抽取對照組、研究組治療前后各3 mL空腹靜脈血,置于非抗凝無菌試管中。3 000 r/min 離心10 min,離心半徑10 cm,隨后分離上層血清,置于-80℃保存待檢。采用雙抗體夾心酶聯(lián)免疫吸附法檢測TNF-α、IL-6、IL-2 水平,試劑盒均由美國RD 生物有限公司提供,詳細步驟嚴格按說明書執(zhí)行。
1.3 隨訪
對研究組進行1年隨訪(截止至2021年8月),觀察患者預后情況,將患者分為預后不良組以及預后良好組。預后不良包括乳腺癌復發(fā)、腫瘤轉移、死亡,其余為預后良好。
1.4 統(tǒng)計學方法
采用SPSS 22.0 統(tǒng)計軟件進行統(tǒng)計分析,計量資料以(±s)表示,行t檢驗;采用ROC 曲線分析TNF-α、IL-6、IL-2 對乳腺癌患者預后的預測價值;以P<0.05 為差異具有統(tǒng)計學意義。
2 結果
2.1 兩組TNF-α、IL-6、IL-2 水平比較
TNF-α、IL-6 水平:研究組治療前>治療后>對照組;IL-2 水平:研究組治療前<治療后<對照組,差異均有統(tǒng)計學意義(P<0.05)。見表1。
表1 兩組TNF-α、IL-6、IL-2 水平比較(±s)Table 1 Comparison of the levels of TNF-α,IL-6 and IL-2 between the two groups(±s)
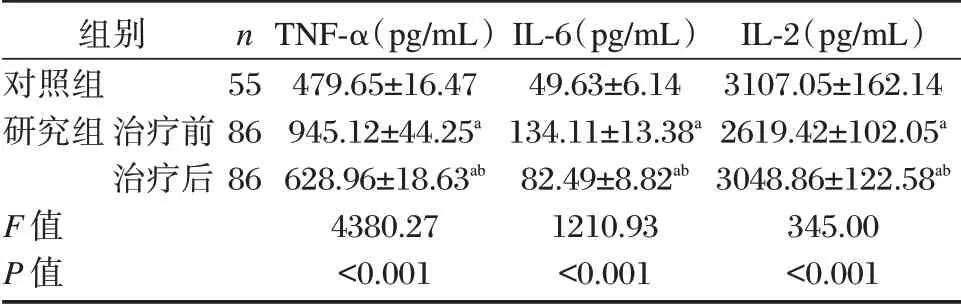
表1 兩組TNF-α、IL-6、IL-2 水平比較(±s)Table 1 Comparison of the levels of TNF-α,IL-6 and IL-2 between the two groups(±s)
注:與對照組比較,aP<0.05;與治療前比較,bP<0.05。
組別對照組研究組n治療前治療后55 86 86 F 值P 值TNF-α(pg/mL)479.65±16.47 945.12±44.25a 628.96±18.63ab 4380.27<0.001 IL-6(pg/mL)49.63±6.14 134.11±13.38a 82.49±8.82ab 1210.93<0.001 IL-2(pg/mL)3107.05±162.14 2619.42±102.05a 3048.86±122.58ab 345.00<0.001
2.2 不同預后乳腺癌患者TNF-α、IL-6、IL-2水平比較
經隨訪,預后不良者17 例(19.77%,預后不良組),預后良好者69 例(80.23%,預后良好組)。治療后,兩組TNF-α、IL-6 水平均較治療前下降,且預后良好組TNF-α、IL-6 水平低于預后不良組,IL-2 水平較治療前增高,且預后良好組IL-2 水平高于預后不良組,差異均有統(tǒng)計學意義(P<0.05)。見表2。
表2 不同預后乳腺癌患者TNF-α、IL-6、IL-2 水平比較(±s)Table 2 Comparison of TNF-α,IL-6 and IL-2 levels in breast cancer patients with different prognosis(±s)

表2 不同預后乳腺癌患者TNF-α、IL-6、IL-2 水平比較(±s)Table 2 Comparison of TNF-α,IL-6 and IL-2 levels in breast cancer patients with different prognosis(±s)
組別預后不良組預后良好組t 值P 值n 17 69 TNF-α(pg/mL)治療前944.65±40.21 945.24±41.09 0.053 0.958治療后701.69±22.96a 611.05±16.47a 18.713<0.001 IL-6(pg/mL)治療前133.54±12.64 134.25±13.34 0.198 0.843治療后96.47±11.32a 79.05±6.17a 8.657<0.001 IL-2(pg/mL)治療前2618.47±101.95 2619.66±100.17 0.044 0.965治療后2806.94±123.98a 3108.47±128.47a 8.725<0.001
2.3 TNF-α、IL-6、IL-2 對乳腺癌患者預后的預測價值
ROC 曲線分析結果顯示,TNF-α、IL-6 及IL-2聯(lián)合檢測的曲線下面積(AUC)、敏感度、特異度分別為0.822、0.899、0.922,均明顯高于單一檢測(P<0.05)。見表3、圖1。

表3 TNF-α、IL-6、IL-2 對乳腺癌患者預后的預測價值Table 3 Predictive value of TNF-α,IL-6 and IL-2 on prognosis of breast cancer patients

圖1 ROC 曲線Figure 1 ROC curve
3 討論
乳腺癌是較為常見的一種疾病,其發(fā)病率位居女性惡性腫瘤第一位。相關報道顯示,TNF-α、IL-6、IL-2 等細胞因子在腫瘤形成過程中具有重要作用,分析患者細胞因子水平變化與預后的關系,將為乳腺癌的治療及預后評估提供可靠依據[7]。
TNF-α 是由活化的巨噬、單核及T 細胞分泌產生,可調控炎癥期間細胞遷移,在促進腫瘤細胞增殖、侵襲、誘導細胞凋亡中具有重要作用[8]。Roy等[9]發(fā)現,乳腺癌患者TNF-α水平顯著高于正常女性,TNF-α高表達可作為乳腺癌不良預后的重要生物學指標。
IL-6 是由巨噬細胞、成纖維細胞等分泌的一種細胞因子[10]。國內外報道發(fā)現,在胃癌、肺癌、卵巢癌等多種惡性腫瘤疾病中IL-6 呈高表達,IL-6 可促進癌細胞侵襲與轉移,導致紫杉醇化療耐藥[11]。郭曉鶯等[12]發(fā)現,IL-6 在乳腺癌患者中呈高表達,且與淋巴結轉移、激素狀態(tài)有關,IL-6 越高者預后越差。
IL-2 又可稱為T 細胞生長因子,可促進細胞毒作用,調節(jié)免疫功能[13]。Ewelina 等[14]研究指出,在惡性腫瘤患者體內,內源性IL-2 產生能力及腫瘤細胞對IL-2 的反應能力均降低,往往導致癌細胞進一步惡化、浸潤與轉移。本研究結果顯示,與對照組相比,乳腺癌患者TNF-α、IL-6 水平更高,IL-2 水平更低。考慮其原因可能是由于乳腺癌患者體內巨噬細胞吞噬或胞飲抗原物質,導致炎癥反應加重,促使單核細胞產生大量TNF-α、IL-6,從而使得血清TNF-α、IL-6 水平增高;而乳腺癌患者自身存在細胞免疫功能紊亂,T、B 淋巴細胞比例失調,進而導致IL-2 水平下降[15]。說明TNF-α、IL-6、IL-2 在乳腺癌發(fā)生、發(fā)展中具有重要作用,可作為評估乳腺癌的有效指標。經化療治療后,乳腺癌患者上述因子水平均明顯改善。推測其原因可能是由于化療可減輕腫瘤導致的免疫抑制,使免疫失調重新趨于平衡,增強對化療的耐受能力,而TNF-α、IL-6 水平低表達、IL-2 水平高表達可刺激T 淋巴細胞的增殖與分泌,從而間接有利于患者預后改善。表明抑制TNF-α、IL-6 表達、上調IL-2 分泌可促進腫瘤細胞凋亡或壞死,可能成為有效控制乳腺癌發(fā)生、發(fā)展的有效途徑之一。進一步研究發(fā)現,預后良好組TNF-α、IL-6 水平明顯低于預后不良組,IL-2 高于預后不良組,說明TNF-α、IL-6、IL-2 可作為乳腺癌預后評估的指標。ROC 曲線結果顯示,TNF-α、IL-6、IL-2聯(lián)合預測晚期乳腺癌預后的AUC 最高,說明多項指標聯(lián)合檢測可有效減少篩檢的誤診、漏診率。Singh 等[16]報道亦發(fā)現,阻斷TNF-α、IL-6 信號通路、重組人IL-2 可抑制癌細胞進展與轉移,側面反映了上述因子對晚期乳腺癌的預后具有一定預測價值,與本研究報道相符。
綜上所述,TNF-α、IL-6、IL-2 在晚期乳腺癌患者中呈異常表達,可作為評估化療治療療效及預測患者預后的有效輔助指標。

