納米纖維素的制備及其在醫藥領域的應用進展*
宋驪澄,閆超英,于新宇,韓淼淼,徐環斐
(青島科技大學化工學院,山東 青島 266061)
生物質資源價格便宜,生物降解性良好,是一種具有納米尺度的纖維素生物質資源,具有低毒性、高比表面積,機械性能良好,故在醫藥、污水凈化、紡織、造紙等眾多領域具有廣泛的應用[1]。根據不同的結構、制備方法、主要原料,納米纖維素可以分為納米纖維素晶(CNC)、納米纖維素纖維(CNF)、細菌纖維素(BC)、靜電紡絲納米纖維素纖絲(ECC)不同種類[2]。制備納米纖維素的方法可以大致分為物理機械法、化學法、生物法[3]。選擇不同的方法進行制備,可以得到所需類型的納米纖維素。不同的制備方法各具優劣,故需要開發更加綠色高效的制備方法。制備納米纖維素載藥復合材料,將納米纖維素優良的物化性質與其他材料的優勢相結合,一方面增加了材料載藥量,增強了材料的強度,也為定點給藥、藥物緩釋提供了更大的可能及更廣闊的前景,例如減少抗癌藥物副作用或研發新型的口服給藥產品。納米纖維素多孔吸水、無毒害、可降解,適合構建納米纖維素基傷口敷料,對于傷口感染等皮膚表面創傷并發癥的治療有一定優勢。利用納米纖維素晶體作為生物墨水,在3D打印以及構建生物支架中應用,可被應用于再生醫學,通過對納米纖維素材料的復合改性,改良其相關性質,有望擴寬其在醫學領域的應用范圍。
1 納米纖維素的制備方法、表面改性及復合材料的加工
1.1 納米纖維素制備方法進展
纖維素的來源在一定程度上影響著納米纖維素的長度、結晶度、直徑等物理特性,當前通常選擇天然可降解的植物纖維作為原料制備納米纖維素。
在目前使用較為廣泛的納米纖維素制備方法中,酸解法較成熟,該法通過對纖維素原纖維無定形區進行水解,使纖維結晶區形成較為穩定的膠體分散納米纖維素材料[5]。由于破壞了纖維結構,且使用的酸易造成環境污染,故目前應用有機酸或固體酸進行酸解,并對使用的酸進行處理回收,很大程度上避免了強酸水解制備納米纖維素的弊端,逐漸被推廣提倡[6]。Wang等[7]使用混合H2SO4/HCOOH水解生產納米纖維素,在避免強硫酸水解的同時,提高了甲酸水解纖維素的水解效率,制備過程更加高效綠色、可持續。同時,Frederikus等球磨纖維素后用順丁烯二酸水解竹纖維素以制備納米纖維素,馬來酸酐易與羥基生成羧基,這使得納米纖維素產量更高且具有一定的膠體穩定性。
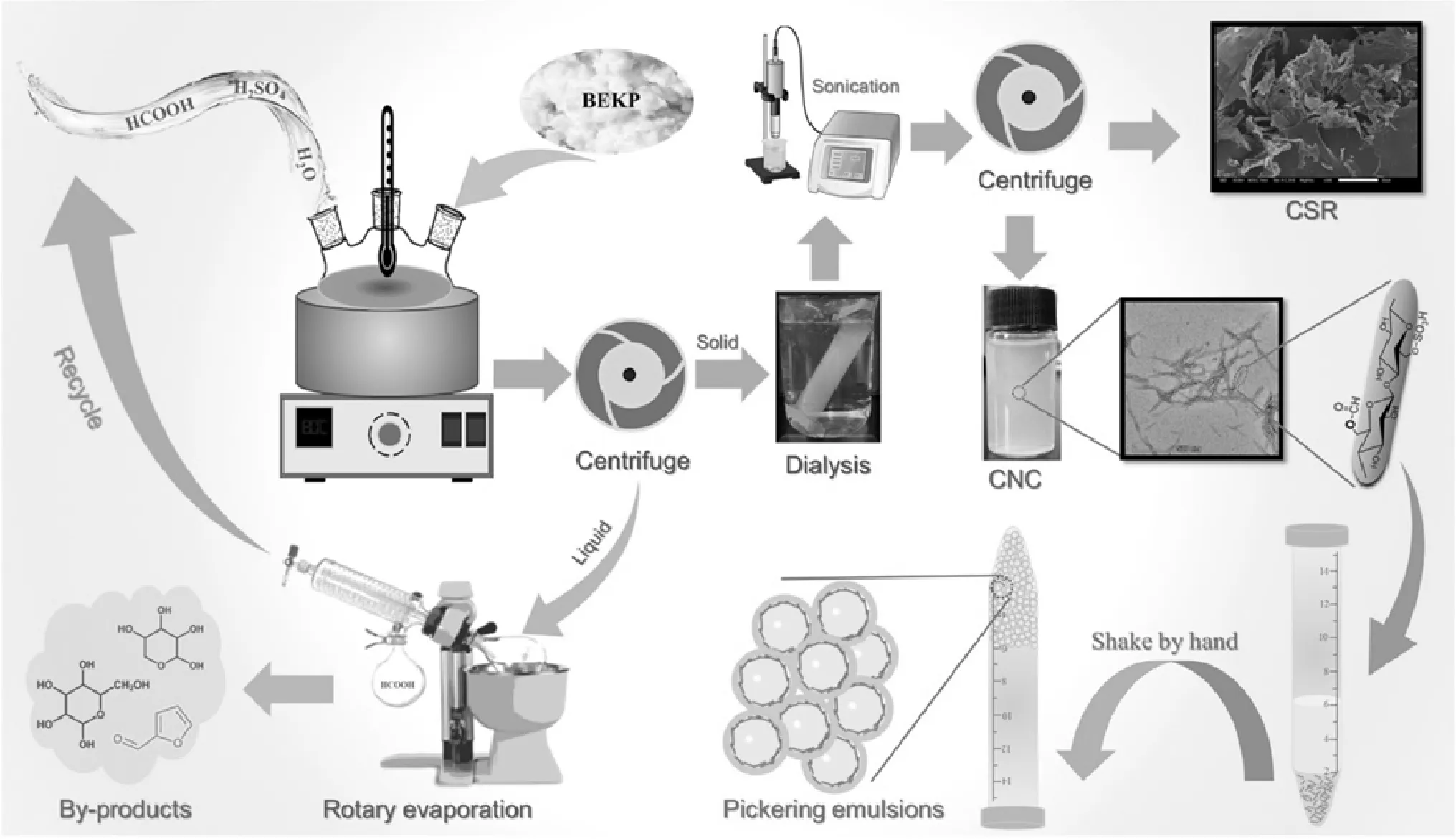
圖1 通過混合 H2SO4/FA 水解制備雙功能 CNCs研究過程

圖2 順丁烯二酸水解竹纖維素以制備納米纖維素研究過程
通過酶對纖維素進行改性、降解以獲得納米纖維素纖維的酶解法操作條件較為溫和,對環境污染小,但所用機理復雜,操作時間較長,效率較低下。而通過機械法如超聲擊碎、球磨、高壓均質等物理方法處理纖維素原料以縮小材料尺寸常需要持續輸入高能量。這兩種方式在生產效率及能耗上均有缺陷。
1.1.1 溶解再生法

圖3 溶解再生法制備納米纖維素的TEM圖[9]
普遍使用的納米纖維素方法各具優劣,故需新的技術方法提高納米纖維素的制備效率并實現操作簡化。近期,Yu等[9]采用磷酸溶解再生法進行制備,既不依靠去除纖維素非晶區,也不依靠機械作用,減小了物料損失并提高了制備效率,同時使用的磷酸腐蝕性小、安全性好、成本低。
另外,Gao等[10]利用含氯化鋰的二甲基乙酰胺(DMAc)溶解竹薄壁纖維素,在甘油-水溶液中再生制成纖維素薄膜,所制得產品具有較高強度和熱穩定性,證明了低濃度氯化鋰的DMAc溶液適用于再生溶解法。
再生溶解法避免了腐蝕性高、污染強的強酸溶解,更環保、高效、低成本,通過對溶劑特質的進一步研究,利用無機熔融鹽或者有機弱酸等更多可能的溶劑,將擴寬納米纖維素制備可能。
1.2 納米纖維素的表面改性
對纖維素進行復合加工以及表面改性是提高機械強度、疏水性及粗糙度重要的一步,常見纖維素的預處理方法為物理吸附法、接枝法以及細菌修飾法等。
目前TEMPO氧化法被學術界公認為是一種成熟有效的制備、化學修飾納米纖維素的方法,該法成本較低,較環保、操作簡單且反應條件溫和。Hippolyte等利用TEMPO氧化法,并通過兩步固定化過程,在水懸濁液中共價結合纖維素納米纖維,制備了納米纖維素。
此外,過硫酸銨(APS)可以直接降解木質素、半纖維素以及其他植物成分,通過簡單操作將纖維素原料加工為納米纖維素[12]。Neng等[13]利用工業牛仔廢料,通過APS氧化法在合適溫度等反應條件下,得到了長(76.14±8.56) nm、直徑(18.10±3.54) nm、結晶度83%的棒狀CNCs。
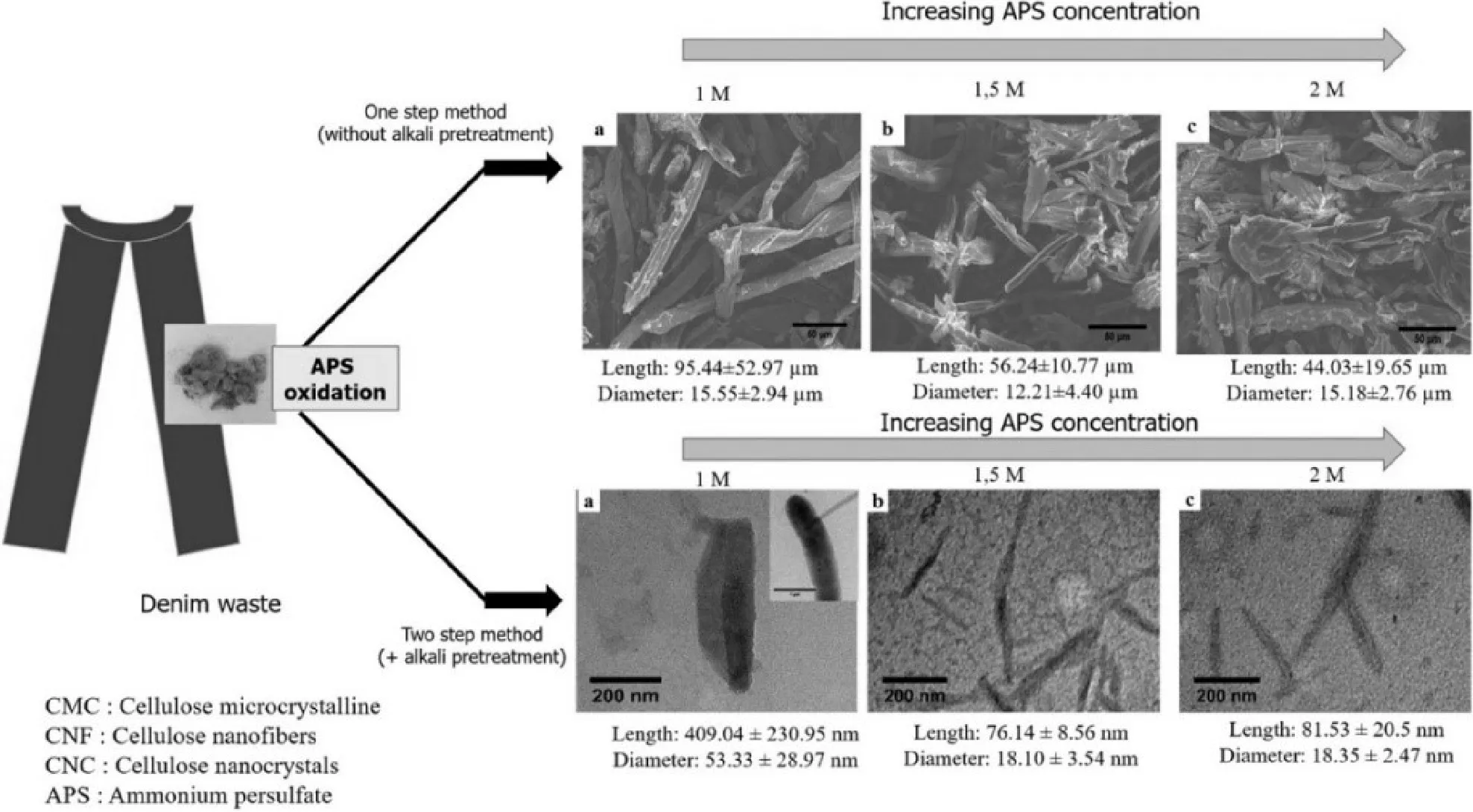
圖4 由牛仔廢料制備不同納米纖維素[13]
而APS處理纖維素耗時較長,APS需求量大,故該法并不被廣泛推用,Liu等利用N,N,N’,N’-四甲基乙二胺活化、超聲波促進崩解,提高了納米纖維素產率并減少了APS的使用量,為更高效、高產的制備提供了思路。
1.3 納米纖維素復合材料的加工
納米纖維素通過分層組裝以制備涂層和多層薄膜復合材料,或者通過一鍋定向組裝法生產高均勻度的厚層復合材料,可以精準地確定材料的成分性能。Sara等[15]在綠色高效超強酸固體催化劑Preyssler酸環境中,采用一鍋法合成了鏈狀CNPs,在環境溫度下,很短時間內成功構建了載抗壞血酸(CNPs/AA)的納米纖維素。
此外,靜電紡絲利用靜電作用,通過聚合物溶液可以制備致密的纖維素納米纖絲。Alireza等利用羧甲基纖維素(CMC)和聚乙烯醇(PVA),采用靜電紡絲法制備了載氟滅酸(FFA)載藥基因的生物相容性CMC/PVA納米纖維,將其用于藥物傳遞。Wang等[17]通過改進的雙浴I-ESP技術制備了光滑、連續的超細CA 納米纖維,簡化了制備方法,提高了生產效率。
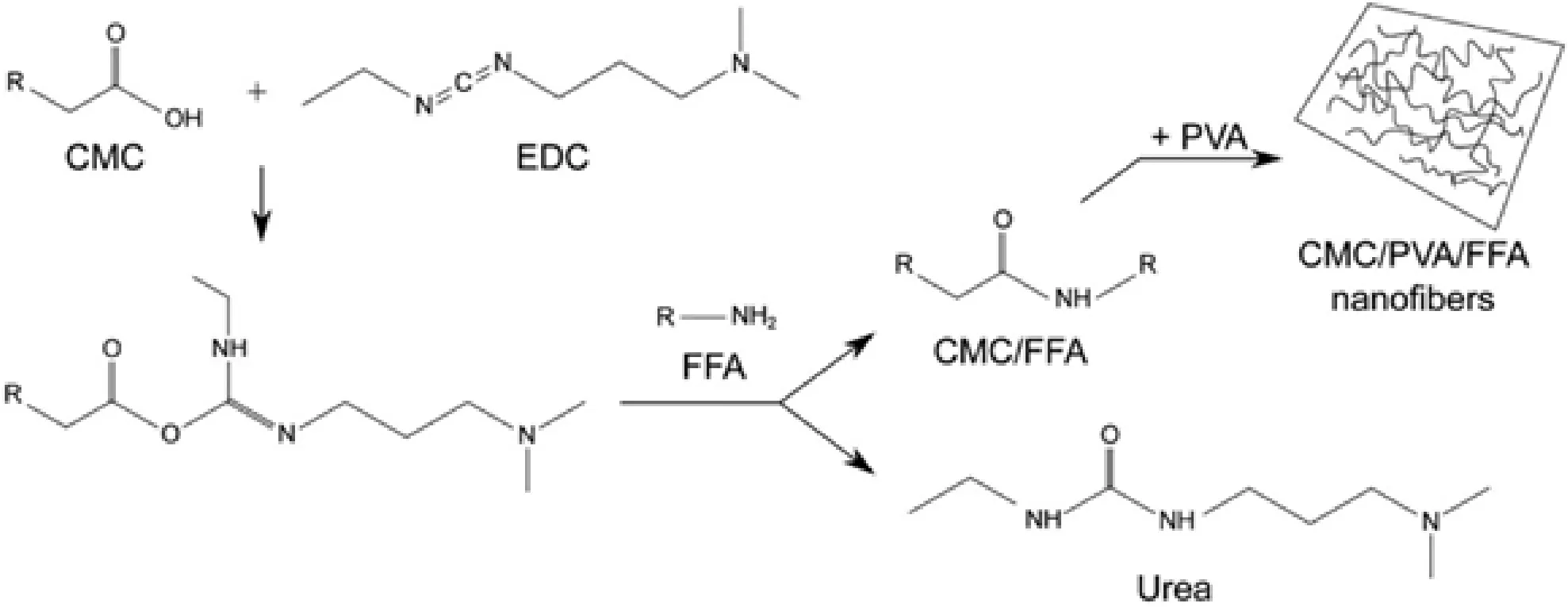
圖5 利用CMC、PVA 和 FFA 的化學結構,以EDC 作為
2 納米纖維素作為藥物載體的應用
藥物的傳遞機制通常是將藥物覆蓋于納米材料表面,或將藥物包裹傳遞至受損組織。納米纖維素具有較高的表面體積比、拉伸強度、剛度、柔韌度,良好的熱學性能,可以作為藥物載體搭載藥物進行定點釋放及藥物緩釋。
水凝膠材料具有高吸水性,對于親水藥物具有強大的包埋潛力,加入納米纖維素,被證明可以很好地調節水凝膠的力學性能和降解能力。Chen等[18]成功地構建了納米纖維素基、PH敏感、可控釋藥的水凝膠載體,并嵌入pH響應性二嵌段共聚物膠束中,實現了局部藥物遞送,并具有長時間刺激驅動和緩釋功能。珠狀水凝膠比表面積大,形態更適于藥物定點運輸。Mohammad等制備了納米羧甲基纖維素,將其接枝在球狀海藻酸鹽水凝膠上,藥物包載率高,實現了定向運輸,減少了藥物在胃部的釋放。
此外,通過對納米纖維素進行表面改性,使其更具疏水性,可以與疏水性非甾體抗炎藥的結合并持續釋藥,例如使用陽離子表面活性劑CTAB(N-十六烷基-N,N,N-三甲基溴化銨)、TBAB(四正丁基溴化銨)等修飾納米纖維素。Renu等制備出NCC后,通過CTAB的改性使NCC-CTAB具有更大的比表面積和高深寬比,作為緩釋給藥系統用于非甾體抗炎藥的體內給藥[21]。
2.1 納米纖維素在構建口腔速溶膜復合材料中的應用
納米纖維素基口腔速溶膜可以提高藥物溶出速度、快速釋藥,以納米纖維素為賦形劑的給藥系統既可以立即給藥,也可以持續給藥。通過口服控制給藥,減少給藥的頻率,避免極端給藥引起的不良反應和毒性,自動地控制藥物的濃度,同時便于兒童、老人以及吞咽困難患者服用藥物。近期,Kirandeep等在生物相容性PVA 中利用AmphotericinB(AmB)和乙基纖維素通過溶高壓乳化溶劑蒸發法成功合成了抗生素AmB-EC-NPs,完成構造口服給藥載體并實現了藥品的持續釋放。
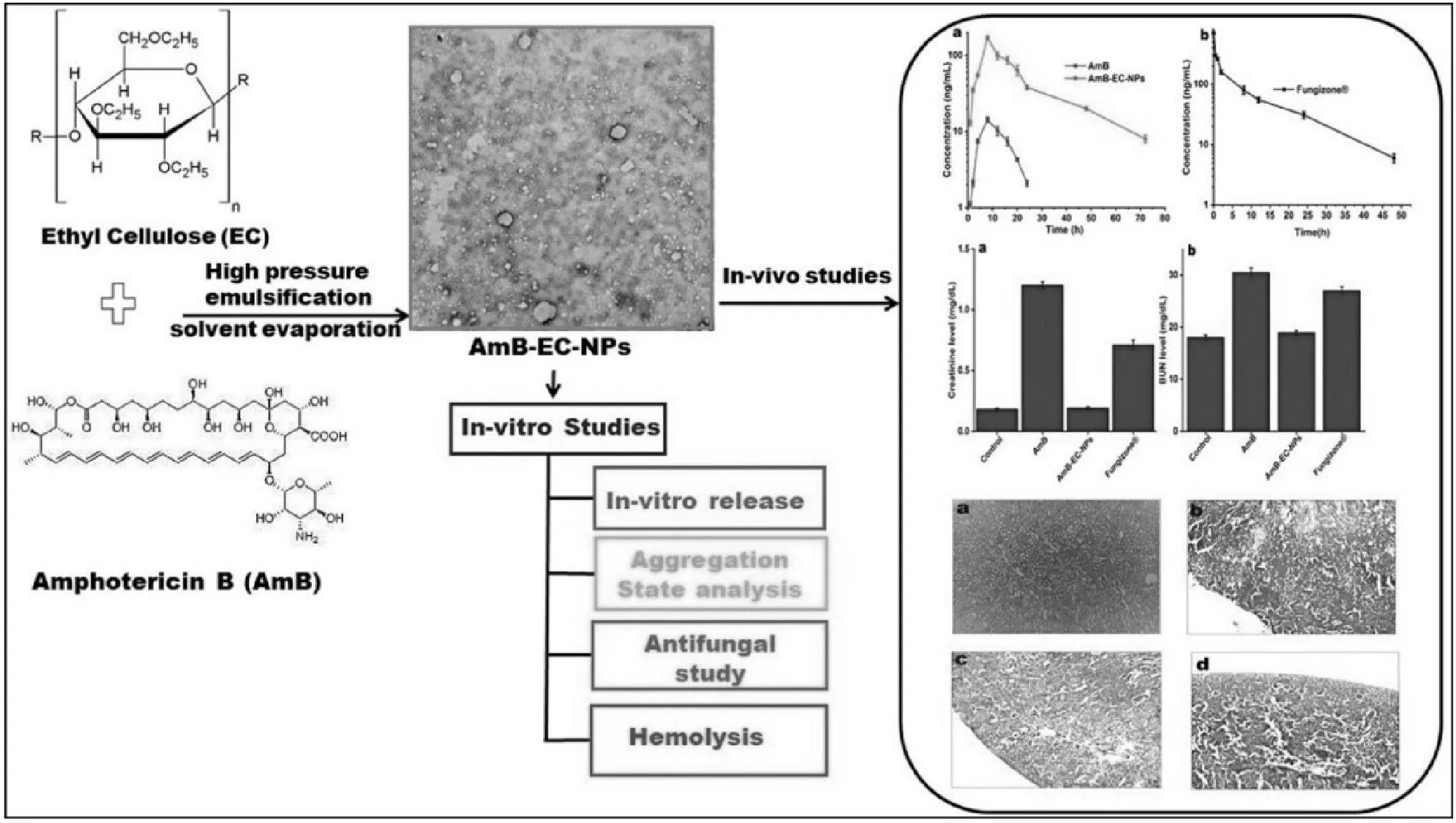
圖6 AmB、乙基纖維素合成抗生素AmB-EC-NPs研究過程
2.2 納米纖維素基復合材料在癌癥治療領域的應用
癌癥的治療是全人類共同面對的難題,傳統抗癌藥物的滲透性和水溶性較低,細胞毒性高,藥物很難在腫瘤部位釋放,從而損害正常細胞[24]。因此需要合適的載體,搭載藥物完成癌癥的靶向治療。納米纖維素與其他材料相結合可以完成對腫瘤的靶向治療,同時增強了藥用材料的載藥能力,可以作為藥物載體被廣泛應用在抗腫瘤治療中。例如,Jarosaw等使用甲氨蝶呤通過甲酯鍵與水溶性羥乙基纖維素連接,完成了搭載甲氨蝶呤抗癌藥物的研究,證明了納米纖維素可以作為甲氨蝶呤載體[25]。
另外,Ji-Hye等采用基于靜電相互作用的分層方法,將帶負電荷的CNC用化療藥物陽離子阿霉素(DOX)分子覆蓋以制備DOX@CNC,后用CD44受體靶向配體陰離子透明質酸(HA)聚合物包裹制備了桿狀HA@DOX@CNC,實驗產品作為生物相容性腫瘤靶向納米級給藥系統具有廣闊的前景。
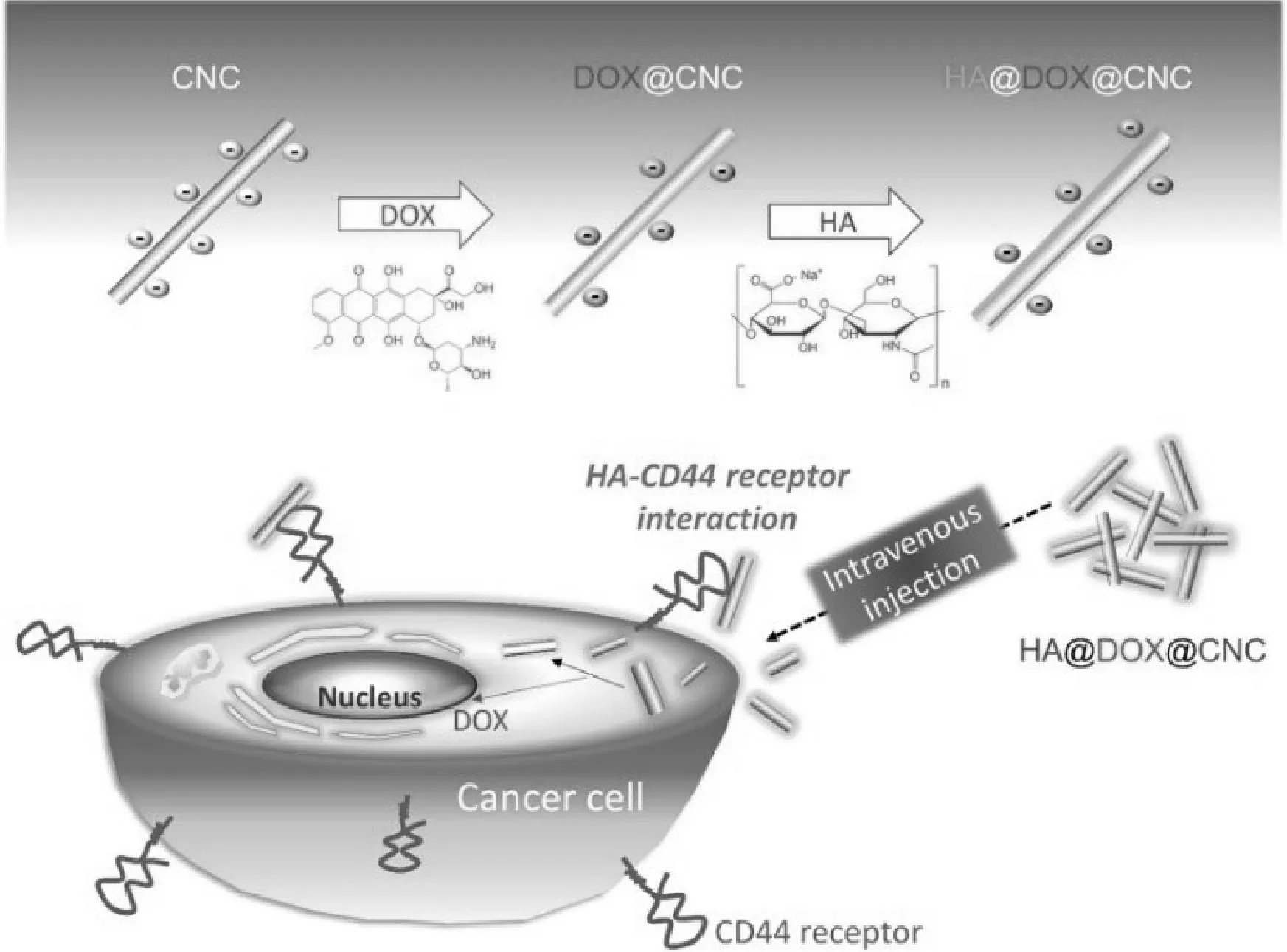
圖7 HA@DOX@CNC腫瘤靶向策略方案圖。
此外,siRNA作為一種可能的新型抗癌藥物,其遞送在體內可能具有高毒性和嚴重的副作用,Young等采用水熱脫硫和化學修飾的方法合成了陽離子型CNCs,后與滾環轉錄并利用Mg2+螯合得到的聚合siRNA絡合,所得復合物具有酶穩定性,可以敲除基因、誘導細胞凋亡,應用于癌癥治療。
3 納米纖維素作為傷口敷料中的應用
傷口愈合遲緩給患者帶來巨大的費用支出,給醫療系統帶來負擔,嚴重時對患者性命造成威脅。納米纖維素作為生物質資源,良好的生物相容性以及多孔材料的吸水性滿足了作為創面敷料所需的透氣、透濕、無毒的要求[29]。
3.1 細菌纖維素用作傷口敷料
學術界發現BC具有優良的持水、釋水能力,可以提供濕度大的環境,有利于傷處痊愈,但其加工具有一定的難度且細菌產量具有限制,導致制成實品較少。另外,BC的干燥時間較短,需要人力對敷料進行更換,導致資源浪費。目前對BC與其他物質進行交聯或者復合制備傷口敷料膜的研究越來越多,選擇不同材料得到的膜抑菌抗菌效果不同。
Oranattee等將純BC和與戊二醛(BG)交聯的BC 浸入有利于皮膚表面細胞再生的木瓜蛋白酶溶液中,使木瓜蛋白酶固定在BC上,大大降低了BC的機械性能,可以加速新組織的生長并具有良好的抑菌效果[30]。Wan等[31]通過新型原位生物合成法制備了BC和銀納米線(AgNWs)的復合材料,結果表明BC/AgNW傷口敷料能夠吸收傷口皮膚滲出物并維持水分環境,實現了銀的持續釋放,有利于皮膚再生。Irina Sulaeva等[32]則添加了海藻酸鈉使BC敷料的持水性得到了提高,并對所得BC/海藻酸鈉材料進一步浸聚六亞甲基雙胍鹽酸鹽(PHMB),抗菌材料比納米金屬更加安全高效且更有利于傷口愈合。Daria等[33]使用檸檬酸和催化劑如磷酸二鈉、碳酸氫鈉等進行簡單的BC交聯過程,優化的交聯BC水容量比現在商用敷料高1.5倍以上,可以用于制作高吸水的慢性傷口敷料。
3.2 醋酸納米纖維素用作傷口敷料
醋酸纖維素(CA)是一種具有生物相容性、較強親水性、較低成本的纖維素衍生物,易溶于大部分有機溶劑,可以利用靜電紡絲技術電紡為納米纖維傷口敷料。
Chen等[34]采用共靜電紡絲技術制備了多孔CA膜(含百里香酚),改善膜的疏水性,初始釋藥速度慢、釋藥時間長,提高了藥物利用率。Rasha等利用CA/聚環氧乙烷與疏水性聚乳酸混合,控制了藥物緩釋的親水比,所得敷料在生物活性和細胞相互作用方面具有明顯的優越性,使傷口處愈合更快[35-36]。
4 納米纖維素在醫藥領域的其他應用
手工細胞播種位置不精確,細胞分布隨機,通過構建生物支架可以在細胞友好的條件下精準地沉降生物細胞,控制其空間位置,實現定制化生產。納米纖維素較高的結晶度、分散性以及其自組裝等理化性質使其適合作為支架填料用于醫療領域。
近期,RagabE等[37]以漂白蔗渣漿與聚乙烯醇(PVA)交聯,制備了羧基和醛基雙功能CNF,將PVA接枝CNF與海藻酸鈉混合,制備了三維打印海藻酸鈉/PVA接枝CNF水凝膠,可用于骨組織工程領域充當支架。Sayan等[38]由海藻酸鈉、明膠和CNC制備了3D打印混合生物降解水凝膠,有利于細胞增殖、粘附、營養物交換和基質礦化,雜化支架機械強度較純聚合物支架強。Semra等[39]制備了含有聚己內酯(PCL)/明膠(Gel)納米纖維復合支架的BC納米晶體(BCNC),測試發現PCL/ Gel/BCNC可促進軸突生長和伸長,是一種很好的仿生GBM腫瘤平臺候選材料。
5 結 語
納米纖維素比表面積、強度均較高,結構性能優良,推動納米纖維素技術發展已經成為多個國家重要的技術發展要求。當前,納米纖維素材料供大于求,其較高的成本亟待新的技術手段來降低,通過創新制備方法,采取更加環境友好型、產率更高的制備方法,解決納米纖維素耗能高的現狀,繼續擴寬納米纖維素在不同領域的應用前景。此外,納米纖維素應用于醫療領域,其生物安全性及降解性需要提高一定的標準,即需要考慮納米纖維素的毒性再進行應用。其在醫藥領域在眼部、牙組織方面應用較少,可以在這些方面進行更加廣泛的研究,以節約醫藥不同領域的成本、環保問題。

