外源性去除神經對結腸炎大鼠的治療作用及可能作用機制▲
張 京 董 琦 全瑩禹
(1 海南省婦女兒童醫學中心普外腫瘤外科,海南省海口市 570312;2 海南省人民醫院兒科,海南省海口市 570311)
結腸炎是一種由多種原因引起的慢性、復發性結腸炎癥,目前大多數學者認為免疫因素在結腸炎的發生和發展中起重要作用。結腸受外源性神經和內源性神經共同支配,神經元是腸壁神經系統和高級中樞神經系統相互聯系的紐帶,可動態地調節結腸的功能和維持結腸的正常生理狀態[1-3]。 游離狀態下的腸道可通過誘導處于增殖狀態的T淋巴細胞發生S期阻滯,直接抑制T淋巴細胞的增殖,同時減少致炎性Th(Th1、Th2、Th17)和具有免疫抑制性的調節性T淋巴細胞在病變黏膜中的浸潤,從而抑制促炎因子和抗炎因子的過度分泌,調節細胞因子網絡平衡,最終鈍化適應性免疫應答,全面抑制炎癥性腸病發展過程中的攻擊性免疫反應[4]。腸道在游離狀態下不受神經支配,去神經手術同樣使結腸不受神經支配,由此我們推測去神經手術可影響腸道的免疫功能。故本文使用葡聚糖硫酸鈉誘導建立大鼠結腸炎模型后予行去神經術,通過檢測結腸組織中分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)、白細胞介素(interleukin,IL)-1β、IL-18的表達水平及外周血巨噬細胞M1/M2比值,探討去神經對結腸炎大鼠的治療作用和可能作用機制。
1 材料與方法
1.1 實驗動物 32只SD大鼠由南方醫科大學實驗動物中心提供[許可證SCXK(鄂)2019-0001,武漢華聯科生物技術有限公司],雌雄各半,150~180 g,周齡7~8周。將大鼠在濕度為50%、溫度為24 ℃左右條件下適應性喂養1周。
1.2 主要試劑和儀器 葡聚糖硫酸鈉(上海翌圣生物科技股份有限公司,貨號:60316EA25),HE染液(北京索萊寶科技有限公司,貨號:G112),蛋白質裂解液(武漢博士德公司,批號:SNl09),二喹啉甲酸試劑盒(碧云天生物技術研究所,批號:C0105),兔源SIgA單克隆一抗(英國Abcam公司,貨號:ab245115),GAPDH抗體(北京同立海源生物科技有限公司,貨號:BC025840),辣根酶標記羊抗兔SIgA二抗(北京中杉金橋生物技術有限公司,貨號:GAl014),SIgA免疫組化試劑盒[杭州聯科美訊生物醫藥技術有限公司,貨號:(IM)-(01)-0208],IL-1β、 IL-18 ELISA試劑盒(武漢恩菲生物科技有限公司,貨號:EH0185,EH0036),FcR-block(碧云天生物科技有限公司,批號:ab153521),CD86抗體(eBioscience公司,批號:20190516),CD163抗體(eBioscience公司,批號20200819)。GS-15R型離心機(美國Beckman公司),BIOBASE-EL10A型酶標儀(山東博科再生醫學有限公司),CX23型生物顯微鏡(日本Olympus公司),CytoFLEX流式細胞儀(美國BD公司)。
1.3 分組和建模方法 采用隨機數字表法將32只大鼠分為正常組、結腸炎組、去神經組、去神經+結腸炎組,每組8只。實驗前,各組大鼠均正常飲食,適應性喂養1周后開始實驗。首先構建結腸炎大鼠模型,使用純凈水將葡聚糖硫酸鈉配制成3%的溶液,作為結腸炎組和去神經+結腸炎組大鼠的日常飲水,其余組大鼠均正常飲用純凈水。如大鼠出現肉眼血便、黏液樣便、腹瀉,同時毛色變差、活動度下降、進食量減少、體重下降,則判定結腸炎大鼠模型建模成功。本研究中結腸炎組和去神經+結腸炎組所有大鼠均建模成功。建模1周后,采用戊巴比妥鈉溶液50 mg/kg通過腹腔注射麻醉去神經組和去神經+結腸炎組大鼠,麻醉成功后模擬結腸手術過程,即在保留近腸壁系膜血管弓的前提下,離斷部分結腸系膜,使其失去外源性神經的支配。正常組、結腸炎組未給予手術干預。
1.4 收集標本 術后14 d處死大鼠,抽取腹腔主動脈血3 mL,3 000 r/min離心10 min后取上清,置于-70 ℃冰箱中保存備用,并留取大鼠結腸組織備用。
1.5 組織病理學觀察 取結腸炎組、去神經+結腸炎組大鼠病變結腸組織,其他組均取相對應的結腸組織,制成石蠟切片,行HE染色后觀察大鼠結腸組織黏膜及肌層形態變化。
1.6 結腸組織中SIgA表達情況的檢測 (1)免疫組化檢測:取結腸炎組、去神經+結腸炎組大鼠病變結腸組織,其他組均取相對應的結腸組織,制成石蠟切片,采用免疫組化試劑盒檢測各組大鼠結腸組織SIgA表達情況,其中棕色細胞為陽性細胞,隨機選取3個視野,在×200倍視野下計算陽性細胞數,取平均值。(2)Western blot檢測:取結腸炎組、去神經+結腸炎組大鼠病變結腸組織,其他組均取相對應的結腸組織,加入蛋白質裂解液提取總蛋白,按照二喹啉甲酸試劑盒說明書進行蛋白定量。取煮沸變性后的蛋白質30 μg,行SDS-PAGE后,將蛋白移至PVDF膜,置于5%脫脂奶粉溶液中在室溫的條件下封閉1 h,緩沖液洗膜3次后加入一抗(1 ∶1 000),在4 ℃的環境下孵育過夜,使用緩沖液清洗3遍后加入二抗(1 ∶5 000),室溫條件下孵育1h后再次用緩沖液清洗3遍,進行ECL發光顯色。以GAPDH為內參蛋白,使用Quantity One軟件計算目的蛋白相對表達水平。
1.7 血清炎癥指標的檢測 采用ELISA試劑盒檢測血清中IL-1β、IL-18水平,嚴格按照試劑盒說明書進行操作。
1.8 外周血巨噬細胞的檢測 取5 mL血液標本,通過Ficoll密度梯度離心法分別獲取小鼠外周血單個核細胞。按照說明書操作,首先使用3 mL濃度為4%的FcR-block孵育5 min,接著依次加入5 μL濃度為20 μg/mL的CD86抗體和5 μL濃度為20 μg/mL的CD163抗體,室溫避光孵育20 min后,1 000 r/min離心5 min,棄去上清后用PBS洗兩次,最后用0.5 mL PBS重懸細胞,經濾紗過濾后,使用流式細胞儀檢測M1型巨噬細胞(CD86)和M2型巨噬細胞(CD163)比值,即M1/M2比值。
1.9 統計學分析 采用SPSS 21.0軟件進行統計分析。計量資料以(x±s)表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠結腸組織病理學變化 正常組大鼠腸黏膜上皮完整,黏膜下血管正常,腺體結構排列規則,無充血水腫,無糜爛潰瘍。結腸炎組大鼠結腸黏膜上皮破潰、脫落,腺體被破壞,存在大量炎性細胞浸潤、血管明顯擴張充血、肉芽組織增生、潰瘍及不同程度灶性糜爛形成的現象,進一步提示建模成功。去神經組大鼠結腸組織可見少量炎性細胞浸潤,以及輕微潰瘍形成。去神經+結腸炎組大鼠結腸組織的炎性細胞浸潤現象及潰瘍程度均較結腸炎組大鼠有所改善。見圖1。
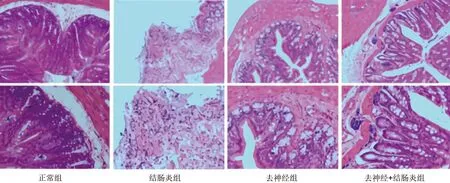
圖1 4組大鼠結腸組織形態變化(HE染色;上、下圖放大倍數分別為×100、×200)
2.2 各組大鼠結腸黏膜中SIgA的表達情況 (1)免疫組化染色顯示,與正常組相比,結腸炎組、去神經組大鼠結腸黏膜中SIgA表達陽性的細胞均減少(均P<0.05);與結腸炎組相比,去神經+結腸炎組大鼠結腸黏膜中的SIgA表達陽性的細胞增加(P<0.05)。見表1和圖2。(2)Western blot實驗結果顯示,與正常組相比,結腸炎組、去神經組的SIgA蛋白表達水平均降低(均P<0.05);與結腸炎組相比,去神經+結腸炎組的SIgA蛋白表達水平升高(P<0.05)。見表1和圖3。
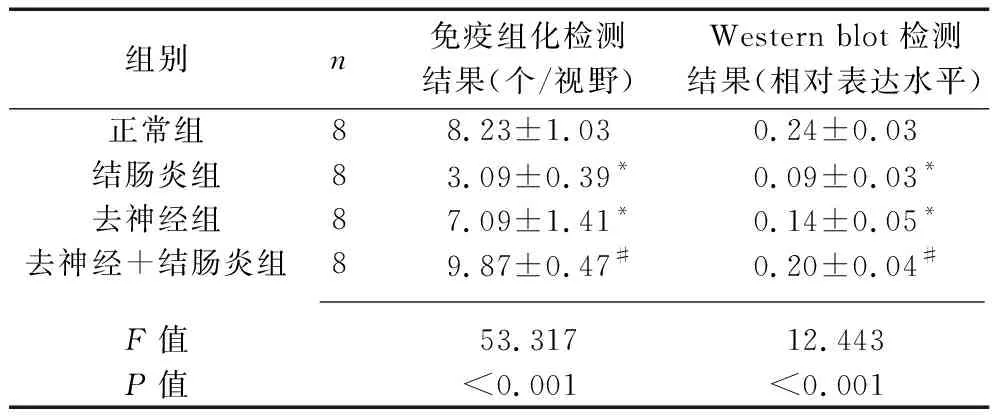
表1 4組大鼠結腸黏膜SIgA蛋白表達水平的比較(x±s)
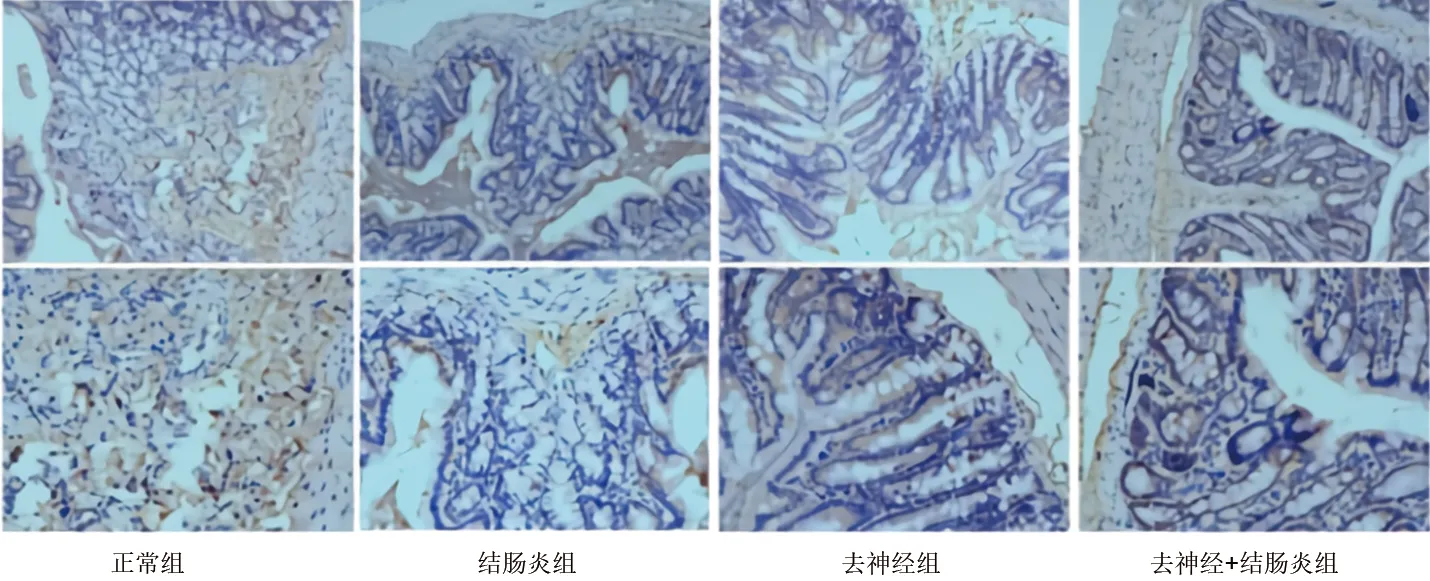
圖2 4組大鼠結腸黏膜中SIgA表達的免疫組化檢測結果(上、下圖放大倍數分別為×100、×200)
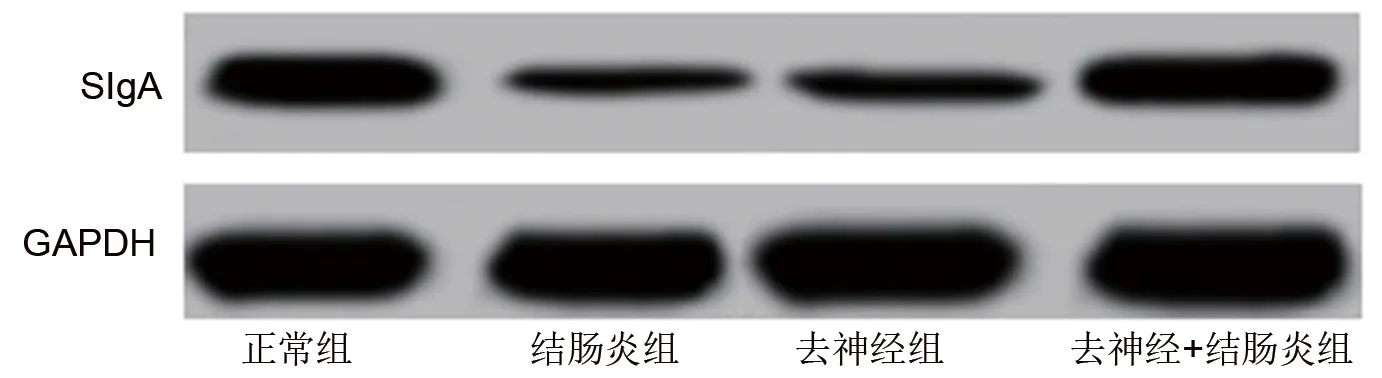
圖3 各組大鼠結腸黏膜組織SIgA表達水平的Western blot檢測結果
2.3 各組大鼠血清IL-1β和IL-18水平的比較 與正常組相比, 結腸炎組、去神經組、去神經+結腸炎組的血清IL-1β和IL-18水平均增加(均P<0.05);與結腸炎組相比,去神經+結腸炎組的IL-1β和IL-18水平均降低(均P<0.05)。見表2。

表2 4組大鼠血清IL-1β與IL-18水平的比較(x±s,pg/mL)
2.4 各組大鼠外周血巨噬細胞分化情況的比較 與正常組相比, 結腸炎組、去神經組、去神經+結腸炎組外周血M1/M2比值均增加(均P<0.05);與結腸炎組相比,去神經+結腸炎組外周血M1/M2比值降低(均P<0.05)。見表3和圖4。
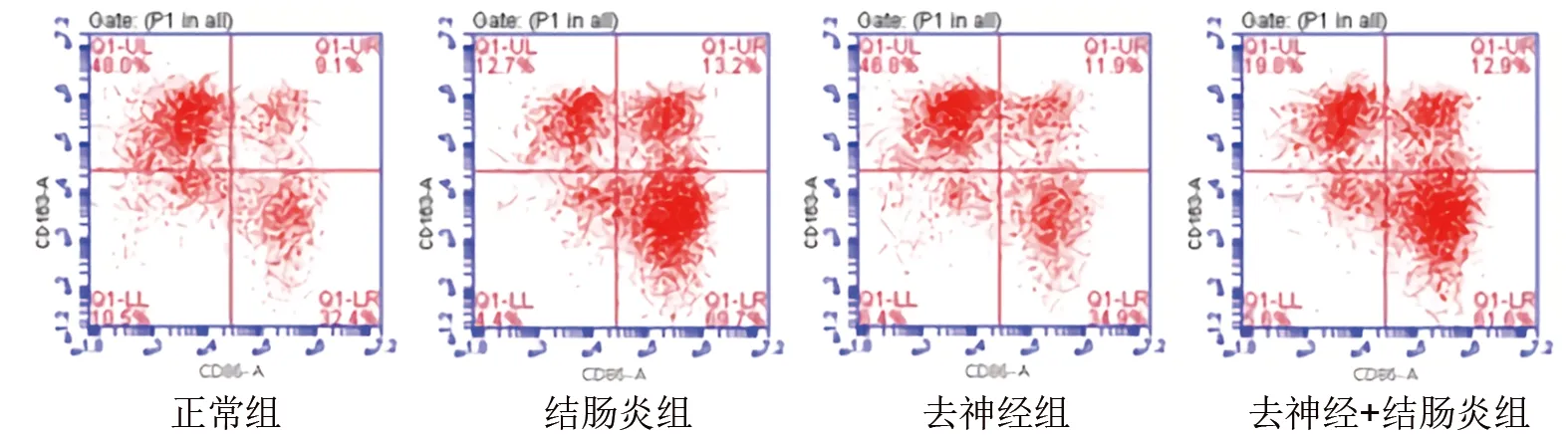
圖4 4組大鼠外周血中M1型和M2型巨噬細胞分化的情況

表3 4組大鼠外周血M1/M2比值的比較(x±s)
3 討 論
在生理狀態下,結腸接觸大量的抗原,為維持正常的生理功能,其免疫耐受和防御方面須保持平衡,而過強或減弱的免疫應答都會導致結腸出現病理狀態[5]。神經系統與免疫系統之間存在腦-腸軸的反饋作用體系,該體系在調節免疫應答中起到重要作用。外源性神經和內源性神經共同調節結腸的運動、免疫、分泌、吸收等各項生理功能。其中外源性神經由交感神經和副交感神經組成,通過釋放神經遞質并作用于內源性神經上的受體來實現調控,當外源性神經損傷時必定會導致神經遞質數量和受體敏感性發生變化[6]。而失去了外源性神經支配,結腸正常的免疫調控必定受到影響。
本研究采用3%葡聚糖硫酸鈉代飲水建立結腸炎大鼠模型,并參照相關文獻[7]對大鼠進行模擬結腸手術處理,利用HE染色觀察各組大鼠腸組織結構變化,結果顯示與正常組相比,結腸炎組大鼠的結腸腺體被破壞,可見大量炎性細胞浸潤,而與結腸炎組相比,去神經+結腸炎組大鼠結腸組織可見少量炎性細胞浸潤,腺體結構較為規則。這提示去神經手術能夠改善結腸炎大鼠結腸組織的病理情況,對結腸炎大鼠有治療作用。
SIgA是腸黏膜表面的主要抗體,其在阻止病原菌的入侵中發揮著關鍵性的作用。SIgA進入腸道后能選擇性地包被革蘭陰性菌,形成抗原-抗體復合物,阻礙細菌與上皮細胞受體結合;同時其可刺激腸道黏液分泌并加速黏液層的流動,從而有效地阻止細菌對腸黏膜的黏附[7]。此外,SIgA對某些病毒、細菌具有抗體活性,能抑制病毒繁殖,是消化道黏膜防御系統的主要成分[8-9]。通過檢測SIgA的分泌表達情況及結腸組織中T淋巴細胞亞群的分化情況,可評估結腸黏膜免疫屏障功能[10]。本研究的免疫組化和Western blot檢測結果顯示,與正常組相比,結腸炎組大鼠結腸組織的SIgA表達水平降低,而去神經+結腸炎組結腸組織的SIgA表達水平較結腸炎組有所升高(P<0.05)。這說明結腸炎發生后腸黏膜的SIgA表達下調,而去神經手術能夠在一定程度上提高結腸炎大鼠腸道的SIgA水平,從而發揮保護腸道黏膜的作用。
IL-1β能介導結腸炎早期的炎癥反應,刺激其他細胞因子和炎癥介質的產生,還能反饋性地促進巨噬細胞和T淋巴細胞分泌IL-2,進而加速炎癥反應[11]。IL-1β還可通過促進白細胞黏附分子的表達,使趨化中性粒細胞等炎性細胞進入腸道病變部位,引發腸道的炎癥反應,導致腸組織破壞[12]。IL-18具有促進IL-1和粒細胞-巨噬細胞集落刺激因子產生,刺激腫瘤壞死因子α和多種趨化因子合成,以及誘導Th1產生Ⅰ型干擾素等多種生物學功能[13]。結腸炎的發病與免疫調節功能紊亂有關,特別是細胞因子的異常表達,IL-18作為一種炎性反應前細胞因子,可誘導單核巨噬細胞釋放γ-干擾素,其在結腸炎的免疫異常及炎性反應中可能發揮重要作用[14]。且研究表明,IL-1β和IL-18具有一定的免疫調節作用,可影響結腸炎的發展[15]。巨噬細胞是一群異質細胞,根據其功能和表型主要可分為M1型及M2型。腸黏膜中存在大量巨噬細胞,其可在不同因素的刺激下分化成兩種不同的類型——經典活化巨噬細胞和替代活化巨噬細胞,從而產生不同的生物學效應。M1型及M2型巨噬細胞的失衡是腸道炎癥發生的關鍵[16]。本研究結果顯示,結腸炎組大鼠血清炎癥因子IL-1β和IL-18水平、外周血巨噬細胞M1/M2比值均升高,而去神經手術能夠有效降低結腸炎大鼠血清炎癥因子水平及外周血巨噬細胞M1/M2比值(P<0.05)。由此可見去神經手術能夠明顯改善結腸炎大鼠結腸組織的病理情況,對大鼠的免疫功能也具有顯著的調節作用。 原因可能是結腸炎發生時,體內炎癥因子會呈瀑布式釋放,引起結腸道損傷[17];而外源性去除神經可通過抑制結腸的免疫反應來減輕這種炎性反應,從而發揮治療結腸炎的作用。機制可能是,T淋巴細胞是一個由多種相互關聯、相互制衡的亞群細胞組成的群體,結腸炎癥的實質就是T淋巴細胞中各亞群比例失調所引起的、以自身組織為攻擊目標的免疫反應造成的結果。外源性去除神經對結腸炎的治療作用可能與其直接的免疫抑制作用有關,即外源性去除神經可通過直接阻滯Th增殖,以及減少Th各亞群(如Th1、Th2)在病變黏膜中的浸潤,而抑制促炎因子γ-干擾素、IL-4、IL-12p70、IL-17和抗炎因子IL-10的分泌,最終全面抑制結腸炎發展過程中的攻擊性免疫反應。
值得注意的是,本研究中,與正常組相比,去神經組大鼠結腸組織可見少量的炎性細胞浸潤,SIgA表達水平降低,血清炎癥因子IL-1β和IL-18水平、巨噬細胞M1/M2比值水平均升高。這說明去神經手術可對正常結腸組織造成一定的影響,在一定程度上降低了保護性抗體SIgA的水平,并增強正常結腸的炎癥反應。因此,外源性去除神經或許可成為治療急性結腸炎的潛在手段,但需在明確診斷和適應證后實施,以免對正常結腸組織造成傷害。
綜上所述,外源性去除神經對結腸炎大鼠有一定的治療作用,其可能通過上調保護性SIgA的表達、抑制外周血巨噬細胞向M1型分化和炎癥因子的表達,來調控機體的免疫炎癥反應,從而發揮治療作用。這或可為外源性去除神經在臨床上的應用,以及成為治療急性結腸炎的潛在手段,提供了一定的實驗基礎。

