燃煤飛灰合成磁性沸石對脫硫廢水中Hg2+吸附性能
朱曉蕾,楊建平,李海龍,趙永椿,張軍營
(1.中南大學 能源科學與工程學院,湖南 長沙 410083;2.華中科技大學 能源與動力工程學院,湖北 武漢 430074;3.華中科技大學 煤燃燒國家重點實驗室,湖北 武漢 430074)
0 引 言
汞的危害已引起廣泛關注,煤炭燃燒被認為是全球最大的人為汞排放源之一[1]。煤中汞在高溫燃燒過程中幾乎全部轉化為單質汞(Hg0),隨煙氣溫度降低,部分轉化為氧化態汞(Hg2+)和顆粒態汞(Hgp)。其中,Hg2+水溶性較好,可被濕法煙氣脫硫(WFGD)系統脫除,脫硫廢水中的汞若未有效脫除,會對周圍環境和人類健康造成巨大危害[2-3]。
近年來含汞脫硫廢水的處理得到廣泛關注,目前處理方法主要是化學沉淀法、膜分離法、離子交換法、吸附法[4-7]等。化學沉淀法設備簡單、成本低,但易產生脫水困難的污泥。目前關于工業污水的排放標準日益嚴格,只依靠化學沉淀法難以達到廢水處理標準;離子交換法處理水量大且出水水質較高,但離子交換材料存在價格昂貴、交換容量有限等缺點;膜分離法選擇性高,可回收重金屬,但需要大量配套設備、處理成本較高;吸附法操作簡單,應用前景廣泛[8-10]。
在眾多吸附材料中,沸石是一種較有潛力的吸附劑,其中,X型沸石具有天然礦物八面沸石的骨架結構、較大的比表面積和孔道結構,為其成為吸附劑提供可能,且X型沸石骨架中負電荷較多,陽離子交換量較大,導致沸石電荷密度高且有較強的吸附能力,使X型沸石具有優良的吸附性能[11-14]。但沸石制備原材料較昂貴,使該類型吸附材料成本較高。沸石是一種含鋁、硅和氧的礦物,而燃煤副產物飛灰中含有大量硅鋁礦物,若能將其活化、提取鋁硅礦物,可作為沸石的制備原料,大幅降低生產成本。盡管目前燃煤飛灰制備沸石并用于煙氣脫硫廢水重金屬離子去除的研究較多,但沸石吸附重金屬離子后,難以從廢水中分離出來,重金屬離子的二次釋放等問題也亟待解決[15-16]。
飛灰中除含硅、鋁礦物外,還含有鐵質礦物(磁珠),若能將其分離出來,引入沸石制備過程中作為磁核,制備磁性沸石,既可實現燃煤飛灰的全組分利用,解決沸石成本高的問題,又可實現吸附劑的有效分離和安全處置的目標。因此,筆者采用飛灰合成了磁性沸石,系統研究了不同條件下脫硫廢水中汞的吸附性能,獲得了最佳吸附條件,為飛灰的精細化利用和燃煤脫硫廢水汞污染控制提供新思路。
1 試 驗
1.1 樣品制備及表征
1.1.1 樣品制備方法
研磨飛灰,過0.074 mm篩,在磁場強度2.4×104~2.4×105A/m下對飛灰進行干式磁選,干式磁選機為ERIEZ制造公司生產的交叉帶式磁選機(H.C.B)。磁選的磁珠作為制備磁性沸石的磁核。利用水熱法合成磁性沸石,制備流程如圖1所示。取一定量飛灰和NaOH顆粒按比例置于燒杯中調節鈉硅比,向燒杯中加入適量去離子水攪拌均勻,在室溫條件下攪拌陳化24 h。陳化后將液體轉移到高壓反應釜中,再加入適量分離出的磁珠,在100 ℃下恒溫水熱反應24 h。反應結束后對樣品進行抽濾,并用去離子水洗滌多次直至中性。最后將合成的磁性沸石烘干、儲存備用。

圖1 磁性沸石的制備過程Fig.1 Preparation process of magnetic zeolite
1.1.2 試驗表征方法
對合成的磁性沸石進行表征分析,表征方法如下:① 通過XRD分析樣品的晶相、晶體結構。使用SIMENS D500 X射線全自動衍射儀(Cu Kα)在電壓40 kV、電流40 mA、掃描速率10 (°)/min、0~80°下掃描。② 通過TEM觀察樣品微觀形貌,使用Tecnai G2 F20型場發射透射電鏡得到樣品透射電鏡(TEM)照片,工作電壓為200 kV。③ 通過BET測試分析樣品的比表面積及孔徑,使用ASAP2020孔結構比表面積分析儀。測試前,在80 ℃ 下脫氣120 min。④ 通過VSM對樣品進行磁性分析,使用LakeShore7404儀器在室溫下對樣品進行磁滯回線測試,磁場強度1.2×106A/m。
1.2 Hg2+吸附性能測試
取50 mL離心管放置于試管架上,將一定量磁性沸石置于其中,加入含Hg2+的模擬脫硫廢水25 mL,經振蕩抽濾離心后取上清液備用。用原子熒光吸收光譜儀測定溶液中Hg2+含量,計算磁性沸石對Hg2+溶液的平衡吸附量qe(mg/g)和脫除率η(%)。
qe=(C0-C)V/m,
(1)
(2)
式中,C0為模擬脫硫廢水溶液中Hg2+質量濃度,mg/L;C為經過磁性沸石吸附后溶液中Hg2+質量濃度,mg/L;m為磁性沸石添加質量,g;V為Hg2+溶液體積,L。
2 結果與討論
2.1 樣品表征
制備的磁性沸石表征結果如圖2所示。圖2(a)出現磁性沸石特征衍射峰、八面沸石衍射峰和磁珠衍射峰,且特征衍射峰強、峰形尖銳,說明合成的磁性沸石量大、結晶度好。由圖2(b)可知,制備的磁性沸石是以球形為主的核殼結構,沸石結晶良好、純度高,磁珠加入沸石后形成磁核被沸石包裹,為沸石提供磁性,這也與XRD結果相吻合。通過BET表征得到磁性沸石的比表面積為4.46 m2/g。由圖2(c)可知,磁性沸石的最可幾孔徑為18.25 nm,屬于介孔,有利于汞離子在孔道內擴散。由圖2(d)可知,沸石表現出磁化滯后,且矯頑力接近10 000 A/m,這種磁化特性使磁性沸石吸附汞后可通過外加磁場從脫硫廢水中分離出來。

圖2 磁性沸石表征Fig.2 Magnetic zeolite characterization
2.2 吸附條件對磁性沸石吸附Hg2+的影響
2.2.1 固液比對磁性沸石吸附的影響
取1組50 mL離心管置于試管架上,分別稱取0.025 0、0.050 0、0.100 0、0.125 0、0.187 5、0.250 0 g磁性沸石加入離心管中,加入200 mg/L含Hg2+溶液25 mL,設置吸附劑與含Hg2+溶液的固液比為1.0、2.0、4.0、5.0、7.5、10.0 g/L,調節溶液pH為5。將上述離心管在室溫下以250 r/min轉速振蕩60 min,離心后取上清液測定Hg2+濃度,確定最佳固液比。
不同固液比下Hg2+吸附性能如圖3所示,固液比從1 g/L增至4 g/L時,磁性沸石對Hg2+的脫除率明顯增大,固液比為4 g/L時,脫除率為89%;而后增幅減小,固液比為5 g/L時,脫除率達91%;繼續增大固液比,磁性沸石對Hg2+的脫除率趨于平衡,固液比10 g/L時,脫除率僅為92%。隨固液比增大,即吸附劑用量增加,Hg2+活性吸附位點相應增加,對Hg2+吸附總量增加,脫除率升高。固液比為5和10 g/L時Hg2+脫除率相當,磁性沸石對Hg2+吸附的最佳固液比設置為5 g/L。

圖3 不同固液比下Hg2+吸附性能Fig.3 Hg2+ adsorption under different solid-liquid ratios
2.2.2 溶液初始pH對磁性沸石吸附的影響
取1組50 mL離心管置于試管架上,稱取0.125 g 磁性沸石置于離心管中,設置吸附劑與含Hg2+溶液固液比為5 g/L,采用稀鹽酸或稀氫氧化鈉調節溶液pH為2、3、4、5、6。將上述離心管在室溫下以250 r/min轉速振蕩60 min,確定磁性沸石對Hg2+吸附的最佳初始溶液pH。
溶液不同初始pH的Hg2+吸附性能如圖4所示,可知磁性沸石對Hg2+的脫除率隨初始pH的增大先增大后減小。pH<5時,脫除率穩定上升,這可能是由于pH較低時,模擬脫硫廢水中的H+會與Hg2+爭奪磁性沸石表面的活性位點,從而發生吸附競爭,影響Hg2+的脫除效果。隨pH增大,模擬脫硫廢水中H+減少,導致Hg2+脫除率迅速上升;pH=5時,脫除率最大(91%);而pH>5后,脫除率開始下降,這可能是由于隨pH增大,磁性沸石表面的負電荷密度增加,吸附活性位點的去質子化作用導致磁性沸石對Hg2+的吸附能力下降,從而導致Hg2+脫除率降低。因此,磁性沸石對Hg2+吸附的最佳初始pH為5。
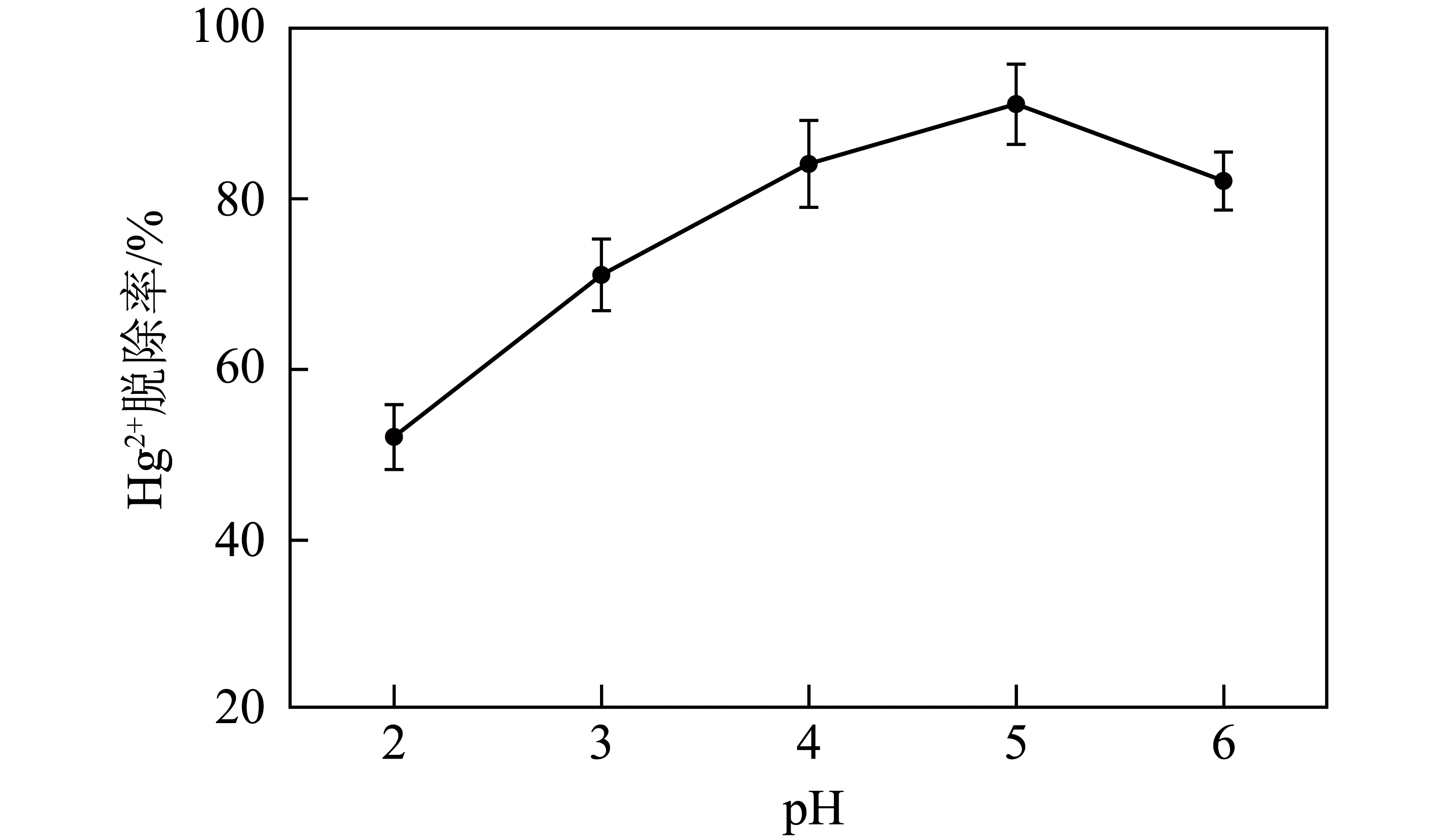
圖4 溶液不同初始pH的Hg2+吸附性能Fig.4 Adsorption of Hg2+ at different initial pH
2.2.3 溶液振蕩時間對磁性沸石吸附的影響
稱取0.125 g磁性沸石置于離心管中,設置吸附劑與含Hg2+溶液固液比為5 g/L,加入稀鹽酸或稀氫氧化鈉調節溶液pH,得到pH=5、質量濃度200 mg/L含Hg2+溶液25 mL。將上述離心管在室溫下以250 r/min轉速振蕩,分別振蕩5、15、30、45、60、90 min,確定磁性沸石對Hg2+吸附的最佳振蕩時間。
不同振蕩時間下Hg2+吸附性能如圖5所示,可以看出不同吸附時間下,磁性沸石對Hg2+的脫除率隨時間的增大先快速升高后增幅緩慢并趨于平緩。振蕩時間為60和90 min時,二者脫除率相近,分別為91%和92%,為確保吸附試驗完全進行,確定磁性沸石對Hg2+實現最佳吸附的溶液振蕩時間為90 min。
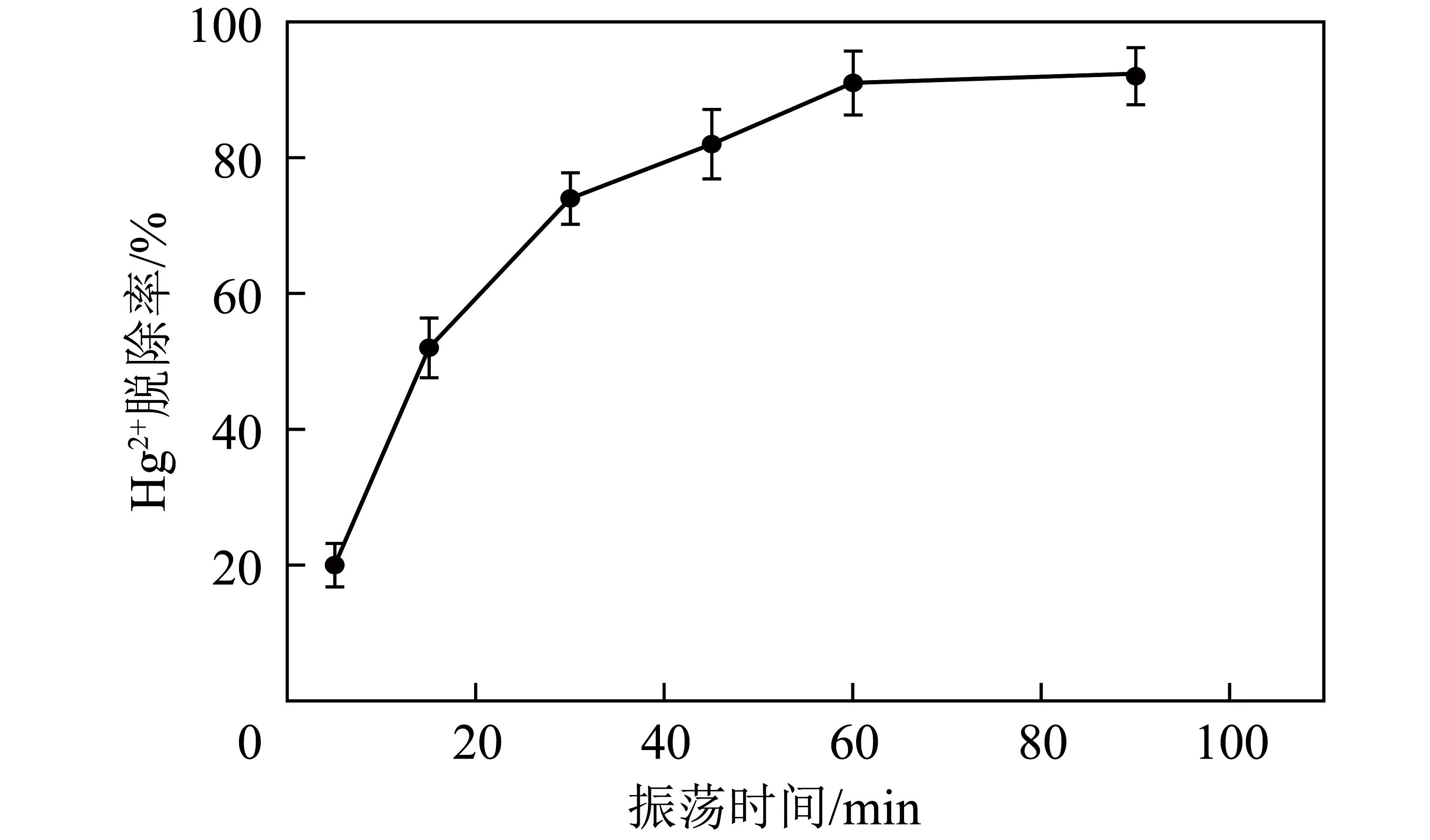
圖5 不同振蕩時間下Hg2+吸附性能Fig.5 Hg2+ adsorption under different shaking times
活性炭材料是目前研究最廣泛的汞吸附劑,通常以活性炭為載體,通過負載硫/鹵素進行改性。但活性炭吸附劑成本較高,且吸附汞后的活性炭難以從廢水中分離出來,面臨汞二次釋放,甚至改性劑(硫和鹵素)釋放污染。磁性沸石對汞離子的脫除率達90%以上,與常見的活性炭吸附劑性能相當[17-19],但磁性沸石原料易得、成本低,且吸附汞后易于磁選分離回收,優勢顯著。
2.3 磁性沸石對Hg2+的吸附動力學研究
2.3.1 吸附動力學
取1組50 mL離心管置于試管架上,稱取0.125 g磁性沸石置于離心管中,吸附劑與含Hg2+溶液固液比為5 g/L,加入稀鹽酸或稀氫氧化鈉調節溶液pH,得到pH=5、質量濃度200 mg/L含Hg2+溶液25 mL。將上述離心管在室溫下以250 r/min 轉速振蕩,分別振蕩5、15、30、45、60、90 min。離心后取上清液測定并且計算吸附后的Hg2+濃度以及磁性沸石對Hg2+溶液的平衡吸附量qe。
2.3.2 吸附動力學曲線
吸附動力學表征吸附劑吸附過程速率,通過動力學模型對數據擬合可得吸附動力學參數[20]。磁性沸石對Hg2+的吸附曲線如圖6所示,振蕩時間對Hg2+吸附量的影響規律與對Hg2+脫除率的影響相似,即隨時間增加,Hg2+吸附量先急劇升高而后增幅減小,最后趨于穩定,達到吸附平衡。振蕩時間90 min時,吸附量達23 mg/g。
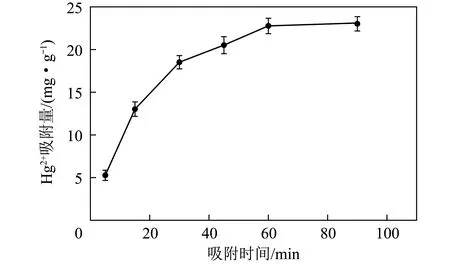
圖6 磁性沸石對Hg2+的吸附曲線Fig.6 Adsorption curve of zeolite for Hg2+
2.3.3 吸附動力學模型
為有效表征吸附過程,采用吸附動力學模型模擬吸附動力學數據相關性,模型公式為
準一級動力學模型:
ln(qe-qt)=lnqe-k1t,
(3)
式中,qe為平衡時吸附容量,mg/g;qt為t時刻吸附容量,mg/g;k1為準一級吸附速率常數,min-1。
準二級動力學模型:
(4)
式中,k2為準二級吸附速率常數,g/(min·mg)。
Weber and Morris顆粒內擴散模型:
qt=kipt1/2+C。
(5)
其中,kip為顆粒內擴散常數,mg/(g·min1/2);C為涉及厚度、邊界層的常數。以t1/2為橫坐標,qt為縱坐標作圖,由斜率和截距計算kip和C。
2.3.4 吸附動力學方程擬合
采用準一級和準二級動力學模型對數據進行擬合,相應擬合參數見表1,準一級動力學模型和準二級動力學模型擬合曲線如圖7所示。

圖7 磁性沸石對Hg2+的吸附擬合曲線Fig.7 Adsorption fitting curve of magnetic zeolite for Hg2+
由表1可知,準一級動力學模型與Hg2+吸附量隨時間變化擬合較好,相關系數R2為0.996 4。采用準一級動力學模型計算的平衡吸附容量為23.24 mg/g,
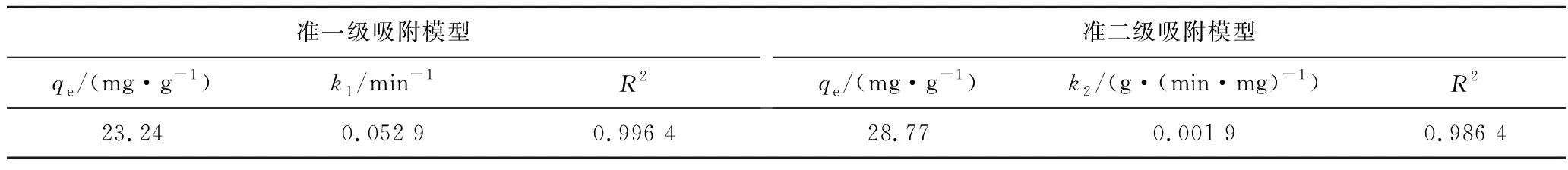
表1 動力學擬合參數
接近試驗值(23 mg/g),進一步證明采用準一級動力學模型表征磁性沸石吸附Hg2+動力學非常可靠。采用準二級動力學模型模擬Hg2+吸附過程,R2為0.986 4,低于準一級動力模型的相關系數,平衡吸附容量為28.77 mg/g,遠高于實際值。因此,針對磁性沸石的Hg2+吸附過程,采用準一級動力學模型優于準二級動力學模型。
在相同溫度、吸附時間0~90 min條件下,以吸附量qt為縱坐標,t1/2為橫坐標作圖,采用顆粒內擴散方程對磁性沸石吸附Hg2+試驗數據進行擬合,擬合曲線如圖8所示。由圖8可知,磁性沸石對Hg2+吸附的顆粒內擴散方程擬合曲線為不過原點的直線。顆粒內擴散常數kip為2.47,C為2.56,相關系數R2為0.860 0,相關性良好,因此顆粒內擴散不是平衡前吸附過程的唯一影響因素。
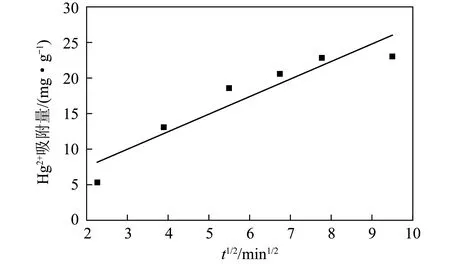
圖8 Weber-Morris方程擬合曲線Fig.8 Weber-Morris equation fitting curve
3 結 論
1)以燃煤飛灰為原料,利用水熱法合成了X型磁性沸石,并采用BET、XRD、TEM等表征手段對樣品進行表征分析。結果表明X型磁性沸石結晶純度高,有一定磁性,矯頑力接近10 000 A/m,最可幾孔徑為18.25 nm,為吸附汞離子提供可能。
2)研究了不同固液比、溶液初始pH、振蕩時間對Hg2+吸附性能的影響,結果表明,Hg2+脫除率隨固液比增加先上升后趨于平緩,最佳固液比為5 g/L;隨溶液初始pH增加,Hg2+脫除率先上升后下降,最佳pH為5;隨振蕩時間的增加,Hg2+脫除率先急劇上升而后趨于平緩,最佳振蕩時間為90 min。在最佳吸附條件下脫汞率達92%。
3)Hg2+吸附量隨時間的變化和準一級動力學模型擬合較好,相關系數R2為0.996 4,計算的平衡吸附容量為23.24 mg/g,與試驗值(23 mg/mg)接近;對Hg2+吸附的Weber and Morris顆粒內擴散方程擬合曲線為不過原點的直線,相關性良好,因此顆粒內擴散不是吸附過程中的唯一影響因素。

