FTO介導RNA的m6A修飾與發育的研究進展
潘明敏,王啟陽,楊麗萍
(河南中醫藥大學 中西醫結合基礎學科, 河南 鄭州 450046)
隨著RNA甲基化免疫共沉淀高通量測序(m6A-specific methylated RNA immunoprecipitation with next generation sequencing, MeRIP-seq)技術的出現,大量可逆的化學修飾開始被深入鑒定和研究,尤其是6-甲基腺嘌呤(N6-methyladenosine,m6A)修飾。m6A修飾作為mRNA上最為常見的甲基化修飾形式,可以調控真核生物mRNA的剪接、出核、穩定和翻譯,同時參與了干細胞分化,精子發生、腦發育等多種生物學功能。m6A修飾受甲基轉移酶、去甲基化酶和結合蛋白的協同調控。甲基化酶包括METTL3(methyltransferase like 3)、METTL14(methyltransferase like 14)、WTAP(Wilms’ tumor 1-associating protein),去甲基化酶包括FTO(fat mass and obetity associated protein)和ALKBH5(alkB homolog 5),結合蛋白主要是YTH結構域蛋白,包括YTHDF1(YTH domain family member 1)、YTHDF2(YTH domain family member 2)、YTHDF3(YTH domain family member 3)、YTHDC1(YTH domain containing 1)和YTHDC2(YTH domain containing 2),當參與m6A修飾的酶或結合蛋白表達異常,可導致發育受阻并產生多種疾病。
本文對首次鑒定提出的m6A去甲基化酶FTO及其介導的生長發育進行闡述,以期能深入了解FTO在生長發育和疾病發生發展過程中的變化規律。
1 FTO
1999年在對插入突變產生的具有融合腳趾(fused toes,FT)表型小鼠研究中發現,Fto基因是突變所致缺失的一個最長基因,涵蓋超過400 kb的基因組序列,其不僅在成年小鼠組織中廣泛表達,在胚胎發育過程中也起著重要作用[1-2]。2007年全基因組關聯分析提示它與人體體質指數(BMI)增加和肥胖密切相關,并將其命名為脂肪含量和肥胖相關基因(fat mass and obesity associated protein)[3]。對其結構進行進一步研究發現FTO具有Fe2+和α-酮戊二酸依賴性雙加氧酶特征,屬于ALKB蛋白家族中的一員,大多定位于細胞核[4]。2010年體外研究首次證明FTO是一種類似于ALKB的DNA/RNA脫甲基酶,對單鏈DNA中的3-甲基胸腺嘧啶和單鏈RNA中的3-甲基尿嘧啶有強烈的偏好性,同時暗示其對RNA可能有去甲基化作用[5]。深入探究表明FTO在單鏈和雙鏈RNA中均以m6A為靶點發揮去甲基化作用,因此正式將FTO蛋白功能定義為m6A去甲基化酶[6]。至此,開啟了FTO與甲基化研究的序幕。
在已鑒定到的150多種RNA化學修飾中,m6A是mRNA上豐度最高、最常見的甲基化修飾形式[7]。m6A修飾分布存在一定的規律性,主要分布在mRNA的3′非翻譯區(3′untranslated region,3′UTR)、轉錄起始區(transcription start site,TSS)和序列編碼區(coding sequence,CDS)。尤其在3′UTR的前部及CDS的終止密碼子區產生大量富集[8]。修飾的區域決定了m6A的不同調控功能,如調控腦發育和記憶的形成、造血干細胞的定向分化、精源細胞生成、胚胎發育、腫瘤生成等。m6A修飾作用的發揮需要甲基轉移酶、去甲基化酶和結合蛋白的協同參與。m6A甲基轉移酶包括METTL3、METTL14和WTAP復合物等,主要作用是催化mRNA的腺苷酸發生m6A修飾;去甲基化酶是FTO和ALKBH5,作用是對已發生m6A修飾的堿基進行去甲基化;結合蛋白主要是具有YTHDF結構域的蛋白,用來識別發生m6A修飾的堿基,激活下游的調控通路,調控mRNA的剪接、出核、定位、穩定和翻譯[9]。而在整個動態修飾過程中FTO的作用尤為突出,FTO具有較高的催化活性,其沉默和過表達與mRNA上m6A的增加和減少直接相關[10]。同時研究表明FTO參與了各種發育過程,與體脂發育、胚胎發育、腦發育、神經發育等緊密相關。
2 FTO及其介導的m6A/mRNA修飾與發育的關系
2.1 調節脂肪生成和體脂代謝
FTO在調節脂肪生成和能量穩態平衡中起著重要作用。Fto過表達的小鼠會出現身體和脂肪質量的依賴性增加從而導致肥胖,而Fto缺乏的小鼠會在出生后出現生長遲緩和食物攝取量減少,并伴隨脂肪組織減少,死亡率增加[11]。自噬是控制脂肪細胞分化、促進脂肪生成的重要途徑,FTO可通過其介導的m6A修飾影響自噬過程,控制脂肪生成。敲除Fto可導致自噬相關因子ATG5和ATG7 mRNA的m6A修飾水平升高,mRNA降解和蛋白表達下降,脂肪生成減少[12]。前脂肪細胞3T3-L1中敲低Fto可抑制前脂肪細胞分化,使脂肪組織生成減少,反之過表達Fto則促進其分化過程,使脂肪組織生成增加。究其原因發現,過表達Fto能夠使脂肪細胞內m6A水平降低,脂肪誘導分化水平提高,脂肪組織生成增加[13]。同時脂肪細胞數量的增加,與脂肪組織Fto的mRNA水平和細胞分化階段Fto的mRNA表達呈正相關,與脂肪細胞編碼基因mRNA的m6A水平成負相關。過表達去甲基化酶FTO可以顯著降低脂肪細胞mRNA的m6A水平,使與脂肪分解相關的三酰甘油脂肪酶(adipose triacylglyceride lipase,ATGL)和激素敏感脂肪酶(hormone-sensitive lipase,HSL)基因的表達水平下降,進而影響細胞內脂肪的沉積。其作用機制為FTO可通過調節剪接位點附近的m6A水平進而控制外源性脂肪生成相關轉錄因子1(RUNX1T1)的剪接,從而在剪接位點周圍積累富含絲氨酸/精氨酸SR蛋白(SRSF2),產生長型和短型兩種亞型的RUNX1T1蛋白質,而FTO則主要通過增加RUNX1T1的短型,促進脂肪細胞分化,調控脂肪生成[14]。綜上所述,脂肪細胞中的FTO通過動態調控m6A修飾參與脂肪生成調控基因子集的剪接和基因表達,進而影響脂肪組織生成。
2.2 調節胎盤和胚胎發育
FTO在胎盤中高表達,其參與胎盤和胚胎發育的機制包括兩個方面:直接FTO效應(與胎盤生長調節無關而直接與胎兒大小有關)和間接FTO效應(通過影響胎盤重量和胎盤功能)。早期學者大多認同直接效應,認為Fto可直接參與并控制胎兒體質量增加[15],胎盤中Fto的表達水平增高,新生兒的頭圍大小和增長速度增加,胎兒身長也會增加[16]。而近年來學者研究提出,胎盤Fto基因的mRNA表達水平與產婦的胎盤質量密切相關,胎盤中FtomRNA的表達水平可通過影響胎盤特定氨基酸轉運蛋白的表達進而影響胎盤質量,調控胎兒發育。在動物實驗中發現:仔豬低出生體質量(low birth weight,LBW)的胎盤中FTO蛋白表達水平降低,m6A修飾水平升高,胎盤中血管生成和脂質代謝基因的表達降低,特別是過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor γ,PPARγ)、血管內皮生長因子(vascular endothelial growth factor,VEGF)mRNA的蛋白水平下降,胎盤血管和營養體轉運功能受阻,從而產生LBW胎盤[17]。研究也發現,在應激狀態下,孕鼠胎盤中m6A水平升高,FTO表達水平下降,胎盤血管生成因子功能受損,胎盤重量降低,活胎數減少。可見,胎盤中FTO通過影響胎盤血管發育及營養物轉運體功能而調節胎盤及胚胎發育。
2.3 調節大腦的發育和功能
FTO廣泛分布于大腦不同區域,如下丘腦、海馬區、前額葉皮質區以及小腦區域等,Fto的表達水平與大腦發育和功能密切相關[18]。Fto缺乏會導致大腦體積的縮小,同時也會降低體內成年神經干細胞的增殖和分化,進而導致學習記憶障礙[19]。與野生型小鼠相比,Fto缺失型小鼠在學習能力和短時記憶能力表現較差[20]。恐懼記憶作為一種獨特的負性記憶與FTO的關系尤為緊密。成年神經元中FTO缺失會導致m6A水平上升,突觸可塑性改變,增強恐懼記憶[21]。不同腦區中FTO缺失均可導致恐懼記憶的持續存在,在野生型小鼠背側海馬區利用CRISPR/Cas9技術特定敲除FTO,可使mRNA的m6A水平升高,恐懼記憶增強[22];靶向注射shRNA敲除小鼠腦內前額葉皮質中的FTO,m6A總水平升高,小鼠在訓練后24 h測得的恐懼記憶也會明顯增強[22]。機制研究表明,FTO主要通過影響抗記憶基因mRNA不同位點的去甲基化從而抑制記憶前轉錄本的翻譯,進而增強恐懼記憶。可見FTO可通過調控m6A水平進而影響靶mRNA的降解或翻譯,使小鼠條件恐懼記憶增強。這表明mRNA甲基化可能是調控記憶能力的一個普遍機制。
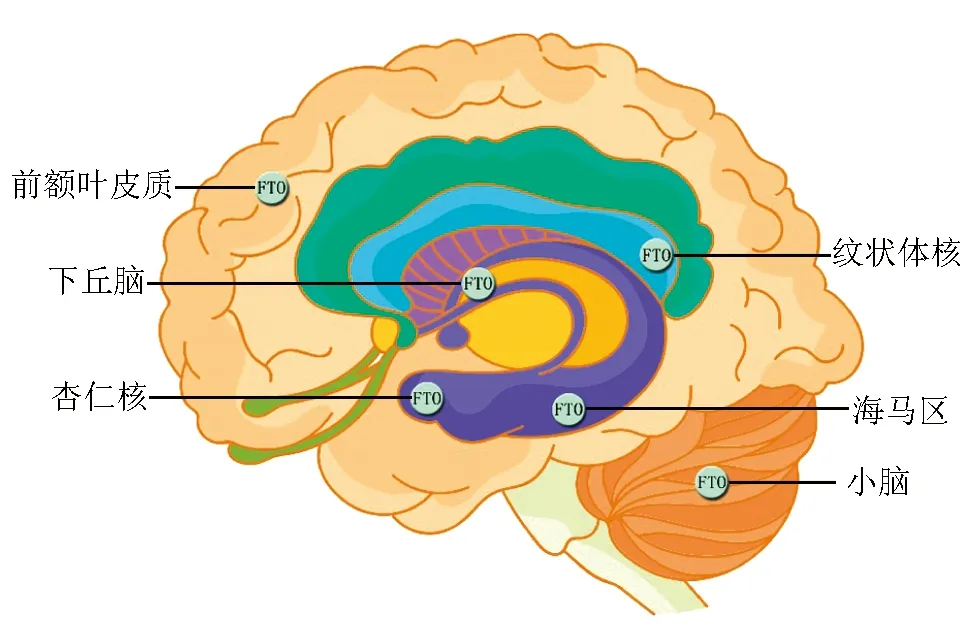
圖1 FTO在大腦不同區域分布圖Fig 1 Distribution of FTO in different regions of the brain
2.4 調節神經發育
FTO調節神經元發育的途徑主要通過參與調控下游mRNA加工代謝的各個過程,包括mRNA的加工、翻譯和降解等[23]。谷氨酸是中樞神經系統中含量最豐富的興奮性神經遞質,幾乎存在于所有神經元中,它具有去極化神經元和誘導同步放電的功能。谷氨酸的功能主要通過離子型N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受體發揮。NMDAR1是一種離子型谷氨酸受體,NMDAR1高表達會損害神經元并導致其凋亡。多巴胺能神經元細胞中FTO水平上升,m6A修飾下降,可增強NMDAR1 mRNA的穩定性,導致多巴胺能神經元細胞凋亡[24]。神經元軸突內的FTO能對軸突部位特定mRNA上的m6A進行去甲基化修飾,在軸突內對Fto進行特異性抑制或沉默會導致靶基因GAP-43的m6A/mRNA修飾水平升高,進而影響GAP-43mRNA的翻譯,導致GAP-43減少和抑制軸突延長。可見FTO能改變靶mRNA的m6A修飾,進而影響靶mRNA的翻譯和功能執行[25]。綜上所述FTO參與下游mRNA加工過程可能是m6A修飾參與神經元發育的普遍模式。
3 問題與展望
盡管眾多學者對FTO進行了深入探索,但其具體作用機制仍未明了,比如:1)由于技術的限制,大多數研究對整體RNA進行了檢測,但并未區分不同的RNA類型,也未說明在m6A作用過程中FTO是否存在底物種類的偏好性或特異性;2)在大多數的結構研究中認為FTO的作用位點是m6A,但最近有學者提出FTO似乎優先作用于2′-O-二甲基腺苷(m6Am),這就需要更加精準的檢測手段確定其具體的作用位點;3)在目前已經發現的甲基化酶、去甲基化酶中,FTO可單獨作用還是需要與其他甲基化酶協同作用以發揮其功能仍待探究。相信這些問題的解決將加深人們對FTO的認識,為深入了解發育過程、開發藥物或治療疾病提供更加有效的手段。

