棘洪灘水庫春季細菌多樣性及影響因素
丁 寧 楊瑩瑩 仇志峰 宋志文#
(1.青島理工大學環境與市政工程學院,山東 青島266520;2.山東省調水工程運行維護中心,山東 青島266111)
細菌是水體的重要組成部分,其群落結構組成與水環境因子相互影響、相互作用,并且在生物地球化學循環中發揮著重要作用,了解細菌群落的時空變化是預測和控制自然與工程系統中細菌功能的必要前提。飲用水系統中的細菌與水的自凈能力密切相關,并可能對公共衛生安全產生影響[1]。細菌群落結構在一定程度上能夠反映水質情況[2],如藍細菌過度繁殖可能會引起“水華”[3],而黃桿菌屬(Flavobacterium)能夠分解有機物改善水質[4]。因此,探究飲用水水源地水體中細菌群落結構組成與環境因子的相關性對水環境保護與供水安全具有重要意義。
引黃濟青工程是將黃河水引向青島的跨流域調水工程,自2014年4月開始與南水北調東線聯合運行,實現黃河水和長江水雙水源調度。棘洪灘水庫是引黃濟青工程中唯一的調蓄水庫,并且是亞洲最大的平原圍壩型水庫,為青島市提供90%以上居民生活用水,是青島市最重要的飲用水水源地。目前關于棘洪灘水庫的研究主要集中在浮游生物群落動態[5]和氮磷營養鹽[6]等方面,對細菌群落結構研究較少。相對于其他季節,春季棘洪灘水庫水體理化因子變化明顯,外源性氮營養鹽增加,總磷濃度低[7-8],浮游植物優勢類群演變復雜,部分進入休眠或死亡狀態[9],微生物種類少,易受環境影響。因此分析春季棘洪灘水體細菌群落結構及影響因素更為重要。
本研究以棘洪灘水庫為研究對象,對春季進水口和出水口斷面進行采樣,分析細菌群落的α多樣性和β多樣性變化,研究細菌群落在門和屬水平的組成,探討細菌群落結構與環境因子的相關性。
1 材料與方法
1.1 區域概況
棘洪灘水庫位于青島市城陽區(36°21′N,120°13′E),總面積為14 km2,設計水位高度14.2 m,圍壩長14.3 km,總容量1.46億m3。
1.2 樣品的采集
在棘洪灘水庫泵站前進水口和水庫出水口設置采樣點,見圖1。采集水面以下0.5 m和5.0 m處水樣各1 L,混合后代表該采樣點的水樣。采樣時間為2021年3—5月每月25日10:00—12:00。每月采集進水口和出水口樣品各1組,共計6組,分別標記為In-Mar(3月進水口)、Out-Mar(3月出水口)、In-Apr(4月進水口)、Out-Apr(4月出水口)、In-May(5月進水口)、Out-May(5月出水口)。使用滅菌聚甲基丙烯酸甲酯取樣器采集水樣,用滅菌聚四氟乙烯塑料瓶在1 h內運回實驗室,通過0.22 μm混合纖維濾膜抽濾,濾膜用無菌離心管于-80 ℃保存。

圖1 棘洪灘水庫采樣點位置示意圖
1.3 環境因子測定
溫度、pH、溶解氧(DO)分別使用溫度計、pH計(HQ40d,美國哈希)和DO儀(HQ30d,美國哈希)現場直接測定。硝態氮采用紫外分光光度法測定;亞硝態氮采用N-(1-萘基)-乙二胺分光光度法測定;氨氮采用納氏試劑分光光度法測定;總氮(TN)采用堿性過硫酸鉀消解紫外分光光度法測定;總磷(TP)采用過硫酸鉀消解鉬銻抗比色法測定;硫酸鹽采用鉻酸鋇光度法測定;化學需氧量(COD)采用重鉻酸鹽法測定[10]。所有理化指標均做3組平行。
1.4 細菌多樣性分析
將濾膜送至上海某生物醫藥科技有限公司進行脫氧核糖核酸(DNA)提取及16S rRNA基因高通量測序,測序片段為16S rRNA基因的V3~V4段,引物序列為338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’),測序平臺為Illumina MiSeq。
1.5 數據分析
通過美吉生物云平臺對DNA測序數據進行優化處理,剔除嵌合體重復序列和沒有重復的單序列,得到優質的樣品序列后進行生物信息統計分析。將獲得的優質序列以相似度97%進行歸并和可操作分類單元(OTU)聚類,選取豐度最高的序列為該OTU的代表序列。通過美吉生物云平臺計算種群豐富度指數(Chao1指數、ACE指數)和群落多樣性指數(Shannon指數、Simpson指數)。對OTU進行組間差異性分析獲得在門和屬水平的細菌豐度和組成。主成分分析(PCA)和層次聚類分析均通過美吉生物云平臺進行,冗余分析(RDA)采用軟件Canoco 5.0進行。
2 結果與討論
2.1 水質分析結果
進出口水質理化指標見表1。水體呈弱堿性,DO、COD、氨氮、TP均滿足《地表水環境質量標準》(GB 3838—2002)Ⅰ類水要求,硫酸鹽滿足GB 3838—2002集中式生活飲用水補充標準。TN接近GB 3838—2002 Ⅴ類水限值,硝態氮滿足《生活飲用水水源水質標準》(CJ 3020—93)要求。

表1 水樣的理化性質
3—5月為水庫引水期,外源性氮磷營養鹽增加,平均水溫較低,浮游植物死亡或進入休眠狀態,會降低硝態氮及TP消耗量,并且冬季水體湍流度小,水體中懸浮物減少,磷酸鹽不易被吸附于懸浮物上[11],水體中硝態氮和TP含量較高。
2.2 樣品的測序結果及細菌群落多樣性分析
水樣的測序結果見表2,6組水樣中最高有效序列為39 523條,最低有效序列為34 495條,覆蓋度為99.43%~99.66%,測序深度能基本反映樣品的細菌群落組成。
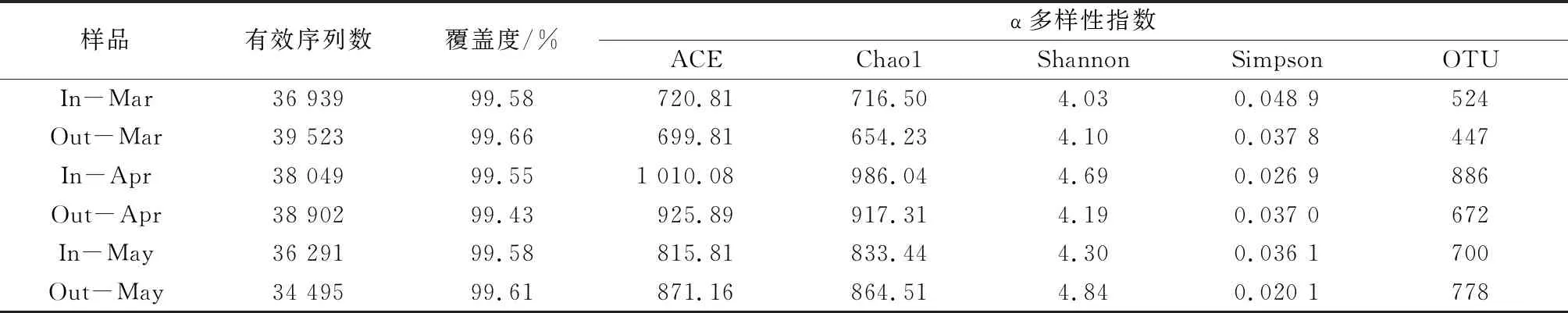
表2 樣品的測序結果及群落α多樣性指數
6組水樣共包含150個OTU,特有OTU數量分別為40(In-Mar)、28(Out-Mar)、72(In-Apr)、19(Out-Apr)、47(In-May)、77(Out-May)個。篩選掉豐度值低于測序總量0.001%的OTU,共分類出1 349個OTU,包含34個門、81個綱、199個目、323個科和524個屬。
樣品α多樣性指數見表2,ACE指數和Chao1指數表現為In-Apr>Out-Apr>Out-May>In-May>In-Mar>Out-Mar,3月和4月細菌群落豐富度出水口低于進水口,5月呈現相反態勢。總體表現為4月最高,3月最低。Shannon指數表現為Out-May>In-Apr>In-May>Out-Apr>Out-Mar>In-Mar,Simpson指數表現為Out-May β多樣性用于分析不同樣品間細菌群落結構的差異性,屬水平的PCA結果見圖2,PC1和PC2對細菌群落組成差異的解釋度分別為54.16%和18.25%。在PC1維度上,同一月份進水口與出水口細菌群落組成相似度較高。在PC2維度上,In-Apr和Out-May細菌群落組成相似,In-Mar、Out-Mar、Out-Apr和In-May細菌群落組成相似。 圖2 細菌群落PCA 層次聚類分析結果表明,In-Mar與Out-Mar、In-Apr與Out-Apr和In-May與Out-May的層次距離較小,即同一月份進水口與出水口細菌群落結構組成相似,不同月份之間細菌群落結構組成差異明顯,與PCA結果基本一致。總體而言,3月進水口和出水口細菌群落結構相似性最高,4月進水口和出水口細菌群落結構相似性最低。 門水平細菌群落組成如圖3所示,所有樣品共檢出34個門,6組樣品分別為20(In-Mar)、25(Out-Mar)、30(In-Apr)、30(Out-Apr)、28(In-May)、27(Out-May)個菌門。其中放線菌門、變形菌門、擬桿菌門和藍細菌門為優勢菌門。放線菌門表現為In-Mar(39.84%) 圖3 門水平結構組成 樣品中共檢出524個菌屬,相對豐度較高的部分菌屬見表3,其中In-Mar相對豐度最高的菌屬為hgcI_clade、孢魚菌科未知屬、綠彎菌屬;Out-Mar相對豐度最高的菌屬為hgcI_clade、孢魚菌科未知屬、CL500-29_marine_group和多核桿菌屬;In-Apr相對豐度最高的菌屬為hgcI_clade、CL500-29_marine_group、綠彎菌屬和藍細菌屬;Out-Apr相對豐度最高的菌屬為hgcI_clade、CL500-29_marine_group、棲湖菌屬和孢魚菌科未知屬;In-May相對豐度最高的菌屬為hgcI_clade、CL500-29_marine_group和孢魚菌科未知屬;Out-May豐度最高的菌屬為hgcI_clade、CL500-29_marine_group和棲湖菌屬。 表3 屬水平上細菌的相對豐度 利用Canoco 5.0軟件,對相對豐度大于1%的優勢菌屬與pH、DO等10個環境因子進行RDA。優勢菌屬主要受DO和COD的影響,其中DO與黃桿菌屬和綠彎菌屬呈正相關,與hgcI_clade、CL500-29_marine_group、沉積物桿狀菌屬和紅育菌屬呈負相關;COD與CL500-29_marine_group、綠彎菌屬、沉積物桿狀菌屬和分枝桿菌屬呈正相關,與hgcI_clade和紅育菌屬呈負相關。 棘洪灘水庫TN大于0.2 mg/L,TP在0.01 mg/L左右,TN是其富營養化的關鍵因素。外界氮磷營養鹽的輸入會促進浮游生物繁殖,導致水質變差[12]。黃河干流氨氮污染嚴重[13],引水可能是棘洪灘氮營養鹽的主要輸入源。棘洪灘水庫TP輸出依靠出水攜帶和底泥吸收,董國棟等[14]通過構建棘洪灘水庫TP變化模型,發現在3—8月TP平均沉降速率為負值,證明春季磷主要來源于引水。 α多樣性分析中,Chao1指數越大表示細菌群落豐富度越高,Shannon和Simpson指數越高代表微生物群落多樣性和均一性越好。3月和4月出水口細菌群落豐富度均低于進水口,這與棘洪灘水庫水流緩慢,細菌大量繁殖有關[15]。3月引水河道溫度較低,導致進水口細菌多樣性低于出水口[16],而Shannon指數最大值和Simpson指數最小值出現在Out-May,即5月出水口細菌多樣性最高,可能與水庫內部受人類影響較小有關。在屬水平上,5月綠彎菌屬和藍細菌屬相對豐度與3、4月有較大差異,綠彎菌屬屬于兼性厭氧菌,能夠進行光合作用參與有機物的降解。而藍細菌屬相對豐度減少與5月COD濃度升高有關[17],也可能與藍細菌屬能夠在缺氧環境利用亞硝酸鹽作為電子受體進行厭氧生長有關[18]。 PARULEKAR等[19]通過對湖泊水體微生物群落結構組成分析,發現放線菌門、變形菌門、擬桿菌門和藍細菌門是水體中優勢度較大的菌門,與本研究結果基本一致。棘洪灘水庫引水河道途徑濱州、濰坊和青島等農田地區,其菌門相對豐度可能受到農田影響。變形菌門和放線菌門是典型淡水菌[20],已有研究表明,變形菌門能夠參與脫氮除磷過程,在有機物降解中也發揮著一定的作用[21]。Out-Mar、Out-Apr和Out-May與In-Mar、In-Apr和In-May相比TN含量較低,可能與藍細菌門有固氮能力有關[22]。擬桿菌門在脫氮和有機物降解過程中起一定作用。李建柱等[23]等在對水體微生物群落研究中發現hgcI_clade、CL500-29_marine_group和綠彎菌屬是水體的優勢菌屬,與本研究結果基本一致。hgcI_clade相對豐度隨溫度升高而明顯增大,與水質變好以及其能夠利用低濃度有機碳有關[24-25]。CL500-29_marine_group能夠利用含碳有機物改善水質[26]。綠彎菌屬屬于兼性厭氧菌,可參與脫氮除磷過程[27]。此外,樣品中還檢測出黃桿菌屬,可能與水庫中魚類活動有關。 RDA結果表明,DO和COD為影響細菌群落結構的主要環境因子,與WEI等[28]和ZHANG等[29]研究結果一致。其中CL500-29_marine_group和紅育菌屬均與亞硝態氮、TP呈負相關,紅育菌屬和CL500-29_marine_group均在氮循環過程中起到一定作用[30]。COD與CL500-29_marine_group呈正相關,可能與CL500-29_marine_group能夠利用COD進行生長繁殖有關[31],hgcI_clade與TN呈負相關,可能與hgcI_clade能夠利用含氮有機物進行異養有關[32]。DO與綠彎菌屬呈正相關,這與綠彎菌屬能在高DO的出水口脫氮和去除COD作用有關[33]。黃桿菌屬與亞硝態氮呈負相關,黃桿菌屬屬于反硝化菌,在富營養的水體中能夠將亞硝態氮最終轉化為氮氣。黃桿菌屬與pH呈正相關,說明它更適應高pH環境。TP、TN與多核桿菌屬呈正相關,說明多核桿菌屬更適應高TP和TN環境[34]。 (1) 棘洪灘水庫中氮磷營養鹽主要來源于進水,α多樣性表現為細菌群落豐富度4月進水口最高,3月出水口最低;細菌群落多樣性5月出水口最高,3月進水口最低;β多樣性表現為3月進水口和出水口細菌群落結構相似性最高,4月進水口和出水口細菌群落結構相似性最低。 (2) 門水平上,放線菌門占比最大,3月到5月擬桿菌門相對豐度均表現為進水口低于出水口,藍細菌門相對豐度呈相反態勢;屬水平上,hgcI_clade相對豐度最高,其次是CL500-29_marine_group、綠彎菌屬和孢魚菌科未知屬。 (3) DO、COD是影響棘洪灘水庫細菌群落結構的主要環境因子。
2.3 細菌群落結構


2.4 環境因子與細菌群落結構相關性分析
3 討 論
4 結 論

