干擾lnc721對牛骨骼肌衛星細胞增殖與分化的影響
譚皓云,劉 茜,胡德寶,張林林,李 新,丁向彬,郭 宏,郭益文
(天津農學院動物科學與動物醫學學院,天津市農業動物繁育與健康養殖重點實驗室,天津 300384)
肌肉系統是維持動物體生長發育的重要基礎。大量研究發現,許多長鏈非編碼RNA(long non-coding RNA,lncRNA)與肌肉生長發育相關,如lncMAR1[1]、lncMALAT1[2]、lncMAAT[3]等。lncRNA曾因為只有極少數序列編碼蛋白質、絕大部分編碼非蛋白質而一度被認為是基因組序列中累積的“垃圾產物”[4]。直到美國啟動ENCODE研究計劃后人們才發現在基因組序列中較大部分為長度>200 nt的lncRNAs[5]。研究表明,lncRNA具有調控肌肉生長發育的作用,是影響骨骼肌功能、疾病的關鍵因子[6]。目前對于lncRNA的研究主要集中在對生物體的調控作用或編碼小肽等方面[7-8]。此外,lncRNA還與肌肉發育相關,如在小鼠體內過表達lncRNA MAR1可增加小鼠肌肉重量和強度,敲低后肌肉重量和強度降低[1];干擾linc-RAM可抑制小鼠骨骼肌衛星細胞分化過程,影響肌肉再生[9];干擾lnc-mg可導致小鼠肌肉萎縮,過表達lnc-mg會造成小鼠肌肉肥大[10]。由于lncRNA作用機制復雜,方式多樣,在物種間保守性很低,使得不同種屬動物lncRNA之間作用關系不大,且目前研究多集中于人和小鼠等生物體內,而對牛肌肉生長影響鮮有報道[11]。實驗室前期測序共發現13條差異表達的lncRNAs,其中lnc23對牛骨骼肌衛星細胞具有調控作用[12]。鑒于此,本試驗選擇其中一條差異高表達的lnc721進行探究,深入分析lnc721干擾模型對牛骨骼肌衛星細胞增殖與分化的調控作用,以期為研究lncRNA在牛肌肉中的作用提供參考。
1 材料與方法
1.1 材料
1.1.1 細胞系 原代牛骨骼肌衛星細胞來源于6月齡西門塔爾胎牛的腿臀肌、肩胛肌,均由天津市農業動物繁育與健康養殖重點實驗室分離并凍存。
1.1.2 主要試劑及儀器 siRNA和Cell-LightTMEdU ApolloinvitroKit均購自廣州瑞博生物技術有限公司;Opti-MEM?Meduium、胎牛血清和馬血清均購自Life Technologies公司;DMEM培養基購自HyClone公司;ECL試劑購自生工生物工程(上海)股份有限公司;胰蛋白酶、RIPA Buffer和PMSF均購自北京索萊寶科技有限公司;反轉錄試劑盒購自TaKaRa公司;All-in-OneTMqPCR Mix購自GeneCopoeia公司;MyHC抗體購自DSHB公司;MyoG抗體、GAPDH抗體和Goat Anti-mouse IgG均購自北京中杉金橋生物技術有限公司。
細胞恒溫培養箱購自三洋電機公司;倒置顯微鏡購自Leica公司;Light Cycler?96熒光定量PCR儀購自上海羅氏制藥有限公司;PowerPac Basic電泳儀、Mini-Protean Tetra、MiniTyans-Blot Cell及電泳凝膠成像系統ChemiDocXRS+均購自Bio-Rad公司。
1.2 方法
1.2.1 細胞培養 原代牛骨骼肌衛星細胞復蘇后采用含10% FBS的DMEM培養基進行培養,待細胞匯合度達80%左右時進行傳代,將細胞傳至合適大小的孔板中,加入含10% FBS的DMEM增殖培養基繼續培養,當細胞全部貼壁后進行轉染處理,轉染時的細胞密度為50%~60%。收取增殖期細胞繼續培養24 h,分化期細胞需使用含2% HS培養基培養[12]。對增殖期及分化期第1、2、3天的牛骨骼肌衛星細胞提取RNA,利用HiFiScript cDNA Synthesis Kit進行cDNA模板制備,反應條件為:42 ℃ 15 min;85 ℃ 5 min。―20 ℃保存備用。
1.2.2 lnc721生物信息學分析與亞細胞定位 根據牛全基因組序列比對,在NCBI中查詢lnc721序列信息及上、下游基因,初步搜索潛在的靶基因;使用CPC網站預測lnc721編碼能力。牛骨骼肌衛星細胞誘導分化48 h后,采用NE-PER Nuclear and Cytoplasmic Extraction Reagents Kit進行核質分離試驗,確定亞細胞定位。通過實時熒光定量PCR對lnc721進行亞細胞定位分析[13],以GAPDH和Pre-GAPDH分別作為細胞質(cyt)和細胞核(nuc)的標志基因,引物序列見表1。PCR反應體系20 μL:2×All-in-OneTMqPCR Mix 10 μL,上、下游引物各0.5 μL,cDNA模板2 μL,ddH2O 7 μL。PCR反應程序:95 ℃預變性10 min;95 ℃變性10 s,60 ℃退火20 s,72 ℃延伸15 s,共40個循環。結果采用2―ΔΔCt方法計算。
1.2.3 牛骨骼肌衛星細胞轉染 3個lnc721 siRNAs干擾序列均由廣州瑞博生物技術有限公司設計并合成:ASO-bta-lnc721_001(si-1):5′-TTTCAAGCAGCCAGACAAAG-3′;ASO-bta-lnc721_002(si-2):5′-AGGATGTCGCT-GTCTGTATA-3′;ASO-bta-lnc721_003(si-3):5′-GGATCACAG-CCTGCCAACAC-3′。將牛骨骼肌衛星細胞培養至可轉染狀態,分別將合成的3個干擾序列及對照(NC)轉染進肌衛星細胞中,每組3個生物學重復。提取增殖期細胞RNA,反轉錄為cDNA后進行實時熒光定量PCR試驗。以GAPDH為內參基因檢測干擾效果,選用效果最佳的siRNA進行下一步試驗。引物序列見表1,PCR反應體系及程序同1.2.2。
1.2.4 EdU檢測 將細胞接種至96孔板中,設置試驗組和對照組,各3個生物學重復,試驗操作按照Cell-LightTMEdU ApolloinvitroKit說明書進行。通過熒光顯微鏡觀察染色結果,每孔拍照并計數,推算出EdU標記指數。
1.2.5 實時熒光定量PCR檢測牛骨骼肌衛星細胞標志因子mRNA表達量 將牛骨骼肌衛星細胞傳代至24孔板中,待細胞貼壁后進行siRNA轉染,轉染后6 h換液處理,24 h后收取增殖期RNA,分化期細胞需更換成分化培養基,并定期觀察細胞分化狀態。于分化第3天收取細胞提取RNA,反轉錄為cDNA后,采用實時熒光定量PCR檢測細胞增殖標志因子(Ki-67和Pax7)及分化標志因子(MyHC和MyoG)的mRNA表達水平,引物序列見表1,PCR反應體系及程序同1.2.2。
1.2.6 Western blotting檢測牛骨骼肌衛星細胞標志因子蛋白水平表達量 采用RIPA蛋白裂解液提取細胞蛋白,采用BCA方法確定蛋白質濃度,使用酶標儀檢測蛋白質量。SDS-PAGE參數:80 V 30 min,120 V 45 min;轉膜條件:300 mA 2 h。采用Western blotting檢測Pax7、Ki-67、MyHC、MyoG及內參蛋白水平表達量,先將待測條帶裝入含有一抗的雜交袋中,4 ℃過夜孵育,取出后清洗5次,每次5 min,隨后孵育對應二抗1 h,再次清洗5次,每次5 min,使用ECL發光液上機曝光[14-16]。
1.2.7 統計分析 采用SPSS 17.0軟件進行統計分析,實時熒光定量PCR及Western blotting結果采用t檢驗進行分析,EdU染色結果采用卡方檢驗進行分析,數據以平均值±標準差表示。P<0.05表示差異顯著;P<0.01表示差異極顯著。
2 結 果
2.1 lnc721在牛骨骼肌衛星細胞分化前后的表達量
收集增殖期、分化期第1、2、3天的牛骨骼肌衛星細胞并提取RNA,通過實時熒光定量PCR分別檢測lnc721的時間序列表達量情況,結果見圖1。由圖1可知,隨著時間的推進,lnc721的表達量逐漸升高,在分化期第2天,lnc721在牛骨骼肌衛星細胞中的表達量開始極顯著升高(P<0.01);在分化期第3天,表達量相較增殖期升高約4倍(P<0.01)。

①GM,牛骨骼肌衛星細胞增殖期;DM1、DM2、DM3,牛骨骼肌衛星細胞分化1、2、3 d。②與GM期相比,*,差異顯著(P<0.05);**,差異極顯著(P<0.01);ns,差異不顯著(P>0.05)
2.2 lnc721生物信息學分析及亞細胞定位
通過NCBI比對發現,lnc721位于18號染色體上,為未報道的lncRNA。CPC網站預測發現,lnc721編碼潛能為―1.33129(圖2)。核質分離試驗表明,lnc721在細胞核和細胞質內均有分布,主要位于細胞質內(圖3)。
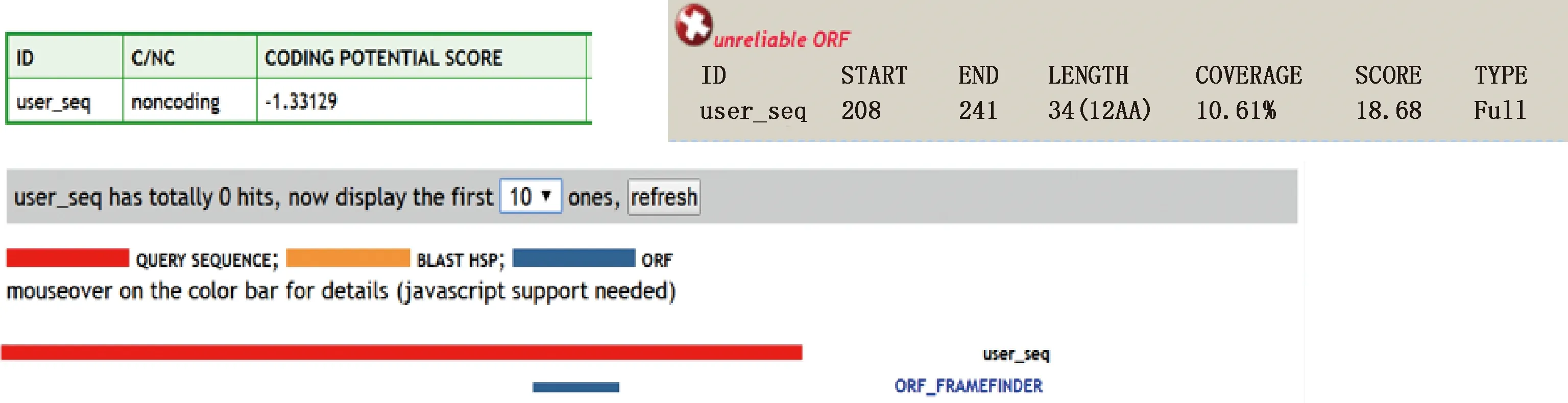
圖2 CPC網站lnc721蛋白編碼能力預測
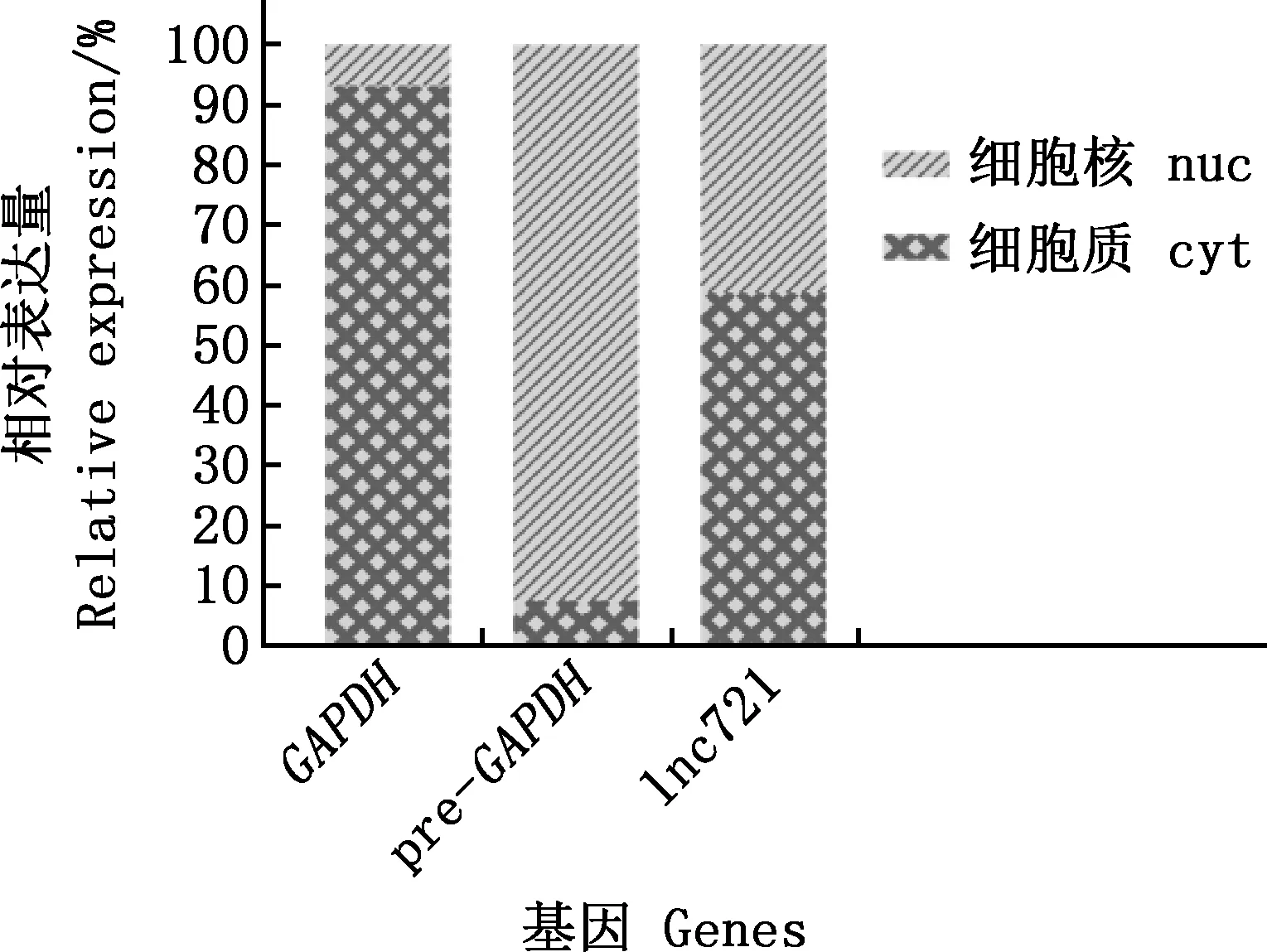
圖3 lnc721亞細胞定位檢測
2.3 干擾lnc721表達對牛骨骼肌衛星細胞增殖的影響
將lnc721的siRNAs(si-1、si-2、si-3)轉染進牛骨骼肌衛星細胞中,收取增殖期細胞,通過實時熒光定量PCR檢測干擾lnc721在增殖期的表達量,結果見圖4。由圖4可知,與對照組相比,si-1、si-2、si-3均極顯著降低了lnc721的表達(P<0.01),其中si-1效果最明顯。
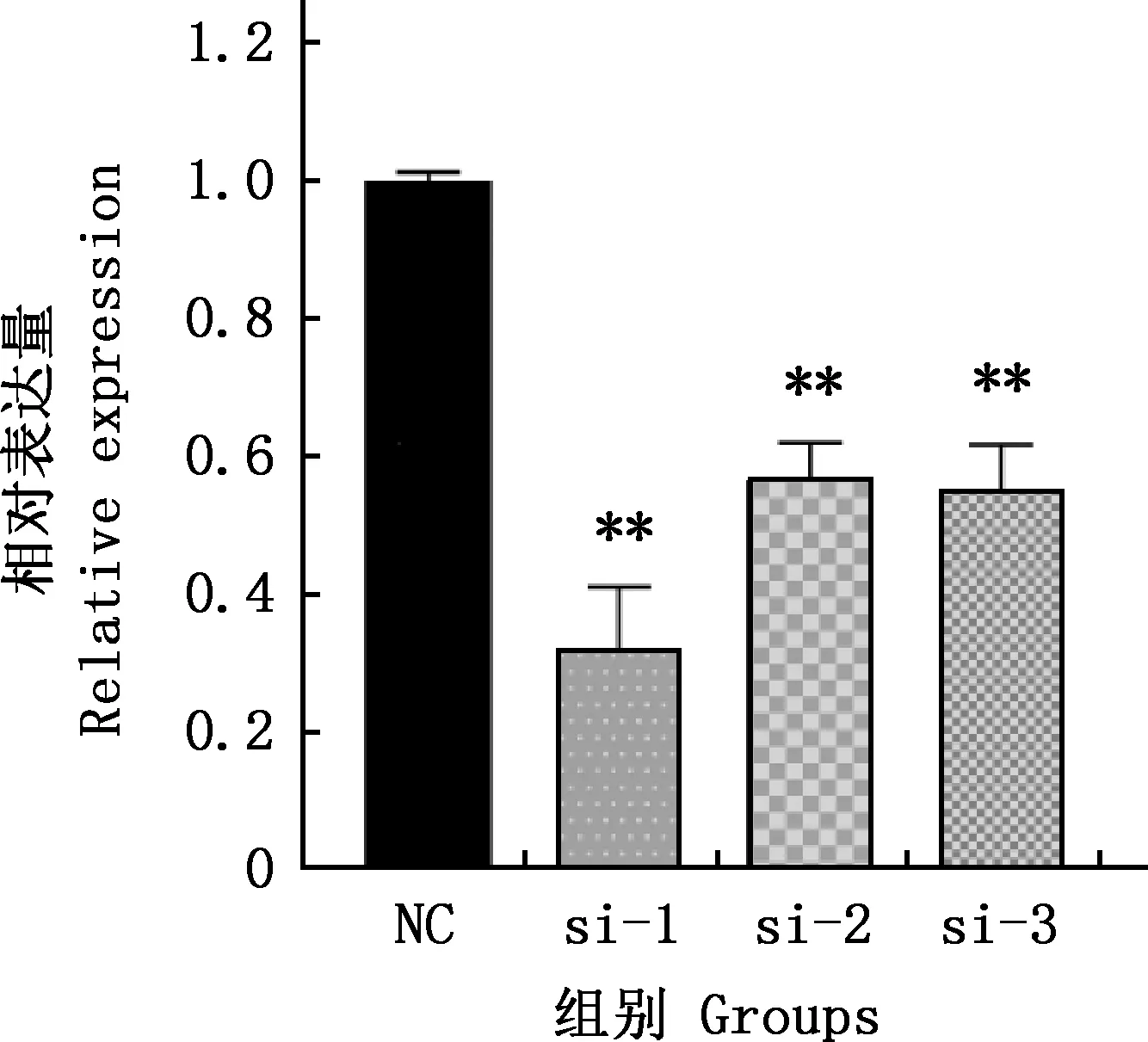
與對照組(NC)相比,*,差異顯著(P<0.05);**,差異極顯著(P<0.01);ns,差異不顯著(P>0.05)。下同
將lnc721的si-1轉染進牛骨骼肌衛星細胞中,分別提取增殖期和分化期RNA進行實時熒光定量定量PCR檢測,結果見圖5。由圖5可知,si-1在細胞增殖期和分化期均極顯著或顯著下調了lnc721表達量(P<0.01;P<0.05)。進一步采用EdU染色試驗檢測增殖期細胞數量變化,結果見圖6。由圖6可知,與對照組相比,試驗組細胞數量明顯增多,統計發現,EdU陽性細胞率顯著高于對照組(P<0.05)。采用實時熒光定量PCR和Western blotting方法檢測干擾lnc721對增殖標志因子Ki-67和Pax7基因在mRNA及蛋白水平表達的影響,結果見圖7、8。由圖7、8可知,干擾lnc721后,Ki-67和Pax7基因mRNA表達量均極顯著上調(P<0.01);Ki-67蛋白表達量變化不顯著(P>0.05),Pax7蛋白表達量極顯著升高(P<0.01)。表明干擾lnc721可促進牛骨骼肌衛星細胞的增殖。
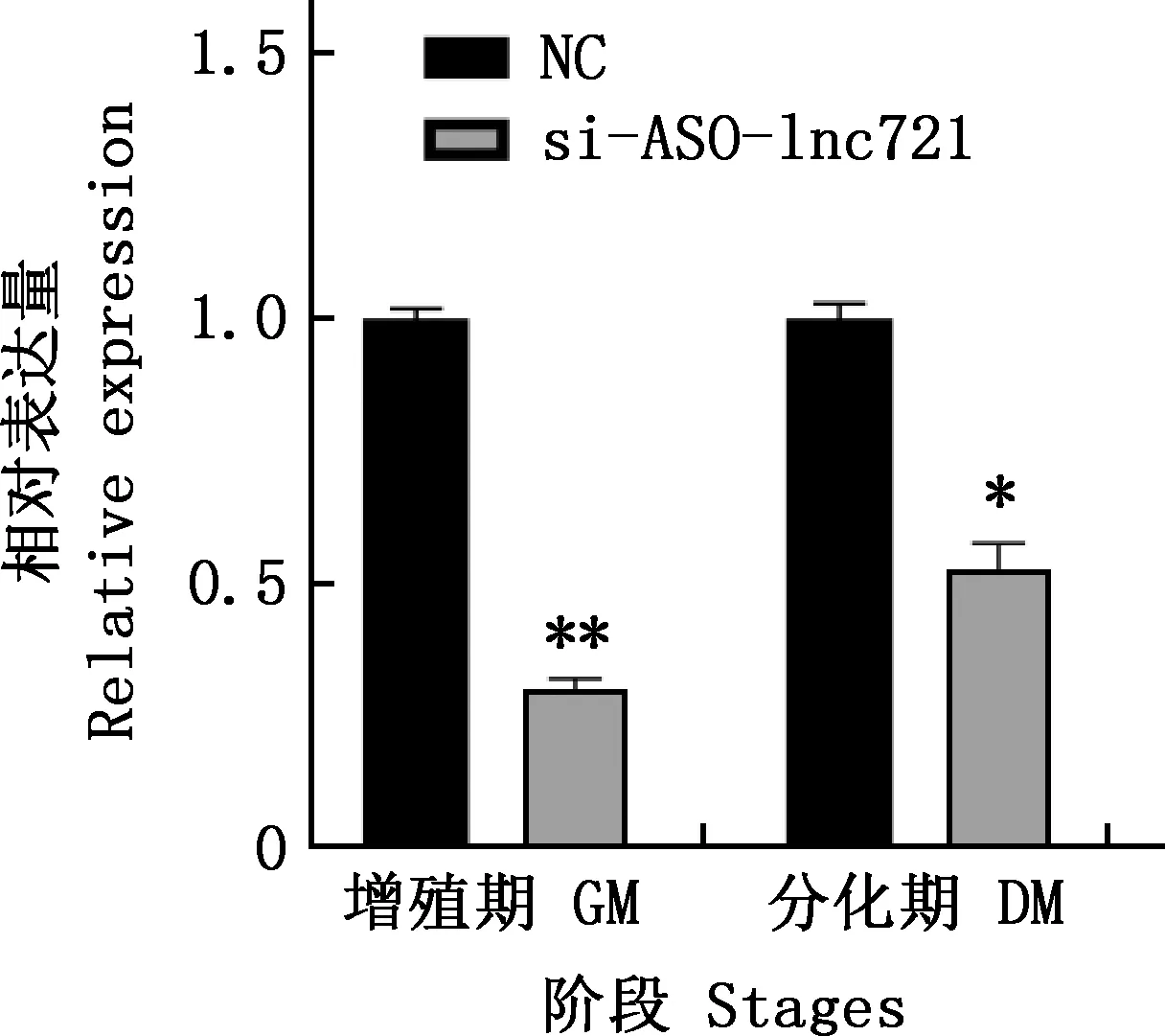
圖5 siRNA對lnc721表達量的影響

A,EdU染色圖;B,EdU陽性細胞率統計圖
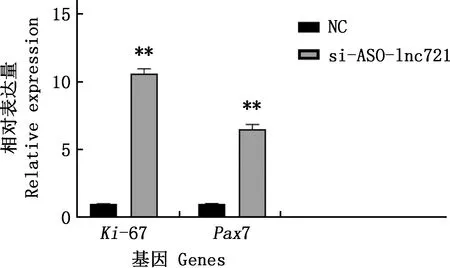
圖7 細胞增殖標志因子mRNA表達水平
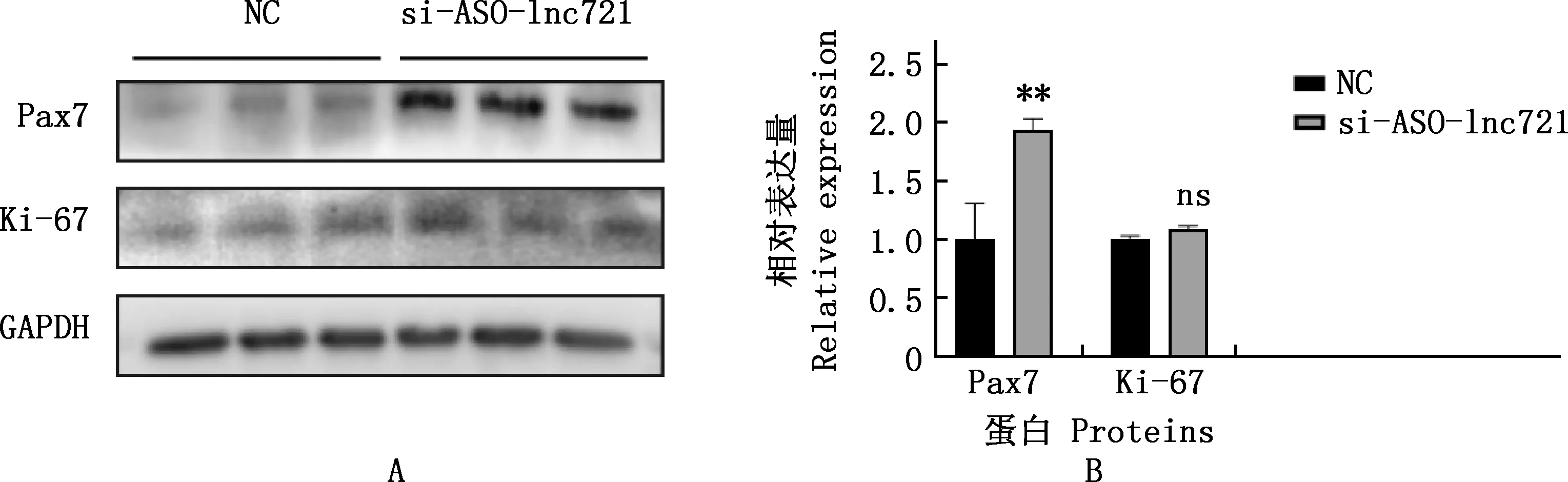
A,Western blotting曝光圖;B,Western blotting量化結果。圖10同
2.4 干擾lnc721表達對牛骨骼肌衛星細胞分化影響
將骨骼肌衛星細胞進行成肌誘導分化,檢測干擾lnc721后對分化標志因子MyHC和MyoG在mRNA及蛋白水平表達的影響,實時熒光定量PCR結果發現,與對照組相比,干擾lnc721后MyHC和MyoG基因表達量均極顯著降低(P<0.01,圖9);MyoG蛋白表達量變化不顯著(P>0.05),但MyHC蛋白表達量極顯著降低(P<0.01,圖10)。提示干擾lnc721可以顯著抑制肌衛星細胞的成肌分化進程。

圖9 細胞分化標志因子mRNA表達水平
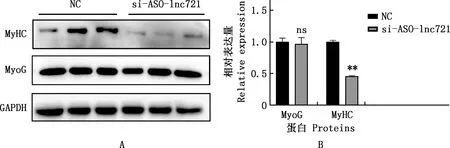
圖10 Western blotting檢測細胞分化標志因子蛋白表達水平
3 討 論
研究發現,許多lncRNAs參與調控肌肉的生長發育,是影響骨骼肌功能的關鍵因子,而這些lncRNAs常常在骨骼肌細胞分化期內展示出時序上升表達趨勢,如linc-MD1[17]、lncMyoD[18]、lncRNA-133a[19]等。本研究通過時序表達譜發現,在骨骼肌細胞分化第3天,lnc721表達量與增殖期相比高達4倍以上,故選取分化期第3天的細胞進行后續干擾試驗,且經檢測發現分化期第3天的lnc721干擾模型對牛骨骼肌衛星細胞分化具有顯著的抑制作用。
亞細胞定位是決定lncRNA功能的關鍵,定位于細胞質和細胞核中lncRNA發揮的功能大不相同。相較于細胞核定位的lncRNA,位于細胞質中的lncRNA可影響mRNA的穩定性[20-21]。另外,細胞質定位的lncRNA通常吸附miRNA形成ceRNA以調節它們的活性和水平,影響蛋白質翻譯后修飾等功能[22-24]。本研究發現,lnc721在細胞核與細胞質中均有分布,但主要定位于細胞質中。Zhai等[25]研究發現,大部分的linc-RAM存在于肌肉細胞的細胞質中,可通過調節PYGM活性促進肌肉細胞分化;Tan等[26]研究報道,定位于細胞質的lncRNAG1430可作為ceRNA海綿吸附ssc_miR-133a-3p,從而促進豬的成肌細胞分化并抑制細胞增殖。本研究中的lnc721與以上研究的lncRNA亞細胞定位相同,推測lnc721可能發揮了某種細胞質lncRNA功能,參與了對牛骨骼肌衛星細胞增殖的正調控及對其分化的負調控。
研究表明,設計過表達及干擾模型可檢測lncRNA在細胞增殖期和分化期的表達量水平[27],而通過不同時期標志因子的表達量檢測可以間接反映出目的基因對牛骨骼肌衛星細胞的調控情況。如Ki-67、Pax7基因在細胞增殖期大量表達,可將其作為細胞增殖期標志因子[28-29]。本研究中,干擾lnc721后發現,Ki-67、Pax7基因的表達量在轉錄組水平上均顯著上調,這與Chen等[12]發現的在干擾lnc23后可正調控牛骨骼肌衛星細胞增殖的作用相一致;而在細胞周期退出、分化開始時期,MRFs家族基因發揮著重要的調控作用,其中MyoG基因參與調控肌細胞融合;MyHC基因作為骨骼肌內粗肌絲的主要成分,在細胞分化后期大量表達[30-31]。本研究在干擾lnc721后,MyHC和MyoG基因表達量在轉錄組水平上均極顯著降低;在蛋白水平上MyHC表達量極顯著下調,即在牛骨骼肌衛星細胞分化期呈現出的負調控作用,與Chen等[12]研究的干擾lnc23可抑制牛骨骼肌衛星細胞分化的調控作用相一致,但與張俊星等[32]研究的干擾lncRNA135494可正調控牛骨骼肌衛星細胞分化作用相反,推測其原因是由于不同基因具有不同的調控表達所致。此外,在對增殖標志因子Ki-67和分化標志因子MyoG的蛋白水平檢測時均出現了表達量變化不顯著的情況,其原因可能與這些標志因子自身表達特性的影響相關,在基因翻譯階段受其他因素影響所致,但根據Pax7及MyHC蛋白水平的表達量結果可以看出,干擾lnc721具有促進牛骨骼肌衛星細胞增殖并抑制其分化的作用。
4 結 論
本研究通過轉染siRNA對牛骨骼肌衛星細胞中lnc721進行干擾發現,干擾lnc721表達可以促進牛骨骼肌衛星細胞的增殖并抑制其成肌分化過程,驗證了干擾lnc721表達在調控肌肉發育分化中的生物功能。

