甜蕎FeHSP83基因的克隆及其在逆境脅迫下的表達分析
徐 銳,熊澤浩,朱旭東,周賓寒,侯澤豪,許嘉盛,羅旖柔,方正武
(長江大學農學院,主要糧食作物產業化湖北省協同創新中心,湖北 荊州 434025)
隨著全球環境的變化,干旱、高溫、鹽堿等非生物脅迫已經成為影響植物正常生長的關鍵因素。蕎麥是蓼科(Polygonaceae)蕎麥屬(FagopyrumMill)藥食兩用的草本植物,主要分為苦蕎(FagopyrumtataricumGaertn)、甜蕎(FagopyrumesculentumMoench)兩個栽培種。其中甜蕎作為一種重要的糧食作物和經濟作物,在我國北方干旱地區得到了大量種植。因此,開展蕎麥抗逆研究對于培育植物抗逆新品種具有重要意義。
熱激蛋白(Heat shock proteins, HSPs)也被稱為熱休克蛋白,是植物遭遇高溫等非生物脅迫時誘導生物體合成的一類保護性蛋白。大多數真核細胞生物體內都有種類豐富的HSPs存在[1],一般根據蛋白質大小以及同源關系,將其分為五大類,分別是HSP60、HSP70、HSP90、HSP110和小分子量sHSP 家族[2],其中HSP90家族蛋白主要存在于真核細胞中,約占細胞蛋白總數的1%~2%[3];在結構上包含有兩個保守結構域,N-端為ATP酶結合域、C-端含有二聚合體結合區,中間段為氨基酸,是一個主要受ATP調控的二聚體伴侶蛋白[4]。已有研究表明HSP90在控制細胞周期、細胞生存、激素等多個細胞過程中扮演重要角色[5],且與其他蛋白間存在互作關系,如Hsp40、p23FKBP52等[6]。近年來,HSP90家族研究逐漸成為熱點[7]。另外,HSP90作為一種功能專一的蛋白折疊工具,在生物體的存活和逆境脅迫應答方面有著重要意義[8]。同時HSP90作為分子伴侶,參與輔助了其他蛋白的合成與加工,在生物體機能維護方面起到了極其重要的作用[9]。
目前HSP90家族在辣椒(CapsicumannuumL.)[10]、南瓜(Cucurbitamoschata)[11]、番茄(Solanumlycopersicum)[12]等植物中得到了廣泛的研究,但其在甜蕎逆境脅迫條件下的分析卻鮮有報道。本試驗以‘西農9976’為材料開展研究,通過同源克隆的方法得到蕎麥FeHSP83基因序列,在此基礎上對該序列進行生物信息學分析,通過進化樹親緣關系比對,發現其隸屬于HSP90家族成員,與此同時運用qRT-PCR的方法探究該基因在干旱、鹽脅迫條件下的表達情況,分析該基因在蕎麥中的表達模式,為蕎麥培育抗旱抗鹽品種提供優異的基因資源。
1 材料與方法
1.1 植物材料、生長條件及脅迫處理
試驗用甜蕎品種為‘西農9976’,挑選飽滿無病害的種子,經消毒沖洗后,置于鋪有雙層濾紙的培養皿中,25℃恒溫催芽,待種子長出根時,將長勢相同的蕎麥種子移栽至水培盒中,進行常規水肥管理。待幼苗長出2~3片真葉后,使用15% PEG 6000溶液和0.1% NaCl溶液對蕎麥幼苗進行脅迫處理,在分別處理3、6、12、24、48 h后對幼苗和根部進行取樣,將脅迫前的材料作為對照,每個處理設置3個生理學重復,樣品通過液氮速凍后放置-80℃冰箱中保存備用。
1.2 供試儀器與試劑
PCR擴增采用Bio-rad T-100 PCR儀(美國Bio-rad公司);凝膠成像儀購自上海培清科技有限公司。RNA提取試劑盒(RN38)購自北京艾德萊生物科技有限公司;反轉錄試劑盒(TaKaRa)及金牌MIX購自北京擎科生物科技有限公司;熒光定量試劑盒、感受態細胞引物合成和DNA測序也均由北京擎科生物科技有限公司完成。
1.3 FeHSP83基因克隆
蕎麥嫩葉基因組DNA,總RNA提取法參考CTAB法[13-14],得到RNA后利用反轉錄試劑盒逆轉錄RNA得到cDNA,具體試驗步驟參照試劑盒說明書進行。以cDNA為模板,使用引物FeHSP83-F/FeHSP83-R(表1)對基因進行擴增。PCR反應體系如下:cDNA 2 μL,上下游引物各1.5 μL,金牌MIX 45 μL。PCR反應條件為:98℃預變性2 min,98℃變性10 s,56℃退火10 s,72℃延伸30 s,35個循環,72℃延伸5 min,4℃保溫。PCR產物使用1.0%瓊脂凝膠電泳進行檢測,產物保存于-20℃備用。參照凝膠試劑盒回收目的條帶,采用007VS載體連接回收產物,轉化大腸桿菌DH5α感受態細胞,通過AMP抗生素進行篩選,挑選陽性克隆進行測序。
1.4 FeHSP83基因的生物信息學分析
通過NCBI(https://www.ncbi.nlm.nih.gov)數據庫網站ORF Finder分析目標基因編碼區;利用在線軟件ProtParam(http://web.expasy.org/protparam/)分析目標基因基本理化特性;利用MEGA7.0軟件,以鄰接法(Neighbor-joining,NJ;bootstrap=1000)構建進化樹;通過WOLF PSORT(https://www.genscript.com/wolf-psort.html) 在線軟件進行蛋白亞細胞定位預測;使用SWISS-MODEL(https://swissmodel.expasy.org/interactive)對蛋白質三級結構進行預測。
1.5 FeHSP83基因的qRT-PCR分析
以反轉錄的cDNA第一鏈為模板,將其稀釋10倍后用于熒光定量分析。設計FeHSP83基因對應的熒光定量引物,根據TB Green(TaKaRa,大連)熒光定量試劑盒操作說明書在CFX96 real-time PCR 儀器(美國BioRad公司)上進行qRT-PCR。qRT-PCR反應體系為20 μL、100 ng cDNA模板、引物各0.6 μL和10 μLPCR-mix(2×)。qRT-PCR反應體系為:95℃,30s,(95℃,10s;55℃,30s)×40個循環。試驗以β-Actin為內參基因,試驗數據通過CK對樣品做標準化處理,并使用2-ΔΔct法計算基因的相對表達量。
1.6 數據處理
通過SPSS 19.0軟件對數據進行單因素方差分析,利用Excel 2019和SPSS 19.0軟件對數據進行整理和統計分析,最后使用Excel 2019軟件繪制基因表達量的柱狀圖。
2 結果與分析
2.1 FeHSP83基因的克隆
以甜蕎cDNA為模板,使用表1中的引物進行擴增,連接007VS載體后轉化大腸桿菌,利用AMP抗生素篩選陽性克隆,成功獲得了目的條帶,通過觀察PCR產物凝膠電泳圖(圖1)可知,PCR擴增得到的長度大約為2 100 bp,與預期的片段大小基本一致。通過BLAST對比發現,甜蕎HSP83基因與藜麥HSP83基因同源性達到80%以上,證實在西農9976中獲得了HSP83基因,將其命名為FeHSP83。
2.2 生物信息學分析
2.2.1 FeHSP83蛋白質理化性質與序列分析 通過ProtParam軟件對FeHSP83蛋白理化特性分析表明,該基因蛋白相對分子量約為80.97 kDa,理論等電點為4.96,總共包括11408個原子,分子式為C3592H5721N933O1137S25。在組成FeHSP83編碼蛋白的704 個氨基酸中,谷氨酸(Glu)含量最高,達到了12.5%,負電荷殘基143個,正電荷殘基109個,脂溶指數為82.56,蛋白的不穩定參數為41.03,具有較強親水性。
2.2.2 FeHSP83蛋白的同源比對和進化分析 利用NCBI數據庫,將FeHSP83基因編碼的氨基酸序列與甜菜(BvHSP83)、黎麥(CqHSP83)、花生(AhHSP83)的HSP83氨基酸序列進行對比(圖2),結果顯示,其蛋白氨基酸長度極為相似,同源性達97.06%,說明FeHSP83蛋白在這幾個作物中存在較高的相似性。

圖2 FeHSP83與其他物種同源蛋白的多序列比對分析結果Fig.2 Multi-alignment of FeHSP83 amino acid sequence with other HSP83s
通過進化樹的構建,發現甜蕎FeHSP83蛋白與甜菜、藜麥HSP83蛋白的親緣關系較近,與番茄、辣椒等作物的HSP83蛋白親緣關系較遠(圖3)。進一步對比發現,同一分支上的甜菜、藜麥與甜蕎都為藜科植物,這種進化關系符合形態學分類規律,由此我們可推測FeHSP83基因具有較高的保守性。
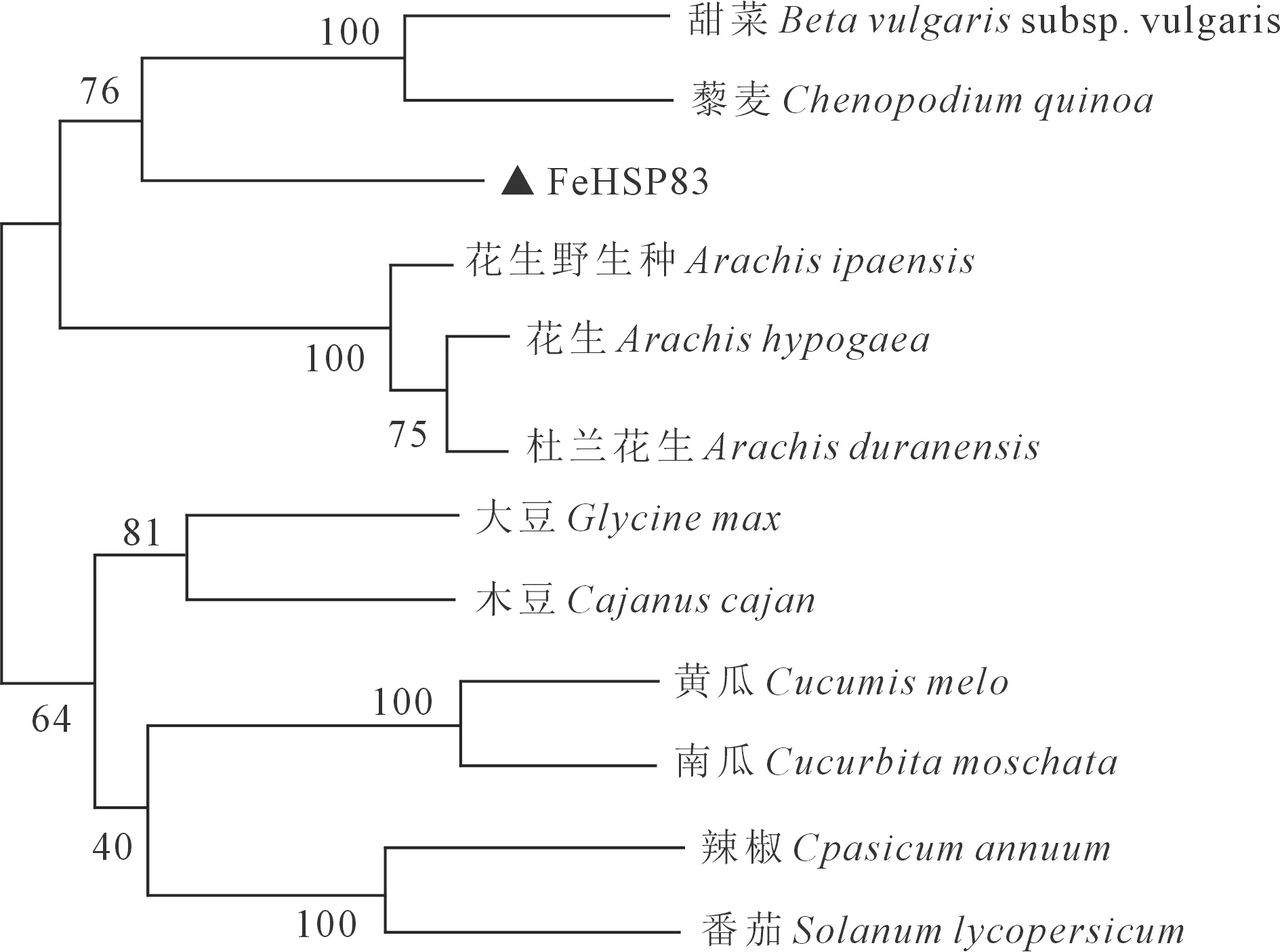
圖3 FeHSP83與其他物種HSP83蛋白的系統發育進化樹Fig.3 Phylogenetic analysis of FeHSP83 with other HSP83-like proteins
2.2.3 FeHSP83蛋白亞細胞定位 WOLF PSORT預測表明,該蛋白主要存在于細胞質,推測其編碼蛋白可能在細胞核外發揮作用。使用SWISS-MODEL網站對FeHSP83蛋白的三級結構進行預測,其結構如圖4所示。

圖4 FeHSP83蛋白的三級結構預測分析結果Fig.4 Prediction of three-dimensional structure of FeHSP83 protein
2.3 FeHSP83基因的表達分析
實時熒光定量PCR結果顯示(圖5),經干旱和鹽脅迫處理后,FeHSP83基因能較快響應脅迫,且在根、葉不同部位的表達量存在較大差異。在干旱脅迫條件下,FeHSP83在植株根部的表達量持續上升,至48 h達到最大,響應較為強烈;葉的表達量呈先升后降的狀態,在48 h時表達量最高,12 h時表達量較低。在鹽脅迫條件下,FeHSP83在植株葉部的響應較為強烈,在12 h時表達量達到最高,之后開始下降;根部的表達量在3 h時迅速升高,隨后緩慢下降。
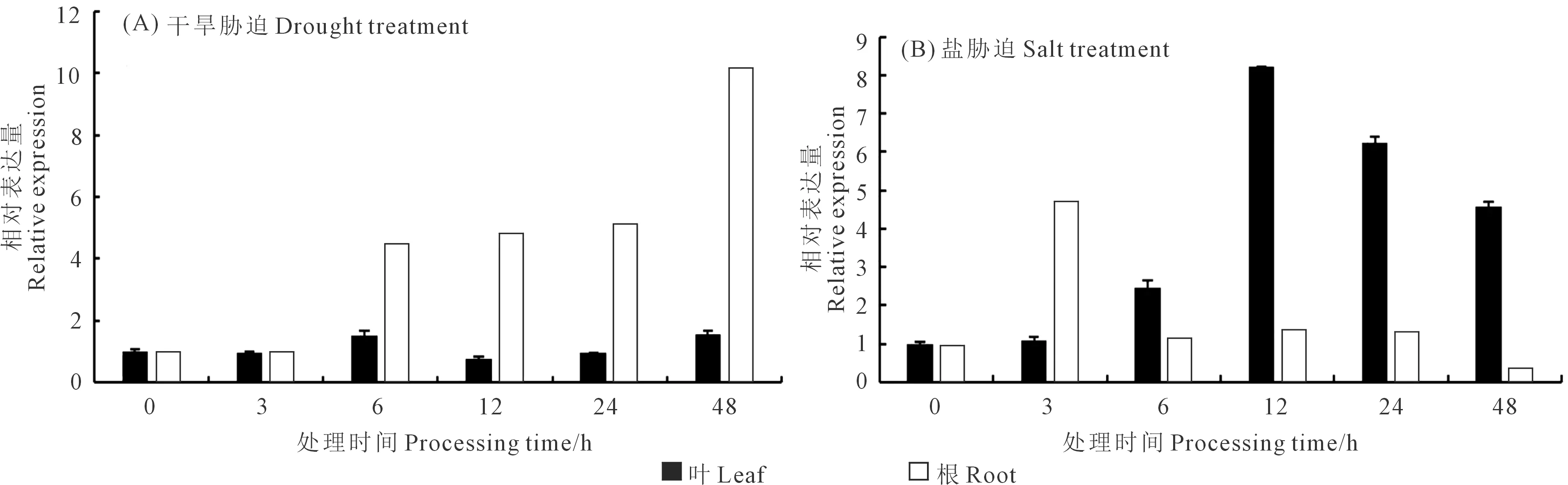
圖5 FeHSP83在甜蕎不同組織中的表達分析Fig.5 Relative expression analysis of FeHSP83 in different tissues of sweet buckwheat
3 討 論
熱激蛋白(HSPs)是一類在生物體受到外界脅迫時由轉錄因子誘導合成產生的高度保守的蛋白質家族。目前,HSP被報道主要有三類生物學功能:(1)分子伴侶,能夠幫助其他的蛋白質折疊、轉運,而自身不參與相關代謝;(2)獲得耐熱性;(3)調控細胞骨架動力學[15]。HSP90作為HSP家族中的一員,分子量大約為90 KD,通常以同型二聚體結構存在于真核細胞中,王彬等[11]研究發現,CmHSP90基因參與了中國南瓜對逆境的應答,表達量與其定位以及執行的功能有一定關系。葉綠體HSP90主要參與光和熱激的信號轉導,而線粒體HSP90的功能較為特殊,主要作用為免受氧化脅迫帶來的傷害。此外,有研究顯示,熱激轉錄因子(HSFs)在逆境信號傳導過程中起著重要的作用,大量HSP家族基因表達受其調控。
甜蕎是我國重要的經濟作物,有很高的營養價值和藥用價值,其生育期短、適應性強、耐貧瘠等優點,在干旱地區作物布局中具有極其重要的地位。本研究根據已知序列進行FeHSP83基因的引物設計,從甜蕎品種西農9976中成功克隆了FeHSP83基因的編碼序列,在對該基因進行生物信息學分析后發現FeHSP83基因具有HSP90家族所有的Pfam區域,在進化關系上與藜麥FeHSP83蛋白、甜菜FeHSP83蛋白較為接近,與番茄FeHSP83蛋白相距較遠,推測FeHSP83蛋白隸屬于HSP90家族,在功能上可能與藜麥較為相似,具有較高的同源保守性。
本研究基于轉錄組測序結果分析,發現了逆境脅迫條件下特異性表達基因FeHSP83,實時熒光定量PCR結果顯示在干旱和鹽脅迫條件下,FeHSP83基因在甜蕎幼苗子葉和根部的表達量顯著上升,且在根和葉不同部位間的反應存在較大差異。在干旱脅迫處理下,甜蕎幼苗子葉和根部反應迅速,子葉部分表達量相對較大,而在鹽脅迫條件下,甜蕎幼苗子葉和根部反應較為遲緩,根部的表達量遠高于子葉部分。因此,我們可以推測,FeHSP83基因參與了甜蕎對逆境脅迫的應答,在甜蕎抗旱研究中起到一定作用。在后續的研究中,我們可以通過農桿菌介導轉化法,構建超量表達載體轉入蕎麥,進一步探究FeHSP83基因在逆境脅迫下的調控機制,為蕎麥的抗逆分子育種奠定基礎。

