神經干細胞來源的外泌體在神經疾病診治中的應用
江張勝,趙晨玲,董 婷
(1.安徽中醫藥大學研究生院,中國安徽 合肥 230038;2.安徽中醫藥大學第一附屬醫院,中國安徽 合肥 230031)
細胞外囊泡(extracellular vesicle,EV)是指包括外泌體(exosome)、微囊泡(microvesicle)和凋亡小體(apoptotic body)在內的一系列囊泡。其中,外泌體是指多泡體(multivesicular body,MVB)與細胞膜融合時釋放到細胞外空間的大小為40~100 nm的腔內囊泡,其不僅可以由包括神經元細胞在內的不同類型細胞從晚期內體細胞區室分泌,還可從諸如腦脊液、血漿和尿液等的條件細胞培養基或體液中分離。外泌體作為疾病診斷和治療的生物標志物及細胞間通信的重要介質,可在膜細胞與胞漿蛋白質、脂質與RNA的轉運中發揮關鍵作用[1]。
目前,中風(stroke)、阿爾茨海默病(Alzheimer’s disease,AD)、脊髓損傷(spinal cord injury,SCI)和帕金森病(Parkinson’s disease,PD)等神經疾病,被認為是危害較大的神經系統疾病,已成為世界性衛生保健難題[2~3]。迄今為止,上述神經疾病尚不能完全治愈,僅可通過藥物改善其癥狀。近年來,神經干細胞(neural stem cell,NSC)在神經疾病損傷修復中的作用逐漸得到了業內人士的普遍認可。NSC不僅可參與神經發生、突觸發生、少樹突發生、軸突連接和髓鞘形成等過程,而且在灰質和白質損害方面也有作用[4]。盡管NSC治療神經疾病的機制尚不清楚,但有研究表明,其可能與細胞外環境中的分泌因子通過旁分泌功能實現的遠距離細胞間通信有關[5]。NSC和受損器官之間的細胞間通信被認為是通過釋放自由分子來調控的,這些分子通過與受體結合傳遞信號[6]。雖然當前外泌體發揮作用的機制仍不清楚,但不可否認的是其為細胞間通信開辟了一個新的研究前沿。眾多研究表明,外泌體可以作為反映神經疾病病理進展和促進康復的生物標志物,其可通過腦細胞的合成與釋放,透過血腦屏障,流入到外周血或腦脊液中[7~8]。由于NSC來源的外泌體可為神經疾病的診斷和治療提供新的途徑,故本文重點介紹了NSC來源的外泌體的性質和特征,以及它們作為神經疾病診斷與治療的生物標志物在臨床前模型中的作用(圖1)。
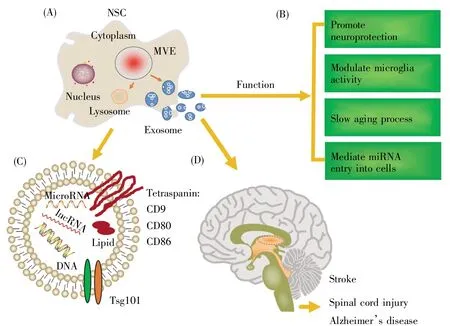
圖1 NSC分泌的外泌體的結構、功能和在神經疾病治療中的應用(根據參考文獻[47~49]、[52~53]修改)(A)NSC分泌的外泌體;(B)外泌體在神經疾病中的治療作用;(C)外泌體的結構和組成成分;(D)外泌體在神經疾病治療中的應用。Fig.1 Structure,function and application of exosomes secreted by NSCs in the treatment of neurological diseases(modified according to References[47~49]and[52~53])(A)Exosomes secreted by NSCs;(B)Function of exosomes in the treatment of neurological diseases;(C)The structure and composition of exosomes;(D)Application of exosomes secreted by NSCs in the treatment of neurological diseases.
1 外泌體
1.1 外泌體的生物學合成及基本特性
外泌體生物發生的第一步是質膜向內出芽,形成一個膜結合的液泡。該液泡在成熟過程中經歷幾個變化,形成一個晚期核內體,晚期核內體的限制膜隨后向內芽出,并夾斷形成被膜包裹的囊泡,稱為管腔小泡(intraluminal vesicle,ILV),即MVB。最后,部分MVB與細胞膜融合釋放到胞外,形成大小均一的囊泡,即外泌體[9]。
多個研究表明,不同來源的外泌體根據其生物發生釋放特定的脂類(膽固醇、磷脂酰絲氨酸、磷酸甘油酯和脂質等[10])、核酸(DNA、編碼RNA、非編碼RNA和microRNA[11])和蛋白質(CD9、CD80、CD86和Tsg101等[12])。目前,檢測外泌體的主要方法包含蛋白質免疫印跡、透射電鏡、免疫熒光染色和納米粒子追蹤分析等技術。
1.2 外泌體的分離和純化
自30多年前發現外泌體以來,人們已經清楚地認識到外泌體對生理和病理的許多方面都有作用,為了提高其應用效率,外泌體的高效分離和純化是十分必要的。目前,高效分離和純化外泌體的主要方法有:1)差速離心法。這也是最常見的一種方法,其操作簡單,產量適中。大容量樣本根據顆粒的大小和密度,采用低速離心、高速離心交替進行的方法,分離得到大小相近的囊泡,但回收率不穩定,且重復離心可能會損壞囊泡膜結構[13~14];2)抗體親和捕獲法。該方法利用抗原、抗體之間高度的特異性結合對外泌體進行分離,在獲得高純度外泌體的同時,可分離不同亞型的外泌體,但外泌體表面抗原可能因阻斷和覆蓋而不能被識別[15];3)微控流芯片法。該方法利用外泌體特異性構建三維微環境,進而從復雜的細胞基質分離出外泌體。雖然其獲得的外泌體純度高,但臨床樣品缺乏標準、規模化測試與方法驗證,同時樣本容量較低[16]。
2 NSC及其分泌的外泌體
2.1 NSC的特征及功能
NSC是神經系統中最不穩定的細胞之一,具有自我更新的功能特性,可產生3種基本的神經外胚層譜系,在整個生命過程中以發育階段的方式產生神經元、星形膠質細胞和少突膠質細胞。研究證實,NSC能夠促進神經元產生神經營養因子和神經生長因子等[17~19],這些因子可減少宿主內源性神經元的細胞死亡,促進軸突/樹突連接、神經營養和炎癥調節、細胞替代和神經可塑性修復,增強神經系統再生的能力。除了替代失去的神經元,NSC還可能發揮神經保護和免疫調節劑的功能,并且NSC移植作為一種潛在的神經退行性疾病的治療方法已被廣泛探索[20]。但是,NSC治療也可能帶來一些安全風險,主要包括畸胎瘤形成、異常細胞生長、免疫排斥和炎癥,以及不希望的細胞分化表型,這些都限制了NSC在臨床上的應用[20]。因此,NSC分泌的外泌體在神經疾病中的診斷和治療受到了極大的關注。
2.2 NSC分泌的外泌體
研究表明,在中樞神經系統中,NSC分泌的外泌體參與神經元和小膠質細胞之間廣泛的相互作用[21]。此外,NSC分泌的外泌體可將神經元中的活性物質轉移到腦內星形膠質細胞中,這可能會調節星形膠質細胞的功能,對突觸活性、神經血管完整性的維持和髓鞘形成等方面產生影響。例如:攜帶miR-124a的NSC外泌體進入星形膠質細胞與興奮性氨基酸轉運體-2/谷氨酸轉運體-1的表達增強有關[22];NSC外泌體可通過轉移miR-132到血管內皮細胞調控腦血管的完整性,導致黏附連接蛋白Cdh5的表達上調[23]。
在某些病理環境中,外泌體被認為是疾病的介質,這種現象在多種神經疾病中都有存在[24]。此外,NSC分泌的外泌體已被報道攜帶特定顆粒從其來源的細胞到其他細胞,導致大腦病理改變的增加,這包括AD中的β-淀粉樣蛋白(amyloidβ-protein,Aβ)和tau蛋白、海綿狀腦病中的朊蛋白、PD中的α-突觸核蛋白和富含亮氨酸的重復激酶-2、肌萎縮側索硬化中的超氧化物歧化酶-1[25]。另一方面,NSC分泌的外泌體也被證明具有神經保護作用,因為它們是周圍神經再生和神經元損傷修復的一部分[26]。Alvarez-Erviti等[27]研究表明,NSC分泌的外泌體表面攜帶的活性物質(如小的RNA)可以作為神經疾病診斷的納米信號。
同時,NSC分泌的外泌體可以作為神經疾病藥物治療的載體[28]。與NSC本身相比,使用NSC分泌的外泌體作為藥物載體有幾個優點。首先,通過鼻內給藥,大量的外泌體可靶向大腦的不同區域[29];其次,與細胞治療不同,外泌體在給藥后發生腫瘤或惡性轉化的可能性幾乎為零,因為它們不是有核細胞,不能復制,在釋放載物后迅速分解[30];最后,靜脈或鼻內給藥不太可能導致血栓形成,因為靜脈給藥能夠穿過血腦屏障并通過胞吞作用穿過內皮細胞形成小泡。因此,提供無細胞療法的外泌體可以改變人們看待藥物的方式,可以在沒有顯著副作用的情況下拯救許多生命。
3 NSC分泌的外泌體在神經疾病中的應用
3.1 外泌體作為診斷的標志物
神經疾病的監測、診斷及治療,需要一個準確、高效且容易檢測的標志物。外泌體能成為中樞神經系統中的生物標志物主要有以下幾個原因。第一,外泌體可以比較容易地通過血腦屏障,特異的中樞神經系統來源的外泌體和外周外泌體均可作為中樞神經系統疾病相關的生物標志物[27,31];第二,外泌體中的核酸、蛋白質和脂質在疾病進展過程中發生改變;第三,外泌體可以從尿液、血液和唾液等容易獲取的生物液體中無創分離出來,可用于疾病的早期診斷,這在中樞神經系統疾病中特別重要;第四,外泌體內容物被保護在膜狀結構中,這比傳統標本更有優勢,因為潛在的生物標志物被保護起來不容易被降解;第五,外泌體高度穩定,這使應用于臨床分析的樣品可以長期保存;第六,外泌體可以被濃縮,從而顯著提高檢測靈敏度。
在中樞神經系統的微環境中,外泌體不僅可以介導大腦功能和神經保護,而且也涉及中樞神經系統疾病的發病機制[27,32]。Guo等[33]通過純化PD患者腦脊液中的外泌體,證實外泌體中存在能夠誘導神經元中α-突觸核蛋白聚集的α-突觸核蛋白寡聚體。Shi等[34]觀察到,PD患者血漿外泌體中的α-突觸核蛋白濃度與健康對照組相比會有所增加。因此,人們通過檢測外泌體中的α-突觸核蛋白在一定程度上可判斷PD患者的病情。另外,Fiandaca等[35]報道,在AD患者血源性外泌體中檢測到磷酸化tau蛋白和Aβ的增加。Jia等[36]驗證了腦脊液與血源性外泌體生物標志物的一致性,證實血源性外泌體與腦脊液中的Aβ42和磷酸化tau蛋白具有相同的AD診斷能力。因此,人們可以通過檢測外泌體中Aβ的表達水平來監測AD患者的發病情況。
3.2 外泌體治療神經疾病的潛力
3.2.1 外泌體在中風治療中的應用
中風是導致死亡和長期殘疾的主要原因之一。到目前為止,臨床唯一批準治療腦卒中的藥物是組織型纖溶酶原激活劑。然而,這種藥物僅適用于及時住院治療的一小部分患者[37]。此外,組織型纖溶酶原激活劑的使用可能會增加一些患者發生出血性轉化的風險。因此,非侵入性的、有希望修復受中風影響的大腦的替代療法是必需的。從這個角度出發,少數研究分析NSC分泌的外泌體在腦卒中模型中的療效具有重要意義。生物標志物對于預測中風的嚴重程度和預后(包括可能形成的出血和其他并發癥)非常有價值。
NSC已知在各種中樞神經系統疾病的組織再生和修復中有效,其可通過分泌外泌體發揮抗炎和神經營養作用[38~39]。Webb等[40]的研究表明,在血栓栓塞性中風后靜脈注射NSC來源的外泌體可以改善中年小鼠的細胞與組織功能。NSC外泌體創造了小膠質細胞向M2型極化的有利環境,這可能與其促進碎片清除和減少慢性炎癥有關,由于中風是通過局部神經免疫反應打開血腦屏障,從而導致慢性神經變性,故在中風后接受外泌體的動物記憶會有所改善[41]。隨后,同一組研究人員在豬腦卒中模型中研究了NSC分泌的外泌體的療效[41],他們通過永久性大腦中動脈閉塞誘導缺血性卒中,并在卒中后2 h、14 h和24 h靜脈給予外泌體,發現受損組織在功能水平上有顯著改善,同時給予的外泌體能夠消除缺血性病變及顱內出血,減少腦損傷體積和腦腫脹,維持了腦白質的完整性。總的來說,中風后使用NSC來源的外泌體可以給患者提供顯著的神經與運動功能保護。
3.2.2 外泌體在AD治療中的應用
AD是一種進行性神經退行性疾病,以記憶喪失和多種認知障礙為主要臨床表現。長期以來,AD病理被認為是有毒的Aβ異構體積累在腦實質。Aβ導致小膠質細胞和星形細胞激活,從而使炎癥反應擴散到整個大腦[42]。遺憾的是,目前尚無有效的方法可以預防或治愈AD患者的神經元細胞死亡、Aβ沉積和認知功能下降。近年來,研究人員發現NSC具有分化為中樞神經系統各種類型細胞的潛能,為神經退行性疾病的治療帶來了希望。自從最初發現外泌體與AD有關[43]以來,多項研究證明了外泌體在AD中的多方面作用。
Dinkins等[44]研究發現,外泌體蛋白質在AD患者大腦的斑塊中積累,它們通過抑制nSMase2,減少外泌體的分泌,從而在體內減少AD患者大腦中的淀粉樣斑塊負荷。有證據表明,Aβ在突觸上結合可導致突觸功能中斷,最終導致樹突棘的收縮和認知障礙[45]。Micci等[46]研究發現,NSC分泌的外泌體可阻止突觸與Aβ受體的結合,并防止相關功能障礙(如記憶回憶缺陷);用NSC外泌體治療小鼠的突觸可塑性和記憶功能均對Aβ誘導的損傷有保護作用;此外,在誘導性轉基因小鼠模型中敲除NSC可導致突觸對Aβ的易損性增加,而外源性給藥NSC外泌體可完全修復該易損性。這些結果表明,由NSC特異性釋放的外泌體在促進或維持突觸對Aβ損傷影響的恢復中發揮關鍵作用,NSC分泌的外泌體通過誘導受體神經元的變化來緩解Aβ介導的毒性。目前已有研究表明,外泌體(包括NSC分泌的外泌體)引發的許多效應可歸因于其特定的microRNA載體作用,包括對衰老[47]、認知、突觸功能[48]的調節以及對神經的保護[49]。因此,NSC分泌的外泌體中特定的microRNA可能介導其對靶神經元突觸的保護作用,提示了開發新的治療途徑促進AD患者認知功能恢復的可能性。
3.2.3 外泌體在SCI治療中的應用
SCI會促使軸突分離和神經元死亡,導致永久性功能損傷。目前,SCI尚無根治方法,但干細胞移植常被認為是緩解SCI發展的最具吸引力治療方法之一。成人脊髓中內源性NSC的發現,為未來SCI的無創治療帶來了希望。但在常規臨床應用前,人們仍需解決移植細胞存活率低、細胞去分化、腫瘤形成等諸多問題。有研究表明,移植的干細胞主要通過旁分泌機制來減輕炎癥反應、提供神經保護和促進修復,而外泌體在促進SCI缺氧缺血后功能恢復的這一過程中發揮重要作用[50]。
自噬對細胞的再生至關重要,基礎或生理的自噬有助于細胞穩態的維持、蛋白質和亞細胞細胞器的控制,且可減少細胞損傷[51]。Rong等[39]研究表明,NSC來源的外泌體可通過提高LC3B和beclin-1表達所介導的自噬,抑制SCI模型大鼠的神經元凋亡、神經炎癥和小膠質細胞激活過程,從而促進功能恢復。因此,未來可將NSC來源的外泌體作為一種新型SCI生物治療途徑。
4 總結和展望
外泌體是目前基礎科學和轉化研究中發展最快的領域之一。然而,來自特定細胞類型的外泌體在不同條件下的功能差異性仍有待探索。在本文中,我們特別指出NSC來源的外泌體的特性、診療潛力及其在生理和病理條件下可能介導的多種功能,為臨床診療提供理論基礎。深入了解外泌體的組成和發展先進的方法來調節外泌體的載體,將進一步提高外泌體對不同神經疾病的治療效果。使用NSC在特定培養條件下分泌的特性良好的外泌體和攜帶所需microRNA、mRNA和蛋白質的外泌體,在治療多種神經疾病方面有很大的前景。
此外,使用NSC外泌體的非侵入性治療方法可能比NSC移植更有效,因為在靜脈或鼻腔給藥后,外泌體可以很容易地穿過血腦屏障到達病變部位。在未來,針對大腦中特定神經元類型或區域的外泌體可能有助于治療不同的神經疾病。但是,NSC外泌體的研究還面臨諸多挑戰,有關NSC外泌體診斷和治療神經疾病方面的研究仍任重道遠。

