石油烴-重金屬復合污染共去除研究進展
夏如馨, 姜 巖, 彭 蕾
(重慶工商大學 廢油資源化技術與裝備教育部工程研究中心,重慶 400067)
傳統的油污染問題依舊廣泛存在且不斷加劇。此外,在政策驅使下,以油企為代表的產污企業遺留下來的污染土地發展成為新問題。主要體現在2個方面:其一,隨著中國工業化園區的建設,出現了很多企業遷址“入園”事件,舊址土地一般都遭受了較為嚴重的油污染;其二,在國家嚴厲的環保政策及行業內部技術升級的驅使和推動下,部分“土煉油”和低產能等企業的關停也遺留了大面積油污染土壤。對于這些土壤的處置研究在以往基本忽略了重金屬的干擾,而事實上油污染場地一定伴隨著重金屬污染。Adeniyi和Afolabi[1]較早關注了二者復合污染問題,發現在兩個加油站、兩個汽修車間和一個國家電站的污染土壤中,均存在石油烴以及Cd、Cr、Cu、Ni和Pb等5種重金屬的混合污染。
發展至今,人們對石油烴與重金屬復合污染問題已經有了較為清楚的認知。首先,原油本身就含有重金屬,Osuji等[2]及祁魯梁等[3]對國內外油田原油的灰分進行了定性分析,發現存在Zn、Cu、Pb、Cd、Ni、Mn、Co、V等34種微量金屬。這些金屬元素與石油烴一起構成了石油的組分,二者相伴相生[4];其次,鉆井開采過程中由于鉆井液添加劑、低品質重晶石的使用[5],或者與碎鉆屑一同從地層中攜帶出來,從而引入重金屬污染。在對鉆井廢棄物的毒性進行檢測時,一些常見的具有危害性的金屬幾乎全部檢測到了蹤跡,如Zn、Pb、Cu、Cd、Ni、Hg、Ba、Cr等[6];最后,對于潤滑油而言,由于二烷基二硫代磷酸鋅(ZDDP)等各類含金屬添加劑的使用,以及機械磨損等過程均會混入重金屬。同時,部分重金屬污染土壤也會伴隨著由機加工和其他操作引起的油污染[7]。在對重慶某化工廠的Cr(Ⅵ)污染土壤進行采樣分析時發現,除了Cr(Ⅵ)(質量分數580~940 mg/kg)以外,石油烴的質量分數最高達到18760 mg/kg,比一些油污染場地的含油量還高。可見,石油烴和重金屬2種污染物經常同時存在于污染環境中,并產生復雜的底物交互作用。不同的重金屬由于具有不同的鍵合度和遷移率而對微生物和環境表現出不同的毒性作用;同一重金屬又能以膠體或可溶性絡合物等形態存在,從而表現出不同的生物毒性和底物競爭特性,使二者的環境行為發生改變,影響污染物的跨膜運輸及生物降解。
以往,對于石油類污染場地中的重金屬缺乏足夠的重視,生物修復研究以生物除油為主,而屏蔽了重金屬的擾動。筆者針對石油烴-重金屬復合污染問題,綜述了當前復合污染微生物修復研究現狀。重點論述了石油烴與重金屬的交互作用,剖析了石油烴降解菌在復合污染環境中進化出的不同金屬抗性機制,指出在生物修復領域中大量基礎研究與實際應用的脫節,提出將重金屬的影響和去除納入到制定油污染場地修復策略中,推動生物修復技術走向實際應用是未來的發展方向。
1 重金屬抑制石油烴的生物降解
重金屬在土壤環境中呈現出復雜的作用結果,僅濃度變化就會對石油烴的生物降解產生不同影響,不過,抑制作用還是占據主導[8-14]。多數研究結果證實,隨著金屬濃度的增加,石油烴生物降解效率降低。Oriomah等[11]的研究就具有代表性,Achromobacterxylosoxidans對Cu(Ⅱ)和廢機油都表現出耐受性,但當二者共存時,隨著Cu(Ⅱ)質量濃度增加至200 mg/L時,A.xylosoxidans對廢機油的降解能力由40%降低到5%。Baltrons等[12]也發現了相似的現象,Cr、Co、Pb、Mn、Ni、Cu和Zn等金屬濃度越高,對微生物降解3~4環多環芳烴的抑制作用越明顯。重金屬抑制石油烴生物降解機制更多地表現為損傷細胞或抑制細胞活力[15]。在重金屬環境中,細胞主動或被動地吸附和吸收重金屬后會影響酶蛋白等生物活性物質的功能特性;細胞還可依靠代謝酶和有機酸等物質在胞內、胞外還原和絡合重金屬。這些作用將會占用細胞正常的代謝通道,形成與天然底物的競爭,細胞對重金屬的應激響應擾動了原有的石油烴代謝途徑。因此,重金屬對石油烴抑制作用的復雜性體現在對細胞代謝的影響上,其作用結果再抑制石油烴的生物利用。
在現有認知中,除了重金屬本身的毒理學效應以外,更多的研究集中在酶蛋白方面。重金屬可以通過抑制石油烴降解酶系來影響其代謝通路。Liu等[16]發現在質量濃度100~300 mg/L的Pb(Ⅱ)作用下,Bacillusmalacitensis的鄰苯二酚2,3-雙加氧酶被誘導,使酶蛋白的空間構象發生改變、催化活性位點被掩蔽,這種作用是通過激發氧自由基的產生而造成酶蛋白損傷;此外,Pb(Ⅱ)的抑制作用也表現在影響細胞骨架的運動從而遲滯細胞的分裂增殖上。加氧酶是多環芳烴(PAHs)類化合物代謝的關鍵限速酶,在石油烴代謝通路中起到重要作用[17]。當前,對該酶的研究手段已較為成熟,相關報道較多。盡管對金屬抑制酶蛋白活性的研究相對較多,但不同的研究體系以及研究角度的不同,對其機制的闡述不盡相同,形成普遍共識的是絕大多數重金屬對酶蛋白會產生抑制作用。
此外,石油烴代謝過程中會產生大量水楊酸等有機酸,這一過程是有機物代謝的普遍規律,與重金屬并不存在直接關聯,但有機酸的累積會降低細胞對重金屬逆性脅迫的抗性[18],導致重金屬對微生物的抑制作用被放大,最終加劇了對石油烴生物降解的抑制。因此,在以往的生物修復研究中,屏蔽重金屬的處理模式不會是最優解決方案。
2 重金屬促進石油烴的生物降解
重金屬抑制細胞代謝是普遍存在的一種生物毒理現象,不過,重金屬的作用并非完全體現在其生物學毒性上,當前的部分研究也發現了其對石油烴降解具有促進作用。個別重金屬在適宜濃度等特定環境中對細胞毒性效應小,而且可以調節微生物對石油烴的吸附作用,如通過群體感應來調控生物膜的形成和胞外多糖產生等過程[19]。在抑制與調控兩種作用競爭下,使重金屬表現出提高石油烴的可生物降解性。表1總結了當前發現的對石油烴降解具有促進作用的重金屬。其中,該現象較多地發生在Cu(Ⅱ)上[19-22]。Ma等[20]發現,Cu(Ⅱ)的存在可以促進真菌Acremoniumsp. P0997對蒽的吸附,使蒽在水和菌絲之間的相分配發生改變,當Cu(Ⅱ)質量濃度增加至600 mg/L時,蒽吸附系數從0.75 L/g遞增至2.25 L/g,吸附系數與Cu(Ⅱ)濃度呈現正相關。2種細胞吸附行為競爭的結果造成了這一現象。重金屬與微生物表面之間存在靜電吸引力,而PAHs則以范德華力吸附于菌體表面,顯然,2種作用力差異明顯,導致重金屬優先占據細胞表面的吸附區[23];隨著金屬陽離子濃度的增加,細胞表面電荷逐漸被中和而呈現出近中性狀態,此時疏水性的PAHs更易于被吸附。在重金屬占據吸附區的初期,PAHs存在一個吸附抑制過程,只是細胞對PAHs的吸附作用原本就非常有限,其生物降解主要依賴于酶系的生物氧化[24],所以抑制結果并不明顯。此外,對于PAHs與重金屬的交互作用存在另外一種認知:由于陽離子-π[25]作用力使PAHs傾向于吸附在聚集于細胞表面的重金屬上,提高了細胞對PAHs的吸附。不過,這一研究結論僅有個別報道,這種新型分子間作用力對復合污染物的去除機制需要進一步探究。
上述研究存在著一個共性問題,隨著金屬濃度的增加而呈現出一致的促進作用,但對于抑制濃度未做報道。而實際上,同一金屬離子處于不同濃度水平時,很可能表現出不同的生物學效應。趙曉秀等[21]研究發現,當土壤中存在23.7 mg/kg的低濃度質量分數Cu(Ⅱ)時,正十六烷的降解率從不含Cu(Ⅱ)的59.0%提高到66.0%;而當Cu(Ⅱ)的質量分數提高到47.4和237.0 mg/kg時,正十六烷的降解率又分別下降至49.0%和39.0%。這一現象可能由于降解十六烷的優勢微生物是Cu(Ⅱ)抗性菌株,能夠耐受一定的Cu(Ⅱ)毒性,而非優勢的其他土著微生物則是Cu(Ⅱ)敏感性菌株,其活性受到Cu(Ⅱ)抑制,減少了對土壤中生長型底物的競爭,從而有利于優勢菌攝取各類營養物質,促進十六烷的降解;但當金屬濃度超過閾值水平時,會對所有抗性和敏感性微生物產生各種生理、生化和遺傳毒性效應,抑制石油烴的微生物降解。
從表1可見,除了Cu(Ⅱ)以外,Pb(Ⅱ)也對石油烴降解具有促進作用。Liu等[16]發現,當Pb(Ⅱ)的質量濃度從150 mg/L降低到50 mg/L時,B.malacitensis胞外和胞內蛋白質的質量分數分別增加了6.0×104和3.0×104。Pb(Ⅱ)誘導菲的降解基因簇表達,刺激了關鍵開環酶的釋放;同時,低濃度的Pb(Ⅱ)刺激產生的毒物興奮效應可引起蛋白質含量增加,促進了酶-金屬-底物三元復合物的形成,最終提高了菲的降解速率;而當Pb(Ⅱ)過量時,則會與Mg(Ⅱ)、Ca(Ⅱ)等營養元素競爭蛋白質成分中的巰基(-SH),又抑制了酶的活性。對于芽孢桿菌屬的研究,筆者所在課題組在近期也發現了一株Bacillustropicus,但該菌僅在Cu(Ⅱ)存在下對潤滑油的降解具有一定促進作用,而當另外3種金屬Pb(Ⅱ)、Cd(Ⅱ)、Cr(Ⅵ)存在時,均產生了抑制作用,體現了重金屬生物學效應的復雜性。另外發現的一種有別于Cu(Ⅱ)和Pb(Ⅱ)的作用機制是在含Cd(Ⅱ)的體系中。Cd(Ⅱ)和芘會脅迫細胞產生過量的活性氧(ROS)來誘導O.radicata[27]產生氧化應激反應,損害細胞活性,但高濃度Cd(Ⅱ)又會誘導抗氧化酶(SOD、CAT、POD)更迅速地分泌,可以強烈抑制由于ROS產生的氧化應激,二者的競爭形成了隨金屬濃度變化的促進效應,因此,表1中芘的去除率提高了9%。總之,微生物為應對重金屬毒性產生的不同抗性機制使復合污染環境中石油烴的降解變得更為復雜,利用和提高重金屬積極作用,削弱和抵消其脅迫是生物修復技術得以發展的優選策略。
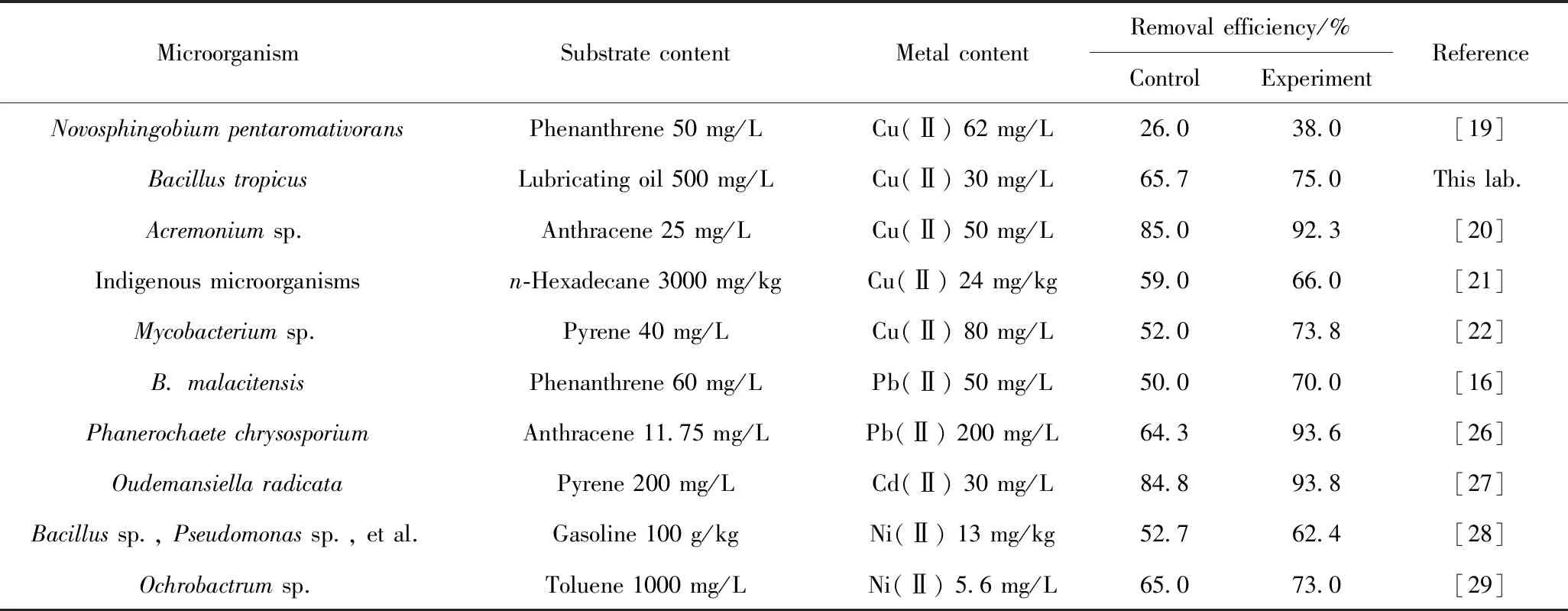
表1 重金屬對石油烴降解的促進作用Table 1 The promotion effect of heavy metals on the degradation of petroleum hydrocarbons
3 耐受重金屬毒性降解石油烴
油污染場地生物除油研究是當前國內外的研究熱點。利用微生物對重金屬具有耐受性進行油類污染物的生物降解是諸多報道的研究思路。無論是否考慮重金屬的影響,也無論是利用土著微生物還是外源菌,在客觀上,只有適應復合污染環境的微生物才能有效代謝石油烴。表2為污染環境中篩選出的耐受重金屬石油烴降解菌。在表2中,從油污染場地中選育出的土著微生物普遍具有環境適應性以及石油烴降解能力。這一功能特性的形成被認為與細胞內形成的特有基因有關,即DNA分子中一般都含有抗性基因或降解基因[30-31]。其中,Oyetibo等[32-33]的研究頗具代表性。除Burkholderiacepacia對于原油和蒽都表現出較高的降解能力外,另外2株Pseudomonasaeruginosa和Corynebacteriumkutscheri對難降解的蒽的去除率只有50%左右,其較高的原油去除率則應體現在對其他石油烴組分的降解上。包括該報道在內表2中的各研究均未觸及重金屬與石油烴的交互作用,但這并不意味著不存在促進或抑制作用,特別是在Oyetibo等的研究體系中,在Ni和Co的存在下,菌株呈現出很高的降解活力原因值得進一步研究。
在實地修復時,可以采用將具有重金屬抗性和石油烴降解能力的組合微生物功能菌群應用于復合污染土壤的方法[40]。Alisi等[41-42]利用混合菌群修復了在Mn、Zn、Cd、Cr、Pb多種金屬存在下的復合污染土壤,經過15 d的修復,直鏈碳氫化合物(C12~C20)的降解率為65%~75%,其中,頑固的異戊二烯烷烴類組分(C15~C18)去除率也達到了50%~60%。他們從微生物群落分析入手,發現在重金屬和有機毒性脅迫下,外源菌群變得非常活躍,推動整個微生物群落表現出高的代謝活性。在該研究中,外源菌群的功效可能來自于對能量流的特異性捕獲,激活整個微生物群落啟動生物降解。根據DGGE(變性梯度凝膠電泳)剖面對生態指標的分析,微生物群落的豐度、結構沒有明顯變化,污染物的脅迫影響主要體現在群落代謝特性上,而非對結構特性產生影響,亦即土壤環境中的微生物多樣性并未發生改變。這一報道從污染生態學角度切入,利用Biolog?ECOPlates研究了生物修復過程中污染場地的微生物群落變化,極具特色。但是,研究結論值得推敲。一般認為,環境在遭受污染后,微生物群落的多樣性趨于簡單化,而微生物的數量在石油烴進入環境后會呈現出逐漸增加的趨勢,其原因很簡單,有機污染物既提供了碳源等生長因子,也產生了有機毒性,在長期作用下后者導致種群種類減少,前者則刺激了耐受性微生物的生長繁殖。該研究中所得結論可能存在一定局限性,問題出現在實驗用的土壤樣品。實驗用土取自于含有少量Cr、Ni、Cu、Mn等金屬的廢棄農田,之后復配了柴油和高濃度的Zn、Pb,穩定3 d后開展了外源菌的修復研究。除了前述長期選擇作用將導致微生物群落簡單化以外,在外源菌的使用上也存在對土著微生物形成競爭性優勢的可能性,繼而抑制部分耐受微生物的生長和代謝,若這種選擇性競爭存在于污染環境中,也會造成微生物種類的減少。
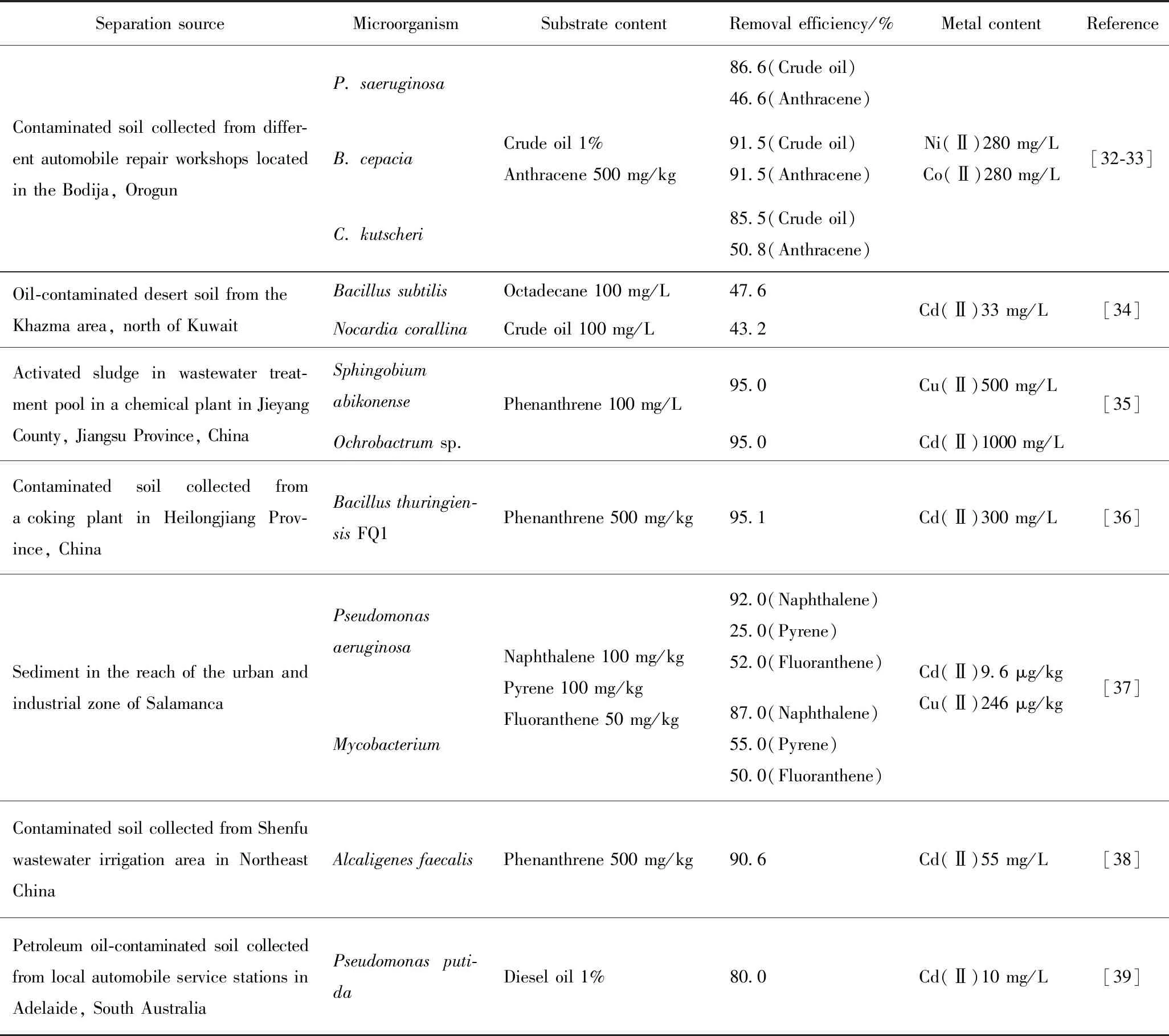
表2 污染環境中篩選出的耐受重金屬石油烴降解菌Table 2 Heavy metal-tolerant petroleum hydrocarbon degrading bacteria screened out in polluted environment
無論如何,依靠具有耐受重金屬特性的微生物降解石油烴、修復油污染場地是以往的主流研究,并且在大多數報道中均屏蔽了重金屬的影響。在筆者看來,利用復合菌群技術處置復合污染場地不失為一種有效手段,其實用性強,符合當前人們的認知水平。
4 石油烴-重金屬的共去除
微生物對石油烴與重金屬共去除的報道很少,但也逐漸發現Pseudarthrobacterphenanthrenivorans[43]、Sphingomonaspaucimobilis[44]、CitrobacterFreundii[45]、StenotrophomonasMaltophilia[46]、Pseudomonasgessardii[47]等菌株在對重金屬的應激反應中進化出相應的防御系統,它們不僅能夠耐受重金屬毒性,還能在代謝石油烴過程中還原轉化和吸附固定重金屬,實現了對有機、無機毒性的共去除,如圖1所示。其中Cr在環境中多以Cr(Ⅵ)和Cr(Ⅲ)形態存在,依靠石油烴降解菌的代謝活動可以將Cr(Ⅵ)還原為低價態,從而極大削弱鉻酸鹽生物毒性;與固定作用相比,還原轉化作用直接削弱了重金屬毒性,這也是抗性生物最主要的解毒機制。對于其他金屬元素而言,多以二價等穩定態存在,難以實現電子轉移的氧化還原反應,決定了其生物去除只能依靠吸附、吸收、絡合等固定作用。當然,固定作用也可以削弱環境污染,但重金屬的積累會對細胞生理活性產生消極影響。與此同時,可給態金屬離子的減少又緩解了對細胞的脅迫,正是一系列綜合作用的結果促成了生物降解石油烴協同去除重金屬。

R—Alkly chain圖1 微生物對石油烴-重金屬共去除作用Fig.1 Microbial co-removal effect on petroleum hydrocarbons and heavy metals
4.1 降解石油烴協同轉化重金屬
在復合污染環境中,微生物的代謝產物或者石油烴本身可以作為電子供體[48]以實現重金屬的還原反應,進而對2種污染物進行解毒。在Huang等[49]對萘和Cr(Ⅵ)的共去除研究中,首次報道了參與萘降解的酶蛋白NahG(水楊酸羥化酶)能夠還原Cr(Ⅵ),使PseudomonasbrassicacearumLZ-4可以同時降解6 mmol/L的萘和500 μmol/L的Cr(Ⅵ)。NahG原本是利用FAD(黃素腺嘌呤二核苷酸)作為輔因子將水楊酸轉化為兒茶酚,如圖2中A、B、C 3條路徑所示,這一過程伴隨著電子從NADH(還原型輔酶Ⅰ)轉移到氧分子上。但當Cr(Ⅵ)存在時,電子轉移則遵循了D途徑,直接轉移到了Cr(Ⅵ)上,從而實現了對鉻酸鹽的還原。此外,王衍麗[43]發現,rhd是編碼PAHs降解酶蛋白的關鍵基因,而chrA基因則與耐受和去除重金屬有關,只有這兩個基因同時存在于細胞內才可能發生共去除效應;繼而利用IMG/M(The integrated microbial genomes with microbiome samples)的全基因組和宏基因組數據庫(Metagenome database)挖掘出13個菌門、20個菌綱、58個菌目、123個菌科、401個菌屬和1164個菌種同時具有這兩種基因。基于基因挖掘信息,利用一株P.phenanthrenivorans菌證實了在對質量濃度為100 mg/L菲的降解過程中伴隨著Cr(Ⅵ)的還原。另外一種研究方法采用了變性梯度凝膠電泳技術,也收到了很好的研究結果。Ibarrolaza等[44]發現,S.paucimobilis對Cr(Ⅵ)形成了明顯的聚驅應激,在S.paucimobilis質量濃度低于3.2 mg/L時,Cr(Ⅵ)和質量濃度為200 mg/L的菲可以被完全去除。這些發現對于生物降解石油烴協同轉化重金屬的研究具有重要意義,畢竟,共去除的核心問題在于污染環境中存在特異性功能型的微生物,這是從事相關研究乃至解決實際問題的物質基礎。
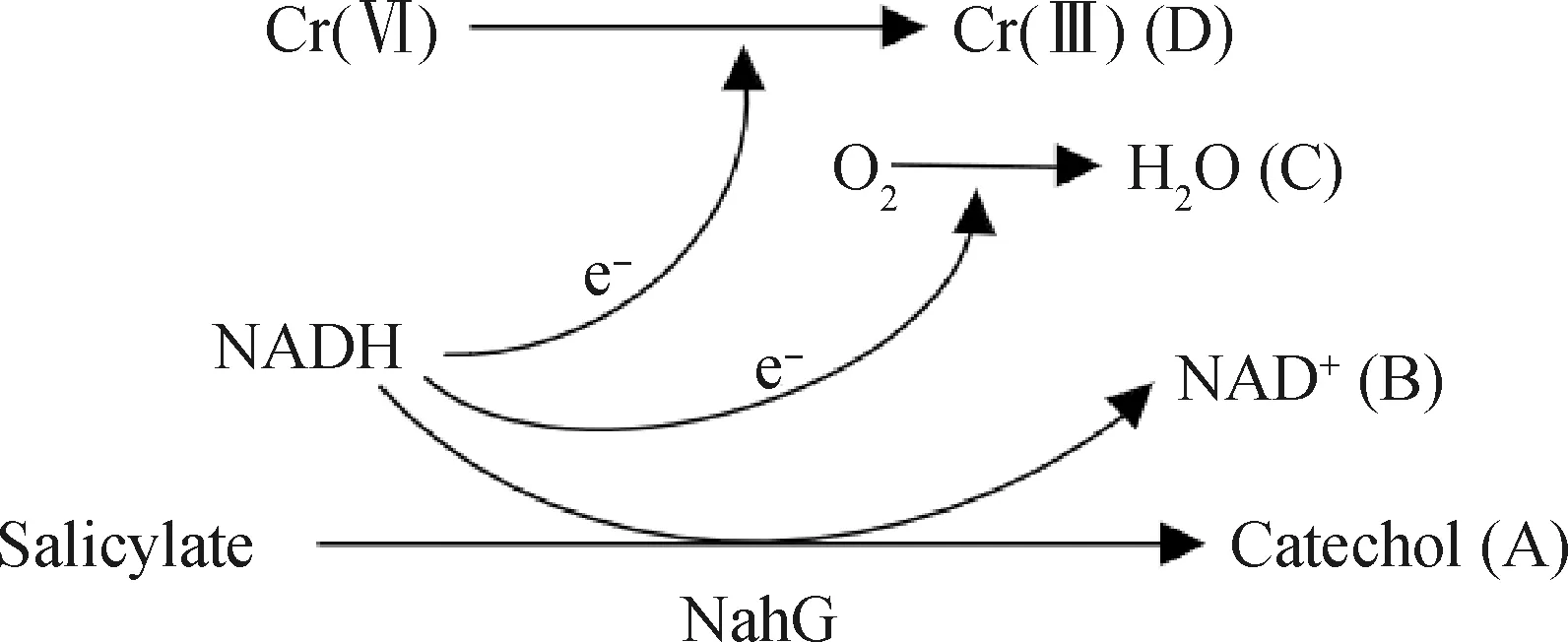
NADH—Reduced form coenzyme;NAD+—Deelectron-reducing coenzyme圖2 水楊酸羥化酶(NahG)還原Cr(Ⅵ)過程[49]Fig.2 Salicylate hydroxylase (NahG) reductionCr(Ⅵ) process[49]
4.2 降解石油烴協同固定重金屬
石油烴降解菌除了可以通過生長代謝活動改變金屬離子的價態,將其轉化為低毒或者無毒的狀態,還可以通過吸附、絡合等作用改變重金屬的形態和移動性,從而緩解重金屬毒性對生物降解石油烴的脅迫,實現生物降解石油烴同時去除重金屬等一系列連鎖反應。固定作用可以直接利用細胞表面帶負電荷的官能團來吸附游離的正電荷金屬離子。孫業政[26]發現在一定濃度范圍內石油烴種類不會對P.chrysosporium吸附重金屬產生影響,相反在質量濃度為64 mg/L萘存在下,真菌在降解萘的過程中對質量濃度為50 mg/L的Pb(Ⅱ)吸附率提高到75.4%。當前,對于真菌的吸附固定能力高于細菌已經得到越來越多的實驗支持。Maddela等[50]就發現與細菌Bacillusthuringiensis和Bacilluscereus對Cu(Ⅱ)的吸附率分別為7.9%和36.3%相比,真菌Geomycessp.對銅的吸附率可以達到97.3%,同時還表現出了對原油的高效降解率。真菌比表面積較大更容易與周圍環境發生物理接觸,尤其是細胞壁多糖的甘露糖醛酸和古糖醛酸中的高羧基含量提高了對重金屬的吸附。這種通過細胞表面官能團吸附固定重金屬的報道越來越多,這是細胞固有的特性,當然不局限在復合污染環境中。細胞在吸附重金屬后,還可以通過膜表面酶或者借助硫酸鹽等離子通道實現跨膜轉運至細胞內,被固定在細胞器內,或與細胞內的蛋白質、絡合素、多肽結合形成沉淀而被固定。近年來,金屬硫蛋白(Metallothionein,MT)在絡合重金屬方面受到越來越多的關注。這是一種普遍存在于生物體內的金屬結合蛋白,其中富含半胱氨酸的短肽,對多種重金屬有高度親和性。如半胱氨酸殘基的硫醇基團可以與Cd(Ⅱ)結合形成金屬-硫代鹽配合物,從而削弱其毒性[51]。這種由重金屬誘導產生的具有運輸和降低有毒金屬作用的蛋白質,對于隔離固定金屬離子起到重要作用。
除了上述表面吸附和胞內積累機制以外,微生物在代謝石油烴過程中分泌的鐵載體和表面活性劑等代謝產物也可以改變重金屬形態[52]。如Fusariumsolani在代謝芘的同時可以產生鐵載體類化合物固定Cu、Zn、Cd、Ni、Pb等重金屬[53];Pseudomonassp.和Burkholderiasp.等代謝石油烴產生的鼠李糖脂表面活性劑可以螯合Cd(Ⅱ)等[54]。總之,對于石油烴與重金屬的共去除作用的認識還非常有限,但這種作用是對污染場地進行生物修復最佳的解決方案,特別在重金屬類污染物負荷較高時尤為重要。不過,當前的研究水平尚無法形成穩定的共去除技術,主要存在兩個瓶頸問題:其一,缺乏高效的物質基礎;其二,成本控制問題。當然,在生物修復領域,環境條件始終是無法回避的現實問題,一定程度地限制了該技術的適用性。筆者所在課題組[55]在石油烴和重金屬共去除方面,針對潤滑油和Cr(Ⅵ)開發出Lysinibacillusfusiformis功能型菌種資源,可以實現對二者的共去除,但就目前進展來看,要想提高修復效率就要增加助劑成本,而為了控制成本又會犧牲去除率,因此,共去除技術還有很長的路要走,但也的確是最優的解決方案。
5 結 語
建立油污染環境伴隨重金屬污染的意識具有重要意義。在油污染環境中,重金屬也以各種途徑進入到污染場地中,形成了石油烴與重金屬的復合污染,在實地修復或油污染修復研究中需要統籌考慮。重金屬與石油烴間會形成復雜的交互作用,往往并存著誘導促進作用與毒性抑制作用。在多數情況下,重金屬的抑制作用占據主導,影響了細胞對石油烴的降解;不過,在部分研究體系中發現,Cu、Cd和Pb等金屬也可以通過調節細胞膜的吸附作用或分泌抗氧化酶等機制而對石油烴降解產生積極的促進作用。
以往對于復合污染認知的不足限制了生物修復技術的發展,由于缺乏共去除技術而形成了使用單一污染物處置技術來應對復合污染的局面,而為實現修復目標只能增加修復成本,這種以犧牲處置成本為代價的修復研究只會把生物修復技術帶入到沒有前途的發展道路。針對復合污染問題,利用特異性石油烴降解菌和重金屬抗性菌解決復合污染問題不失為一種切實可行的手段,當然,在生物降解石油烴過程中,能夠協同轉化、吸附、固定重金屬以實現二者的共去除,是最理想的修復策略之一,有助于推動生物修復技術的穩定應用,成為該領域的發展出路。

