桃Ⅱ型NADH脫氫酶家族基因鑒定和表達分析
張春華, 沈志軍, 馬瑞娟, 張圓圓, 郭紹雷, 蔡志翔, 俞明亮
(江蘇省農業科學院果樹研究所/江蘇省高效園藝作物遺傳改良重點實驗室,江蘇 南京 210014)
Ⅱ型NADH脫氫酶(Type ⅡNADHdehydrogenase,EC 1.6.99.3)廣泛存在于真細菌、古細菌、酵母、真菌和植物線粒體中[1-3],基因組測序的100%植物種類中均有Ⅱ型NADH脫氫酶[4]。Ⅱ型NADH脫氫酶家族蛋白質的典型特點是存在一個保守的C端結構域,該結構域在介導蛋白質的二聚化、膜錨定以及底物的識別中發揮著重要作用[5]。Ⅱ型NADH脫氫酶不傳遞質子,位于線粒體內膜表面(內側或者外側),也有位于質體和葉綠體的報道。Ⅱ型NADH脫氫酶相對分子質量低,一般由單個多肽鏈組成,驅動電子從NADH轉移到泛醌[6]。與多聚體復合物I相反,Ⅱ型NADH脫氫酶對魚藤酮不敏感,通常含有1個FAD非共價結合分子作為氧化還原修復基團[2,7]。
植物能通過Ⅱ型NADH脫氫酶氧化外源NADH和NADPH[8-9]。Ⅱ型NADH脫氫酶介導的NADH氧化可以驅動更快的新陳代謝的產能過程,以及加快碳元素流入生物合成路徑,因而可以更高效地合成ATP[5]。每種植物至少含有4種對魚藤酮不敏感的Ⅱ型NADH脫氫酶[9]。多種植物基因組測序的完成為研究Ⅱ型NADH脫氫酶家族基因提供了便利。根據報道,來自部分植物的Ⅱ型NADH脫氫酶基因已經被鑒定,擬南芥(Arabidopsisthaliana,At)7個[9]、水稻(Oryzasativa,Os)6個、黃豆(Soybean)2個[10]、土豆(Solanumtuberosum,St)2個[11]、玉米(Zeamays,Zm)2個[9,12]、甜菜(Betavulgaris,Bv)2個[12-14]等。另外,來自萊氏衣藻(Chlamydomonasreinhardtii,Cr)7個Ⅱ型NADH脫氫酶已被初步鑒定。
不斷增加的證據顯示Ⅱ型NADH脫氫酶家族基因在氧化、光呼吸、生物和非生物逆境及其他代謝途徑中起重要作用[10,15]。土豆葉片的Ⅱ型NADH脫氫酶蛋白質NDA1依賴光,且對低溫敏感,5 ℃冷害處理6 d后,蛋白質表達量下降為原來的10%;在早上蛋白質表達量出現峰值,并可能與晝夜節律和光合作用有關[16-17];輸入的蛋白質Ⅱ型NADH脫氫酶在洋地黃素滲透時與膜相關。擬南芥葉片的Ⅱ型NADH脫氫酶基因AtNDA1受光控制,AtNDA2不依賴光,AtNDA2在檢測的擬南芥所有組織中均有表達,AtNDA1特異性地在擬南芥地上所有組織中表達,在根中幾乎無表達;AtNDB1和AtNDB2在擬南芥所有組織中均有表達,AtNDB3和AtNDB4在擬南芥葉片中不表達,AtNDB4在莖中也不表達;AtNDC1在擬南芥所有檢測組織中均有高表達,表明可能與異養代謝、呼吸等活動相關。在萊氏衣藻中,NDA1在復合物I缺乏的情況下,起到氧化基質的作用[18]。Ⅱ型NADH脫氫酶是一類冗余蛋白質,但是擁有良好的可塑性,可以根據環境的不同起到不同的作用,賦予了生物體更好的適應環境的能力[5]。
桃(Prunuspersica)是薔薇科(Rosaceae)李屬(Prunus)植物,果實柔軟多汁、營養豐富,深受消費者喜愛,是世界廣泛栽培的果樹。中國是世界桃生產大國,據聯合國糧農組織統計數據庫(FAOSTAT)最新統計,2019年中國桃種植面積(84 0919 hm2)和總產量(15 841 928 t),均穩居世界第一,分別占世界桃種植總面積(1 527 052 hm2)的55.07%和總產量(25 737 841 t)的61.55% ;中國桃種植面積排在李、黑刺李、蘋果、梨和柿子之后,超過葡萄;總產量僅次于蘋果、梨,也已超過葡萄(http://www.fao.org/about/en)。桃是二倍體(2n=2x=16),具有相對小的基因組(約265 Mb),特別是桃Lovell、Chinese Cling全基因組測序獲得26 335~27 852個注釋基因[19-20],為研究桃每個家族基因的特點和功能提供了堅實的基礎。
目前,尚未有桃Ⅱ型NADH脫氫酶家族成員的系統鑒定和分析報道。鑒于此,本研究鑒定了桃Ⅱ型NADH脫氫酶家族成員,并分析了進化特征、基因結構、蛋白質結構、組織表達等特性。研究結果將為進一步驗證桃Ⅱ型NADH脫氫酶家族基因在桃生長發育中的功能奠定基礎。
1 材料與方法
1.1 桃Ⅱ型NADH脫氫酶家族成員的鑒定
根據擬南芥7個Ⅱ型NADH脫氫酶基因及其編碼的蛋白質氨基酸序列,利用BLAST工具檢索薔薇科基因組數據庫(http://www.rosaceae.org/node/355)桃參考基因組蛋白質氨基酸序列,將這些候選序列逐一提交到NCBI的在線工具 CD Search(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)進行保守結構域(NADHdehydrogenase-like)搜索,預測這些蛋白質有無Ⅱ型NADH脫氫酶結構域。存在NADHdehydrogenase-like保守區域的蛋白質就被認為是Ⅱ型NADH脫氫酶蛋白質。
1.2 桃Ⅱ型NADH脫氫酶家族基因克隆
使用植物總RNA提取試劑盒(北京天根生化科技有限公司產品)分別提取桃野雞紅葉芽、老葉、幼葉、一年生枝條的枝表皮、根、幼果肉、熟果肉、熟果皮組織的總RNA,使用1.5%的瓊脂糖凝膠電泳和微量紫外可見分光光度計檢測總RNA的純度和濃度,分別以1 μg各組織的總RNA為模板,使用PrimeScriptTMⅡ 1st Strand反轉錄試劑盒[寶生物工程(大連)有限公司產品]合成cDNA第一條鏈,并稀釋10倍。
根據桃每個Ⅱ型NADH脫氫酶基因的參考基因組CDS序列設計引物(表1),以桃葉片cDNA 為模板,PCR擴增每個桃Ⅱ型NADH脫氫酶基因的開放閱讀框(Open reading frame,ORF)全長序列。PCR反應體系50.0 μl:21.0 μl ddH2O,25.0 μl DNA聚合酶混合物,上、下游引物(10 μmol/L)各1.0 μl,cDNA 2.0 μl。PCR反應程序:94 ℃預變性5 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸60 s,共35個循環;72 ℃延伸10 min。PCR產物經2%瓊脂糖凝膠電泳和膠回收后,回收片段與pEASY-T3載體(北京全式金生物技術有限公司產品)連接并轉化DH5α感受態細胞,選取菌液PCR鑒定為陽性的克隆,由通用生物系統有限公司測序。

表1 桃Ⅱ型NADH脫氫酶基因克隆所用引物
1.3 桃與其他物種Ⅱ型NADH脫氫酶蛋白質系統進化樹的構建
利用軟件MEGA 4.1內置的Clustal W程序對6個桃Ⅱ型NADH脫氫酶與擬南芥7個、水稻8個、玉米1個、土豆2個、萊氏衣藻6個Ⅱ型NADH脫氫酶蛋白質氨基酸序列進行比對分析。7個擬南芥Ⅱ型NADH脫氫酶蛋白質氨基酸序列AT1G07180.1、AT2G29990、AT4G28220、AT4G05020、AT4G21490、AT2G20800、AT5G08740下載自http://www.arabidopsis.org/;8個水稻Ⅱ型NADH脫氫酶蛋白質氨基酸序列Os07t0564500-01、Os01t0830100-02、Os01t0830100-01、Os05t0331200-01、Os06t0684000-02、Os06t0684000-01、Os08t0141400-01、Os06t0214900-01下載自https://rapdb.dna.affrc.go.jp;1個玉米Ⅱ型NADH脫氫酶蛋白質氨基酸序列Zm00001eb151430下載自https://plants.ensembl.org/index.html;2個土豆Ⅱ型NADH脫氫酶蛋白質氨基酸序列PGSC0003DMG400021670、PGSC0003DMG400004168下載自https://phytozome-next.jgi.doe.gov;6個萊氏衣藻Ⅱ型NADH脫氫酶蛋白質氨基酸序列XP_001698901.1、XP_001702271.1、XP_001703055.1、XP_001703643.1、XP_001691969.1、XP_001703056.1下載自https://www.ncbi.nlm.nih.gov/。
根據多序列聯配的結果,使用MEGA 4.1軟件以相鄰連接法構建系統進化樹,并對構建的系統進化樹進行自舉評估,隨機抽樣重復次數設為1 000,其他參數使用系統默認值。并根據擬南芥和水稻Ⅱ型NADH脫氫酶家族的亞家族分類情況進行了桃Ⅱ型NADH脫氫酶家族的亞家族分類。
1.4 桃Ⅱ型NADH脫氫酶基因結構、啟動子及保守結構域分析
每個基因序列及所在染色體位置下載自薔薇科基因組數據庫(http://www.rosaceae.org/node/355)。運用在線網站GSDS(http://gsds.cbi.pku.edu.cn/)分析Ⅱ型NADH脫氫酶基因結構,包括外顯子、內含子、3′UTR和5′UTR。在GDR數據庫下載每個基因起始密碼子前的1~2 000 bp,將序列輸入Promoter 2.0服務器在線預測Ⅱ型NADH脫氫酶基因啟動子。
使用在線工具Multiple EM for Motif Elicitati(MEME, version 4.8.1, http//meme-suite.org/tools/meme)分析每個成員編碼蛋白質的保守結構域,并下載LOGO圖。參數設置為:保守區域(Motif)數量最多5個,保守區域寬度6~100。
1.5 桃Ⅱ型NADH脫氫酶蛋白質的一級、二級結構預測
利用ExPaSy的Protparam軟件(http://expasy.org/tools/protparam.html)預測Ⅱ型NADH脫氫酶蛋白質一級結構及特性,包括氨基酸數目、相對分子質量大小、分子式、總原子數量、穩定性指數、理論等電點、蛋白質親疏水性等。利用在線工具TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)預測每個蛋白質的跨膜結構域。信號肽預測網站采用https://novopro.cn/tools/signalp.html 和http://www.cbs.dtu.dk/services/SignalP-4.0/。
利用在線工具SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)預測桃Ⅱ型NADH脫氫酶蛋白質二級結構中α-螺旋、β-折疊和無規則卷曲等在整體結構中所占的比例,窗口寬度設置為17,相似性閾值設置為8。
1.6 桃Ⅱ型NADH脫氫酶基因的表達分析
以各組織cDNA為模板,采用Primer Premier 5.0軟件(Premier Biosoft),為每個基因設計實時熒光定量PCR引物(表2),使擴增產物出現在6個基因間的非保守序列,采用SYBR? Premix Ex TaqTM(Tli RNaseH Plus)試劑盒[寶生物工程(大連)有限公司產品]進行熒光定量PCR反應,反應體系和反應程序等參考Zhang等[21]的方法。 使用SPSS20.0 對數據進行差異顯著性分析,所有數據以鄧肯氏新復極差法進行檢驗。

表2 桃Ⅱ型NADH脫氫酶基因熒光定量PCR所用引物
2 結果與分析
2.1 桃Ⅱ型NADH脫氫酶家族成員鑒定
根據擬南芥Ⅱ型NADH脫氫酶基因編碼的蛋白質檢索出6個桃候選Ⅱ型NADH脫氫酶(表3),用Conserved Domain Search軟件對其保守結構域進行預測,結果顯示,桃有6種Ⅱ型NADH脫氫酶蛋白質。其中,Prupe.6G055600.1、Prupe.4G039000.1、Prupe.3G231400.1只含有1個NADHdehydrogenase-like結構域;Prupe.3G231300.1和Prupe.4G037100.1除了含有NADHdehydrogenase-like結構域外,還含有EF-hand保守結構域,Prupe.3G231300.1氨基酸序列的426~499 aa含有2個EF-hand結構域,Prupe.4G037100.1只含有1個EF-hand結構域,位于390~464 aa;Prupe.5G076700.1氨基酸序列含有1個小的NADH結合結構域,這個小的NADH結合位點被包含在一個更大的、被稱作氧化還原輔基的FAD結合結構域里。
2.2 桃Ⅱ型NADH脫氫酶家族基因克隆
從野雞紅葉片中分離出5個基因,根據測序結果和參考基因組序列比對,發現5個Ⅱ型NADH脫氫酶基因與桃參考基因組Lovell品種中5個相應基因的ORF分別完全一致,Prupe.6G055600.1、Prupe.4G039000.1、Prupe.3G231400.1、Prupe.4G037100.1、Prupe.5G076700.1ORF全長分別是1 506 bp、1 653 bp、1 746 bp、1 764 bp、1 620 bp,分別編碼501個、550個、581個、587個、539個氨基酸;這些基因分別位于3~6號染色體上(表3)。在多個組織的cDNA文庫中,多次設置不同溫度梯度和模板濃度,Prupe.3G231300.1都沒有被擴增出來(圖1)。

a:Prupe.6G055600.1;b:Prupe.3G231400.1;c:Prupe.3G231300.1;d:Prupe.3G231400.1;e:Marker;f:Prupe.4G037100.1;g:Prupe.3G231300.1;h:Prupe.5G076700.1;i:Prupe.4G039000.1;j:RPII。圖1 桃6個Ⅱ型NADH脫氫酶家族基因克隆Fig.1 Cloning of type Ⅱ NADH dehydrogenase family genes in peach

表3 桃Ⅱ型NADH脫氫酶家族基因信息
2.3 桃與其他物種Ⅱ型NADH脫氫酶蛋白質系統進化樹的構建
為評估桃和其他物種Ⅱ型NADH脫氫酶蛋白質的進化關系,對桃和其他5個物種Ⅱ型NADH脫氫酶家族蛋白質氨基酸序列進行系統進化樹構建(圖2)。根據不同物種間Ⅱ型NADH脫氫酶家族蛋白質氨基酸序列的相似性和進化關系的遠近,特別是根據擬南芥Ⅱ型NADH脫氫酶亞家族蛋白質分類,將桃Ⅱ型NADH脫氫酶蛋白質分成3個亞家族:NDA、NDB、NDC,分別包含2個、3個、1個成員。

圖2 桃與其他物種Ⅱ型NADH脫氫酶家族成員系統進化樹Fig.2 Phylogenetic tree of type Ⅱ NADH dehydrogenase family members in peach and other species
NDA亞家族中的Prupe.6G055600.1與At1g07180(AtNDA1)和At2g29990(AtNDA2)親緣關系均較近,同時Prupe.6G055600.1與土豆StPGSC0003DMG400004168(StNDA1,NCBI序列號:CAB52796.1)進化關系也很近,因此,將Prupe.6G055600.1 命名為PpNDA1。Prupe.4G039000.1 命名為PpNDA2。
桃Prupe.3G231400.1與擬南芥At4g28220(AtNDB1)和土豆StPGSC0003DMG400021670(StNDB1)緊密聚在一起,親緣關系最近,因此,將Prupe.3G231400.1命名為PpNDB1。桃Prupe.3G231300.1與擬南芥At2g20800(AtNDB4)聚在一起,將Prupe.3G231300.1命名為PpNDB4; Prupe.4G037100.1與擬南芥At4g21490(AtNDB3)親緣關系更近,將Prupe.4G037100.1命名為PpNDB3 (表3)。
桃NDC亞家族中僅含有Prupe.5G076700.1一個成員,其與擬南芥At5g08740(AtNDC1)親緣關系最近,在同一分支內,因此,Prupe.5G076700.1被命名為PpNDC1(表3)。
桃Ⅱ型NADH脫氫酶家族成員比擬南芥Ⅱ型NADH脫氫酶家族成員少了1個,桃沒有與擬南芥AtNDB2相對應的同源基因。
2.4 桃Ⅱ型NADH脫氫酶基因結構、啟動子及保守結構域分析
桃Ⅱ型NADH脫氫酶基因結構(圖3)顯示,NDA亞家族的2個基因均含有8個外顯子和7個內含子,而且2個基因之間外顯子長度和外顯子排列順序幾乎完全相同,但是內含子長度、3′UTR長度和5′UTR長度有很大不同。NDB亞家族的Prupe.3G231400.1(PpNDB1)和Prupe.4G037100.1(PpNDB3)基因均分別含有10個外顯子和9個內含子,Prupe.3G231300.1(PpNDB4)含有11個外顯子10個內含子,且無上下游3′UTR和5′UTR結構。基因間相比,同一編號的外顯子長度幾乎相等。Prupe.5G076700.1(PpNDC1)的基因結構與其他亞家族基因不同,沒有內含子,由3′UTR、5′UTR和1個長外顯子構成。

圖3 桃Ⅱ型NADH脫氫酶家族基因結構Fig.3 Gene structure of type Ⅱ NADH dehydrogenase family in peach
桃Ⅱ型NADH脫氫酶家族6個基因的啟動子分別位于基因起始密碼子前2 000 bp范圍的496~546 bp、1 330~1 380 bp、1 771~1 821 bp、1 153~1 203 bp、1 612~1 662 bp、1 678~1 728 bp 處(表4)。

表4 桃Ⅱ型NADH脫氫酶基因啟動子分析
保守區域分析結果(圖4和圖5)顯示,每個PpNDA和PpNDB亞家族成員均含有4個相同的保守結構域: motif 1、motif 2、motif 3、motif 5,這4個保守結構域在每個成員的氨基酸序列中出現的先后順序也相同。PpNDB亞家族的3個成員除了含有上述4個保守結構域外,還含有1個PpNDB亞家族成員特有的保守結構域motif 4。PpNDC亞家族成員只含有保守結構域motif 2和motif 3。
理學作為現代科學技術的基礎學科在社會生產生活中有著重要的地位和作用,可“物理是高中最難學的一門課”也已經成為多年來師生們的共識,相當一部分學生因為學不好物理而放棄物理,進而放棄理科選擇文科。但對幾屆學生的調查得知,這些反映高中物理不好學的同學當中有相當一部分在初中其實很喜歡物理,并且成績也不錯。

圖4 桃Ⅱ型NADH脫氫酶家族蛋白保守結構域標志Fig.4 Conserved domain markers of type Ⅱ NADH dehydrogenase family proteins in peach

藍色:motif 1;紅色:motif 2 ;桔黃:motif 3;紫色:motif 4;綠色:motif 5 圖5 桃Ⅱ型NADH脫氫酶家族蛋白質保守結構域Fig.5 Conserved domain of type Ⅱ NADH dehydrogenase family proteins in peach
2.5 桃Ⅱ型NADH脫氫酶蛋白質一級、二級結構預測
桃Ⅱ型NADH脫氫酶蛋白質一級結構預測結果(表5)表明,桃Ⅱ型NADH脫氫酶蛋白質氨基酸數目介于501~621 aa,相對分子質量介于55 340~70 070;而且發現 NDC亞家族和PpNDA亞家族成員的氨基酸數目和相對分子質量小于PpNDB亞家族成員。
Prupe.3G231400.1(PpNDB1)和Prupe.5G076700.1 (PpNDC1)理論等電點值均小于7,說明是酸性蛋白質;其余4個蛋白質的理論等電點均大于7,是堿性蛋白質。6個蛋白質的不穩定指數介于31.58~39.18,均屬于穩定蛋白質。6個桃Ⅱ型NADH脫氫酶蛋白質親水性指數平均值介于-0.135~-0.308,均是親水性蛋白質(表5)。
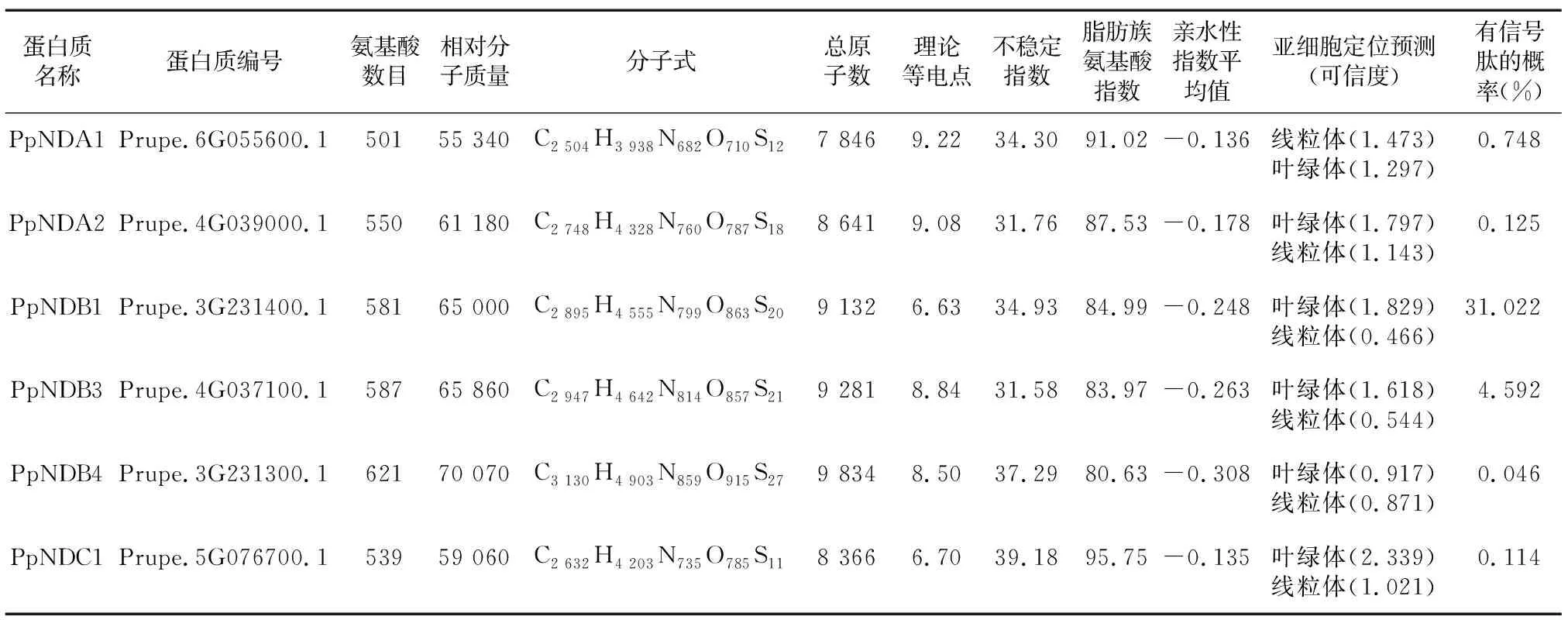
表5 桃Ⅱ型NADH脫氫酶家族蛋白質一級結構分析
亞細胞定位預測結果(表5)顯示,6個桃Ⅱ型NADH脫氫酶蛋白質大概率位于線粒體或葉綠體;跨膜結構域預測結果表明,6個蛋白質均無跨膜結構域;6個蛋白質Prupe.6G055600.1、Prupe.4G039000.1、Prupe.3G231400.1、Prupe.4G037100.1、Prupe.3G231300.1、Prupe.5G076700.1有信號肽的概率分別是 0.748%、0.125%、31.022%、4.592%、0.046%、0.114%。
利用SOPMA程序對6個桃Ⅱ型NADH脫氫酶家族蛋白質的二級結構進行預測,結果(表6、圖6)顯示,PpNDB亞族成員蛋白質的二級結構全部以α-螺旋為主要構成元件,其次是無規則卷曲,β-轉角所占比例最低。而PpNDA和PpNDC亞族成員蛋白質的二級結構中占比最高的是無規則卷曲,其次是α-螺旋,β-轉角所占比例最低。

表6 桃Ⅱ型NADH脫氫酶家族蛋白質二級結構分析

藍色:α-螺旋;紅色:β-折疊;綠色:β-轉角;紫色:無規則卷曲。圖6 桃Ⅱ型NADH脫氫酶家族蛋白質二級結構Fig.6 Secondary structure of type Ⅱ NADH dehydrogenase family proteins in peach
2.6 桃Ⅱ型NADH脫氫酶基因表達水平分析
以RPII為看家基因,以葉芽表達量為1,其他7個組織相對于葉芽組織表達量的相對水平進行計算,桃Ⅱ型NADH脫氫酶家族基因在8個組織中的相對表達水平分析結果(圖7)表明,Prupe.6G055600.1(PpNDA1)在熟果肉中表達量顯著高于老葉、枝表皮和其他組織;Prupe.4G039000.1(PpNDA2) 在根中表達量最高,其次是老葉,再次是葉芽,在果肉中表達量最低;Prupe.3G231400.1(PpNDB1)在老葉和幼果肉中表達量最高,其次是根,再次是葉芽和幼葉,在熟果肉中幾乎無表達;Prupe.4G037100.1(PpNDB3)在老葉和根中表達量顯著高于其他組織,在熟果肉中幾乎不表達,在枝表皮、幼果肉、熟果皮表達量相近。Prupe.3G231300.1(PpNDB4)在枝表皮和熟果肉中檢測不到表達,在幼葉和根中表達量顯著高于其他組織,在熟果皮、幼果肉、葉芽中表達量相近,沒有顯著差異;Prupe.5G076700.1(PpNDC1)在老葉中表達量最高,其次是葉芽、幼果肉、枝表皮,再次是幼葉和根,在熟果肉中幾乎檢測不到表達。

圖7 桃Ⅱ型NADH脫氫酶家族基因相對表達水平Fig.7 Relative expression level of type type Ⅱ NADH dehydrogenase family genes in peach
3 討 論
3.1 桃Ⅱ型NADH脫氫酶家族成員鑒定
本研究鑒定出桃有6個桃Ⅱ型NADH脫氫酶成員,比擬南芥少了一個AtNDB2成員,這表明擬南芥與桃Ⅱ型NADH脫氫酶家族成員數目方面稍有差異,也有很高的保守性;這種物種間的保守性和差異性在其他植物中也被發現,水稻有8個Ⅱ型NADH脫氫酶成員。這在一定程度上驗證了以往報道:每種植物線粒體一定程度上至少含有4個不同的Ⅱ型NADH脫氫酶[9]。綜合這些研究結果,也說明植物Ⅱ型NADH脫氫酶家族成員數目較少,是較小的家族。
桃Ⅱ型NADH脫氫酶家族被分成3個亞家族,其他植物Ⅱ型NADH脫氫酶家族也是被分為3個亞家族[22],這體現了同一家族基因在不同物種間的保守性。特別是PpNDC亞家族,有且只有1個成員PpNDC1,在擬南芥、水稻、白腐菌及本研究中都得到了證實[22]。
3.2 桃Ⅱ型NADH脫氫酶家族基因克隆
從野雞紅的8種組織cDNA池中均無法擴增出PpNDB4(Prupe.3G231300.1)條帶,經過在NCBI中查找該基因的基因組序列,發現與GDR中下載的基因組序列不同,有待進一步研究;但是根據參考基因組Lovell品種中Prupe.3G231300.1的CDS序列設計的qRT-PCR引物能擴增出127 bp目的片段,其表達水平在一些組織中也能被檢測到。這與以往擬南芥中發現的類似:AtNDB3無法克隆,并被認為是一個假基因[23]。在萌發過程中的轉錄組分析結果表明,AtNDB3在萌發早期表達[24]。假基因是基因家族在進化過程中形成的,往往存在于真核生物的多基因家族中。例如,大多數光合作用的基因已經丟失或消失,只保留為假基因[25]。由于假基因在選擇壓力降低的條件下進化,可以推測出它們的種間變異性增加,因此,這些假基因可能是分類學研究中有用的分子工具[25]。這是首次報道在桃中發現假基因,Prupe.3G231300.1的利用有待進一步深入探索。
3.3 桃Ⅱ型NADH脫氫酶家族基因結構及蛋白質特性
基因結構方面,桃PpNDA亞家族2個基因的外顯子數量相同,各8個,這與擬南芥AtNDA亞家族2個基因的外顯子數量相等[9]。說明2個物種間NDA亞家族基因在外顯子數量上是保守的。比較桃NDA亞家族的2個基因,發現外顯子長度和外顯子排列順序、內含子排列順序幾乎完全相同,但內含子長度、上下游長度有很大不同。比較擬南芥NDA亞家族的2個基因,所有內含子的位置、大多數內含子長度都是保守的[9],這說明桃和擬南芥2個物種的NDA亞家族成員基因結構高度保守,除了2個物種間內含子長度略有不同。桃NDB亞家族3個基因的外顯子位置、長度、數目、順序高度保守,內含子長度有差異;比較擬南芥NDB亞家族4個基因,大多數內含子位置保守,和NDB1及NDB2相比,NDB4丟失了幾個內含子,這些體現了2個物種間雖然略有差異,但是具有高度保守性。這些基因結構上的保守性也為進化分析結果提供了支持。NDC亞家族唯一成員擬南芥NDC1有9個內含子,而桃NDC亞家族唯一成員NDC1(Prupe.5G076700.1)沒有內含子,這可能是自然選擇的結果,這種選擇是由最小化轉錄成本所產生的優勢驅動的,因為內含子較短,可以減少轉錄和剪接等過程的能量消耗,從而提高轉錄效率[26]。
PpNDC1(Prupe.5G076700.1)與擬南芥 AtNDC1(AT5G08740)均是 NDC家族唯一蛋白質,兩者的氨基酸序列均含有1個小的NADH 結合結構域,這個小的NADH結合位點被包含在一個更大的、被稱作氧化還原輔基的FAD結合結構域里。說明物種間同源基因結構上具有高度保守性,可能起源于同一個祖先。
EF-hand是1個由α-螺旋“E”(一個可能結合鈣的環)和第二個α-螺旋“F”組成的基序[27]。含有EF-hand保守區域的蛋白質主要有2類:鈣離子傳感器,可傳遞鈣離子信號;鈣離子信號調節劑,可調節鈣離子信號的形狀和/或持續時間,或參與鈣離子穩態[28]。PpNDB亞家族3個成員中有2個成員含有EF-hand保守結構域,而且PpNDB4(Prupe.3G231300.1)含有2個緊緊相鄰的EF-hand結構域,PpNDB3(Prupe.4G037100.1)在390~464 aa含有1個EF-hand結構域且是鈣離子結合位點,這與以往報道相同,植物NDB蛋白含有1個EF-hand保守區域,大約70個氨基酸殘基長度,它能結合鈣從而保證活性,在煙草中已得到證實,NDB活性依賴于鈣[4,29]。這間接說明含有EF-hand結構域的氨基酸序列有共同的祖先,一個家族的成員間是同源基因。PpNDB4(Prupe.3G231300.1)蛋白質含有2個緊鄰的EF-hand結構域,這與以往報道的EF-hand保守結構域經常成對出現的結論一致[27]。含有EF-hand保守結構域的蛋白質具有一系列多種功能[28],有待在桃中進一步探索和挖掘。
桃NDC1(Prupe.5G076700.1)有1個包含在大的FAD結構域里面的1個小NADH結合結構域,相對分子質量是59 056。這與以往報道相同:含有1個FAD結構域的典型的Ⅱ型NADH脫氫酶,相對分子質量大小是50 000~60 000[2]。擬南芥中也有1個具有FAD結構域的典型的Ⅱ型NADH脫氫酶蛋白質NDC1(AT5G08740.1),相對分子質量是57 018,也介于50 000~60 000。大腸桿菌(Escherichiacoli)NDH和釀酒酵母(Saccharomycescerevisiae)NDI1也分別是包含FAD的單個多肽Ⅱ型NADH脫氫酶蛋白質,相對分子質量是45 000~50 000[9]。這些說明NDC亞家族中的NDC1相對分子質量在植物、細菌、酵母等生物中是不同的,在植物中含有1個FAD結構域的典型的Ⅱ型NADH脫氫酶蛋白質NDC1,相對分子質量符合50 000~60 000的規律[2],在細菌和酵母等生物中NDC相對分子質量范圍需要進一步確定和總結。這可能與物種的基因組大小相關,植物基因組比細菌、酵母等基因組大。
3.4 桃Ⅱ型NADH脫氫酶家族蛋白質亞細胞定位預測
最初的體內GFP融合方法確定擬南芥NDA1、NDA2、NDB1、NDB2、NDC1蛋白質都位于線粒體中[9]。Elhafez等[23]通過對分離線粒體進行體外導入分析后確定NDB1、NDB2和NDB4定位于線粒體內膜的外部,NDA1、NDA2和NDC1定位在線粒體內膜的內部。而NDB3因無法克隆,亞細胞定位未知。然而,隨后的研究發現,擬南芥Ⅱ型NADH脫氫酶蛋白質事實上是雙重定位的,NDA1、NDA2和NDB1被發現定位在線粒體和過氧化物酶體,NDC1被確定定位在線粒體和質體[30]。這些研究得出的結論不同,是因為最初的研究僅使用目標蛋白質的C端GFP標簽加上N端前50~100個氨基酸構建載體[22]。
為了得到確定結論,Xu等[22]2013年通過AtNDA1、AtNDA2基因ORF全長C端融合表達,確定AtNDA1和AtNDA2表達的蛋白質定位在線粒體中。如果只把編碼AtNDA1、AtNDA2蛋白質最后10個氨基酸的基因融合表達,則發現AtNDA1、AtNDA2表達的蛋白質定位在過氧化物酶體。OsNDA1基因ORF全長C端融合表達,確定OsNDA1表達的蛋白質定位在線粒體中,如果只把編碼OsNDA1蛋白質的最后10個氨基酸的基因融合表達,則發現OsNDA1表達的蛋白質不定位在任何位置,OsNDA2表達的蛋白質定位在線粒體和過氧化物酶體;AtNDB1表達的蛋白質定位在線粒體和過氧化物酶體,AtNDB2和AtNDB4表達的蛋白質均只定位在線粒體;OsNDB1和OsNDB2基因ORF全長C端融合表達,確定OsNDB1和OsNDB2表達的蛋白質定位在線粒體中, 如果只把編碼OsNDB1和OsNDB2蛋白質最后10個氨基酸的基因融合表達,則OsNDB1和OsNDB2表達的蛋白質定位在過氧化物酶體;AtNDC1和OsNDC1表達的蛋白質均定位在線粒體和質體。在植物中,線粒體和質體的功能也對各種發育和環境作出反應,但有關信號的細節仍然未知;質體功能可以影響線粒體的生物發生和活性[31]。光合作用缺陷細胞可改變線粒體基因在葉中表達和基因組拷貝數,但不影響在根中的表達和基因組拷貝數,這在大麥中較為明顯[32]。
本研究中6個Ⅱ型NADH脫氫酶蛋白質被預測定位在線粒體或葉綠體的概率較高,這與其他物種(擬南芥和水稻)C端融合表達確定的亞細胞定位結果[22]既有相同之處,又有差異。PpNDA1被預測的最高可信度的亞細胞定位在線粒體,這與已驗證的擬南芥AtNDA1[9]、萊氏衣藻CrNDA1[18]、土豆StNDA1[11]的亞細胞定位結果相同。萊氏衣藻CrNDA2和CrNDA3定位于葉綠體,CrNDA1、CrNDA5、CrNDA6、CrNDA7亞細胞定位結果目前還未知[33];AtNDB2和StNDB1位于線粒體。下一步將對桃Ⅱ型NADH脫氫酶蛋白質亞細胞定位進行試驗確定。
3.5 桃Ⅱ型NADH脫氫酶家族基因表達水平
基因表達水平分析結果顯示,桃NDB亞家族的3個基因均在老葉、幼葉、根中表達量更高,在熟果肉、熟果皮和枝表皮中表達量相對低或檢測不到,說明同一亞家族成員之間不僅在基因結構、蛋白質保守區域、蛋白質理化性質方面具有保守性,在行使的功能方面也可能具有保守性,且在成熟果實中行使的功能少或只在特定條件下的成熟果實中才具有功能。除了Prupe.3G231300.1(PpNDB4) 外,其余5個桃Ⅱ型NADH脫氫酶基因在老葉中的表達水平均分別顯著高于其在幼葉中的表達水平,據此推測5個桃Ⅱ型NADH脫氫酶基因在成熟的、深綠的老葉中行使的功能可能強于其在淺綠的嫩葉中行使的功能。Prupe.4G039000.1(PpNDA2)、Prupe.4G037100.1(PpNDB3)、Prupe.3G231300.1(PpNDB4)在白色幼根中表達量較高,且顯著高于其在葉芽、枝表皮、幼果肉、熟果肉、熟果皮中的表達水平,據此推測這3個Ⅱ型NADH脫氫酶基因可能在根生長、發育等方面具有重要作用。有研究結果表明,通過線粒體呼吸鏈中的非磷酸化途徑氧化NADH在陸地植物和濕地植物中都很常見;在濕地植物的根部,這些特性尤為顯著,所以它們可以在長期缺氧和缺氧脅迫下生存[34-35]。將來可以進一步從Ⅱ型NADH脫氫酶基因入手,解析其在桃樹抗澇等方面的分子作用機理。
6個桃Ⅱ型NADH脫氫酶成員的系統性分析為未來基因功能研究提供了重要方向和依據。下一步將通過轉基因、亞細胞定位、蛋白質互作等試驗驗證基因功能,以期明確桃Ⅱ型NADH脫氫酶基因在調控光呼吸、適應生物和非生物逆境(如冷害、澇害等)及其他代謝途徑等過程的具體作用機理。

